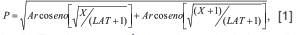Anopheles darlingi Root, 1926, es considerado como el principal vector de la malaria, o paludismo, en Colombia (1-3). La distribución geográfica de la especie va desde el sur de México hasta el norte de Argentina (4-7). La especie pertenece al subgénero Nyssorhynchus, sección Argyritarsis, cuyos individuos se caracterizan por presentar el V tarsómero de la pata posterior blanco, esternito abdominal I sin línea submedial de escamas claras y el quinto palpómero completamente claro. Las autopomorfias de la especie incluyen el mesanepimeron anterior con un grupo conspicuo de escamas claras, el mesanepimeron superior sin escamas claras y la mancha prehumeral oscura (Prehumeral Dark Spot, PHD), con una longitud entre tres y cuatro veces mayor que la de la mancha humeral clara (Humeral Pale Spot, HP) (4). No obstante, las poblaciones naturales de An. darlingi se caracterizan por presentar una importante variabilidad genética y morfológica (8-13) relevante tanto para la taxonomía de la especie como para los estudios de asociación de aspectos de su biología y su papel como vector.
Con base en las variaciones del grado de fusión de las manchas de la vena costal del ala, se han descrito ocho patrones alares en poblaciones de Venezuela y Colombia (14). Con respecto al tamaño del ala, se han encontrado cambios asociados a factores ambientales y ecológicos determinantes propios de las ecorregiones que ocupa la especie (15). El tamaño del ala ha sido un estimador indirecto del tamaño corporal en insectos de importancia médica (16). En anofelinos, las diferencias en el tamaño corporal constituyen un rasgo de gran importancia epidemiológica para la malaria. Se ha observado que la reserva de energía que requiere una hembra para la búsqueda de su fuente de alimentación con sangre depende de su tamaño corporal expresado en biomasa (17) y que las hembras pequeñas requieren más de una ingestión de sangre para completar su primer ciclo gonotrófico (16), lo cual puede incrementar la probabilidad de adquirir los parásitos de la malaria humana. La forma y la longitud del ala constituyen características que contribuyen a definir la eficacia del vuelo (17), rasgo fundamental para la búsqueda de sitios aptos para la oviposición, la búsqueda de fuentes de sangre (9), la dispersión de genes de resistencia a insecticidas (18) y la propagación de esporozoítos de Plasmodium spp. (17). Estos rasgos del ala no dependen solo del acervo genético (19), sino que se ven afectados por variables ambientales, como la temperatura, la humedad relativa y la altitud (20,21).
Los estudios de morfometría en anofelinos han permitido análisis que contribuyen a una mejor resolución taxonómica y a una mejor comprensión de las variaciones en la población de una especie y entre varias de ellas (20,22-25).
El objetivo de este trabajo fue caracterizar las variantes morfométricas de las características las alas y de la pata posterior de poblaciones naturales de An. darlingi recolectados en seis localidades de cuatro departamentos de Colombia donde la malaria es endémica. Con este propósito, para cada espécimen de las poblaciones estudiadas se establecieron: a) los patrones alares según la presencia, ausencia o fusión de las manchas de la vena costal; b) la relación de la longitud de cada mancha de la vena con respecto a la longitud alar total; c) la relación de la longitud de la banda oscura del tarsómero posterior II con respecto a la longitud total del tarsomero, y d) se hicieron los análisis de morfometría lineal y geométrica para estimar el tamaño corporal de las poblaciones del insecto y los posibles cambios en la forma alar.
Materiales y métodos
Sitios de estudio
Los especímenes estudiados eran hembras silvestres recolectadas mediante exposición de humanos durante 50 minutos por hora entre las 18:00 y las 06:00 horas, en dos noches consecutivas de cada mes, tanto en el intradomicilio como en el peridomicilio de las zonas geográficas donde la malaria es endémica (26-29). Las poblaciones de estudio provenían de Pacurita (CHQP), municipio de Quibdó y Bete (CHQB) municipio de Medio Atrato, en el departamento del Chocó, ambos localizados al occidente de la cordillera Occidental (28). En el oriente de la cordillera Oriental, se incluyeron las localidades de Puerto Gaitán (MPG) en el departamento del Meta (28); San José del Guaviare (SJG) y Miraflores (GM) en el departamento del Guaviare (26,27) y Puerto Carreño (VPC) en el departamento del Vichada (29) (cuadro 1, figura 1).
Cuadro 1 Sitios de recolección de ejemplares adultos de Anopheles darlingi en siete localidades de Colombia
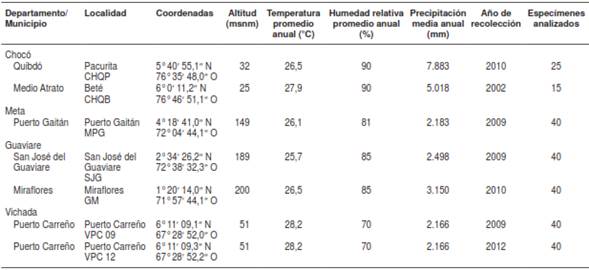
Figura 1 Localización geográfica de los sitios de estudio de Anopheles darlingi en seis localidades de Colombia: Beté, Chocó (1); Pacurita, Chocó (2); Puerto Gaitán, Meta (3); San José del Guaviare, Guaviare (4); Miraflores, Guaviare (5); Puerto Carreño, Vichada 2009 y 2012 (6)
Se analizaron 240 alas derechas en posición dorsal que exhibieran claramente las manchas de la vena costal y 240 patas posteriores que presentaran todos los tarsómeros. Cada pata y cada ala se colocaron en seco sobre láminas de vidrio, cubiertas luego con laminilla y selladas en los bordes con esmalte industrial o bálsamo de Canadá (figura 2, A y B).
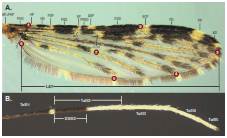
Figura 2 A. Patrón I, sin fusiones en el ala de Anopheles darlingi. Los puntos rojos señalan la ubicación de los puntos de referencia analizados: PR1, intersección de la vena humeral con la vena costal; PR2, intersección de la vena subcostal con la vena costal; PR3, intersección de la vena radial 3 con el margen alar; PR4, intersección de la vena cubital 1 con el margen alar; PR5, intersección de la vena anal con el margen alar; PR6, alula; PR7, intersección de la vena cubital anterior con la transversal m-cu. B. Tarsómeros de la pata posterior de An. darlingi
Caracteres morfológicos considerados para los análisis
Alas. Se consideraron todas las manchas ubicadas en la vena costal según la nomenclatura vigente (14,30), así: basal clara y prehumeral clara (basal pale-BP + prehumeral pale-PHP), prehumeral oscura (prehumeral dark-PHD), humeral clara (humeral pale-HP) (31), humeral oscura (humeral dark-HD), presectorial clara (presector pale-PSP), presectorial oscura (presector dark-PSD), sectorial clara (sector pale-SP), sectorial proximal oscura (proximal sector dark-PRSD), accesoria clara (accesory sector-ASC), sectorial distal oscura (distal sector dark-DSD), subcostal clara (subcostal pale-SCP), preapical oscura (preapical dark-PD), preapical clara (preapical pale-PP), y apical oscura (apical dark-AD) (30,32,33). La longitud total del ala se midió desde el alulae hasta la intersección de la vena radial 3 con la margen alar (figura 2A).
Pata posterior. Se midió la longitud total del tarsómero II de la pata posterior (Ta-III2 ) y su correspondiente área oscura (DS-III2)(figura 2B).
Morfometría lineal. Se midieron todas las manchas de la vena costal de cada espécimen con 30 aumentos, en tanto que Ta-III2 y DS-III2 se midieron con 63 aumentos utilizando un estereomicroscopio Nikon 5MZ 800 ® con micrómetro ocular. Los datos obte-nidos se consignaron en milímetros en una base de datos de Excel®.
Con el propósito de obtener datos estandarizados de la longitud alar de cada mancha de la vena costal, las mediciones se transformaron mediante la siguiente ecuación (34):
donde P es la proporción transformada de la longitud de la mancha de la vena costal con respecto a la longitud total del ala, X es la longitud de la mancha en mm y LAT es la longitud del ala en mm.
En los análisis de morfometría lineal, solo se incluyeron los patrones alares I y VI (n=179) por ser los más frecuentes. Para comparar las medidas de las manchas, las longitudes de las manchas PSD, SP y PRSD del patrón I se sumaron, ya que en el patrón VI estas se encuentran fusionadas. En cada espécimen se midieron 10 manchas alares estandarizadas, tres proporciones de manchas (PHD/HP, DSD/SCP, DSIII2 /TaIII2 ) y la longitud alar en milímetros.
Después de aplicar un test de normalidad de los datos (35), se hizo un análisis de varianza multivariado (ANDEVA) (36), con el objetivo de establecer diferencias significativas en las mediciones de estos caracteres entre poblaciones y por región, agrupando las poblaciones del occidente de la cordillera Occidental y las del oriente de la cordillera Oriental. Se utilizó la prueba de Hotelling (37) asumiendo un alfa de 0,05 para estimar el agrupamiento de los especímenes según su población de origen.
Se hizo un análisis de conglomerados basado en la similitud de las medias aritméticas de las variables evaluadas en cada población según el algoritmo Unweighted Pair Group Method with Arithmetic Mean, UPGMA (38), y se seleccionó el dendrograma con el coeficiente de correlación cofenética más alto. Se hizo un análisis canónico (Canonical Discriminant Analysis, CDA) (39) para describir algebraicamente las relaciones entre dos o más localidades, de tal manera que las diferencias entre ellas se maximizaran o se hicieran evidentes (36). Se realizó análisis de varianza no paramétrica de la longitud alar, agrupando los datos por sitio de captura (intradomicilio o peridomicilio) y por población de origen. Se utilizó el programa estadístico RWizard (40).
Morfometría geométrica. Se organizó un banco de fotografías de las alas evaluadas (n=240) en posición dorsal con 30 aumentos y en la misma escala para todos los especímenes utilizando una cámara digital Nikon DS-2Mv ® acoplada a un estereomicroscopio Nikon 5MZ 800 ® . Se seleccionaron siete puntos de referencia (41) (cinco de los cuales correspondieron al tipo I, es decir, hitos (landmarks) situados en intersecciones de dos de las curvas de las venas del ala), que permitieran el trazado de un polígono para cubrir el área total del ala, incluidas su longitud y su forma (figura 2A), las cuales se digitalizaron sobre cada imagen usando el programa TPSDig2 (42).
Se hizo un análisis de Procusto por población para obtener las variables asociadas a la forma (dos coordenadas de Procusto por cada punto de referencia, una en el eje X y otra en el eje Y) y al tamaño alar, definido como el tamaño del centroide correspondiente a la raíz cuadrada de la suma de las distancias cuadradas de cada punto de referencia con respecto al centroide del polígono.
Utilizando el programa MorphoJ (43), se aumentaron proporcionalmente las configuraciones de los puntos de referencia y se rotaron por superposición con respecto a la configuración de consenso (44).Con estos datos, se hizo un análisis discriminador que se graficó utilizando el programa estadístico RWizard (40).
Se obtuvo un dendrograma de los resultados relacionados con la forma y el tamaño alar a partir del análisis de similitud, según el algoritmo UPGMA con el programa InfoStat (45). Asimismo, se hizo análisis de varianza del tamaño del centroide por población de origen, para lo cual las poblaciones de Pacurita y Beté se agruparon como una sola, con el fin de incrementar el tamaño de la muestra de análisis y equilibrar las poblaciones consideradas. El efecto del tamaño sobre la forma del ala se evaluó mediante un análisis de regresión de las coordenadas de Procusto con respecto al tamaño del centroide, y su significación estadística se determinó con una prueba de 10.000 permutaciones (46) con el programa MorphoJ (43).
Todo el trabajo se llevó a cabo en el Área de Genética de Insectos de Interés Económico del Laboratorio de Entomología de la Facultad de Ciencias Agrarias de la Universidad Nacional de Colombia, sede Bogotá.
Consideraciones éticas
El proyecto Malaria Vector Biology in Brazil: Ecology and Genetics, en cuyo marco se recolectaron los mosquitos objeto del presente estudio (26-29), contó con la aprobación de los comités de ética de la Facultad de Medicina de la Universidad Nacional de Colombia, de la Institutional Review Board del New York State Department of Health y de los National Institutes of Health de los Estados Unidos.
En la alimentación de los mosquitos se siguieron los protocolos de manejo de vertebrados de la Facultad de Medicina, Veterinaria y Zootecnia de la Universidad Nacional de Colombia y del Comité de Ética en cuidado animal de la Office of Laboratory Animal Welfare (Assurance N| A5791-01) de los National Institutes of Health y del Institutional National Animal Care and Use Committee del New York State Department of Health, según protocolo N° 11-420.
Resultados
Patrones alares
Se encontraron 19 patrones de manchas costales (figura 3). Puerto Carreño (Vichada, 2009) y Puerto Gaitán (Meta) presentaron la mayor diversidad, ambos con 10 patrones diferentes en sus poblaciones naturales de An. darlingi. El patrón alar I fue el más frecuente, con 49% (n=118/240), seguido del patrón VI, con 28% (n=66), excepto en Puerto Gaitán, en donde se encontraron 15 ejemplares con el patrón VI y 14 con el patrón I del total de 40 evaluados (cuadro 2).
Cuadro 2 Frecuencias (%) de los patrones alares de las manchas de la vena costa en Anopheles darlingi de seis localidades de Colombia. Miraflores, Guaviare (GM); San José del Guaviare, Guaviare (SJG); Pacurita, Chocó (CHQP); Beté, Chocó (CHQP); Puerto Carreño, Vichada 2009 y 2012 (VPC); Puerto Gaitán, Meta (MPG)

Morfometría lineal
Con base en el rango de 3,00 a 4,00 propuesto para la relación de las manchas prehumeral oscura y humeral clara (PHD/HP) en poblaciones naturales de An. darlingi (4,47), se encontró que el 46% (106/240) de los especímenes analizados estuvieron en este rango, exceptuando los individuos con patrones IX y XXII, en los cuales estas manchas se encuentran fusionadas. El 89 % (213/240) de los individuos analizados estuvo dentro del rango entre 0,35 y 0,55 para la proporción DSIII2 /TaIII2, definida como uno de los caracteres diagnósticos para la especie (4,47).
Se encontraron diferencias significativas en las poblaciones entre la longitud de las manchas analizadas y la longitud alar (ecuación [1]) y las proporciones diagnósticas PHD/HP y DS-III2 /Ta-III2 (F=4,90; gl=72,959; p<0,001) a partir del ANDEVA. Se encontraron diferencias significativas entre las poblaciones (H=25,76; gl=6; p>0,001) al comparar las medias de la longitud alar con el test de KruskalWallis (48).
Se encontraron diferencias significativas entre las poblaciones en cuanto a la longitud de las manchas analizadas con respecto a la longitud de las alas: Miraflores (GM=2,95 mm), Puerto Gaitán (MPG=2,85 mm), San José del Guaviare (SJG=2,91 mm) y Puerto Carreño (VPC 09=2,89 mm; VPC 12=2,86 mm). Por el contrario, las dos poblaciones de Chocó presentaron, en promedio, menores longitudes alares (CHQP y CHQB=2,79 mm).
En general, se observaron diferencias significativas (H=13,44; gl=1; p<0,001) en el promedio del tamaño alar entre las poblaciones del occidente de la cordillera Occidental (2,79 mm) y las localizadas al oriente de la cordillera Oriental (2,89 mm). En las poblaciones del oriente, se observó una relación del tamaño alar con respecto a la latitud por gradiente geográfico, encontrándose alas más grandes hacia el sur (Miraflores, Guaviare) y en poblaciones del norte (Puerto Carreño, Vichada).
También, se encontraron diferencias significativas (H=4,27; gl=1; p=0,038) en el tamaño alar según el sitio de captura: en los mosquitos capturados mientras picaban en el intradomicilio (2,91 mm) eran más grandes que en los capturados en el peridomicilio (2,85 mm).
Morfometría geométrica
Se encontraron diferencias significativas en la forma alar (coordenadas de Procusto) (F=1,65; gl=50; p<0,001) y en el tamaño del centroide (F=3,37; gl=5; p=0,005) según la localidad de origen de los individuos analizados. Mediante morfometría geométrica, se confirmaron las diferencias (F=4,22; gl=1; p=0,041) en el tamaño corporal de los mosquitos capturados en el intradomicilio (2,70 mm) comparados con los recolectados en el peridomicilio (2,66 mm), tal como se observó en el análisis mediante morfometría lineal.
Aunque no se encontraron diferencias significativas en el tamaño de las alas entre las regiones occidental y oriental (F=3,14; gl=1; p=0,077), las poblaciones de Chocó (2,64 mm) mantuvieron la tendencia a presentar mosquitos con alas más pequeñas que los de las poblaciones de la región oriental (2,68 mm). El análisis UPGMA (figura 4C) reveló una agrupación similar a la obtenida con los datos de morfometría lineal (figura 4A), aunque la población del Meta se asoció con las poblaciones de Vichada y no con las de Guaviare. Mediante el análisis discriminante (figura 4D), los especímenes se clasificaron nuevamente y de forma satisfactoria (72,43 %, ‘reclasificación’ primaria; 62,57 %, a través de 1.000 permutaciones) de acuerdo con su localidad de origen. La mayor variación en la forma alar en las poblaciones estudiadas, se encontró en las regiones cubital y anal del ala (figura 5).
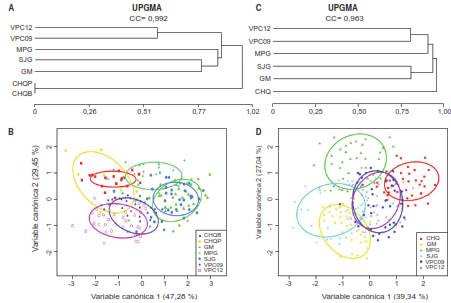
Figura 4 A) Análisis de conglomerados (UPGMA) mediante morfometría lineal. B) Análisis discriminador mediante morfometría lineal. C) Análisis de conglomerados (UPGMA) mediante morfometría geométrica. D) Análisis discriminador mediante morfometría geométrica. Miraflores, Guaviare (GM); San José del Guaviare, Guaviare (SJG); Pacurita, Chocó (CHQP); Beté, Chocó (CHQP); Puerto Carreño, Vichada 2009 y 2012 (VPC); Puerto Gaitán, Meta (MPG)
Discusión
Se encontraron variantes morfológicas que representaban 19 patrones de manchas en la vena costal de poblaciones naturales de An. darlingi en Colombia, los cuales incluyeron los ocho registrados previamente (14). Aunque los patrones I y VI fueron los más frecuentes, pueden presentarse fusiones entre áreas claras y oscuras de la vena costal, con excepción de la mancha preapical clara. La frecuencia de patrones alares está en función de la representatividad muestral y geográfica (12,14) de los especímenes estudiados, pero se ha asociado de forma relevante con factores abióticos, particularmente durante su desarrollo embriológico.
En el presente trabajo, se registraron entre seis y diez patrones alares por localidad, pero resulta interesante el hecho de que se encontraron diferentes frecuencias de patrones alares en las muestras recolectadas en 2009 y 2012 en Puerto Carreño, Vichada. En 2009 hubo una clara influencia del fenómeno El Niño-Oscilación del Sur (ENSO), caracterizado por la disminución en la precipitación y los incrementos en la temperatura ambiental (49), en tanto que en 2011, se inició en el país el fenómeno de La Niña, el cual se extendió hasta el 2012, con un incremento significativo de las precipitaciones, aumento de la humedad relativa y disminución de la temperatura (50).
En Puerto Carreño, el incremento de las lluvias suele provocar el desbordamiento de los ríos Meta y Orinoco, lo que genera criaderos de gran extensión favorables para An. darlingi, en tanto que durante los periodos de escasa precipitación, los criaderos se encuentran fragmentados y en aguas de escorrentía que podrían tener un mayor contenido de materia orgánica y de minerales, también aptos para la especie. La exposición de los huevos y de las formas inmaduras a tales condiciones ambientales puede determinar las variaciones morfológicas de los patrones alares representados por las manchas de la vena costal. No obstante, estos hallazgos deben ser confirmados en estudios controlados de laboratorio para evaluar el efecto que podrían tener las diferentes variables, especialmente la temperatura, en la expresión de los caracteres fenotípicos de las manchas de la vena costal y el tamaño corporal.
A partir del agrupamiento basado en la morfometría lineal de las poblaciones de la región oriental, se observó un gradiente geográfico en el cual se evidenció una mayor diversidad de los patrones alares en la alta Orinoquia (VPC 09 y MPG) y una menor en Miraflores, Guaviare, localidad asociada a la Amazonia. Esta relación se mantuvo en cuanto al tamaño de las alas de la especie, con alas má s grandes en la población de Vichada y más pequeñas en la población de Miraflores. Este gradiente latitudinal determina características ecológicas propias de la Orinoquia y su transición a la Amazonia con cambios en la vegetación, los vientos y las variables abióticas ambientales específicas que influyen en el desarrollo de la especie (51). Estas características, asociadas con la estacionalidad en el régimen de lluvias, determinan la aparición de criaderos con mayor influencia antrópica unos que otros, muchos con exposición total al sol, en tanto que otros aparecen en el bosque inundado, en donde la relación de nutrientes y sombra permanente es propicia para las formas inmaduras de la especie (26) e influye en su desarrollo embriológico y larval (52).
En este mismo contexto, se pudo establecer un agrupamiento por región, en el cual las poblaciones de Pacurita y Beté de Chocó conformaron un único grupo externo y las poblaciones de la región oriental conformaron otro grupo mayor relacionado. Ello significa que las barreras geográficas, representadas por la cordillera de los Andes y los ríos Magdalena y Cauca, han aislado a estas poblaciones debido a la distancia y han contribuido a la fijación de estos rasgos en las poblaciones (13).Las larvas de An. darlingi requieren de condiciones químicas y físicas estables propias de criaderos grandes, profundos y con aguas claras, que propician temperaturas entre los 20 y los 28 °C y un pH entre 6,5 y 7,3 (53). Sin embargo, factores como la deforestación para abrir espacio a la agricultura y a la actividad minera, generan criaderos totalmente expuestos al sol que pueden alcanzar temperaturas de hasta 40 °C, con efectos importantes en el desarrollo de la especie y sus características morfológicas (54,55). Estos cambios en la composición del paisaje afectan la disposición de los criaderos y determinan cambios en la temperatura y la humedad relativa ambiental, que afectan el desarrollo de las formas inmaduras y la tasa de vuelo de los adultos.
En la taxonomía de las poblaciones de An. darlingi en Colombia es importante considerar que algunos individuos presentan una mayor proporción de manchas PHD/HP, con un rango entre 2,0 y 5,0 para este rasgo, y agrupó en este estudio el 89 % del total de los especímenes analizados. El rango propuesto no afecta la separación de An. darlingi de otras especies de la sección Argyritarsis, a la cual pertenece (4,47), con excepción de An. pictipennis Philippi, 1865, con valores de PHD/HP que oscilan entre 2,0 y 3,0 (4), pero cuya distribución geográfica se encuentra restringida a la región central de Chile y occidental de Argentina (56),y que se distingue, además, por presentar el quinto palpómero totalmente claro y no tener tufos oscuros caudolaterales en los segmentos abdominales (4,47).
Asimismo, la relación entre la longitud total del tarsómero posterior II y su correspondiente área oscura (DS-III2 /Ta-III2 ), la cual se propone en el rango de 0,35 a 0,55 (4,47), es un rasgo sólido de diagnóstico para todas las poblaciones de An. darlingi estudiadas, ya que agrupó al 89 % de los especímenes y constituyó la variable más relevante en la asignación de individuos a cada población al hacer el análisis discriminante.
La selección de puntos de referencia para el análisis de morfometría geométrica en alas de mosquitos del género Anopheles, debe establecerse con base en los sitios de intersección de las venas alares (41) y no con respecto a la ubicación relativa de las manchas alares sobre la vena costal (57), debido a que, como se encontró en el presente estudio, estas varían en longitud y posición. Además de representar la variación morfológica de caracteres diagnósticos para la especie, al igual que las manchas de la vena costal, los puntos de referencia en las alas permiten estimar los parámetros de forma y tamaño, características de gran interés epidemiológico (14,15), tanto por la dispersión de adultos durante el vuelo (18-21) como por la relación de su tamaño corporal y el número de ingestiones de sangre para el completo desarrollo de los ciclos gonotróficos (16,17).
En el presente estudio, se encontró que los puntos de referencia cuatro, seis y siete, así como las variaciones en las regiones cubital y anal en las alas, constituyeron rasgos de importancia para diferenciar las poblaciones de An. darlingi evaluadas. Se sugiere tener en cuenta estas variaciones de la forma alar en trabajos posteriores y establecer si dichos cambios están relacionados con variables ambientales locales.
La búsqueda y la selección de la fuente de sangre por parte de las hembras de anofelinos depende tanto del acervo genético propio de la población como de las características ecológicas del área geográfica, de los patrones de vuelo y de la disponibilidad de la fuente de sangre. Se ha encontrado que la especie puede tener rangos largos de vuelo, de hasta 7,2 kilómetros, con ayuda del viento (58). No obstante, se considera que los adultos de An. darlingi se agrupan en pequeñas áreas cercanas a los criaderos, lo que contribuye a reducir la necesidad de vuelos largos (9) y a hacer un uso más eficiente de la energía. En este contexto, el tamaño y la forma alar de las poblaciones, características definidas por su genética (11-13), y las variables abióticas ambientales y de los criaderos (2,57), constituyen aspectos fundamentales para el vuelo de la especie y, por ende, para establecer las características de la bionomía propia de cada población. En poblaciones de An. darlingi de Brasil, se encontró que la longitud de la mancha prehumeral clara (PHP) de la vena costal cambió en función del tamaño del ala de mosquitos con diferente tamaño alar (9), por lo que es claro que los estudios de morfometría lineal deben considerar la forma y el tamaño alar establecidos mediante la morfometría geométrica.
El presente estudio permitió definir 19 patrones de manchas alares, así como confirmar que la relación de DS-III2/Ta-III2 constituye un rasgo sólido para el diagnóstico taxonómico, y que se encuentran diferencias en el tamaño corporal y la forma de las alas en las poblaciones naturales de An. darlingi en Colombia. Desde el punto de vista de la taxonomía ‘integrativa’ (59), el estudio de poblaciones de insectos asociados como vectores y que, además, presentan características genéticas que los definen como complejos, deben evaluarse integralmente para definir su estatus taxonómico y la asociación de los diversos aspectos de su bionomía, lo cual es fundamental para determinar estrategias de vigilancia entomológica y de control.