Diversas malformaciones congénitas cerebrales se derivan de una embriogénesis anormal o de procesos disruptivos 1 que pueden ser causados por agentes infecciosos (Toxoplasma spp., virus de la rubéola, del herpes simple, de la coriomeningitis linfocítica, de la varicela zóster, el parvovirus B19, el citomegalovirus y el echovirus, y Treponema pallidum), así como por radiación, consumo de alcohol, ingestión de medicamentos y factores genéticos, entre otros.
En Colombia, la infección por Toxoplasma gondii representa un problema de salud pública durante la gestación, al cual se han sumado recientemente las infecciones debidas a flavivirus, específicamente los virus del chikungunya (CHIKV) y del Zika (ZIKV), cuyo posible efecto congénito a nivel cerebral se ha venido estudiando.
En Suramérica, incluido nuestro país, se han descrito formas de infección porT. gondii más graves que las reportadas en otros continentes, lo que se explica por una mayor circulación de cepas atípicas con alelos de virulencia que interfieren con la reacción inmunitaria de protección 2-4.
Se conocen tres linajes clonales (I a III) y diversas cepas atípicas 5 deT. gondii, coccidio tisular intracelular obligado, de distribución cosmopolita, del filo Apicomplexa 5, que infectan de manera crónica a una tercera parte de la población mundial y a un gran número de mamíferos terrestres y acuáticos, así como a aves.
Cuando el parásito se adquiere durante la gestación, la madre lo transmite al feto y se presenta la toxoplasmosis congénita. La probabilidad de presentar esta infección varía según el momento en que la mujer embarazada se infecta. Si sucede durante las dos primeras semanas de gestación, la probabilidad es muy baja, pero aumenta a medida que avanza la gravidez 6. La gravedad del daño en el feto depende del trimestre del embarazo en que la infección se transmita 7. En menos del 10 % de los casos, los parásitos se transmiten durante el primer trimestre del embarazo, alrededor del 30 %, en el segundo trimestre, y del 60 a 70 %, en el tercer trimestre 8. Cuando la infección ocurre en el último trimestre, el 80 % de los recién nacidos son asintomáticos 9, pero si se da en el primer trimestre, las consecuencias son graves para el desarrollo fetal, pues produce anomalías e, incluso, el aborto. Entre los daños más serios que puede producir, figuran la hidrocefalia, el retardo mental, las convulsiones, la microcefalia, la sordera, el déficit psicomotor y la coriorretinitis 10.
En el 2013, se calculó que la incidencia anual de la toxoplasmosis congénita a nivel mundial era de 190.100 casos (IC95%179.300-206.300), lo que equivalía a una carga de 1,20 millones de años de vida con discapacidad (IC95%0,76-1,90). En Suramérica y en algunos países de Oriente Medio, así como en países de bajos ingresos, se ha observado una carga elevada de la infección 11.
La fiebre del chikungunya es una enfermedad causada por el CHIKV, un virus perteneciente al género Alphavirus de la familia Togaviridae, transmitido por la picadura de mosquitos Aedes infectados, principalmente A. aegypti12. Entre las manifestaciones neonatales del CHIKV se cuentan las anomalías del sistema nervioso central 13-16. La encefalopatía que produce se ha asociado con edema cerebral y presencia del genoma viral en el líquido cefalorraquídeo 13,14. Sin embargo, también se ha constatado que, en mujeres con signos de infección por CHIKV durante el embarazo, la infección intrauterina se presentó de forma excepcional y que sus hijos nacieron aparentemente sanos 14-17.
La enfermedad debida al Zika es causada por el ZIKV, virus perteneciente al género Flavivirus de la familia Flaviviridae, grupo IV del orden sin clasificar, muy cercano filogenéticamente a virus como los del dengue, la fiebre amarilla, la encefalitis japonesa y el del Nilo occidental. El ZIKV es transmitido a los humanos por la picadura de mosquitos Aedes infectados, principalmente A. africanus, A. luciocephalus, A. aegypti, A. apicoargenteus, A. furcifer, Aedes l. y A. vitattus. Se ha informado que el síndrome congénito asociado con la infección por ZIKV produce malformaciones cerebrales, disfunción del tronco cerebral y microcefalia 18,19. A pesar de que se ha detectado el ARN del ZIKV en la placenta y el líquido amniótico, así como en restos fetales y en cerebros de niños fallecidos con microcefalia en quienes se ha confirmado la transmisión vertical, no existen pruebas suficientes para determinar la causalidad 20. Hasta el 30 de junio de 2016, se habían notificado en Brasil 1.638 casos confirmados de síndrome congénito asociado con la infección por el ZIKV, 11 en Colombia, 12 en Estados Unidos, uno en El Salvador, uno en Guayana Francesa, uno en Martinica, uno en Panamá y otro en Puerto Rico 21.
Se presenta aquí un caso de transmisión vertical de T. gondii, CHIKV y ZIKV durante el segundo trimestre del embarazo de una mujer que probablemente se infectó en el suroccidente de Colombia en el 2015.
Reporte de caso
A finales de enero del 2016, una mujer embarazada de 18 años de edad acudió a un servicio de salud del municipio de Popayán y solicitó la interrupción voluntaria del embarazo debido a que se había detectado una anomalía congénita en el feto.
La mujer, ama de casa, cabeza de familia, afrodescendiente, desplazada, y con un nivel educativo de secundaria incompleta, vivía en el área urbana de El Bordo, cabecera municipal del municipio de Patía en el departamento del Cauca, Colombia. Se abastecía de agua no potable que almacenaba en la vivienda que habitaba.
El Bordo ha sido una zona endémica para dengue y CHIKV, y en el último trimestre del 2015, cuando se presentó este caso, ya circulaba el ZIKV, por lo que las autoridades sanitarias emitieron la alerta epidemiológica correspondiente.
El 30 de diciembre del 2015, la mujer asistió a su primera y única consulta prenatal en El Bordo. No recordaba la fecha de la última menstruación y en ese momento se determinó por ultrasonografía una edad de gestación de 25,4 semanas. En noviembre del 2015, presentó sintomatología de infección por ZIKV.
En la ultrasonografía realizada en la semana 23 de gestación, se observaron áreas ecogénicas densas en el parénquima cerebral periventricular del feto, con un índice de líquido amniótico normal y un hematoma extraplacentario. En la ultrasonografía de la semana 28 de gestación (18 de enero de 2016), se vio un crecimiento fetal asimétrico y disarmónico (percentil 22 para el peso fetal) y pérdida de tejido en la región fronto-parieto-temporal, ausencia de línea media a nivel frontal, presencia de tálamos y pedúnculos cerebrales confenómeno disruptivo, medidas craneanas por debajo del segundo percentil para la edad gestacional (microcefalia), con placenta implantada en el fondo uterino e índice de líquido amniótico normal.
El mismo 18 de enero, se practicó amniocentesis ante un probable trastorno de la migración neuronal. El 21 de enero de 2016 se reportaron los resultados para toxoplasma (IgG positiva, IgM negativa), rubéola (IgG positiva, IgM negativa) y HIV (prueba de Elisa negativa). En el hemoleucograma de esa fecha, se reportaron 7,67 leucocitos por 10 ml, 70,7 % de neutrófilos, 21,0 % de linfocitos, y hemoglobina de 11,9 g/dl. No había registro de pruebas para toxoplasma antes del embarazo.
Dadas las anomalías fetales cerebrales, la madre solicitó la interrupción voluntaria del embarazo, la cual está autorizada en Colombia en los términos de la sentencia C-355 de 2006 de la Corte Constitucional 22. El embarazo se dio por terminado a las 29 semanas de gestación mediante intervención médica.
El feto presentaba una cabeza pequeña en relación con el resto del cuerpo (microcráneo). Se le practicó ultrasonografía diagnóstica cerebral transfontanelar, en la cual se evidenció malformación del sistema nervioso central, defecto disruptivo, cráneo pequeño con relación al tamaño de la cara, fontanela anterior reducida, ausencia total del hemisferio cerebral izquierdo, pequeño remanente cortical occipital en el hemisferio derecho, y aumento anormal del hemisferio derecho con el ventrículo lateral comunicado con el espacio subaracnoideo periférico; no se observó hoz cerebral.
También, se hizo una tomografía axial computadorizada en la que se observó una gran atrofia de ambos hemisferios cerebrales y disminución importante de su volumen; se logró apreciar, asimismo, algo de sustancia blanca con múltiples calcificaciones a su alrededor, y grandes higromas quísticos que ocupaban la mayoría de la bóveda craneana (figura 1).

Figura 1 Cortes axiales de tomografía axial computadorizada craneal. Se observa una gran atrofia de ambos hemisferios cerebrales, con importante disminución de su volumen, el cual aparece reducido a pequeñas áreas en las cuales se logró apreciar algo de sustancia blanca con múltiples calcificaciones a su alrededor y desarrollo de grandes higromas quísticos que ocupaban la mayoría de la bóveda craneana
Materiales y métodos
Mediante la extracción de ADN genómico a partir de una alícuota de líquido amniótico empleando el estuche comercial Pure Link Genomic DNA™ (Invitrogen) se confirmó la presencia de los microorganismos en el Instituto Nacional de Salud.
Asimismo, mediante PCR estandarizada se amplificó un fragmento del genB1 de T. gondii (132 pb) utilizando los iniciadores B1-F 5´-TCTCTCAAGGAGGACTGGCA-3` y B1-R 5´-GTTTCACCCGGACCGTTTAG-3, y las siguientes condiciones de amplificación: desnaturalización a 94 °C durante cinco minutos; 40 ciclos a 94 °C durante un minuto, a 60 °C durante un minuto, a 72 °C durante un minuto, y una extensión final a 72 °C durante cinco minutos. Como control positivo, se empleó una cepa de referencia y, como controles negativos, un control de extracción (no se reporta) y agua libre de nucleasas en reemplazo del ADN (figura 2, carril 3).
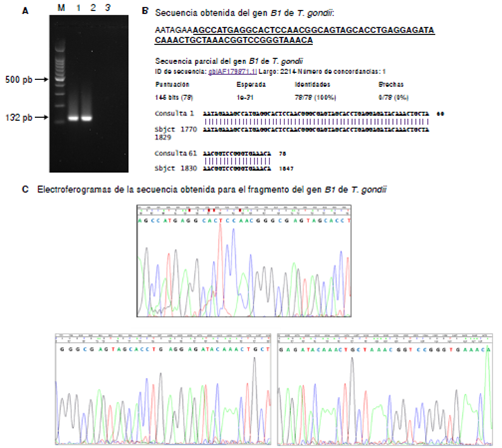
Figura 2 Detección de Toxoplasma gondii. A. Electroforesis en gel de agarosa al 1,8 % que muestra en 1, el producto de amplificación para el fragmento del gen B1 de la muestra de líquido amniótico; en 2, el control positivo obtenido de exudado de ratones con toxoplasma, y en 3, el control negativo de la PCR. M corresponde al marcador de peso molecular de 100 pb (Promega). B. Arriba: secuencia obtenida para el fragmento del gen B1 de T. gondii. Abajo: comparación de la secuencia obtenida con las secuencias del National Center for Biotechnology Information (NCBI). Nótese que hay una homología de 100 % para el producto obtenido. C. Electroferogramas de la secuencia obtenida. En los tres paneles se muestra parte de la secuencia que se encuentra subrayada, y en B, esta se ve arriba, en negrilla
La identidad de los productos amplificados se verificó mediante secuenciación de ácidos nucleicos con el método de Sanger en el analizador genético ABI Prism 310™ (Perkin Elmer). La calidad de las secuencias obtenidas se evaluó mediante el índice de Phred y su comparación se hizo con la herramienta BLASTn™ (nucleotide BLAST) del National Center for Biotechnology Information (NCBI). La extracción de ARN y la síntesis del ADNc se hicieron a partir de la misma muestra de líquido amniótico mediante PCR, para amplificar fragmentos del gen de la poliproteína del ZIKV (79 pb) y del CHIKV (100 pb).
Resultados
Los productos amplificados y la secuencia obtenida para el genB1 de T. gondii fueron positivos (figura 2), como se evidenció en la electroforesis en gel de agarosa al 1,8 % y la secuenciación de ácidos nucleicos realizada a partir de los productos amplificados purificados con el estuche Ilustra GFX PCR ADN and Gel Band Purification™ (GE Healthcare), según las indicaciones del fabricante. La calidad de las secuencias se verificó mediante el índice de Phred (http://genoma.unsam.edu.ar/trac/docencia/wiki/Bioinformatica/Guias/PhredPhrapConsed), con lo cual se eliminó la región inicial de la secuencia con baja calidad, se identificaron todas las bases de la secuencia y su posición, y se revisaron los valores de calidad (99, en general), como puede observarse en los electroferogramas (figura 2C).
Los resultados de la extracción del ARN, la síntesis del ADNc y la amplificación de fragmentos del gen de la poliproteína del ZIKV (79 pb) y la del CHIKV (100 pb) mediante PCR en la muestra de líquido amniótico, fueron positivos. Dichos resultados se confirmaron mediante secuenciación de ácidos nucleicos (figura 3), en tanto que la identidad de la secuencia se confirmó mediante la comparación de las secuencias obtenidas con la herramienta BLASTn del NCBI, la cual evidenció una homología de 100 % para los fragmentos de las secuencias de los virus del Zika y el chikungunya.

Figura 3 . Detección de fragmentos de genes de los virus del Zika y del chikungunya. A. Electroforesis en gel de agarosa al 1,8 % que muestra, en 1, los productos amplificados para el virus del Zika (banda inferior de 79 pb) y del chikungunya (banda superior de 100 pb); y en 2, el control negativo de la PCR. M corresponde al marcador de peso molecular de 100 pb (Promega). B. Secuencia obtenida para los fragmentos del gen de la poliproteína de los virus del Zika y el chikungunya. C. Comparación de las secuencias obtenidas con las secuencias del National Center for Biotechnology Information (NCBI). Nótese que hay una homología de 100 % para los productos obtenidos
Discusión
En el caso reportado se encontraron anomalías congénitas cerebrales e infecciones debidas a T. gondii, CHIKV y ZIKV por transmisión vertical.
En 1982, la prevalencia de la toxoplasmosis en la población general colombiana era de 47 % y, en la región del Pacífico, llegaba a 36 % 23; aunque son pocas las investigaciones sobre toxoplasma congénito hechas en el país, en el 2002 se estimaba que las tasas en recién nacidos oscilaban entre 3 y 15 por mil 24. Por otra parte, se ha reportado la circulación simultánea del CHIKV y el ZIKV en Nicaragua, Ecuador, Brasil y Colombia 25-28. Específicamente en Nicaragua, un estudio serológico encontró que la infección simultánea se presentaba en el 4,6 % de las personas 25. Sin embargo, hasta el momento no se ha descrito la infección concomitante por toxoplasma, ZIKV y CHIKV, y se desconoce la interacción de estos microorganismos en el desarrollo de defectos congénitos.
El diagnóstico diferencial del defecto congénito cerebral no es fácil. Sus causas son múltiples y su definición se basa en argumentos clínicos que se complementan con una serie de pruebas de laboratorio. En el caso que se presenta, el diagnóstico prenatal de las anomalías congénitas cerebrales se hizo con base en los hallazgos de las imágenes de ultrasonido, pero el examen posterior del líquido amniótico evidenció la infección por Toxoplasma, CHIKV y ZIKV.
Si bien es cierto que la mujer gestante había resultado positiva para toxoplasma (IgG positiva e IgM negativa, sin realizar la prueba de avidez y sin repetir la IgM), en el estudio realizado el 21 de enero de 2016 el examen del líquido amniótico fue positivo para Toxoplasma. Es posible que este caso haya correspondido a una reinfección por este parásito en una mujer inmunocompetente, hipótesis factible dados los resultados que indicaron una infección anterior por el microorganismo. Es probable que la mujer gestante se haya infectado con otra cepa de Toxoplasma spp. yque, por la falta de seguimiento del nivel de IgG, no se haya podido detectar su variación, como se ha reportado en otros casos 29,30. Además, se ha informado que la reinfección en mujeres inmunocompetentes durante el embarazo es poco frecuente, y que el resultado positivo de los análisis de IgG no siempre indica que haya protección contra la toxoplasmosis congénita 31.
Se sabe que en los seres humanos afectados por toxoplasmosis congénita la infección afecta el sistema nervioso central y puede producir necrosis parenquimatosa difusa y multifocal hasta llegar a formar calcificaciones. La distribución y la gravedad de las calcificaciones varían según el momento en que ocurre la infección materna 32,33. La infección congénita es más grave si se adquiere en el primero o el segundo trimestre. Las manifestaciones neurológicas más frecuentes en los pacientes sintomáticos en el momento del nacimiento, son la hidrocefalia, las calcificaciones intracraneales y la coriorretinitis 34.
En cuanto al CHIKV, aunque no se lo considera un virus neurotrópico, esporádicamente se han reportado casos con manifestaciones neurológicas durante la infección aguda 35, y en la isla Reunión (La Réunion), por ejemplo, se informó en recién nacidos infectados por transmisión vertical como la manifestación clínica más común de la encefalopatía grave 14.
Por otra parte, desde el 2015 se ha reportado en Brasil un aumento de casos de niños con sospecha de microcefalia y anormalidades en el desarrollo del sistema nervioso central, probablemente asociados con la infección por el ZIKV 36,37.
En estos casos, las imágenes diagnósticas del cráneo comenzaron a evidenciar anomalías a nivel cerebral desde la semana 23 de gestación, en la semana 28 apareció la microcefalia y otros daños mayores, y en la semana 29 se confirmó la malformación del sistema nervioso central consistente en atrofia de los hemisferios cerebrales y en múltiples calcificaciones alrededor de los remanentes de sustancia blanca.
En la toxoplasmosis fetal grave, las imágenes diagnósticas del cráneo se suelen evidenciar ventriculo megalia asociada con múltiples nódulos eco-densos, destrucción del cerebro, disgenesia del cuerpo calloso 38-40 y calcificaciones nodulares 41,42.
En la infección causada por el CHIKV, las imágenes no han sido muy específicas y se ha observado edema cerebral, vasculitis lentículo-tálamo-triatal, hiperdensidades en la sustancia blanca y en los hemisferios cerebrales 43, encefalopatía 14 y lesiones dispersas en la sustancia blanca con áreas de hemorragia intraparenquimatosa 13.
En la infección debida al ZIKV, las imágenes han revelado calcificaciones en la unión cortico-medular de la sustancia blanca, asociadas con malformaciones del desarrollo cortical y los lóbulos frontales y parietales, así como ventriculomegalia, retraso en la mielinización e hipoplasia del cerebelo y del tronco cerebral 44-47.
Teniendo en cuenta los hallazgos en las imágenes diagnósticas y lo reportado en los diversos estudios, es posible que en el caso que se reporta las alteraciones se debieran a la presencia de Toxoplasma sp. Sin embargo, no se puede descartar la participación del ZIKV, si se tiene en cuenta que aún no se conoce la interacción entre el parásito y el CHIKV y el ZIKV, ya sea que estos últimos se presenten solos o concomitantemente en la producción de las lesiones en el sistema nervioso central. La secuencia parcial del ZIKV obtenida coincidió con las reportadas a nivel mundial 48,49.
Para el diagnóstico etiológico del defecto congénito cerebral, se requiere, como mínimo, que la futura madre asista regularmente a sus controles prenatales y en ellos se realice un excelente interrogatorio y un examen físico completo, y que se soliciten las pruebas de laboratorio que permitan investigar las infecciones que causan defectos congénitos cerebrales (como toxoplasmosis, rubéola, infección por citomegalovirus, herpes, sífilis, e infección por el ZIKV, el CHIKV y por el parvovirus B19), así como imágenes diagnósticas. También, se ha recomendado hacer el estudio virológico en el líquido amniótico.
En cuanto al mortinato o recién nacido, además del examen físico completo, deben practicarse las mismas pruebas de laboratorio hechas a la madre a partir de sangre del cordón umbilical. Además, debe investigarse la presencia del ZIKV y del CHIKV en el líquido cefalorraquídeo, y la de citomegalovirus y ZIKV en la orina. El estudio se debe complementar con imágenes diagnósticas de cráneo y el análisis del cariotipo. En los casos de muertes perinatales y neonatales, se debe proceder a la necropsia y al examen histopatológico de la placenta.
Hubo limitaciones en la presentación de este caso, ya que no se obtuvo información sobre los antecedentes de exposición a gatos domésticos, sobre el consumo de carne mal cocida, ni sobre los síntomas asociados con las condiciones detectadas o el consumo de esteroides. Además, no se descartó la infección por el virus linfotrópico de células T humanas (HTLV), ni se conocieron la técnica y los valores de la prueba de toxoplasma reportada.
Este es uno de los primeros casos que se detectó durante la pasada epidemia por ZIKV en Colombia y, dadas las condiciones de emergencia, no se tuvo en cuenta la recolección de todos los datos relevantes. El gran número de personas que acudió a los servicios de salud en ese periodo, probablemente, impidió que el médico tratante dedicara el tiempo suficiente a investigar los antecedentes personales y patológicos del caso. Las limitaciones también tienen que ver con la calidad de los datos que se recopilan en las historias clínicas y la falta de información sobre síntomas relacionados con la toxoplasmosis y las infecciones por el ZIKV y el CHIKV, las que, además, pueden haber sido asintomáticas y, por lo tanto, no se reportaron.
Debido a sus condiciones ecoepidemiológicas, aptas para mantener la transmisión de las infecciones debidas a flavivirus, diversos territorios de Colombia se han convertido en áreas endémicas de las enfermedades debidas a los virus del dengue, el CHIKV y el ZIKV, en donde, además, una mujer embarazada puede adquirir otras infecciones como la toxoplasmosis. A pesar de las indicaciones que se han impartido con respecto a la necesidad de hacer los exámenes pertinentes para la detección de defectos congénitos, estos no se hacen rutinariamente, y ello retrasa el diagnóstico y el manejo de los pacientes.
En este contexto, el reporte del presente caso de infección por T. gondii, ZIKV y CHIKV contribuye a resaltar algunas de sus características clínicas y los estudios de confirmación por el laboratorio que se exigen, pues dos de estos microorganismos presentan manifestaciones clínicas muy similares que pueden producir confusión y alarma en la comunidad, lo que refuerza la necesidad de mejorar la calidad de la información que se recaba para elaborar la historia clínica, y garantizar mayor rigurosidad en la toma y el procesamiento de las muestras.














