La encefalitis viral se define como un proceso inflamatorio asociado con disfunción neurológica que resulta en la muerte o en daños graves permanentes, incluidas alteraciones cognitivas y de conducta 1,2. Las infecciones del sistema nervioso central habitualmente se producen como una complicación de infecciones virales sistémicas y pocas pueden prevenirse con la vacunación masiva o individual; además, se cuenta con pocos tratamientos farmacológicos específicos 3. Los signos y síntomas de los pacientes con encefalitis viral son variables e incluyen alteración del estado mental, convulsiones, déficit neurológico focal, cefalea, fiebre, síntomas psiquiátricos o alteraciones cognitivas 4. La encefalitis viral está asociada con morbilidad y mortalidad significativas y usualmente requiere hospitalización. Muchos casos no se reportan a las autoridades de salud y son múltiples los agentes causales que, además, pocas veces logran ser identificados. La incidencia fluctúa entre 3,5 y 7,4 por cada 100.000 habitantes, y afecta a personas de todas las edades, aunque la incidencia es relativamente mayor en la población pediátrica, y afecta a los dos sexos con cierto predominio en hombres. Se distribuye mundialmente y no se registra predominio estacional. Para el diagnóstico es necesario obtener líquido cefalorraquídeo, lo cual es una limitante que afecta la posibilidad de prescribir el tratamiento más adecuado 5-7.Entre los agentes virales capaces de producirla se reportan más de 100 patógenos 8.
En México se desconocen la prevalencia y la incidencia de la encefalitis viral aguda debido a que es una enfermedad infecciosa cuya notificación no es obligatoria; solo se registra en reportes de casos en los cuales no se identifican los agentes virales implicados. En el presente trabajo se estudió el líquido cefalorraquídeo mediante reacción en cadena de la polimerasa en tiempo real (Real Time Polymerase Chain Reaction, RT-PCR) en pacientes con sospecha de encefalitis viral aguda admitidos en el Hospital Civil de Guadalajara Fray Antonio Alcalde.
Materiales y métodos
Pacientes
Se captaron 66 pacientes entre enero de 2011 y diciembre de 2014 con signos y síntomas sugestivos de encefalitis viral aguda atendidos en el servicio de urgencias del Hospital Civil de Guadalajara Fray Antonio Alcalde, Jalisco, México. Los principales criterios de inclusión de pacientes fueron las alteraciones del estado mental, el comportamiento, el estado de conciencia, así como los cambios en la personalidad, la letargia y la somnolencia en el curso de menos de 24 horas sin otra causa detectada. Entre los criterios secundarios se incluyó la presencia de fiebre (≥ 38 °C) durante las 72 horas previas a la hospitalización, las crisis convulsivas y los hallazgos neurológicos focales, así como el líquido cefalorraquídeo con un grado de alteración que no se correlacionara con la gravedad del cuadro, una pleocitosis de 5 WBC/mm3 o mayor, una resonancia magnética que revelara anormalidad del parénquima cerebral o neuroimágenes que sugirieran la presencia de encefalitis, localización de la inflamación o encefalomielitis diseminada aguda. Los casos con turbidez del líquido o cultivo bacteriano positivo se excluyeron del grupo de estudio.
Diseño del estudio
Todos los pacientes tenían menos de diez días de evolución a partir del inicio de los síntomas. Los principales síntomas fueron la fiebre de más de 38 °C, alteraciones de la conciencia y la conducta, alteraciones en el líquido cefalorraquídeo (se excluyeron aquellos con turbidez, daño traumático, intoxicación aguda por drogas o pesticidas), así como un historial previo de convulsiones e infección por el virus de la inmunodeficiencia humana (HIV). Se generó una base de datos en Excel para su posterior exportación a paquetes estadísticos.
Análisis del líquido cefalorraquídeo
Las punciones lumbares para la obtención de líquido cefalorraquídeo se ajustaron a los estándares éticos del Hospital Civil de Guadalajara Fray Antonio Alcalde. Las muestras se enviaron al laboratorio para la extracción de los ácidos nucleicos virales y se almacenó una alícuota a -80 °C para posteriores análisis.
Extracción de ácidos nucleicos virales
La extracción de los ácidos nucleicos viralesse hizo de manera automatizada en el equipo MagNAPure LC Roche Compact 2.0 con el estuche de extracción de ácidos nucleicos totales de referencia 03038505001; el procedimiento siguió las especificaciones del proveedor.
Transcripción inversa
Esta se hizo empleando la transcriptasa inversa del virus de la leucemia murina Moloney (Moloney Murine Leukemia Virus Reverse Transcriptase, M-MLV RT) (Invitrogen™, Cat # 28025-013), así como el inhibidor de ribonucleasas Recombinant RNasin® Ribonuclease Inhibitor, Promega (Cat. N2511). El procedimiento se llevó a cabo siguiendo las especificaciones del proveedor a partir de 5 ug deARN total.
Iniciadores y sondas para la identificación de neurovirus
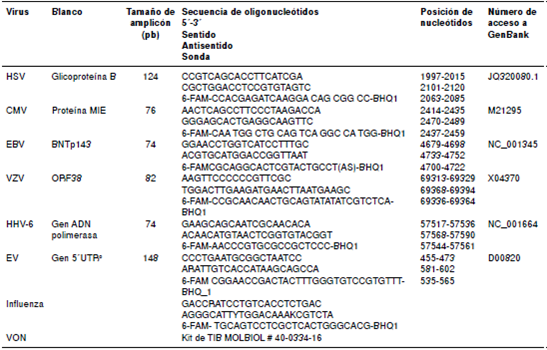
Las determinaciones se llevaron a cabo mediante PCR en tiempo real con sondas TaqMan®. Para la identificación de los neurovirus se usaron los iniciadores y las sondas descritas previamente para el citomegalovirus (CMV), el virus de Epstein-Barr (EVB), el virus varicela-zóster (VZV), el virus de herpes humano tipo 6 (HHV- 6) y los enterovirus (HEV) 9, diseñados con el programa Primer Express™, versión 2.0, de Applied Biosystems®, en tanto que los iniciadores y las sondas para el virus del herpes simple (HSV) se tomaron del protocolo validado de Spartan Bioscience©. Los del virus de influenza A se tomaron del protocolo de los Centers for Disease Control and Prevention (CDC) y, por último, para los del virus del Nilo occidental (WNV) se utilizó el estuche comercial de TIB MOLBIOL® # 40-0334-16, todos estos mencionados en el cuadro 1. Como control positivo interno se utilizó el gen de la gliceraldehído 3- fosfato deshidrogenasa (GAPDH) para determinarla presencia o ausencia de neurovirus. Los iniciadores y las sondas de Integrated DNA Technologies (IDT®) con calidad de cromatografía líquida de alta eficacia (high performance liquid chromatography, HPLC) (cuadro 1). Todos los controles positivos se adquirieron en vircell.
Los productos de cada juego de iniciador y sonda se validaron mediante PCR de punto final; con el programa Basic Local Aligment and Search Tool (BLAST) se comprobó que efectivamente los iniciadores flanquearan la región de interés y no reconocieran otra molécula diferente.
Se utilizó el equipo Light cycler® Nano de Roche para los estudios de diagnóstico viral y elLightCycler® TaqMan® Master para los ensayos de PCR en tiempo real con sondasTaqMan® (Roche, Cat No. 04 735 536 001), el cual contiene la enzima ADN polimerasa FastStart™ Taq DNA Polymerase, el tampón de reacción MgCl2 y el trifosfato dedesoxiadenosina (deoxyadenosine triphosphate, dNTP). Las cantidades de los reactivos se ajustaron a las especificaciones del proveedor para un volumen total de 20 µl.
Tipificación del HSV-1 y el HSV-2
La discriminación entre el HSV-1 y el HSV-2 se hizo mediante PCR de punto final utilizando el estuche de Seegene Seeplex® Meningitis-V1 ACE Detection (V2.0) (# Cat MG6611) siguiendo las especificaciones del proveedor.
Análisis estadístico
El análisis estadístico descriptivo se hizo con el programa estadístico SPSS, versión 20.0.0. Para todos los análisis se consideró un nivel de significación de p<0,05.
Consideraciones éticas
El estudio se adhirió a los principios éticos establecidos en la Declaración de Helsinki y fue evaluado y aprobado por el Comité de Investigación, Bioética y Bioseguridad del Hospital Civil de Guadalajara-FAA, Jalisco, México. Los pacientes incorporados al estudio aceptaron su participación mediante la firma del consentimiento informado y, cuando se trataba de menores de 16 años de edad, los padres autorizaron su participación.
Resultados
Se captaron 66 muestras, de las cuales seis fueron positivas para el HSV, ocho para enterovirus y dos para CMV. Los pacientes provenían del servicio de urgencias y del área de infecto-pediatría del hospital, y su media de edad era de 16 años (figura 1).
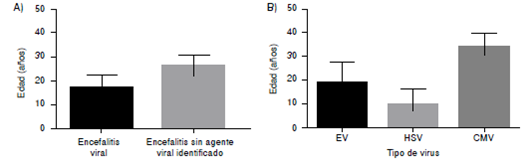
Figura 1 Distribución etaria de pacientes por grupo de estudio y virus identificado. Los datos se presentan como media y error estándar. A. Distribución de la edad por grupo de estudio. B. Distribución de la edad por tipo de virus identificado. EV: enterovirus, HSV: virus herpes simple, CMV: citomegalovirus
Características clínicas y demográficas
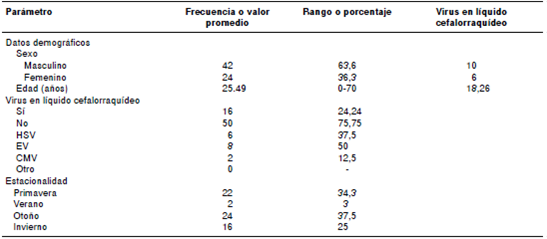
Se analizaron los datos demográficos de los 66 pacientes (cuadro 2), incluidos aquellos que no fueron positivos para ningún agente viral. En el momento de ingreso al hospital los pacientes habían sido diagnosticados con una gran variedad de condiciones: parálisis flácida aguda, encefalitis viral, cefalea, neuroinfección, epilepsia y estado convulsivo.
Se observó un mayor número de casos en otoño (24/64; 37,5 %), aunque dichos pacientes no eran necesariamente positivos. Asimismo, hubo una leve mayoría de casos en hombres (42/66; 63,6 %) comparados con las mujeres (24/66; 36,3 %),incluso entre quienes sí estaban infectados por un agente causal. El promedio de edad de los pacientes infectados fue de 25,5 años. La mediana de edad para los infectados por HSV fue de 4 (0- 43 años), para los infectados por HEV fue de 7,5 (1-70 años) y para los infectados por CMV fue de 34 (28-40 años).
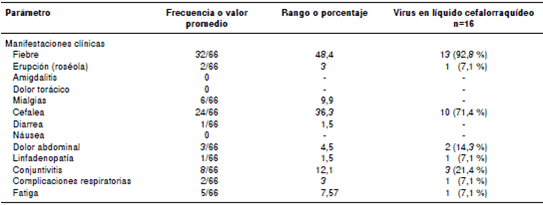
Se analizaron los datos clínicos (cuadro 3) de los 66 pacientes para establecer la frecuencia de la presentación de los síntomas importantes de la enfermedad: fiebre (48,4 %) y cefalea (36,3 %), los cuales son los principales síntomas de la triada para el diagnóstico presuntivo.
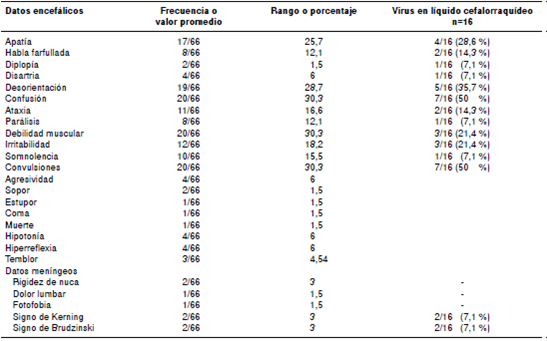
Los síntomas encefálicos y meníngeos se presentaron en menor proporción (cuadro 4), siendo la confusión, las convulsiones y la debilidad muscular los más frecuentes (30 % de los pacientes), seguidos de la desorientación (en 28,7 %). Solo dos de los pacientes presentaron el signo de Kerning y de Brudzinski (3 %) y únicamente un paciente falleció (1,5 %, por HEV).
Parámetros en el líquido cefalorraquídeo
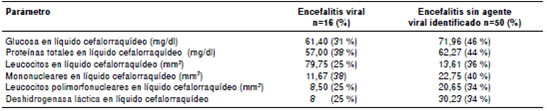
Los parámetros evaluados en las muestras de líquido cefalorraquídeo se resumen en el cuadro 5. Se obtuvieron los datos de glucosa normal en ambos grupos de estudio, un aumento de las proteínas en los dos grupos, y aumento de leucocitos con predominio mononuclear en el grupo de encefalitis viral. Por último, la deshidrogenasa láctica (DHL) fue significativamente mayor (p<0,05) en el grupo de encefalitis sin agente viral identificado. Los datos se presentan como media.
Tomografía axial computarizada
En 22 pacientes fue posible confirmar el diagnóstico mediante tomografia axial computarizada (figura 2), con la cual se detectaron zonas de inflamación y necrosis.
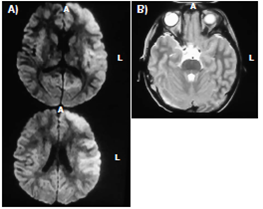
Figura 2 A. Paciente masculino de cinco años de edad con diagnóstico de encefalitis viral con imágenes hipertensas que comprometen la parte externa e inferior de los lóbulos frontal y temporal del lado izquierdo y parte del parietal, con leve incremento del tamaño de las astas posteriores de ventrículos laterales. B. En T2 se alcanza a visualizar la zona de necrosis de lóbulos temporales típicos de la encefalitis viral
Discusión
La encefalitis en México está subdiagnosticada debido a dos circunstancias principales: la mayoría de las veces el cuadro clínico es confundido con problemas psiquiátricos y no se identifican los patógenos en el líquido cefalorraquídeo por deficiencia en la implementación de herramientas diagnósticas moleculares efectivas y oportunas (PCR) en los hospitales. El reporte del agente causal de encefalitis no es obligatorio en el país, excepto en los casos de tuberculosis. Por ello, hasta la fecha no ha habido estudios de identificación directa del agente causal en los casos de encefalitis viral aguda mediante técnicas moleculares como la PCR. La PCR en tiempo real ha llegado a considerarse la prueba de referencia para el diagnóstico de infecciones virales 10. Existe un reporte de hace una década de un brote de enterovirus ECHO tipo 30 11, sin embargo, en el estudio el diagnóstico se basó exclusivamente en la presentación clínica de la condición. También se encontró otro reporte en el norte de México en el cual se alude a la vigilancia de flavivirus (dengue y WNV) en pacientes con encefalitis; en dicho estudio el diagnóstico se hizo con la técnica de ELISA 12,13, método que no identifica de manera directa el patógeno causal, por lo que podía tratarse de anticuerpos de una infección previa.
Los resultados epidemiológicos relacionados con la identificación de agentes etiológicos en líquido cefalorraquídeo descritos en el presente estudio concuerdan con lo reportado por otros grupos de investigación de distintos países. En el 24 % de las muestras recolectadas se identificó el agente viral en el líquido cefalorraquídeo, lo que coincide con el 22,9 % reportado en población polaca 14, en tanto que la identificación en población francesa se ha registrado en menos del 20% 15.
Entre los virus identificados el HEV fue el más frecuente, con ocho (50 %) casos de los 16 en los que el agente viral se identificó. Estos datos son similares a lo reportado en el 2008, cuando las infecciones por HEV (coxsackie y echovirus) fueron las más comunes: en 80 % de los casos de infecciones del sistema nervioso central en población pediátrica, seguidos de las infecciones por HSV 16. La prevalencia de HEV en la población pediátrica obtenida en el presente estudio coincide con lo reportado por Li, et al., en el 2015, en cuyo estudio, de los 13.206 pacientes analizados, 2.673 pacientes menores de 5 años de edad fueron positivos para HEV 17. Por último, con relación al sexo y la edad, nuestros resultados coinciden con reportes previos en los cuales el promedio de edad de pacientes con encefalitis viral fue de 18 años (24 %) en comparación con aquellos en los que no se identificó el agente (26 años, 76 %); el sexo masculino resultó más afectado (64 %), lo cual coincide con otro estudio que reportó 70 % de hombres afectados 18.
Las manifestaciones clínicas de la encefalitis viral son inespecíficas, aunque en ocasiones los pacientes presentan una constelación de signos frontales y temporales como afasia, cambios de personalidad y convulsiones focales, que sugieren el diagnóstico. El compromiso del estado de la conciencia, la fiebre, la cefalea, los cambios de personalidad, las convulsiones, los vómitos, la hemiparesia o la pérdida de memoria ocurren con la misma frecuencia observada en la encefalitis de otro origen. Los reportes sobre los signos y síntomas presentados por los pacientes son diversos, y en varios estudios se menciona que la mayoría de ellos presentó fiebre (80 %), cefalea (67 %) y, en mucha menor proporción, signos focales (<15 %) y fallecimientos (13,35%) 18. Lo observado en nuestros pacientes fue similar, aunque con menores frecuencias: fiebre (48,4 %) seguida de cefalea (36 %) y confusión y convulsiones (30 %). Solo dos de los pacientes presentaron el signo de Kerning y de Brudzinski (3 %) y solo un paciente falleció por encefalitis viral (1,5 %). Es importante señalar que en el estudio de Fica, et al., en el 2005, se detectaron 15 casos de encefalitis en dos lugares de Chile al cabo de 14 años de estudio. En nuestro estudio se incluyeron 66 pacientes a lo largo de tres años 19. Los valores de pleocitosis siguen siendo controversiales para delimitar las infecciones del sistema nervioso central 20,21.
Es importante mencionar, además, que en la situación epidemiológica actual se deben considerar los virus del chikungunya y el Zika como nuevos agentes causales de encefalitis 22,23.
Una limitante del presente estudio fue la falta de estudios para clínicos completos en todos los pacientes, lo cual hubiera permitido un análisis más amplio, así como los pocos estudios de imágenes diagnósticas, lo que hubiera permitido establecer más correlaciones con el agente etiológico identificado. Esta problemática no es exclusiva de México, pues incluso en muchos países desarrollados no se cuenta con estudios completos y en muchos casos no se identifica el agente etiológico 24.