Los anticuerpos son sensores moleculares importantes en la investigación biomédica. Se han usado ampliamente como herramientas diagnósticas y en la terapéutica de diversas enfermedades 1,2. En inmunología y alergología estas moléculas tienen aplicación como reactivos en la detección de proteínas involucradas en la fisiopatología de enfermedades alérgicas 3,4.
La producción de anticuerpos monoclonales y policlonales frecuentemente se hace empleando una gran variedad de mamíferos 5,6. Sin embargo, se ha visto que la inmunogenicidad obtenida en ratones, conejos y hámsters contra algunos antígenos es baja 7. Otros animales, como cabras, ovejas y caballos, a pesar de que permiten la obtención de mayores niveles de título y volumen de anticuerpos, son difíciles de manipular por su tamaño y su mantenimiento es costoso en condiciones de bioterio 8,9. Además, la producción de anticuerpos en mamíferos involucra una serie de procedimientos, como la toma de las muestras de sangre para el seguimiento de la titulación de los anticuerpos, que pueden ocasionar estrés, dolor y sufrimiento al animal, provocando cambios fisiológicos que añadirían otras variables a los resultados experimentales 7,10. Hoy existe un gran interés por la búsqueda e implementación de procedimientos alternativos experimentales (in vivo)para la producción de anticuerpos que impliquen un menor sufrimiento del animal. En este sentido, el uso de aves para la inmunización representa un refinamiento del proceso de producción de anticuerpos, ya que estas transfieren los anticuerpos del suero sanguíneo a la yema de huevo de donde se pueden extraer, metodología que se conoce como tecnología IgY 11-15.
En alergología experimental la tecnología IgY se ha utilizado en la producción de anticuerpos contra alérgenos de alimentos como el maní (Arachis hypogaea L.) 16. En el 2004 se describió el desarrollo de un anticuerpo IgY policlonal contra proteínas de avellana tostada, el cual se empleó en la detección de alérgenos de este fruto mediante un ensayo de ELISA competitivo indirecto, con un límite de detección de 10 µg/ml y una IC50 de 618 µg/l 17. En otro estudio se reportó el uso de la tecnología IgY para la detección simultánea de múltiples alérgenos de alimentos, tales como las proteínas de avellana, la nuez de Brasil y el maní, con límites de detecciónentre 0,1 y 1µg/g, lo cual demostró la viabilidad de estos anticuerpos en el diseño de pruebas inmunoquímicas para la detección de alérgenos 18.
También se ha descrito la producción de bibliotecas de fragmentos variables de anticuerpos de cadena sencilla (scFv) mediante la tecnología de producción en fagos a partir de una sola ave inmunizada, con lo que se obtuvieron inmunoglobulinas aviares contra el alérgeno recombinante de la saliva y el epitelio del gato (Fel d1), el alérgeno nativo del polen de la ambrosía (Amb a1) 19 y varios alérgenos nuevos de dos especies de cucaracha, Blattella germanica y Periplaneta americana20.
Dermatophagoides pteronyssinus, Dermatophagoides farinae y Blomia tropicalis son ácaros domiciliarios predominantes en regiones tropicales. Sus proteínas principales son una fuente de alérgenos aéreos sensibilizadores y participan en los mecanismos fisiopatológicos de la cascada inflamatoria de enfermedades alérgicas como el asma bronquial atópica y la rinitis alérgica 21. Entre los alérgenos principales están los del grupo 1 de la familia de las cisteína proteasa, que son los más dominantes en la expresión de la hipersensibilidad mediada por IgE contra ácaros del polvo doméstico 22, de aquí la importancia de obtener anticuerpos específicos para su detección y diagnóstico. En el 2014, Lee, et al., publicaron su estudio sobre la producción de anticuerpos IgY específicos contra proteínas de los ácaros D. pteronyssinus y D. farinae; sin embargo, en dicho estudio las IgYs obtenidas mostraron inmunorreactividad contra un amplio rango de proteínas en el Western blot, lo cual limitó su especificidad 23.
El propósito del presente estudio fue producir anti-cuerpos policlonales IgY específicos contra epítopes de alérgenos de los ácaros del polvo doméstico utilizando como inmunógenos oligopéptidos sintéticos no glicosilados diseñados por simulación computacional a partir de las proteínas naturales de los alérgenos del grupo 1 de los ácaros D. pteronyssinus, D. farinae y B. tropicalis (Der p 1, Der f 1 y Blo t 1, respectivamente).
Materiales y métodos
Diseño de epítopes y síntesis de péptidos
Los oligopéptidos se diseñaron a partir de las secuencias de aminoácidos de los alérgenos Der p 1, Der f 1 y Blo t 1 reportadas en las bases de datos de proteínas del National Center for Biotechnology Information (NCBI). Con el objeto de hallar secuencias específicas y homólogas, se emplearon secuencias no conservadas y conservadas de los alérgenos de este grupo, analizando la homología con los programas Blast (http://blast.ncbi.nlm.nih.gov/Blast.cgi) y Clustalw (http://www.ch.embnet.org/software/ClustalW.html). La hidrofobia de estos péptidos se evaluó con el programa ProtScale de ExPasy Molecular Biology (http://web.expasy.org/protscale/). Para el mapeo de los oligopéptidos diseñados en la estructura en 3D de Der p 1 se utilizó el programa Epítope Viewer (http://tools.immuneepitope.org/). Para la selección de los seis oligopéptidos definitivos se tuvo en cuenta que no fueran glicosilados, con el propósito de obviar la posible reactividad inespecífica o cruzada con otros epítopes de alérgenos.
Los oligopéptidos se sintetizaron en el Instituto de Inmunología de la Universidad del Valle, Colombia, mediante el método en fase sólida F-moc en un equipo automatizado Advanced ChemTech APEX 396, se purificaron mediante cromatografía líquida rápida de proteínas (Fast protein liquid chromatography, FPLC), y posteriormente se liofilizaron. La pureza de los péptidos se verificó por cromatografía líquida de alta eficiencia en fase reversa (Reversed phase high-performance liquid chromatography,RP-HPLC). La identidad de cada péptido se confirmó por espectrometría de masas.
Inmunización
Para la producción de los anticuerpos se inmunizaron un total de 12 gallinas de la variedad Hy Line Brown de 16 a 20 semanas de edad obtenidas en un centro avícola local. Se hicieron cuatro inmunizaciones en los músculos pectorales de las gallinas (dos gallinas por cada péptido sintético); cada inmunización se realizó a intervalos de dos semanas durante dos meses. Cada antígeno (oligopéptidos sintéticos) se inyectó en una concentración de 100 µg/ml, emulsionado en adyuvante completo de Freund (Sigma-Aldrich®) para la primera inmunización y en adyuvante incompleto de Freund (Sigma-Aldrich®) para los tres refuerzos siguientes. Los huevos se recogieron diariamente antes y después de la primera inyección, y se rotularon y almacenaron a 4 °C. Las gallinas del grupo de control se inyectaron con adyuvante completo e incompleto de Freund sin el antígeno, usando el mismo protocolo descrito para el grupo de estudio 12,24. El seguimiento del título de producción de los anticuerpos policlonales se hizo empleando una prueba de ELISA indirecta. Todos los protocolos experimentales se ajustaron a los parámetros de cuidado y uso del laboratorio de animales aprobados por los comités de ética de la Universidad Javeriana y la Universidad del Norte.
Extracción de los anticuerpos IgY
Los anticuerpos presentes en la yema de cada huevo se separaron siguiendo un protocolo modificado descrito previamente 25. Brevemente, el contenido de la yema se emulsionó en igual volumen de tampón salino fosfato 0,1 M con pH de 7,4 (PBS) y los lípidos se extrajeron con dos volúmenes de cloroformo. El sobrenadante con los anticuerpos se recolectó y se almacenó a -20 °C hasta su procesamiento y purificación.
Ensayo inmunoabsorbente ligado a enzima (ELISA)
La reactividad de los anticuerpos producidos por las gallinas se determinó mediante un inmuno-ensayo de ELISA indirecto. Los antígenosusados fueron extractos de proteínas totales de los ácaros D. pteronyssinus y B. tropicalis obtenidos previamente 26.
Se sensibilizaron placas de microtitulación de poliestireno (Nunc Maxisorp®) con 50 µl de extracto de proteína de ácaro en una concentración constante de 20 µg/ml, correspondiente a 1 µg de proteína total por pozo, disueltos en solución reguladora de fosfatos (PBS 1X, pH 7,4). Las placas se incubaron en cámara húmeda a 37 °C durante 18 horas, luego se bloquearon durante 2 horas a 37 °C con 200µl de solución de bloqueo (PBS 1X, Tween 20 al 0,05 % v/v, leche descremada al 5 % p/v), y se lavaron con solución PBST (PBS 1X /Tween 20 al 0,05% v/v).
Inicialmente se estableció la concentración de anticuerpos IgY para los inmunoensayos de ELISA, para lo cual se usaron extractos crudos IgY antipéptido P01 obtenidos ocho días después de la tercera inmunización, cuya concentración de proteína total se ajustó previamente en 2,5 mg/ml. Los extractos IgY se diluyeron a 1/250 y 1/500, 1/1000 y 1/2000 en solución de anticuerpo (PBS 1X, Tween 20 al 0,05% v/v, leche descremada al 2,5% p/v). Se agregó un volumen de 100 µl/pozo de cada dilución de IgY, y se incubó en cámara húmeda durante una hora a 37 °C. Con el fin de retirar los anticuerpos no unidos, se realizaron lavados cuatro veces con PBST como se describió anteriormente. Un volumen de 100 µl de conjugado anti-Chicken IgY-peroxidasa de rábano (HRP) (Promega® G1351) diluidoa 1/1000 se agregó a cada pozo, y se incubó durante una hora a 37 °C. Se hicieron tres lavados con solución de lavado. La prueba se reveló con sustrato TMB (3,3´,5,5´ tetrametilbenzidina) (SureBlue Reserve™ Microwell Substrate, KPL Inc.), la reacción se detuvo con ácido clorhídrico 1N y se leyó en un lector de placas Synergy™HT - BioTek, a una longitud de onda de 450 nm.
La mejor dilución de los extractos IgY se definió como aquella cuya absorbancia en el ELISA fuera mayor a la media ± tres desviaciones estándar (DE) de la absorbancia del extracto IgY pre-inmunización. La concentración de todos los extractos crudos de IgY se ajustó previamente en aproximadamente 2,5 mg/ml de proteína total.
Purificación de los anticuerpos IgY
Los extractos de las yemas de huevo que presentaron las concentraciones más altas de anticuerpos IgY se purificaron mediante cromatografía de columna tiofílica usando la técnica descrita por Hansen, et al.27, con algunas modificaciones introducidas en trabajos previos 25. La purificación se hizo en un equipo BioLogic™ LP System - Bio-Rad, y la monitorización de la cromatografía utilizando el programa LP Data View (Bio-Rad). Brevemente, la fase estacionaria (Sepharose® CL4B, Sigma-Aldrich) se activó con divinilsulfona (DVS) y beta-mercaptoetanol (β-MESH); un volumen de 2 ml del soporte activo se equilibró en 50 mM de solución reguladora de fosfato con pH de 7,4 a la cual se agregaron 0,5 M de Na2SO4(solución reguladora de equilibrio). Posteriormente, una dilución de 1:2 de la muestra en solución reguladora de equilibrio se agregó al soporte de sefarosa activada. La elución de la IgY retenida se obtuvo mediante la adición de 50 mM de la solución reguladora de fosfato con pH de 7,4 y se monitorizó mediante espectrofotometría a una longitud de onda de 280 nm.
La cantidad de proteína total presente en los extractos de yema de huevo antes y después de la purificación, se determinó mediante el microensayo de Bradford usando el estuche comercial Quick-Start™ Bradford Protein Assay de Bio-Rad®. La concentración de proteínas total en cada muestra se determinó extrapolando la absorbancia obtenida en una curva de titulación construida utilizando un patrón de gammaglobulina (GGB) 28.
Los extractos de los anticuerpos purificados se corrieron en un gel de poliacrilamida con dodecilsulfato de sodio (SDS-PAGE) usando un equipo Mini Protean® IIIcell (Bio Rad). Se prepararon geles de poliacrilamida con concentraciones 12 %T y 4 %C. Se sembraron 20 µg de muestra por pozo; el corrido electroforético se hizo a 120 V durante dos horas. Los geles se tiñeron con azul de Coomassie R-250 durante dos horas para luego ser visualizados con el equipo Universal Hood II, Serie n° 76S/7786 (Bio-Rad).
Para identificar las proteínas en los extractos de los ácaros reconocidas por las IgY purificadas se hizo un ensayo de Western blot. Brevemente, los extractos de proteínas de B. tropicalis y D. farinae (20 - 25 µg/carril) se separaron mediante electroforesis en gel de poliacrilamida con dodecilsulfato de sodio (sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE), como se describió antes. Las proteínas se transfirieron del gel a membranas de nitrocelulosa de 0,2 µm (Trans-Blot® Transfer Medium de Bio-Rad), luego se lavaron con una solución reguladora salina con Tris (TBS 1X) pH 7,5 y se bloquearon durante dos horas en una solución de bloqueo (TBS 1X/ Tween-20 0,1 % v/v/leche descremada 2,5 % p/v). Cada membrana se incubó durante dos horas en una dilución de 1/250 de IgY antipéptido P02, antipéptido P04, antipéptido P06 y pre-inmunización. El exceso de anticuerpo se lavó con solución TBST (TBS 1X/ Tween-20 al 0,1% v/v). Las IgY unidas se detectaron con el conjugado anti-Chicken IgY- peroxidasa de rábano (HRP) (Promega® G1351) diluidoa 1/1000 en solución de bloqueo. El revelado se hizo con una solución compuesta por imidazol al 0,1 % y diaminobenzidina al 0,001 % disuelta en PBS 1x Triton X-100 0,1 %, y 15 µl de peróxido de hidrógeno 30 % al 0,05 %. Después de visualizadas las señales, la reacción se detuvo con agua destilada.
Ensayos de especificidad de las IgY purificadas
ELISA indirecto. La especificidad de los anticuerpos purificados se evaluó mediante un inmunoensayo de ELISA indirecto siguiendo el protocolo descrito antes. Para estos experimentos se escogieron los anticuerpos IgY antipéptico P02 e IgY antipéptido P04 por presentar la mayor reactividad para B. tropicalis y Dermatophagoides sp, respectivamente; también se escogió el IgY antipéptido P06 por tratarse de un anticuerpo diseñado para B. tropicalis y Dermatophagoides sp.
Los antígenos provenían de extractos de cuerpo entero de ácaros D. pteronyssinus, D. farinae, B. tropicalis, así como un extracto de cuerpo entero de cucaracha (P. americana) donado por el Dr. Enrique Fernández-Caldas (Laboratorios Leti, Madrid, España), usado como control negativo y para evaluar la especificidad de los anticuerpos IgY.
Inicialmente se estableció la mejor dilución de los anticuerpos IgY purificados usando diluciones de 1/100, 1/250 y 1/500 ajustando previamente la concentración de proteína total en 1,5 mg/ml. Luego se determinó el límite de detección de cada anticuerpo sensibilizando las placas con 1 - 0,5 - 0,25 - 0,125 - 0,06 - 0,03 y 0 µg/pozo de proteína total de cada antígeno.
Dot Blot. Se prepararon diluciones dobles seriadas de cada extracto de ácaros (D. pteronyssinus, D. farinae y B. tropicalis) a partir de 0,5 a 0,03 µg/µl de proteína total en solución TBS 1X con pH de 7,5. Se agregaron 50 µl de cada dilución sobre una membrana de nitrocelulosa Z-probe (Bio-Rad). La membrana se incubó con los extractos durante dos horas a temperatura ambiente, luego se lavó tres veces con solución TBST y se incubó durante 45 minutos con solución de bloqueo. Los pasos de detección y revelado de los puntos se hicieron como se describió en el Western blot con una dilución de 1/100 de cada IgY en solución de bloqueo. Los puntos se analizaron con el programa de acceso libre Just Quantify Free Version 0.3 (http://www.sweday.com), programa que permite expresar cuantitativamente la intensidad de los puntos generados en cada reacción.
Análisis de datos
Para la producción de los anticuerpos se inmunizaron dos gallinas por cada péptido. Los ensayos de cuantificación de proteína total y las pruebas de ELISA se llevaron a cabo por duplicado. Todos los datos obtenidos se sometieron a un análisis estadístico univariado utilizando medidas de frecuencia y pruebas de tendencia central y de dispersión con el paquete estadístico SPSS Statistics 19 para Windows de IBM (SPSS Inc., an IBM Company, Chicago, H, IL, USA). Los gráficos se hicieron con el paquete ggData2, versión 2.1.0., en el programa R versión 3.2.1 (2015) (http://www.rstudio.com).
Consideraciones éticas
El estudio fue aprobado por los comités de ética de la Universidad del Norte y de la Pontificia Universidad Javeriana previo estudio del cumplimiento de las disposiciones determinadas en la Ley 84 de 1989 y los lineamientos consignados en la resolución No. 008430 de 1993 del Ministerio de Salud de Colombia sobre la investigación biomédica con animales.
Resultados
Diseño de epítopes y síntesis de oligopéptidos
Se diseñaron y sintetizaron seis oligopéptidos no glicosilados con tamaños entre 17 y 20 aminoácidos, los cuales se organizaron en tres grupos según el diseño de la secuencia, a saber: grupo A, conformado por los péptidos P01, P04 y P06, diseñados a partir de una secuencia homóloga de las cisteína proteasas de ácaros del género Dermatophagoide ssp. y de la especie B. tropicalis; grupo B, conformado por los péptidos P02 y P05 diseñados a partir de la secuencia del alérgeno Blot 1, y grupo C, conformado por el péptido P03 diseñado a partir de una secuencia homóloga del Der p 1 y Der f 1 (cuadro 1).
Cuadro 1 Secuencia de aminoácidos de los oligopéptidos de la cisteína proteasa de ácaros domiciliarios del género Dermatophagoides y la especie B. tropicalis (patente: US009416163B2)

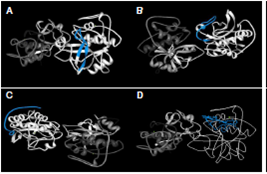
El mapeo de los oligopéptidos P01, P03, P04 y P06 en la estructura en 3D de Der p 1 evidenció que las secuencias sintetizadas se encontraban expresadas en la proteína madura de la cisteína proteasa del ácaro D. pteronyssinus (figura1). El mapeo para los oligopéptidos de Blomia tropicalis (P02 y P05) no se hizo debido a que aún no se tiene una estructura en 3D de esta proteína.
Producción de anticuerpos IgY antiácaros
Se recolectaron los huevos de las gallinas cada ochodías a partir del día previo a la inmunización (día cero o pre-inmunización). La titulación de los extractos IgY antipéptido P01 evidenció que la mayor reactividad de este anticuerpo frente al extracto alérgeno de D. pteronyssinus (1µg/pozo) ocurrió con la dilución de 1/250 v/v, siendo significativamente mayor a la obtenida con el IgY pre-inmunización (figura 2). Por ello, se escogió esta dilución para evaluar la reactividad de todos los extractos IgY antipéptidos contra los alérgenos de B. tropicalis y D. pteronyssinus durante un periodo de inmunización de ocho semanas.
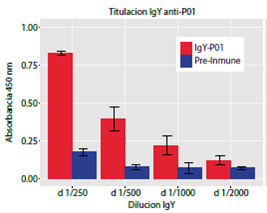
Figura 2 Titulación del anticuerpo IgY anti-péptido P01 en los extractos de yema de huevo. Las placas de titulación se sensibilizaron con extracto de D. pteronyssinus (1μg/pozo). Las diluciones de 1/250 y 1/500 del extracto IgY antipéptido P01 (2,5 mg/ml) mostraron ‘reactividades’ significativamente diferentes (> media ± 3 DE) a las de la IgY pre-inmunización (2,5 mg/ml).
Las IgY en los huevos de los animales inmunizados con el péptido P02 del grupo B presentaron su mayor reactividad antiácaros en el día 40 después de la primera inmunización, sin embargo, la reactividad fue más alta contra los alérgenos de B. tropicalis (figura 3). Asimismo, aquellos inmunizados con P05 y P03 mostraron un mejor reconocimiento de B. tropicalis. Por otro lado, los animales inmunizados con los péptidos P01 y P04 (grupo A), presentaron mayor título de anticuerpos contra D. pteronysinnus. El péptido P06 (grupo A), por su parte, reconoció las proteínas de ambos ácaros con una reactividad similar, alcanzando una reactividad máxima en el día 32 después del inicio del esquema de inmunización y coincidiendo con la tercera inmunización, lo cual podría explicarse por un fenómeno estocástico sin ninguna relación con la inmunización y la respuesta específica del modelo experimental.
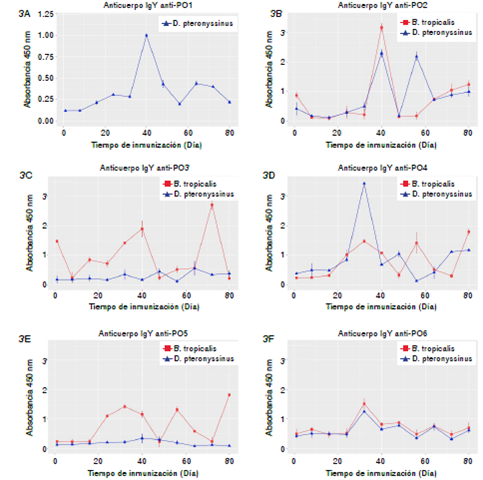
Figura 3 A. Reactividad de anticuerpos IgY antipéptido P01; B. P02; C. P03; D. P04, E. P05 y F. P06, en los extractos de yema de huevo (dilución de 1/250). Las placas de titulación se sensibilizaron con extractos de B. tropicalis (Bt) y D. pteronyssinus (Dp) con 1 μg/pozo. Las gallinas se inmunizaron en los días 1, 16, 32 y 48.
Extracción y purificación de los anticuerpos IgY
Las concentraciones de proteína total en los extractos ‘deslipidados’ de la yema de huevo fue de 3,49 ± 0,16 mg/ml; después de la purificación por columna tiofílica se obtuvo una concentración de IgY de 1,94 ± 0,68 mg/ml de extractos de yema de huevo, lo cual equivale a 18,9 - 39,3 mg de IgY por huevo.
El análisis de los extractos IgY mediante SDS-PAGE mostró dos bandas bien definidas, cuyos tamaños son cercanos a los reportados para las cadenas pesadas (67 kDa) y livianas (25 kDa) de la IgY 11. También se detectaron impurezas menores a nivel de los 110 kDa y una banda de alto peso molecular que podría ser la IgY completa (aproximadamente 160 kDa) (figura 4).
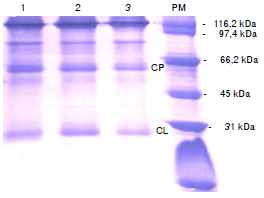
Figura 4 Perfil de la electroforesis SDS-PAGE de extractos de IgY en yemas de huevos. 1:- IgY antipéptido P02; 2:- IgY antipéptido P04; 3:- IgY antipéptido P06. CP: cadenas pesadas; CL: cadenas livianas; PM: marcadores de peso molecular (Molecular Weight Standards, Broad Range de Bio-Rad).
El Western blot con las IgY antipéptidos P02, P04, P06 y pre-inmunización, comparadas con los extractos de ácaros D. farinae y B. tropicalis, mostró que todas las IgY antipéptidos reconocían varias proteínas de los ácaros, destacándose dos bandas intensas entre los 21 y 31 kDa que podrían corresponder a los alérgenos Blo t 1 y Der f 1 (figura 5). Cheong, et al., estimaron un peso molecular de 26 kDa para la proteína nativa Blo t 1 detectada tanto en extractos crudos de B. tropicalis como en el medio de cultivo 29; por otra parte, el peso molecular estimado de la proteína madura del Der f 1 con una glicosilación es de 25,6 kDa 30. El reconocimiento inespecífico de otras proteínas se atribuye al carácter policlonal de los anticuerpos IgY.
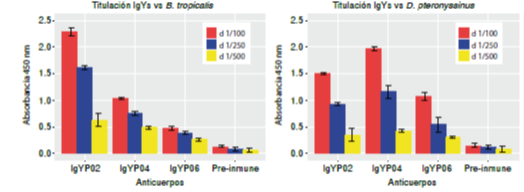
Figura 5 Western bot con las IgY antipéptidos P02, P04, P06 y pre-inmunización. Perfil electroforético de las proteínas SDS- PAGE de los extractos de ácaros D. farinae (Df) y B. tropicalis (Bt) (A). Inmunorreacción con los distintos anticuerpos y extractos de ácaros. Se muestra que todas las IgY antipéptidos reconocieron varias bandas electroforéticas en los extractos, destacándose una banda intensa en Bt y otra en Df a nivel de los 26 kDa, las cuales podrían corresponder a los alérgenos Blo t 1 y Der f 1. PM: marcadores de peso molecular (Molecular Weight Standards, Broad Range de Bio-Rad)
Titulación de los extractos de IgY purificados
Un ensayo de ELISA con diferentes diluciones (1/100, 1/250 y 1/500) de los IgY purificados por columna tiofílica permitió establecer que las diluciones de 1/100 y 1/250 v/v mostraron las reactividades más altas comparadas con las IgY pre-inmunización; sin embargo, la dilución de 1/100 produjo las mejores reactividades contra ambos extractos de ácaros, D. pteronyssinus y B. tropicalis (figura 6 A y B).

Figura 6 Titulación de los IgY purificados. Los anticuerpos IgY antiP02, antiP04 y antiP06, purificados por columna tiofílica, se titularon frente a los extractos de proteína total de los ácaros B. tropicalis (A) y D. pteronyssinus (B) en una concentración de 1μg/ pozo. La dilución de 1/100 v/v de los tres anticuerpos presentó las reactividades más altas con ambos ácaros, comparada con la del IgY pre-inmunización.
Inmunorreactividad y especificidad de las IgY purificadas
Las IgY antipéptidos P02, P04 y P06 purificadas por columna tiofílica fueron inmunorreactivas frente a los extractos alérgenos de ácaros D. farinae y B. tropicalis; sin embargo, las IgY antipéptido P02 fueron más reactivas al extracto de B. tropicalis, mientras que las IgY antipéptido P04 y P06 fueron más reactivas al ácaro D. farinae (figura 7A, B y C).
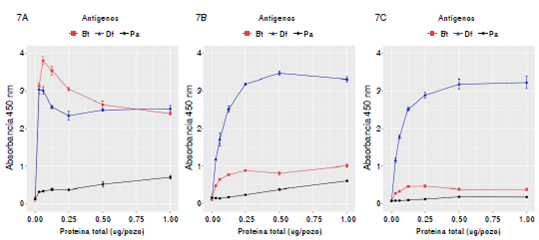
Figura 7 Especificidad de los IgY antipéptido purificados por columna tiofílica. La fuente de antígenos fueron los extractos alergénicos de los ácaros B. tropicalis (Bt), D. farinae (Df) y de la cucaracha P. americana (Pa) de 1 μg/pozo a 0 μg/pozo. Los anticuerpos IgY antipéptido P02 (A), antipéptido P04 (B) y antipéptido P06 (C) se usaron en diluciones de 1/100 (equivalentes a 15μg/ml). Todos los IgY antipéptidos fueron inmunorreactivos contra los extractos de ácaros en la concentración mínima ensayada (0,03 μg/pozo de proteína total). Los IgY antipéptidos P02 y P04 mostraron un escaso reconocimiento inespecífico contra P. americana.
Por otra parte, los anticuerpos IgY antipéptido P02 y P04 mostraron un escaso reconocimiento inespecífico contra el extracto de la cucaracha P. americana (otra fuente común de alérgenos domiciliarios), en contraste con las absorbancias obtenidas contra D. fariane y B. tropicalis, lo cual confirma la especificidad de los anticuerpos contra alérgenos de los ácaros bajo las condiciones experimentales del estudio.
Los resultados del inmunoensayo Dot Blot concordaron con el ELISA indirecto, observándose una mayor actividad de unión de las IgY purificadas con las proteínas de extractos alérgenos de los ácaros D. farinae y B. tropicalis. Cuando se usó como antígeno el extracto de D. pteronyssinus, la actividad de unión fue más baja. Además, el extracto de yema de huevo pre-inmunización no reaccionó con los extractos alérgenos de los ácaros (figura 8).
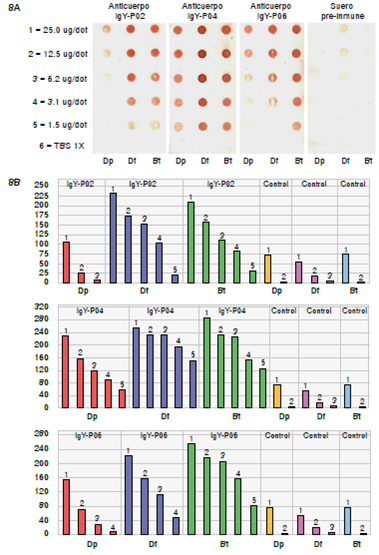
Figura 8 Dot Blot con las IgY antipéptidos P02, P04, P06 y suero pre-inmunización (control) frente a extractos alergénicos de D. pteronnyssinus (Dp), D. farinae (DF) y B. tropicalis (Bt). A. Resultados de la inmunorreacción con los distintos anticuerpos y antígenos. B. Gráficos de volumen de los puntos calculado con el programa Just Quantify free, versión 0.3. Los resultados evidenciaron que la IgY antipéptido P04 presentó una mayor inmunorreactividad contra los tres antígenos (Dp, Df y Bt).
Discusión
La síntesis de oligopéptidos y el mapeo mediante simulación computacional de epítopes de células B contenidos en estos oligopéptidos constituye una herramienta valiosa para el diseño de inmunógenos de aplicación en alergología 31-33. No se encontraron artículos científicos que describieran la producción de oligopéptidos sintéticos lineales no glicosilados de alérgenos mayoritarios de los ácaros D. farinae y B. tropicalis, como tampoco sobre su aplicación en alergología experimental. En el presente estudio se sintetizaron seis oligopéptidos a partir de secuencias de los alérgenos Der p 1, Der f1 y Blo t 1, los cuales se utilizaron como inmunógenos en un modelo experimental aviar. Los seis péptidos diseñados indujeron la producción de títulos elevados de anticuerpos IgY policlonales frente a extractos alérgenos de ácaros domiciliarios. Durante las ocho semanas de inmunización, los títulos de anticuerpos fueron diferentes entre los grupos, siendo los animales inmunizados con el péptido P02 y P04 los que produjeron los títulos más elevados de anticuerpos. Existen factores asociados a las características de los péptidos que pueden influir en el proceso de inmunización y la obtención de un título de anticuerpos en cualquier organismo; algunos de ellos pueden ser: 1) la sensibilidad a la proteólisis; 2) la estabilidad durante la administración en el cuerpo del animal; 3) la disposición de epítopesmásantigénicos, y 4) el plegamiento del péptido en conformaciones que no correspondan a la secuencia dentro de la proteína intacta 34. Por otra parte, Leenaars, et al., han señalado algunos factores asociados al proceso de inmunización que pueden contribuir a que el título de anticuerpos varíe, por ejemplo, causar estrés o dolor al animal durante la inmunización, usar un antígeno mal homogenizado con el adyuvante, lo cual impide una correcta administración del antígeno en el sistema inmunitario del animal, y no inyectar de forma adecuada, causando que el antígeno se introduzca por una vía distinta a la intramuscular, como la intradérmica, la cual es menos eficiente en la distribución del antígeno en el animal 7.
Los anticuerpos IgY antipéptidos P02, P04 y P06 reconocieron proteínas en los extractos alérgenos de D. farinae y B. tropicalis. Las secuencias de Der f 1 y Blo t 1, publicadas en la base de datos de proteínas del NCBI, tienen un 32,8 % de identidad entre ellas, lo cual posibilita que los anticuerpos reconozcan epítopes compartidos. Asimismo, la similitud estructural entre las proteínas puede hacer que la disposición de los residuos expuestos en la superficie de la estructura terciaria influya en la unión de los anticuerpos a las cisteína proteasas usadas 35,36. Estas hipótesis está respaldada por las observaciones de Cheong, et al., quienes publicaron la secuencias de aminoácidos de una proteína recombinante del Blo t1, la cual presentó 34 y 32 % de identidad con Der p1 y Der f1, respectivamente; el modelamiento molecular del Blo t1 y Der p1 sobre la estructura cristalina de otras dos cisteínas proteasas, la actinidina y la papaina, demostró que Blo t 1 presenta una gran similitud estructural con Der p 1 en tres regiones importantes: un dominio I de la hélice alfa conformado por residuos del extremo N-terminal; un dominio II de hoja beta plegada antiparalela y hélices cortas conformado por residuos del extremo C-terminal, y en una hendidura ubicada entre los dominios I y II, la cual conforma el sitio catalítico 30.
En cuanto a la especificidad de los anticuerpos, las IgY antipéptidos P02, P04 y P06 tuvieron un muy bajo reconocimiento de las proteínas de P. americana (extracto de cucaracha), un insecto que se ha descrito como otra fuente importante de alérgenos domiciliarios 37,38. Esto demuestra la utilidad del uso de estos anticuerpos para la monitorización de la presencia o concentración de alérgenos de ácaros en espacios intramuros.
Hasta donde se sabe, este es el primer reporte de producción de anticuerpos IgY policlonales contra alérgenos del grupo 1 de los ácaros domiciliarios producidos por la inmunización de aves utilizando oligopéptidos sintéticos no glicosilados. Se ha descrito la producción de anticuerpos monoclonales y policlonales contra alérgenos Der p 1, Der f1 y Blo t1 usando ratones para la inmunización 39. Estos anticuerpos se han utilizado para la cuantificación de alérgenos de ácaros en muestras de polvo domiciliario y la purificación de alérgenos nativos a partir de extractos totales 40-42. A diferencia del modelo de inmunización en ratones, el uso de gallinas para la producción de anticuerpos permite una mayor producción de anticuerpos en las yemas de los huevos, lo cual disminuye los costos de producción. En este trabajo se obtuvo una concentración de IgY de 1,94 ± 0,68 mg/ml de extracto de yema de huevo, y una producción de 18,9 a 39,3 mg de IgY por huevo, cantidad superior a la producción de anticuerpos IgG reportada en mamíferos 43.
En su conjunto, los resultados presentados en este trabajo sugieren que los anticuerpos IgY policlonales antialérgenos del grupo 1 de los ácaros del polvo doméstico podrían usarse en futuros protocolos de diagnóstico y control de alérgenos de ácaros en ambientes intramuros.