La osteoporosis es una alteración esquelética común que se caracteriza por una baja densidad mineral ósea, deterioro de la microarquitectura ósea y un incremento de la propensión a las fracturas, especialmente de cadera, columna vertebral y muñeca 1. Se ha determinado que su relevancia aumenta en relación directa con el envejecimiento de la población, ya que la probabilidad de fracturas relacionadas con esta condición es mayor en mujeres de más de 50 años 2. En México, la osteoporosis representa un serio problema de salud pública; Clark, et al., en el 2009, señalaron que el 17 % de las mujeres y el 9 % de los hombres mayores de 50 años de ese país presentaban osteoporosis y estimaron que para el 2050 la cantidad de casos de fracturas de cadera será de 110.055, lo que representaría un costo sumamente elevado para los sistemas de salud 3.
La patogenia de la osteoporosis es multifactorial, ya que resulta de la interacción de componentes genéticos y ambientales. Se estima que la densidad mineral ósea es de carácter hereditario en más del 60 % de los casos 4,5. En diversos estudios, se han podido identificar múltiples regiones génicas que se asocian con variaciones en la densidad mineral ósea y con la etiología de la osteoporosis, principalmente, en poblaciones con ascendencia europea y asiática 6-8. En el caso de la población mexicana, los estudios de caracterización de los factores genéticos involucrados en la propensión a desarrollar osteoporosis han sido de asociación en series de casos y controles. Los principales genes han sido el del receptor de la vitamina D, VDR9-12, el del receptor de estrógenos alfa, ER-alfa13, el del colágeno de tipo I alfa1, COLIA114, el de la interleucina 6, IL-615, el de la calcitonina 16 y el de la proteína 5 relacionada con el receptor de las lipoproteínas de baja densidad (Low-Density Lipoproteins, LDL), LRP517.
En varios estudios sobre la asociación con genes candidatos y del genoma completo (Genome-Wide Association Study), se han evidenciado múltiples regiones génicas relacionadas con variaciones en la densidad mineral ósea en algunas poblaciones. Sin embargo, algunos resultados son contradictorios, ya que dichas asociaciones no se repiten en otras poblaciones 6,18. Una de estas regiones se localiza en el gen MEF2C (Miocyte Enhancer Factor 2C), miembro de la vía de señalización Wnt 19. El producto de este gen participa en la regulación de la expresión de la esclerostina (SOST), la cual controla la actividad osteoblástica 20,21, y se ha sugerido que algunos de sus polimorfismos de un solo nucleótido (SNP) pueden estar asociados con variaciones de la densidad mineral ósea en el cuello femoral y en ambas caderas en la población europea y asiática, respectivamente 7,8,22.
Otro gen que participa en las variaciones de la densidad mineral ósea es el gen JAG1, el cual está involucrado en la diferenciación osteoblástica de las células madre mesenquimales (Human Mesenchymal Stem Cells, hMSC) por medio de la vía de señalización canónica Notch 23,24. En recientes informes del Genome-Wide Association Study, se ha establecido que el SNP rs2273061 del gen JAG1 se asocia con una baja densidad mineral ósea en la columna lumbar y en el cuello femoral en sujetos de ascendencia europea y en poblaciones asiáticas 25. En cuanto a los estudios en población mexicana, los grupos de trabajo de Rojano-Mejía y Velázquez-Cruz han investigado la posible asociación del polimorfismo rs2273061 con la densidad mineral ósea en mujeres mestizas mexicanas posmenopáusicas, en la Ciudad de México y en Cuernavaca, respectivamente, sin encontrar asociación 26,27.
Por otro lado, la proteína del factor neurotrófico derivado del cerebro (Brain-Derived Neurotrophic Factor, BDNF) codifica un miembro de la familia de neurotrofinas de factores de crecimiento que están relacionadas con la vía canónica del factor de crecimiento nervioso. En varios estudios se ha demostrado que dicho factor desempeña un papel clave en la diferenciación de los condrocitos, el desarrollo del cartílago y la osteogénesis 28. Se ha reportado que su ARN mensajero (ARNm) se expresa en osteoblastos de ratón (células MC3T3-E1) 29, y que el SNP rs6265, relacionado con la fosforilación en el factor neurotrófico derivado del cerebro, está asociado con la densidad mineral ósea en humanos 30. En estudios recientes, se ha descrito que el gen BDNF está asociado con las fracturas debidas a la osteoporosis y, en estudios funcionales, se ha demostrado que tiene un papel preponderante en la diferenciación osteoblástica 31.
La población mexicana es una mezcla con una estructura genética compleja; incluye genes de origen nativo americano (51 %), europeo (45,4 %) y africano (3,7 %) 32,33. Dicha complejidad genética se ha puesto de manifiesto en los análisis de las variaciones existentes entre las diferentes regiones geográficas 34 y, por ello, es necesario estudiar detalladamente la estructura poblacional con datos geográficos para evaluar la frecuencia y la prevalencia de enfermedades genéticas en las diversas poblaciones del país.
Delezé, et al., compararon la densidad mineral ósea del cuello femoral y de la columna lumbar de 4.460 mujeres entre los 20 y los 69 años de edad, provenientes de zonas urbanas de México, y concluyeron que la densidad mineral ósea variaba significativamente según la región de la población estudiada: las mujeres del norte tenían una densidad mineral ósea más alta en la columna lumbar que las mujeres del centro o del sur 35.
Dado que son pocos los estudios que examinan la asociación de los SNP y la variación de la densidad mineral ósea, y que estos corresponden a poblaciones del centro del país, el objetivo de este estudio fue examinar la posible asociación de los SNP de los genes JAG1 (rs2273061, rs6514116, rs2235811 y rs6040061), MEF2C (rs12521522, rs11951031 y rs1366594) y BDNF (rs6265), con la variación de la densidad mineral ósea en mujeres del norte de México.
Materiales y métodos
Población de estudio
El grupo de estudio incluyó mujeres nacidas en el norte de México, con antecedentes de, al menos, dos generaciones oriundas de esta región; no se consideraron la raza ni la etnia.
La invitación a participar en el estudio se hizo de forma directa o a través de redes sociales. En total, 180 mujeres de 40 a 80 años de edad respondieron a la invitación y acudieron al Centro de Investigación en Nutrición y Salud Pública de la Facultad de Salud Pública y Nutrición de la Universidad Autónoma de Nuevo León.
Se excluyeron las participantes con enfermedades o condiciones que pudiesen tener efecto sobre el metabolismo óseo (trastornos crónicos, enfermedades metabólicas y enfermedades esqueléticas diferentes a la osteoporosis), menopausia precoz (antes de los 40 años), pacientes que utilizaban fármacos con efecto en el metabolismo óseo (terapia de reemplazo hormonal, corticoides, anabolizantes, medicamentos anticonvulsivos e inhibidores de la resorción ósea); además, como lo sugieren Deng, et al.36, para este tipo de estudios, se excluyeron las mujeres con parentesco familiar, con lo cual se incluyeron 124 mujeres aparentemente sanas.
El estudio fue aprobado por el Comité de Investigación de la Facultad de Salud Pública y Nutrición (14-FaSPyN-SA-07), y se obtuvo el consentimiento informado de todas las participantes según lo establecido en el Reglamento de la Ley General de Salud de México en materia de investigación para la salud 37.
Determinación de la densidad mineral ósea
La determinación de la densidad mineral ósea de todo el cuerpo, en ambas caderas, en el cuello femoral, en el triángulo de Ward, en el trocánter, en la columna lumbar antero-posterior, L1-L4 y L2-L4, se hizo mediante absorciometría dual de rayos X utilizando el densitómetro Lunar Prodigy Advance™, modelo 301264, (GE Healthcare), según el protocolo proporcionado por el fabricante. Las mediciones se presentan en gramos por centímetro cuadrado (g/cm2).
Genotipificación
La extracción del ADN genómico a partir de muestras de sangre periférica de las participantes, se hizo utilizando el estuche comercial QIAamp DNA Blood Maxi Kit™ (QIAGEN Inc., Valencia, CA), según las instrucciones del fabricante.
Los SNP se seleccionaron de acuerdo con los siguientes criterios: una frecuencia del alelo menor (Minor Allele Frequency, MAF) de más del 5 % en población caucásica, aquellos previamente asociados con la densidad mineral ósea en estudios de asociación con el gen candidato, en el Genome-Wide Association Study y en metaanálisis.
La genotipificación de los SNP se hizo mediante ensayos de discriminación alélica, utilizando las siguientes sondas TaqMan™ ya diseñadas (Applied Biosystems, Foster City, CA): C_29449322_10 para rs6514116, C_16177763_10 para rs2273061, C_1265674_1_ para rs2235811 y C_1265679_20 para rs6040061 en el gen JAG1; C_3297670_10 para rs1366594, C_2836624_10 para rs12521522, C_2836609_10 para rs11951031 en el gen MEF2C, y C_11592758_10 para rs6265 del gen BDNF.
Cada sonda TaqMan™ consta de un solo tubo listo para su uso, el cual contiene dos oligonucleótidos específicos de la secuencia para amplificar el SNP de interés, dos sondas TaqMan™ específicas para la detección de los alelos del SNP, una marcada en el extremo 5’ con el fluoróforo VIC™ para el alelo 1 y con FAM™ para el alelo 2. Además, ambas sondas contienen en el extremo 3’ una molécula apagadora (quencher) unida al fluoróforo TAMRA™, el cual inhibe la emisión de la fluorescencia mientras la sonda permanece intacta.
Durante la reacción de PCR, hay hibridación de los oligonucleótidos con una secuencia específica del molde de ADN; si este contiene la secuencia polimórfica, la sonda TaqMan también presenta hibridación con su secuencia homóloga. En la PCR, la enzima AmplitaqGold, que tiene actividad tanto de la ADN polimerasa como de la exonucleasa 5’ → 3’, es capaz de digerir la sonda marcada durante la amplificación y liberar al fluoróforo de la acción del quencher, por lo que, bajo las condiciones utilizadas durante la reacción, solo la sonda específica para el SNP presente sufre hibridación. De esta forma, es posible diferenciar un alelo del otro con base en el tipo de fluorescencia emitida.
Las reacciones de PCR se hicieron en un volumen final de 5 μl cada una, siguiendo el protocolo del fabricante; se llevaron a cabo en una placa de 96 pocillos en un sistema de PCR en tiempo real (StepOnePlus Real-Time PCR System™, Thermo Fisher Scientific, Inc.). El protocolo de amplificación consistió en un ciclo de 10 minutos a 95 °C, seguido de 45 ciclos de 15 segundos a 95 °C y de 60 segundos a 60 °C. Los genotipos se asignaron mediante la detección de fluorescencia específica del alelo con el programa SDS 2.2.3 para la discriminación alélica (Applied Biosystems, Foster City, CA).
Análisis estadístico
Los datos bioquímicos y antropométricos se presentan como promedios y desviaciones estándar. Las frecuencias genotípicas y alélicas de todos los SNP se expresaron como porcentajes. Para descartar la subestructura genética de la población, se compararon las frecuencias alélicas de los SNP presentes en las mujeres que conformaban la generación 15 (54 a 80 años) y la generación 16 (menores de 53 años), para lo cual, primero se determinó que ambas poblaciones estuvieran en equilibrio de Hardy-Weinberg y, posteriormente, se analizó la similitud en la frecuencia de alelos con la prueba de ji al cuadrado. El equilibrio de Hardy-Weinberg se determinó utilizando el programa de Court 38, disponible en internet.
La asociación entre la densidad mineral ósea y los polimorfismos, se determinó mediante un análisis de regresión lineal simple, ajustando los valores por edad e índice de masa corporal (IMC). En estos análisis se utilizaron los modelos de herencia aditivo (1/1 Vs. 1/2 Vs. 2/2), dominante (1/1 Vs. 1/2 + 2/2) y recesivo (1/1 + 1/2 Vs. 2/2), como lo proponen Iniesta, et al. 39. Los análisis estadísticos se hicieron con el programa SPSS™, versión 20 (SPSS, Inc.; Chicago, IL, USA). Los valores de p menores de 0,05 se consideraron estadísticamente significativos.
Resultados
Las características generales de la población estudiada se presentan en el cuadro 1. En la etapa inicial se analizaron ocho SNP: cuatro del gen JAG1, tres del gen MEF2C y uno del gen BDNF, cuyos detalles se describen en el cuadro 2. Dos de los polimorfismos del gen MEF2C resultaron monomorfos en la población estudiada (para el rs12521522 solo se obtuvo el genotipo TT y, para el rs11951031, solamente el genotipo CC), por lo que fueron excluidos de los análisis posteriores.
Cuadro 1 Características generales de la población estudiada
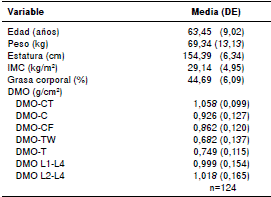
DE: desviación estándar; IMC: índice de masa corporal; DMO: densidad
mineral ósea; CT: todo el cuerpo; C; cadera, CF: cuello femoral; TW:
triángulo de Ward; T: trocánter; n: número de pacientes.
L1-L4: lumbar 1-4
L2-L4: lumbar 2-4
Cuadro 2 Información correspondiente a los polimorfismos de un solo nucleótido analizados en este estudio
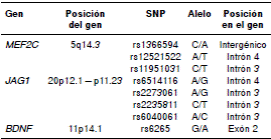
SNP: polimorfismo de un solo nucleótido
Para descartar la existencia de subestructuras genéticas y, dado que la ciudad de Monterrey fue fundada en 1596 y hasta el momento han transcurrido 17 generaciones, se compararon las frecuencias alélicas de los SNP presentes en las generaciones 15 (mujeres de 54 a 80 años, n=103) y 16 (mujeres de 40 a 53 años, n=21). En general, en las dos generaciones la distribución alélica de los SNP analizados fue similar, observándose valores de p entre 0,19 y 0,52; ambas poblaciones estuvieron en equilibrio de Hardy-Weinberg (p entre 0,51 y 0,99). El único SNP que no cumplió con esta condición fue el rs6265 del gen BDNF (p=0,01 y p=0,03 para las generaciones 15 y 16, respectivamente).
Las frecuencias alélicas y genotípicas de los polimorfismos en la población total, se muestran en el cuadro 3. Se observó que los polimorfismos de los genes JAG1 y MEF2C se encontraban en equilibrio de Hardy-Weinberg, en tanto que el correspondiente al gen BNDF no cumplía con esta condición.
Cuadro 3 Frecuencias genotípicas, alélicas y valores de p del equilibrio de Hardy-Weinberg de los polimorfismos de un solo nucleótido de los genes JAG1, MEF2C y BDNF en mujeres del norte de México
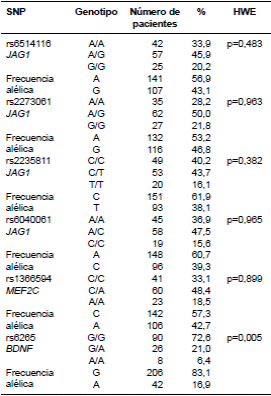
SNP: polimorfismo de un solo nucleótido
HWE: equilibrio de Hardy-Weinberg
Los resultados de los análisis de regresión lineal con asociación significativa o tendencias de asociación entre los SNP y las variaciones de la densidad mineral ósea, se presentan en el cuadro 4. Solo el rs2235811 del gen JAG1 se asoció significativamente con variaciones de la densidad mineral ósea de todo el cuerpo, al utilizar el modelo dominante. El resto de los SNP del gen JAG1 (rs6514116, rs2273061 y rs6040061) mostraron tendencias a asociarse (valores de p>0,050 y <0,099) con variaciones de la densidad mineral ósea de todo el cuerpo con el mismo modelo. Asimismo, los SNP rs2273061, rs2235811 y rs6040061 mostraron tendencia a asociarse con la densidad del trocánter en el modelo dominante, en tanto que con los rs2235811 y rs6040061 se observaron tendencias de asociación con la densidad mineral ósea del triángulo de Ward en el modelo recesivo.
Cuadro 4 Asociación de los polimorfismos de los genes JAG1, MEF2C y BDNF con la densidad mineral ósea en mujeres del norte de México
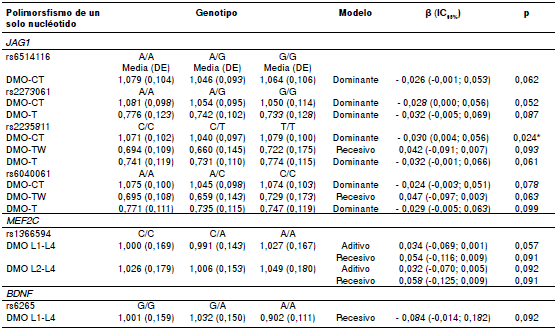
DE: desviación estándar; DMO: densidad mineral osea; CT: todo el cuerpo; TW: triángulo de Ward; T: trocánter; L1-L4: lumbar 1-lumbar 4; L2-L4: lumbar 2-lumbar 4; *Diferencia estadísticamente significativa (p<0,05)
Por otra parte, el rs1366594 del gen MEF2C no mostró asociación estadísticamente significativa con las regiones óseas analizadas; sin embargo, en la columna lumbar (L1-L4) se determinó una tendencia a la asociación con variaciones de la densidad mineral ósea en los modelos aditivo y recesivo; también, se observó esta tendencia a la asociación con la región L2-L4. Por último, con el rs6265 del gen BDNF solo se observó una tendencia a la asociación con la región L1-L4 en el modelo de herencia recesivo.
Discusión
En este estudio se analizó la asociación de ocho polimorfismos de los genes JAG1, MEF2C y BDNF con variaciones en la densidad mineral ósea de mujeres del norte de México.
En la población analizada, los SNP rs12521522 y rs11951031 del gen MEF2C fueron monomorfos, resultados similares a los reportados en estudios de otros autores en la población mexicana 27. Con el rs1366594, el alelo A resultó ser el de menor frecuencia, aunque con una frecuencia superior (0,43) a la encontrada previamente en la población mexicana (0,33) y en la africana (0,14) 27, y fue similar a la de la europea (0,52) y la asiática (0,39) 8,40. Aunque se confirmó la presencia del rs1366594, no se encontró asociación significativa con la densidad mineral ósea de las diferentes regiones corporales analizadas. Este resultado concuerda con lo descrito previamente en la población del centro de México 27, pero difiere de los resultados obtenidos por Park, et al. 23, quienes reportaron una asociación de este SNP con la densidad mineral ósea del cuello femoral, pero no con la de la columna lumbar, en una población coreana.
Las frecuencias de los alelos menores de los SNP rs2273061, rs2235811 y rs6040061 del gen JAG1, fueron similares a las reportadas previamente para la población mexicana 26,27; la frecuencia del alelo menor del rs2273061 fue superior a la descrita para la población de Hong Kong 25. Los análisis de asociación de los polimorfismos del JAG1 con la densidad mineral ósea, revelaron que únicamente el rs2235811 se asociaba con variaciones en la densidad ósea de todo el cuerpo. Estos resultados concuerdan con lo reportado en estudios en mujeres mexicanas posmenopáusicas de origen étnico mestizo en el centro del país, en los que tampoco se encontró una asociación significativa 26,27. Aunque no de manera significativa, algunos SNP mostraron tendencia a asociarse con diferentes regiones óseas, principalmente en el modelo dominante.
Es interesante señalar que los resultados obtenidos, tanto en este estudio como en estudios previos en población mexicana, evidencian que, mientras que el rs2235811 del JAG1 se asoció con variaciones de la densidad mineral ósea, en el resto de los SNP no se observó tal asociación. Estos resultados son completamente antagónicos a los reportados en estudios en poblaciones europeas o asiáticas, en los cuales se ha determinado que los SNP rs2273061 y rs6514116 son los que presentan asociación significativa con la densidad mineral ósea del cuello femoral y la columna lumbar, mientras que con el rs2235811 no se ha observado tal asociación.
En cuanto a los polimorfismos del gen BDNF, en investigaciones recientes se ha encontrado que el polimorfismo rs6265 se asociaba con variaciones en la densidad mineral ósea 6,30,41. Este SNP se caracteriza por el cambio alélico G/A y, en el estudio de Estrada, et al., de 2012 en varones de Europa y de Asia Oriental, se asoció significativamente con la densidad mineral ósea del cuello femoral, siendo los homocigotos para el alelo de menor frecuencia (A) los que presentaron menor densidad mineral ósea, en comparación con los individuos con el alelo G (GA y GG) 6. En otro estudio, Deng, et al.30, reportaron resultados similares al encontrar una asociación entre el rs6265 y la densidad mineral ósea de ambas caderas en sujetos tanto de origen caucásico como de origen asiático, en tanto que, en los individuos homocigotos AA, se determinaron niveles menores de densidad mineral ósea comparados con quienes presentaban el alelo G (GA y GG).
Por el contrario, en el presente estudio no se encontró asociación entre el rs6265 y la densidad mineral ósea de las mujeres participantes, aunque debe señalarse que este SNP no presentaba el equilibrio de Hardy-Weinberg. La pérdida de dicho equilibrio puede deberse a una baja frecuencia del alelo menor y al método de genotipificación empleado, lo que podría dar lugar a sesgos en la interpretación de los resultados, ya que en ocasiones resulta más fácil detectar un genotipo que otros 39. Esta es una de las posibles razones de no haber encontrado asociación entre el rs6265 y la densidad mineral ósea en la población de estudio, ya que la frecuencia del alelo menor fue muy baja en ella (0,17) y, por ello, estos datos deben tratarse con reserva. Otra posible interpretación de las discrepancias encontradas es que en el estudio de Deng, et al., de 2013, se hizo en varones de origen caucásico y asiático.
Por último, es importante considerar que, en la población estudiada, el alelo que presentó mayor frecuencia fue el G (83,1), el cual se ha asociado con valores de densidad mineral ósea mayores en el cuello femoral en comparación con el alelo A, hallazgo que sugiere que la población incluida en el presente estudio posee un alelo protector frente a los valores bajos de densidad mineral ósea.
La población de México es genéticamente diversa 34,42, por lo que se requieren estudios más detallados de la estructura genética para evaluar la frecuencia y la prevalencia de las enfermedades genéticas más comunes en sus poblaciones nativas y mestizas. En estudios anteriores, se han reportado diferencias significativas tanto genéticas como fenotípicas según la región geográfica, lo cual evidencia la necesidad de un análisis exhaustivo de las diferentes poblaciones del país.
En conclusión, este es el primer reporte sobre las frecuencias de los polimorfismos de los genes JAG1, MEF2C y BDNF en mujeres del norte de México en el que se ha detectado una asociación entre el SNP rs2235811 y la densidad mineral ósea de todo el cuerpo. Sin embargo, debido a la gran diversidad genética de la población mexicana, se requiere de una muestra más grande para confirmar la asociación detectada y tener un cuadro más completo de la predisposición genética hacia la osteoporosis y los SNP asociados con ella en la población del norte de México.














