La cuantificación de la inestabilidad cromosómica es un parámetro importante para estimar la radiosensibilidad y evaluar la genotoxicidad relacionada con la exposición terapéutica, ocupacional, ambiental o accidental. Los métodos convencionales emplean la visualización microscópica de daños cromosómicos o nucleares, sin precultivo celular o con él, como es el caso del ensayo clásico de alteraciones cromosómicas en linfocitos en división, o el de micronúcleos en linfocitos binucleados 1-5. Su amplio uso y su validez son incuestionables, pero demandan laboriosos análisis visuales de, por lo menos, un centenar de mitosis o dos mil células interfásicas por muestra, lo cual dificulta la rápida obtención de resultados. De ahí que la automatización o el empleo de la citometría de flujo constituyan alternativas para acortar los tiempos de análisis 3,6,7, y aumentar el poder estadístico, incrementando hasta en 20 veces el número de células analizables por muestra, como se evidencia en el presente reporte.
Los eritroblastos son una población celular mitóticamente activa, precursora de eritropoyesis, con nicho en la médula ósea, cuyos núcleos se expulsan pocas horas después de la última mitosis. De allí se generan células enucleadas denominadas eritrocitos inmaduros o reticulocitos. Estas células recién producidas en la médula ósea fueron el blanco de observación para la prueba original in vivo de micronúcleos en extendidos de médula ósea de ratones estandarizado por Schmid 8,9. En humanos, los reticulocitos constituyen una fracción minoritaria de los eritrocitos circulantes, lo cual dificulta su empleo en esta prueba mediante microscopía. La citometría de flujo, en cambio, facilita su detección mediante la marcación diferencial de los reticulocitos con el anticuerpo anti-CD-71, el cual detecta la transferrina, que es la proteína encargada de transportar el hierro y es específica para esta población. El tamaño de los reticulocitos es similar al de las plaquetas, las cuales se pueden diferenciar, filtrar y descartar, empleando anti-CD-61 y citometría de flujo 10.
Por el otro lado, la evaluación de la genotoxicidad a nivel cromosómico en linfocitos de sangre periférica, se ha hecho tradicionalmente en cultivos celulares con presencia de un mitógeno, en tanto que el ensayo de micronúcleos basado en los reticulocitos, no tiene este requisito; además, una vez estandarizada la metodología, las células obtenidas no necesitan el precultivo y pueden procesarse de inmediato siguiendo procedimientos mínimos 3. Este es un método práctico y expedito para evaluar in vivo la inestabilidad cromosómica constitutiva o del daño genómico inducido, en personas expuestas a genotóxicos potenciales por razones terapéuticas, ocupacionales, ambientales o accidentales. Eventualmente, también se podría utilizar para evaluar la radiosensibilidad en pacientes que deban someterse a radioterapia.
El presente estudio se diseñó con el fin de estandarizar y adaptar la metodología propuesta por Dertinger, et al.11, para cuantificar micronúcleos en células RETCD71+ mediante citometría de flujo de tres canales, establecer el número basal de reticulocitos micronucleados en una población de voluntarios sanos, y cuantificar la frecuencia in vivo de micronúcleos en sangre periférica, en una población de pacientes con gliomas de alto grado, como forma de medir la inestabilidad citogenética antes del tratamiento.
Materiales y métodos
Reactivos
Se emplearon metanol absoluto (Merck, USA, I5680090), heparina sódica (Grand Pharma), solución de sales de Hank (HBSS-H1387), RNAsa (R5000) y el yoduro de propidio (P4170) de Sigma (St Louis, MO, USA), así como los anticuerpos humanos anti-CD71 (clon T56/14) y anti-CD61 (clon F11) de Invitrogen™ (Camarillo, CA, USA).
Población de estudio
Se incluyeron 50 voluntarios en el estudio: 25 personas sanas que fueron reclutadas en la Universidad de Antioquia y 25 pacientes recién diagnosticados con glioma de alto grado en el Instituto de Cancerología de la Clínica Las Américas en un lapso de 12 meses. A cada individuo se le tomó una muestra de 4 ml de sangre venosa en un tubo Vacutainer™ con heparina.
Los consentimientos informados fueron firmados por los voluntarios sanos antes de la toma de la muestra y por los pacientes después del diagnóstico y previa explicación por parte del médico. Los pacientes fueron pareados por edad (± 5 años) y sexo.
Fijación de la muestra
Se agregó 1 ml de sangre tratada con heparina a un tubo cónico con 5 ml de diluyente (500 unidades de heparina/ml: Hanks’s Balanced Salt Solution, HBSS); luego se fijó la muestra adicionando 450 μl de la dilución anterior en 5 ml de metanol frío (-80 °C), y se agitó en un agitador de vórtice durante 20 segundos, para luego almacenarla a -80 °C durante 24 horas.
Marcación con yoduro de propidio y anticuerpos conjugados
Después de la fijación, 1 ml de la muestra se agregó a un tubo cónico con 13 ml de diluyente HBSS, se centrifugó durante cinco minutos a 600g y se descartó el sobrenadante por decantación; luego se agitó brevemente para resuspender el botón celular y se adicionaron 20 μl de esta suspensión de células a un tubo de citometría (polipropileno, 12 x 75 mm) que contenía 75 μl de solución ARNsa (980 μl de HBSS y 20 μl de ARNsa 1mg/ml).
Las muestras se analizaron usando tres marcadores: antiCD-71-PE, para identificar reticulocitos, anti-CD-61-FITC, para la exclusión citométrica de las plaquetas, y yoduro de propidio, para cuantificar la cantidad relativa de ADN. Se agregaron 5 μl de cada anticuerpo siguiendo las recomendaciones del proveedor.
Las muestras se incubaron consecutivamente durante 30 minutos a 4 °C y, luego durante 60 minutos a temperatura ambiente. Pasado este tiempo, se lavaron con 3 ml de HBSS y se centrifugaron durante cinco minutos a 600g; luego, se adicionó 1 ml de solución de yoduro de propidio (PI) (1,25 μg/ m de PI en HBSS). Por último, se almacenaron durante 15 minutos a 4 °C y se leyeron en un citómetro de flujo FACS Canto II™ (BD-Immunocytometry System, San José, CA).
Las células fueron excitadas con un láser de 488 nm y se analizó la emisión de los fluorocromos a 530/30 nm (FITC), 585/42 (PE) nm y 670/LP nm (yoduro de propidio). La adquisición de eventos para cada muestra procedió hasta que el número de células RETCD71+ fue mayor o igual a 80.000 o hasta que se agotó el volumen de la muestra. El porcentaje de células RETCD71+PI+ se determinó en cada muestra de sangre.
Cálculo de la compensación
Para calcular la matriz de compensación, se ajustaron los voltajes de tamaño, granularidad y fluorescencia de las muestras con una muestra de células sin tinción. Sobre dichos voltajes, se calculó la matriz de compensación utilizando las micropartículas Compbeads revestidas con anticuerpos de captura anti-Mouse Igκ mezcladas con cantidades equivalentes de perlas de control negativo.
El control de compensación para el yoduro de propidio se construyó utilizando el control negativo de las micropartículas CompBeats mezcladas con núcleos de eritrocitos de pollo (BD™ CEN).
La matriz se calculó de forma automática en el programa BD FACSDiva™, versión 6.1.3. La estabilidad en los índices de tinción se verificó en, por lo menos, tres momentos independientes. La estabilidad en los voltajes y la eficiencia de los detectores se verificaron mediante esferas BD Cytometer Setup and Tracking™ (CST). Los parámetros de lectura estuvieron dentro de las variantes aceptadas para el instrumento, estimados mediante las gráficas de Levey-Jennings construidas a partir de la señal de los detectores implicados en el análisis de los micronúcleos.
Estándares biológicos para la verificación de la compensación
En los análisis de citometría, se verificó la corrección del derramamiento espectral entre los fluorocromos mediante tinciones individuales para cada marcador de superficie según lo descrito por Dertinger, et al., y Torous, et al.12-14. Esta misma estrategia permitió establecer la positividad de las células en cada región.
Se prepararon cuatro muestras de cada individuo. La primera contenía 20 μl de la muestra con yoduro de propidio, la segunda, anti-CD-71-PE, y la tercera, anti-CD-61-FITC. Con estas se hizo la corrección de la compensación y con el cuarto tubo, que contenía ambos anticuerpos, se analizó el porcentaje de células CD61-CD71+ PI+ después de haber excluido células 2n y los agregados mediante una región definida sobre FSC-A Vs. FSC-H; luego, se determinó la frecuencia de reticulocitos micronucleados en la fracción de células RETCD71+.
Adquisición de datos y análisis estadísticos
Para la estimación de las frecuencias de reticulocitos micronucleados, se utilizó el programa de citometría de flujo FlowJo™ 7.6.2.
En cuanto al análisis estadístico univariado, se acudió a los indicadores clásicos de resumen, a saber, media, mediana, desviación estándar y coeficiente de variación para las variables cuantitativas, y porcentajes para las variables cualitativas.
En el análisis bivariado, dada la no normalidad del resultado en su escala original (establecida con la prueba de Shapiro-Wilk), se utilizó la prueba no paramétrica U de Mann-Whitney para determinar la diferencia en los rangos promedios del porcentaje de reticulocitos micronucleados con cada uno de los factores que ameritaron valoración.
En el análisis multivariado, se construyó un modelo de regresión logística explicativo, tomando como variable dependiente el porcentaje de dichos reticulocitos (normal-alto).
Debe advertirse que la categorización se originó al segmentar la variable original con un nivel de medición de razón y el porcentaje de reticulocitos micronucleados utilizando la media como criterio estadístico.
Se consideraron como variables independientes aquellas establecidas como importantes por su efecto sobre el resultado. La finalidad en la construcción del modelo de regresión logística estribó en controlar el efecto presuntamente confusor de cada una de las variables incluidas en el modelo frente a las otras. Estos resultados estadísticos se obtuvieron utilizando el programa SPSS™, versión 22.
Resultados
Selección de la población de análisis
Inicialmente, se descartaron los eventos celulares mayores a 2n mediante los parámetros de exclusión FSC-H y la incorporación de yoduro de propidio (figura 1 a); de allí, se tomaron los eventos menores de 2n (P1) y se excluyeron los agregados (P2) mediante el uso de los parámetros FSC-H y FSC-A (figura 1b). En la figura 1 c se muestra la distribución de las poblaciones celulares en cuanto a su tamaño (FSC-A) y granularidad (SSC-A). Posteriormente, y dado que las plaquetas tienen un tamaño similar a la porción de reticulocitos inmaduros, se utilizó el anticuerpo anti-CD61 para excluirlas (figura 1d), y se seleccionó la población correspondiente a células RETCD71+ (figura 1e). Por último, en la población seleccionada, se cuantificaron los eventos con mayor cantidad de yoduro de propidio, es decir, el cuadrante Q2-2 correspondiente a los reticulocitos micronucleados (figura 1f).
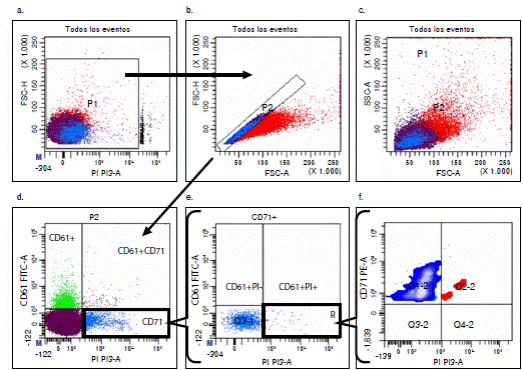
Figura 1 Gráficas bivaridas que ilustran la estrategia de portales (gating) usada para los análisis de muestras de sangre humana. a) Selección de eventos (<2n, P1); sobre el límite superior de esta región se observan las células 2n. b) Exclusión de agregados utlizando los parámetros de FSC-Area Vs. FSC-Height. c) Distribución de tamaño (FSC-A) Vs. granularidad (SSC-A); en color rojo aparecen los agregados y en azul los eventos únicos. d) Exclusión de plaquetas CD61+. e) Selección de la población celular RETCD71+. f) Cuantificación de reticulocitos multinucleados (RET-MN) (CD71+PI+)
Medición de la población de reticulocitos micronucleados
Las muestras de los 50 individuos (25 pacientes y 25 controles) se analizaron para detectar las frecuencias de células RETCD71+ y de reticulocitos micronucleados. El número de eventos únicos totales evaluados por individuo osciló entre 28.000 y 520.000, de los cuales alrededor del 1 % pertenecía a la población total de reticulocitos. Con base en el valor promedio de células RETCD71+ para estos individuos, y en los análisis con los cuales se midieron las frecuencias de reticulocitos establecidos sobre la fluorescencia asociada a los ácidos nucleicos, se estimó que el anticuerpo anti-CD-71-PE había marcado, aproximadamente, entre 98 y 100 % de la población de reticulocitos.
Comparación de las frecuencias de RET-MN de pacientes y controles
Inicialmente, se analizó el porcentaje de reticulocitos micronucleados en las muestras de voluntarios sanos, el cual varió entre 0,00 y 8,48 %, con una mediana de 2,31 % y un rango intercuartil de 3,51. En los pacientes con cáncer (gliomas de alto grado), por el contrario, las frecuencias de estos reticulocitos fueron mayores que en los controles (0,384; 61,76 %), con una mediana de 12,45 % y un rango intercuartílico de 18,325. Los datos de frecuencias se presentan en el cuadro 1.
Cuadro 1 Medidas estadísticas descriptivas del porcentaje de reticulocitos micronucleados.

RET-MN: reticulocitos micronucleados; CV: coeficiente de variación Los valores de p<0,05 indican diferencias significativas entre controles y pacientes.
En la figura 2 se presenta una gráfica bivariada que compara la frecuencia de las RETCD71+ de un voluntario sano (control) (figura 2 a) y la de un paciente con glioma de alto grado antes del tratamiento (figura 2b); como se observa en el cuadrante Q2-3, el número de reticulocitos micronucleados fue mucho más elevado en el paciente que en el control.
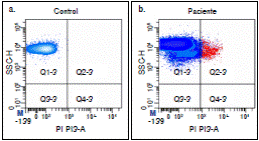
Figura 2 Gráfica bivariada que ilustra la resolución de fluorescencia de la subpoblación celular RETCD71+: a) en sangre periférica de un voluntario sano, y b) en un paciente con glioma antes de iniciar el tratamiento
En el análisis multivariado solo los casos tuvieron un efecto significativo sobre el porcentaje de reticulocitos micronucleados; de hecho, su porcentaje de riesgo alto (por encima de la mediana) fue 93,9 % más bajo en los controles que en los casos después de ajustar por las variables de ser hombre, consumir alcohol o tabaco, no consumir antioxidantes, usar medicamentos y ser adulto mayor (cuadro 2).
Cuadro 2 Regresión logística del análisis multivariado para el porcentaje del riesgo de reticulocitos micronucleados (MN-RET) según los factores de interés
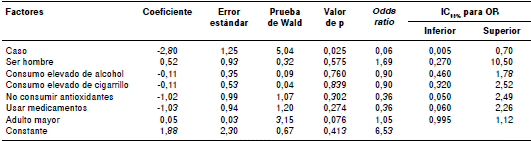
Aunque las demás variables constitutivas del modelo no tuvieron significación estadística, cabe mencionar que, al ajustar por las variables mencionadas, el riesgo de un porcentaje alto de reticulocitos micronucleados fue 68 % mayor en los hombres que en las mujeres, y 5,3 % mayor en adultos mayores que en los adultos jóvenes.
Por último, el análisis de las variables independientes evidenció que estas solo explicaron el 42,3 % de la presencia de reticulocitos micronucleados.
Discusión
La detección de micronúcleos por citometría de flujo en reticulocitos humanos se basa en la marcación de la población de interés y la cuantificación de dichos micronúcleos en estas células de manera específica, siguiendo un protocolo de fijación y marcación celular diferencial en muestras de sangre periférica.
Los procedimientos descritos en este artículo son sencillos y se basan en el uso de colorantes de ácidos nucleicos con gran especificidad para el ADN, así como los reportados por Dertinger, et al. La técnica no incluye la separación física de los eritrocitos CD71+ sino el uso de anticuerpos contra CD71 marcados con fluoróforos, que se utilizan para distinguir la fracción inmadura de los eritrocitos en el citómetro de flujo 6,12,13.
La eficiencia con la cual el bazo humano remueve de la circulación los eritrocitos que contienen micronúcleos, se ha considerado un obstáculo para utilizar la medida de reticulocitos micronucleados en sangre periférica como un indicador confiable del daño citogenético 12,13. Sin embargo, los datos presentados en este estudio sugieren que sería posible evaluar el daño citogenético en individuos no sometidos a esplenectomía utilizando un sistema de análisis de alto rendimiento, como el de la citometría de flujo, con el cual se puede detectar la rara aparición de la subpoblación RETCD71+ y de los micronúcleos.
Con base en los resultados obtenidos y la efectividad de este procedimiento, se puede afirmar que los reticulocitos recién formados en sangre periférica representan un blanco celular alternativo con muchas ventajas: se requieren bajos volúmenes sanguíneos; son muy pocos los pasos de procesamiento de la muestra, pues la cosecha de células es mínimamente invasiva; los requisitos del equipo son poco sofisticados, y el conteo es automatizado e imparcial, pues el análisis de muestras de sangre para la detección de micronúcleos excede las tasas de hasta 1.000 eventos por segundo, lo cual equivale a un gran número de células si se compara con las empleadas en microscopia óptica, en la cual se analizan máximo 2.000 células binucleadas por muestra 14. Además, se cuantifica simultáneamente el porcentaje de reticulocitos y el de reticulocitos micronucleados, y el tiempo requerido para recolectar los datos en el citómetro es de 20 minutos por muestra, aproximadamente 13.
La citometría de flujo da una indicación de la medida de inestabilidad genómica determinando la frecuencia de los reticulocitos micronucleados en una población, aunque tiene una única desventaja, y es que no provee información sobre la composición cromosómica de los micronúcleos ni distingue entre los diferentes mecanismos de acción de los inductores (clastogénicos o aneugénicos); el ensayo tampoco determina si una célulatiene un micronúcleo o varios, como sí lo hace la microscopía convencional 6.
Las muestras de sangre de los 25 voluntarios sanos fueron importantes para estimar el número basal de reticulocitos y de aquellos micronucleados. Aunque los porcentajes de estos últimos no fueron tan elevados en este grupo de control (2,31 %; RIQ=3,51), el coeficiente de variación fue alto (79,46 %). Al igual que en otros estudios 1,3,15-17, se observó un rango variable de micronúcleos en las frecuencias tanto de los voluntarios sanos como de los pacientes, lo que indica una variabilidad individual significativa. Así, el conocimiento de los cambios espontáneos en las frecuencias de estos eventos permitiría determinar los parámetros basales en la población.
Los análisis de covarianza demostraron que la variación en la frecuencia basal tal vez no está relacionada con la edad y el sexo, lo cual contrasta con otros estudios que sugieren efectos significativos de estos factores en la incidencia de micronúcleos. Tales discrepancias pueden estar relacionadas con diferencias en las células blanco (eritroblastos Vs. linfocitos) u otros factores inherentes a la variabilidad entre individuos 3,16.
Las frecuencias de micronúcleos antes del tratamiento en los pacientes con cáncer, también fueron variables y más elevadas que las de los voluntarios sanos, con una mediana de 12,45 % (RIQ=18,32), lo que evidenciaría la presencia en sangre circulante de factores genotóxicos de naturaleza aún desconocida, o una posible propensión a padecer la enfermedad, como se ha observado en otros estudios sobre diferentes tipos de cáncer 16-21. Los experimentos aquí descritos sugieren que los reticulocitosCD71+ micronucleados en sangre periférica podrían representar un posible biomarcador de la propensión a desarrollar este tipo de neoplasias.
Una de las estrategias más prometedoras para la prevención del cáncer es desarrollar y validar biomarcadores que puedan anticiparse al diagnóstico clínico. De hecho, los biomarcadores son instrumentos que ayudan a detectar personas en alto riesgo, y se pueden dividir en tres grupos: el primero, para definir la exposición a agentes carcinogénicos; el segundo, para mostrar efectos biológicos, y el tercero, para dar información sobre la propensión individual 21,22.
El uso de los micronúcleos como biomarcadores de genotoxicidad o riesgo de cáncer 23, se fundamenta en el hecho de que las alteraciones citogenéticas hacen parte del fenotipo tumoral y en la hipótesis de que el daño cromosómico está involucrado directamente en la etiología del cáncer 21,22. Sin embargo, es difícil establecer una relación causal entre el aumento del número de micronúcleos y el riesgo de cáncer, pues dicho aumento puede ser consecuencia de la enfermedad (causalidad inversa) o el reflejo de una propensión individual a eventos que generan inestabilidad genómica 16,22.
La asociación entre las frecuencias elevadas de micronúcleos y el riesgo de desarrollar cáncer, no está confinada a cánceres en sitios específicos 22. Sin embargo, reflejan la acumulación de alteraciones genéticas causadas por factores genotóxicos endógenos y exógenos, así como las variaciones individuales en la vulnerabilidad frente a estos factores 16,21.
Hasta la fecha, las investigaciones sobre biomarcadores en tumores cerebrales han presentado pocas opciones útiles para la práctica clínica, por lo que se hace necesario buscar nuevas opciones de marcadores tumorales, por ejemplo, los basados en sangre periférica o en biopsias líquidas, los cuales resultarían más prácticos que los actuales, ya que se pueden hacer sin necesidad de repetir la cirugía o las biopsias en los pacientes. La investigación de biomarcadores en gliomas de alto grado es todo un reto, dada la baja frecuencia y la diversidad genética de estos tumores. Además, al comparar con otros cánceres, su adopción en la práctica clínica se ha visto obstaculizada por las bajas tasas de detección.
Por último, cabe destacar que la detección de micronúcleos por citometría de flujo en reticulocitos humanos, es una técnica moderna, rápida y eficiente que evalúa la genotoxicidad en los reticulocitos micronucleados con un grado de eficiencia y sensibilidad sin precedentes. Los datos aquí suministrados respaldan la hipótesis de que las frecuencias de estos reticulocitos en sangre periférica pueden ser una alternativa de mayor sensibilidad que los análisis convencionales basados en la técnica de linfocitos binucleados, y podrían constituir una nueva herramienta validable como biomarcador para la predicción y la detección temprana del cáncer.














