Staphylococcus aureus es un importante agente responsable de varias infecciones en pacientes hospitalizados, incluidas la bacteriemia, la neumonía asociada con el respirador y las infecciones de piel y tejidos blandos 1. Los aislamientos de S. aureus resistente a la meticilina (SARM) solían asociarse casi exclusivamente con infecciones de origen hospitalario, pero desde 1990 también se empezaron a detectar infecciones causadas por tales aislamientos en personas de la comunidad aparentemente sanas y sin factores de riesgo establecidos 2,3. Su diseminación se ha incrementado a nivel mundial en adultos y en niños, con manifestaciones clínicas como infecciones de piel y tejidos blandos, neumonía y bacteriemia más patogénicas, asociadas con altas tasas de morbilidad y mortalidad, lo cual las ha convertido en un problema de salud pública 4,5.
La resistencia es un factor que contribuye al desarrollo de infecciones complicadas de piel y tejidos blandos y limita el efecto de algunos agentes antimicrobianos, lo que exige el desarrollo de nuevos tratamientos 6.
En Colombia, el porcentaje de resistencia de S. aureus a la meticilina es elevado; según los reportes del Instituto Nacional de Salud, en el primer semestre de 2016 fueron de 30,1 % en unidades de cuidados intensivos y de 37,1 % en otras secciones hospitalarias 7, en tanto que, según algunos investigadores, dicha resistencia fue de 21,9 % en las primeras y de 26,9 % en las segundas 8. Según los informes del Grupo para el Control de la Resistencia Bacteriana de Bogotá (Grebo), en el 2015 la resistencia de los aislamientos de SAMR en infecciones de piel y tejidos blandos fue de 42 % 9.
El fosfato de tedizolid es una nueva oxazolidinona con una potencia in vitro cuatro a ocho veces mayor que la del linezolid contra bacterias Gram positivas, como S. aureus (sensibles y resistentes a meticilina), Enterococcus faecalis y Streptococcus agalactiae, S. pyogenes y S.anginosus10. Su acción se produce por la unión a la fracción ribosómica 50S, inhibiendo la síntesis de proteínas. Además, tiene una muy buena penetración en piel y tejidos blandos en adultos, una gran biodisponibilidad y una prolongada vida media, lo que lo sitúa como un candidato para el tratamiento de este tipo de infección frente al aumento de la resistencia de los aislamientos de S. aureus. El tedizolid fue inicialmente aprobado por la Food and Drug Administration (FDA) de los Estados Unidos en julio de 2014 y, recientemente, fue introducido en nuestro país.
Aunque en Colombia se dispone de un número importante de moléculas para el tratamiento de infecciones de la piel y los tejidos blandos causadas por SARM (doxiciclina, trimetoprim-sulfametoxasol, clindamicina, vancomicina, linezolid, daptomicina, ceftarolina, tigeciclina y fosfomicina), es necesario verificar la actividad antimicrobiana in vitro de nuevas moléculas como el tedizolid que, según se anotó antes, cuentan con un adecuado perfil farmacocinético con muy buena penetración en la piel y los tejidos blandos, así como una prolongada vida media que permite la administración una vez al día por vía oral con gran biodisponibilidad; además, tiene un adecuado perfil de seguridad con escasos efectos secundarios e interacciones farmacológicas, lo que lo convierte en candidato para el tratamiento de este tipo de infección dado el aumento de la resistencia de los aislamientos de S. aureus11.
El objetivo de este estudio fue evaluar la actividad antimicrobiana in vitro del tedizolid y de otros antibióticos de comparación en aislamientos de S.aureus resistentes a meticilina, causantes de infecciones de piel y tejidos blandos en hospitales de tercer nivel de Colombia.
Materiales y métodos
Recolección de aislamientos
Se llevó a cabo un estudio multicéntrico prospectivo y descriptivo a lo largo de un periodo de 12 meses (entre enero y diciembre de 2016) en siete hospitales de tercer nivel de complejidad en dos ciudades de Colombia. Se recolectaron 102 aislamientos de S. aureus resistente a meticilina provenientes de pacientes de ambos sexos mayores de 18 años con infección de piel y tejidos blandos, atendidos en las instituciones de salud participantes en el estudio. La información de los pacientes se recolectó utilizando un formato que incluía las variables de edad, sexo, tipo de muestra, diagnóstico de la infección, servicio hospitalario y tipo de infección.
Determinación de la sensibilidad antimicrobiana
En todos los aislamientos se confirmó la resistencia a oxacilina mediante el método de difusión en agar con disco de cefoxitin (30 μg), y se determinó la concentración inhibitoria mínima (CIM) mediante la técnica de ETEST® (BioMérieux) de los siguientes antibióticos: tedizolid, linezolid, vancomicina, daptomicina, trimetoprim-sulfametoxazol y clindamicina.
Se seleccionó esta técnica por mostrar una buena concordancia con el método de microdilución en caldo para S. aureus frente a las oxazolidinonas y los demás antibióticos de comparación 12. Los resultados de la prueba se interpretaron según las recomendaciones del fabricante. En el caso de los aislamientos con disminución de la sensibilidad a vancomicina, esta se confirmó mediante la técnica de microdilución en caldo. Las pruebas de sensibilidad y la interpretación de los resultados se ajustaron a los parámetros del Clinical and Laboratory Standards Institute (CLSI) de los Estados Unidos para el 2016 13. Como control de calidad de las pruebas de difusión en agar, se utilizó la cepa de S. aureus ATCC 25923 y, para el ETEST®, la cepa ATCC 29213.
Análisis de los datos
El análisis de la información sobre resistencia antimicrobiana se hizo con el programa Whonet, versión 5.6. Los análisis de los perfiles de sensibilidad y la determinación de la CIM50 y la CIM90 se ajustaron a las recomendaciones vigentes del CLSI 2016 13. Además, se compararon las distribuciones de la CIM del tedizolid y el linezolid mediante un gráfico de dispersión con el programa Whonet.
Consideraciones éticas
Todos los hospitales participantes aprobaron el protocolo de investigación. En todos los casos, se garantizó la confidencialidad de la información. No se requirió consentimiento informado, ya que no hubo intervenciones, lo cual fue autorizado por todos los comités de ética e investigación de las instituciones participantes.
Resultados
De los 102 pacientes analizados, 56 (54,9 %) eran hombres. El promedio de edad fue de 46,8 años, con un rango entre 18 y 88 años. Los pacientes habían estado en los siguientes servicios de atención: hospitalización, 51 (50 %), urgencias, 45 (44,1 %) y consulta ambulatoria, seis (5,8 %). En 77 (75,4 %) de ellos, la infección se había iniciado en la comunidad, en 19 (18,6 %), se había asociado con la atención en salud y, en seis (5,8 %), se había originado en el hospital. Predominaron las muestras de abscesos con 69 (67,6 %) casos, de heridas quirúrgicas con 17 (16,6 %) casos, y de úlceras con 16 (15,6 %) casos.
Los resultados de sensibilidad a los antimicrobianos se presentan en el cuadro 1. Los 102 aislamientos de SARM registraron una sensibilidad de 100 % a vancomicina, daptomicina, linezolid, tedizolid y trimetoprim-sulfametoxazol, y de 90,2 %, a clindamicina. El tedizolid tuvo una mayor actividad in vitro en comparación con el linezolid. Los rangos de la CIM del tedizolid oscilaron entre 0,125 μg/ml y 0,5 μg/ml, en tanto que los del linezolid estuvieron entre 1 y 2 μg/ml. En cuanto a los porcentajes acumulativos de la CIM, en 61 (59,3 %) de los aislamientos la CIM del tedizolid fue de 0,25 μg/ml y, en 81 (79,4 %) de ellos la del linezolid fue de 2 μg/ml (cuadro 2). Los valores de la CIM50 del tedizolid estuvieron cuatro diluciones dobles por debajo de los del linezolid (0,25 μg/ml comparado con 2 μg/ml) y los de la CIM90, tres diluciones dobles por debajo de los del linezolid (0,5 μg/ml comparado con 2 μg/ml).
Cuadro 1 Perfil de sensibilidad a tedizolid y antibióticos de comparación frente a Staphylococcus aureus resistente a meticilina (SARM)
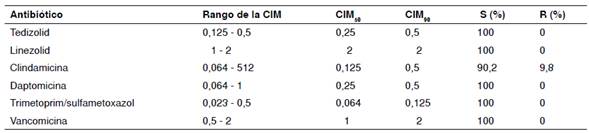
CIM: concentración inhibitoria mínima; % S: porcentaje de sensibilidad; % R: porcentaje de resistencia
Cuadro 2 Porcentaje acumulativo de la CIM de tedizolid y linezolid en aislamientos de Staphylococcus aureus resistentes a meticilina (SARM)
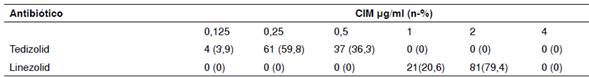
CIM: concentración inhibitoria mínima
El análisis del gráfico de dispersión evidenció que los patrones más frecuentes fueron la CIM del tedizolid, de 0,25 μg/ml, y la del linezolid, de 2 μg/ml en 49 aislamientos; y la CIM del tedizolid de 0,25 μg/ml y del linezolid de 2 μg/ml en 29 aislamientos (figura 1).
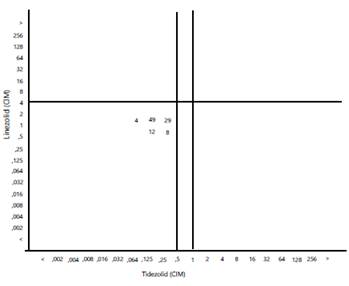
Figura 1 Gráfico de dispersión del tidezolid comparado con el linezolid en aislamientos de Staphylococcus aureus resistentes a meticilina (SARM) CIM: concentración inhibitoria mínima
Se observó que en 53 (51,9 %) de los aislamientos la CIM de la vancomicina fue de 1 μg/ml y, en 48 (47,05 %), de 2 μg/ml. En cuanto a los otros antibióticos probados, se observó que la CIM90 del trimetoprim-sulfametoxazol fue de 0,125 μg/ml, es decir, cuatro diluciones dobles por debajo del punto de corte de sensibilidad, en tanto que las de la daptomicina y la clindamicina se situaron una dilución doble por debajo del punto de corte de sensibilidad.
En cuanto al origen de la muestra, 5 % de los aislamientos de origen comunitario fueron resistentes a clindamicina comparados con 24 % de los aislamientos de pacientes con infecciones asociadas con la atención en salud y hospitalaria, pero con los demás agentes antimicrobianos probados no se encontraron diferencias en las distribuciones de las CIM.
Discusión
Las infecciones por S. aureus siguen siendo un importante problema tanto en la clínica como en el laboratorio de microbiología, especialmente por la presencia de resistencia a la meticilina, por lo cual la introducción de nuevos agentes, o la evaluación de los ya disponibles, es fundamental para seleccionar los tratamientos con base en los datos de la epidemiología propia de una región o país 14.
En este estudio de vigilancia, se evidenció la gran sensibilidad de los clones circulantes de SARM en Colombia al tedizolid y a las oxazolidinonas en general. Teniendo en cuenta que los clones circulantes cambian cada 5 a 10 años, esta información es de utilidad para los médicos tratantes y permite conocer las opciones de tratamiento para pacientes con sospecha de infección por S. aureus, especialmente, cuando se trata de infecciones de piel y tejidos blandos adquiridas en la comunidad o en el hospital.
A principios del siglo XXI, los clones de SARM circulaban únicamente en los hospitales o en pacientes que habían estado en contacto con ámbitos hospitalarios. Hacia el segundo lustro del siglo, se detectaron clones de SARM en la comunidad. En el país, estos clones pertenecían a aquellos con el casete cromosómico (SCCmec) IV. En los años siguientes, su presencia se incrementó en la comunidad 15, y se documentó en infecciones asociadas con la atención en salud y en el hospital, así como la desaparición de los clones que circulaban previamente 16,17. Los datos del presente estudio evidenciaron que el tedizolid es una alternativa para estos pacientes, independientemente del lugar de adquisición de la infección (comunidad u hospital) o la situación (asociado o no a la atención en salud), con una sensibilidad de 100 %.
Además, en el presente estudio se confirmó la mayor potencia del tedizolid en comparación con el linezolid, tal como se ha registrado en estudios multicéntricos europeos y norteamericanos 18, pues su CIM se mantuvo en valores inferiores a los 0,5 μg/ml, en tanto que la del linezolid se ha reportado con valores entre 1 y 2 μg/ml, es decir que la potencia del primero suele ser entre cuatro y ocho veces mayor. Estos datos coinciden con los informados en estudios en Asia y Latinoamérica, en los cuales se ha informado que la CIM90 del tedizolid lo hace cuatro a ocho veces más activo que el linezolid 19.
En el presente estudio se evidenció la gran frecuencia de cepas de SARM en nuestro medio, con una CIM para la vancomicina superior a 1μg/ml (en 48 % de las cepas). En un estudio previo realizado en Bogotá, se sugirió la presencia de este cambio en la CIM de los aislamientos en un hospital de tercer nivel, pero la metodología no permitía determinar con precisión la proporción de aislamientos con una CIM elevada (mayor de 1 μg/ ml) 20. En los estudios clínicos se ha demostrado que una CIM elevada de la vancomicina en pacientes con bacteriemia por SARM tiene un efecto deletéreo debido al impacto negativo sobre la posibilidad de alcanzar una relación adecuada del área bajo la curva. En diversos estudios se ha documentado cómo esta relación predice una menor probabilidad de fracaso terapéutico o de mortalidad cuando está por encima de 400 21. Aunque ello no se ha demostrado en las infecciones de piel y tejidos blandos, es importante llamar la atención en torno a la necesidad de mantener la vigilancia de los aislamientos de SARM. Dada la poca información previa sobre la sensibilidad a la vancomicina, cabe suponer que las CIM de este antibiótico se han incrementado en Colombia en los últimos diez años.
La eficacia del tedizolid se ha demostrado en estudios comparativos en pacientes con infecciones de piel y tejidos blandos, incluidos grupos de población latinoamericana, en quienes se encontró SAMR en 27 a 42 % 22. Los datos del presente estudio sustentan su posible utilización en los aislamientos colombianos y, dada la menor frecuencia de efectos secundarios gastrointestinales y su administración una vez al día, sería una alternativa clínica clara para el paciente, especialmente en el ambulatorio 23.
Este fue un estudio de vigilancia de SARM en el que se recolectaron aislamientos previos a la introducción del medicamento en el mercado colombiano. Sin embargo, dado que el linezolid lleva en uso más de diez años, la frecuencia de resistencia parece ser considerablemente baja. En estudios multicéntricos alrededor del mundo, se ha determinado una tasa de resistencia extremadamente baja (inferior al 0,2 %), la mayoría de ellos con resistencia conferida por mutaciones en las proteínas ribosómicas o en el ARNr 23s 24. Es muy importante seguir haciendo este tipo de estudios después de la introducción del medicamento en el mercado para evaluar el comportamiento de la resistencia en el tiempo.
No sobra decir que un nuevo antibiótico debe introducirse siguiendo rigurosos protocolos para limitar su uso a las indicaciones aprobadas y en aquellas situaciones en las que haya un claro beneficio para el paciente y la comunidad.
En conclusión, en este estudio de vigilancia se evidenció una gran sensibilidad de las cepas circulantes en hospitales colombianos al tedizolid, con un aumento de la CIM comparada con la de la vancomicina según la información previa disponible, y con una pérdida de sensibilidad a la clindamicina del 20 %. El tedizolid constituye una alternativa terapéutica para las infecciones de piel y tejidos blandos en Colombia.














