La ingestión de alimentos y el procesamiento y aprovechamiento de los nutrientes son elementos clave para la supervivencia, pero también constituyen un reto para la homeostasis metabólica1. En el momento posprandial aparecen estados proinflamatorios, cuya magnitud varía según la presencia de comorbilidades, como la obesidad abdominal y el tipo de alimento ingerido2,3. Dicho estado se caracteriza por el aumento en la circulación de lipoproteínas ricas en triacilglicéridos y lipopolisacáridos, los cuales se relacionan con el aumento de marcadores inflamatorios4 y la formación de células espumosas5, y contribuyen al desarrollo de enfermedades cardiovasculares.
En los estudios en ciudades de Colombia, entre ellas Cartagena, se ha evidenciado la transición demográfica y nutricional por la que el país transita, caracterizada por una tendencia creciente a la prevalencia de obesidad6 y de enfermedades cardiovasculares que han pasado a ocupar los primeros lugares en morbilidad y mortalidad7,8. Sumado a ello, los hábitos de nuestra población llevan a que un individuo promedio pase la mayor parte del día en estado posprandial, y tenga consumos hipercalóricos y poca actividad física9. Dichas circunstancias motivaron esta investigación, cuyo objetivo fue conocer de qué manera la ingestión de una comida estandarizada, rica en grasas saturadas, modifica los perfiles metabólicos de glúcidos y lípidos, y promueve estados de inflamación, así como la influencia de la obesidad abdominal en ese contexto.
Materiales y métodos
Se llevó a cabo un ensayo clínico en 42 participantes adultos, escogidos por muestreo aleatorio entre los empleados de una universidad de la ciudad, a quienes previamente se les había hecho una entrevista para verificar los criterios de inclusión (sexo masculino, bajo nivel de actividad física y aparentemente sanos). Se excluyeron del estudio a los fumadores, a las personas en dieta o que tomaran medicamentos o vitaminas, a quienes tenían un consumo elevado de alcohol, o registraran concentraciones de proteína C reactiva mayores de 10 mg/l.
A los participantes se les solicitó que no hicieran cambios en sus estilos de vida durante la semana anterior al estudio y que observaran 12 horas de ayuno antes de la toma de la muestra de sangre basal, y dos más una hora y cuatro horas después de ingerir un desayuno que incluía 100 g de pan untado con 70 g de mantequilla y un café azucarado, el cual aportaba 874 calorías, 59 % de las cuales provenían de grasas (saturadas, 32 %, monoinsaturadas, 23 %, y poliinsaturadas, 4 %), 37 % de hidratos de carbono y 4 % de proteínas. Durante la espera se les permitió beber agua, pero no consumir otros alimentos ni realizar ejercicio físico. El tiempo de seguimiento se estableció considerando los intervalos de cuatro horas en promedio, habituales entre comidas.
Los sueros se separaron y se conservaron a -20 °C para la posterior cuantificación de la glucosa, la insulina, el colesterol total y la fracción HDL (C-HDL), los triacilglicéridos, los lipopolisacáridos, la interleucina 6 (IL-6) y la proteína C reactiva.
Las concentraciones de glucosa y el perfil lipídico se midieron mediante métodos enzimáticos espectrofotométricos, utilizando estuches comerciales (Human). Para la medición de la insulina y la IL-6, se utilizaron técnicas de inmunoensayo enzimático: Insulin-AccuBind™ y Human IL-6 High Sensitivity-eBioscience™, respectivamente. El índice HOMA-IR (Homeostatic Model Assessment) se calculó según la siguiente fórmula: insulina (µUI/ml) x glucosa (mmol/l) / 22,5. La proteína C reactiva se determinó mediante el método turbidimétrico cuantitativo de alta sensibilidad (Spinreact). Las muestras en ayunas y a las cuatro horas para la medición de los marcadores inflamatorios se tomaron en brazos distintos y en venas de fácil acceso, con el fin de controlar posibles contribuciones inespecíficas derivadas de la punción.
Todo el material para la determinación de los lipopolisacáridos se certificó como apirógeno, utilizando el método cromogénico de punto final (QCL-1000 Endpoint Chromogenic LAL Assays™-Lonza), previa dilución del suero en agua libre de pirógenos (1/20) e inactivación a 75 °C durante 15 minutos. En todas las pruebas, las curvas estándares tuvieron un coeficiente de correlación superior a 0,97. Para controlar las reacciones de inhibición, se adicionó una cantidad conocida de lipopolisacáridos (0,4 EU/ml), con lo cual se logró una recuperación de 108 %, acorde con el estándar de calidad establecido por el fabricante (± 25 %). Las pruebas se llevaron a cabo en los laboratorios de atención a la comunidad y de investigaciones de la Universidad de San Buenaventura en Cartagena, y se ajustaron a los estándares y controles de calidad requeridos para asegurar la validez y la confiabilidad de los resultados según las especificaciones de los fabricantes.
Análisis estadístico
El número de participantes se calculó con la fórmula para la comparación de medidas repetidas en dos grupos y un 15 % adicional para prever posibles pérdidas.
El impacto global de la intervención se midió como el área bajo la curva (Area under the Curve, AUC) calculada con el método trapezoidal, y el aumento sobre el nivel basal se estimó como el incremento del área bajo la curva (Incremental Area under the Curve, iAUC), sustrayendo previamente los valores en ayunas de cada medida posprandial10,11.
Se utilizó el test de Shapiro-Wilk para verificar la normalidad de las variables cuantitativas y, el de Levene, para examinar la igualdad de varianzas.
Las medidas de tendencia central se expresaron como promedio y desviación estándar (DE), o como medianas y rangos intercuartílicos (RIC), según el comportamiento de las variables.
Para las comparaciones entre grupos, se utilizaron las pruebas t de Student y la U de Mann-Whitney, y para las comparaciones previas y posteriores, la prueba t de Student en muestras relacionadas y la prueba de los rangos con signo de Wilcoxon para las variables paramétricas o no paramétricas.
Las correlaciones se establecieron calculando los coeficientes de correlación de Pearson o de Spearman (ro). Para los cálculos, se usó el paquete estadístico SPSS™ (versión 21.0, SPSS Inc., Chicago, IL).
Consideraciones éticas
El proyecto fue sometido a evaluación y aprobación por parte de los comités de bioética de las Universidades de San Buenaventura de Cartagena e ICESI de Cali. Todos los participantes firmaron el consentimiento informado antes de comenzar el estudio. Esta investigación forma parte de un macroproyecto cuyo objetivo es determinar el impacto del agregado de aceite de Sacha Inchi a una comida rica en ácidos grasos saturados, registrado en ClinicalTrials.gov con el número NCT02886169.
Resultados
La muestra quedó conformada por 42 hombres, 21 con obesidad abdominal, cuyas edades fluctuaban entre 38,7 ± 10,1 años (grupo sin obesidad) y 41,4 ± 7,6 años (grupo con obesidad), sin diferencia significativa (p=0,339; IC95%: -8,2 a 2,9). En ese mismo orden, los índices de masa corporal(IMC) fueron de 23,0 ± 2,2 kg/m2 y 30,1 ± 4,1 kg/m2 (p=0,001, IC95%: -9,1 a -5,0) y, los perímetros de cintura, de 85,0 ± 6,3 cm y 103,2 ± 8,9 cm (p=0,001; IC95%: -23,0 a -13,4).
Los valores de glucosa, de insulina y el índice HOMA-IR en ayunas, así como el impacto de la ingestión, se presentan en el cuadro 1. La glucemia en ayunas no superó los límites normales en ninguno de los participantes, aunque mostró una ligera tendencia a valores mayores en el grupo con obesidad, diferencia que alcanzó significación estadística a la hora. La insulinemia registró valores mayores en los participantes con obesidad en todos los tiempos evaluados. El incremento del área bajo la curva de insulina fue menor en el gruposin obesidad (iAUC=32,6 µUI/ml; RIC=20,2-43,1) que en el grupo con obesidad (iAUC=82,7 µUI/ml; RIC=40,2-133,9; p=0,001), pero no se halló diferencia para la glucosa, en tanto que las áreas totales bajo la curva fueron mayores para ambos parámetros en el grupo con obesidad (cuadro 1).
Cuadro 1 Niveles de glucosa e insulina en ayunas y respuestas posprandiales tras la ingestión de una comida rica en grasas saturadas en el grupo sin obesidad abdominal (n=21) y el grupo con obesidad abdominal (n=21)
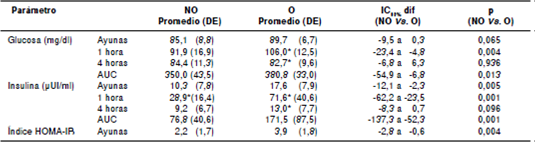
NO: grupos sin obesidad abdominal; O: grupo con obesidad abdominal; AUC: área bajo la curva; DE: desviación estándar* p<0,005 comparado con el valor en ayunas
En lo concerniente a las variables lipídicas de triacilglicéridos, colesterol total y HDL-C, solo se registró diferencia entre los grupos en la concentración basal de los primeros, y fue mayor en el grupo con obesidad. El colesterol total y los triacilglicéridos aumentaron luego de la intervención, y se mantuvieron durante todo el tiempo que duró el ensayo, tal como se aprecia en el cuadro 2.
Cuadro 2 Niveles lipídicos en ayunas y respuestas posprandiales tras la ingestión de una comida rica en grasas saturadas en elgrupo sin obesidad abdominal (n=21) y el grupo con obesidad abdominal (n=21)
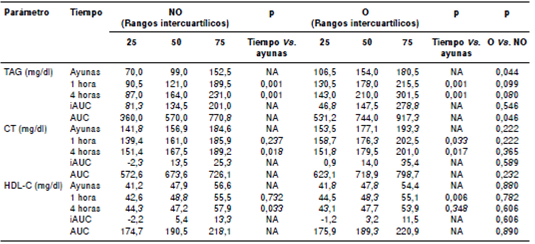
NO: grupos sin obesidad abdominal; O: grupo con obesidad abdominal; TAG: triacilglicéridos; CT: colesterol total; HDL-C: colesterol de lipoproteínasde alta densidad; iAUC: incremento del área bajo la curva; AUC: área bajo la curva; NA: no aplica
Las concentraciones de triacilglicéridos en ayunas se correlacionaron con los valores a las cuatro horas (r=0,854; p<0,001), con el AUC de los triacilglicéridos (r=0,936; p<0,001), así como con el iAUC (r=0,474; p<0,001).
Al comparar los grupos clasificados según la presencia de obesidad abdominal, el iAUC de los triacilglicéridos fue similar; sin embargo, cuando los participantes se reclasificaron según los niveles de triacilglicéridos, el grupo con niveles en ayunas superiores a 150,0 mg/dl (n=16; 38 %) registró un iAUC (179,3 mg/dl; RIC=123,6-283,9) significativamente mayor que en los restantes 26 sujetos (n=26; 62 %), cuyos niveles estuvieron por debajo de ese valor (iAUC=113,3 mg/dl; RIC=41,1-197,6; p=0,041).
En el cuadro 3 se presentan los valores basales y posprandiales de los marcadores inflamatorios para ambos grupos. La proteína C reactiva en ayunas y a las cuatro horas fue mayor en el grupo con obesidad. Tras la ingestión, la IL-6 disminuyó en el grupo sin obesidad y los lipopolisacáridos aumentaron en ambos grupos. Los niveles de triacilglicéridos y de lipopolisacáridos a las cuatro horas, registraron una correlación positiva significativa solamente en el grupo con obesidad (r=0,635; p=0,002).
Cuadro 3 Concentraciones de los marcadores inflamatorios en ayunas y posprandiales en el grupo sin obesidad abdominal (n=21)y el grupo con obesidad abdominal (n=21)
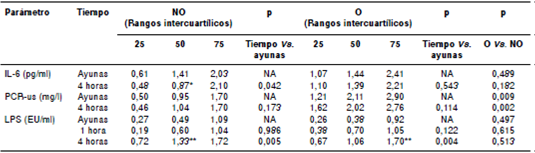
NO: grupos sin obesidad abdominal; O: grupo con obesidad abdominal; IL-6: interleucina 6; PCRus: proteína C reactiva ultrasensible; LPS:lipopolisacáridos; NA: no aplica; * p<0,05; ** p<0,01comparado con el valor en ayunas
Discusión
En los dos grupos se registraron concentraciones similares de glucemia basal (inferiores a 100 mg/dl); sin embargo, la cuantificación de la insulina y el cálculo del índice HOMA-IR en ayunas evidenciaron el estado de resistencia a la insulina en el grupo con obesidad. Además, el reto alimentario permitió mostrar el aumento de las alteraciones fisiopatológicas en la homeostasis de este grupo, lo que otorga al momento posprandial una relevancia especial en la detección oportuna y temprana de este tipo de alteraciones12, y permite ilustrar cuán inadecuado resulta descartar alteraciones del metabolismo de los glúcidoscon base en determinaciones aisladas de glucemia en ayunas.
Es interesante señalar que el mayor incremento de las concentraciones de glucosa e insulina en el grupo con obesidad en el momento posprandial cayó a las cuatro horas a valores menores que los del ayuno, situación que no se observó en el grupo sin obesidad y que coincide con lo hallado por Rubin, et al., en el 201013. Este comportamiento alerta sobre fallas en la regulación de la insulina y sobre el exceso de secreción posterior al estímulo, eventos que contribuyen al agotamiento del páncreas y favorecen los efectos derivados de la hiperinsulinemia, reflejando la pérdida de la capacidad de restaurar la homeostasis, que en la actualidad se considera incluida en el concepto de salud como la habilidad para adaptarse y manejar de manera autónoma los retos de la ingestión de alimentos14.
El impacto específico derivado de la intervención, medido como iAUC, fue similar entre los grupos para la glucosa pero no para la insulina, lo cual demuestra el esfuerzo pancreático del grupo con obesidad para controlar la glucemia, en tanto que el aumento global (AUC) fue mucho mayor en presencia de obesidad para una y otra, lo cual pone en evidencia la sobrecarga bioquímica que acompaña la alteración metabólica en este grupo.
A diferencia de lo hallado para la glucemia, en el cuadro 2 se evidencia que las concentraciones de triacilglicéridos en ayunas fueron mayores en el grupo con obesidad y que los valores posprandiales de triacilglicéridos y colesterol total se mantuvieron por encima de los del ayuno en todos los tiempos de evaluación en ambos grupos, lo cual se asemeja a lo reportado en otros estudios15. Es importante destacar que, si se asumen frecuencias alimentarias de cuatro horas en promedio y un consumo de alimentos ricos en grasas saturadas en un día normal, un individuo no lograría regresar a sus valores lipídicos en ayunas durante la mayor parte del día. Esto evidencia que la medición de las concentraciones no basales, especialmente de triacilglicéridos y colesterol total, permite verificar la respuesta metabólica a la ingestión y el estado más habitual en un día normal, aun cuando pueda resultar más complicada desde un punto de vista operativo.
Además, aunque el papel de los triacilglicéridos como factor de riesgo cardiovascular ha sido objeto de controversia16, en estudios clínicos recientes se ha evidenciado que, especialmente, los niveles posprandiales se relacionan con la enfermedad coronaria17.
En este estudio, se registraron diferencias en los triacilglicéridos en ayunas entre los grupos clasificados según la obesidad, pero similares respuestas posprandiales, a diferencia de otras investigaciones que demostraron aumentos mayores en los obesos que en quienes no lo eran, aunque la medición se hizo en los grupos cuyos triacilglicéridos en ayunas estaban en los niveles normales18.
Por ello, en el presente estudio se decidió reclasificar los grupos según la presencia de niveles alterados de triacilglicéridos en ayunas (≥150,0 mg/dl), lo cual permitió demostrar que, en el grupo cuyos niveles eran elevados, los incrementos posteriores a la ingestión eran mayores. Estos hallazgos, sumados a la significativa correlación entre ambos valores, avalan lo expresado por Almeda, et al.,en el sentido de que la concentración basal de los triacilglicéridos representa uno de los principales factores determinantes de la lipemia posprandial19.
En estudios previos en adultos con sobrepeso, la ingestión de un desayuno de 1.416 calorías (52 % de las cuales provenía de grasas) resultó en incrementos del colesterol total y de los triacilglicéridos, y en un aumento de los marcadores inflamatorios y de los lipopolisacáridos20. Según la información disponible, estos lipopolisacáridos se transportarían ligados a lipoproteínas ricas en triacilglicéridos y participarían en procesos de inflamación y de expresión de citocinas y moléculas de adhesión, contribuyendo así al desarrollo de enfermedades cardiovasculares21-24. En el presente estudio se encontró que los valores basales de los lipopolisacáridos y de la IL-6 fueron similares en ambos grupos, pero su comportamiento posprandial difirió, como puede observarse en el cuadro 3. En cuanto a la proteína C reactiva, la concentración basal fue mayor en el grupo con obesidad, lo cual evidenció el proceso crónico, sin variación posterior a la ingestión, lo que parece indicar que no responde en los tiempos usuales de una intervención aguda, como se ha hallado en otros estudios3,25.
En cuanto a la IL-6, esta había presentado resultados contradictorios en estudios anteriores, lo que llevó a postular que su aumento podía deberse a variaciones fisiológicas26 o a efectos derivados de la inflamación local por las punciones repetidas o el uso de catéter27,28. Las precauciones en la toma de la muestra que ya se explicaron garantizan la validez de los resultados de este estudio y evidencian que la caída en los niveles de la IL-6 en el grupo sin obesidad reflejaría un menor impacto inflamatorio en este grupo, lo cual coincide con lo hallado por otros autores29.
Los lipopolisacáridos aumentaron en ambos grupos en la etapa posprandial, lo cual se ha descrito en diversos estudios como relacionado con el incremento de los triacilglicéridos en el grupo con obesidad, y era de esperarse dadas las evidencias de que los lipopolisacáridos entran en circulación mediados por lipoproteínas ricas en triacilglicéridos30. El aumento de los lipopolisacáridos en la etapa posprandial en el grupo sin obesidad, discrepa de lo hallado en otros estudios23, lo que podría deberse a la mayor edad de nuestros participantes, circunstancia que ha demostrado afectar las reacciones posprandiales31.
Por otra parte, la ausencia de correlación entre los niveles de triacilglicéridos y lipopolisacáridos en este mismo grupo, podría deberse a diferencias derivadas del tipo de alimentación y a los niveles previos de translocación de los lipopolisacáridos, así como al desarrollo de la memoria adaptativa inmunitaria o a la presencia de proteínas de transporte que podrían enmascarar el aumento en los valores basales o posprandiales32,33, o reflejarse en habilidades diferentes para el manejo de los incrementos de endotoxinas34, aspectos que deberán abordarse en el futuro.
A diferencia de otros estudios que ensayan cargas lipídicas en forma de batidos y con seguimiento a las ocho horas, en este ensayo se incluyó un alimento similar en contenido y consistencia al consumido habitualmente por los participantes y se hizo seguimiento a las cuatro horas, considerado como el tiempo promedio entre comidas, lo cual otorga a nuestro estudio la fortaleza de asegurar tiempos de vaciado gástrico y digestión similares a una ingestión común, que podrían alterarse con el consumo de cargas grasas exclusivamente líquidas. La aleatorización del muestreo, las indicaciones para la semana previa al estudio y el riguroso cumplimiento de los criterios de inclusión y exclusión, permitieron el control de variables derivadas de los estilos de vida.
Se requieren, sin embargo, estudios posteriores que incluyan mayor número de variables, especialmente del estado inflamatorio, así como intervenciones con diferentes ácidos grasos o seguimientos a largo plazo, para evaluar la ingestión crónica.
En suma, los resultados obtenidos muestran que la ingestión de una comida rica en ácidos grasos saturados modificó las variables relacionadas con el metabolismo de los glúcidos en ambos grupos, con mayor impacto en el grupo con obesidad al incrementar el estado de resistencia basal a la insulina. En cuanto a los lípidos, los dos grupos tuvieron una respuesta similar del colesterol, a diferencia de los triacilglicéridos, parámetro que aumentó mucho más en el grupo con obesidad, especialmente cuando se registraba mayor concentración en ayunas. El grupo sin obesidad registró menores niveles de inflamación basal y posprandial, según la estimación de las concentraciones de proteína C reactiva en ayunas y la disminución de IL-6 después de la carga, respectivamente.
Cabe destacar que, aunque requiere de una mayor inversión de recursos y una mejor estandarización para fortalecer su valor clínico, la evaluación del estado posprandial refleja el estado más habitual de un díanormal y hace posible evidenciar la respuesta metabólica a la alimentación, lo que contribuye a detectar los trastornos metabólicos tempranos relacionados con la presencia de obesidad abdominal en personas aparentemente sanas.














