Los nematodos parásitos de la súperfamilia Metastrongyloidea son de ciclo indirecto. Por lo general, sus huéspedes intermediarios son caracoles, en los cuales entran en el estadio larval 1 (L1) cuando estos se comen las heces de vertebrados parasitados. En el molusco, las larvas cambian a L2 y luego a L3, estadio en el que tienen la capacidad de infectar a los vertebrados que las ingieren en alimentos contaminados o al consumir el tejido crudo o mal cocido de los caracoles que las portan 1-3.
En Colombia, los registros de pacientes infectados con nematodos patógenos transmitidos por moluscos son muy escasos 4. Sin embargo, en la actualidad, los habitantes de 29 departamentos del país se encuentran en riesgo de sufrir nematodosis relacionadas con la presencia del caracol invasor africano Lissachatina (=Achatina) fulica (Bowdich, 1822) 5,6. Este es un molusco terrestre originario del oriente de África, con registros en Argentina, Bolivia, Brasil, Ecuador, Paraguay, Perú y Venezuela.
Además, está presente en Asia, Europa, Norteamérica y Oceanía 7-9.
En África, Brasil, Ecuador y en algunas islas del Pacífico, se ha demostrado que L. fulica representa un riesgo para la salud humana, ya que funge como huésped intermediario de nematodos de la superfamilia Metastrongyloidea, como Angiostrongylus cantonensis, agente etiológico de la meningoencefalitis eosinofílica, enfermedad zoonótica endémica en países asiáticos. Además, en Brasil es vector de Angiostrongylus vasorum, parásito originario de Europa que afecta principalmente a los perros, y de Aelurostrongylus abstrusus, un nematodo patógeno para gatos y perros domésticos 10-14.
En Antioquia, el primer hallazgo de este caracol tuvo lugar en enero del 2012, en el municipio de Santa Fe de Antioquia 15. En estudios parasitológicos de L. fulica provenientes de Santa Fe de Antioquia, se pudo demostrar la presencia abundante y frecuente de larvas L3 16, así como la riqueza de morfotipos al analizar los helmintos en caracoles africanos procedentes de otras regiones de Colombia. El tiempo de vida de las larvas en el laboratorio es muy corto, lo que exige jornadas de trabajo largas, intensas y agotadoras.
La posibilidad de disponer de formas larvarias de organismos de interés potencial en salud mediante su cultivo en laboratorio, ha permitido recopilar información sobre los cambios morfológicos de los helmintos, la relación entre huésped y parásito, las necesidades nutricionales de los parásitos y su organización estructural. Además, ha hecho posible la evaluación de antihelmínticos, la producción de vacunas y otras herramientas útiles en los programas para la prevención y el manejo de las nematodosis 17-20.
En este contexto, en el presente estudio se propuso estandarizar el cultivo in vitro de larvas L3 en caracoles africanos de Santa Fe de Antioquia, con el fin de aumentar el tiempo de vida de los helmintos en el laboratorio y facilitar, así, las observaciones, mejorar la calidad de vida del personal encargado de los análisis y allanar el camino hacia futuras investigaciones.
Materiales y métodos
Recolección de los caracoles
Entre julio y noviembre de 2014, se recolectaron ejemplares de A. fulica, observando las medidas de protección necesarias (guantes y tapabocas), en el municipio de Santa Fe de Antioquia, localizado a 06° 33’ 682’’ N y 75° 49’ 746’’ O. Posteriormente, los ejemplares fueron trasladados por separado al Laboratorio de Malacología Médica y Tremátodos del PECET en la Universidad de Antioquia.
Sacrificio de los caracoles
En el laboratorio se midieron los caracoles y se los adormeció. Se quebró la concha de cada ejemplar y se retiró la parte blanda, la cual se cortó en trozos, se depositó en un vaso de precipitación, se cubrió con HCl al 0,7 % y se dejó en reposo durante seis horas 12,14.
Recuperación de las larvas
El contenido de cada vaso se depositó en un embudo siguiendo el método de Baermann. Se dejó en reposo durante 18 horas para permitir la migración de las larvas y, posteriormente, se recolectaron 15 ml del líquido en un tubo Falcon. La porción recolectada se dejó sedimentar durante 40 minutos, aproximadamente 18,19.
El contenido del tubo Falcon se observó con un estereomicroscopio Nikon SMZ445™ para recuperar las larvas con una pipeta Pasteur. Las larvas se extrajeron, se contaron y se depositaron en una caja de Petri con agua del grifo, y, posteriormente, se lavaron tres veces con suero fisiológico. Se midieron diez de las larvas, 140 se sembraron en los medios de cultivo seleccionados y diez se fijaron en alcohol al 96 % para su futuro estudio molecular.
Medios de cultivo
Las larvas se sembraron en tres medios de cultivo: Schneider, DMEM y RPMI, sin suplemento de SFB al 20 % y con este. Como medio de control se usó agua destilada más SFB al 20 %.
Para reducir la contaminación de los medios de cultivo, antes de sembrar las larvas, los platos de 12 pozos, las pipetas, las puntas, los tapabocas y los guantes se introdujeron en una cámara de bioseguridad y se irradiaron con luz ultravioleta durante 20 minutos.
Siembra de las larvas
La zona de trabajo se limpió con alcohol al 96 % y se mantuvieron los mecheros encendidos. Para cada medio de cultivo y para el control, se acondicionaron cuatro pozos del plato de ELISA, cada uno con un mililitro del medio de cultivo y cinco larvas. El volumen del medio de cultivo se midió con una micropipeta automática y las larvas se sembraron con una pipeta Pasteur. Los platos se incubaron en una estufa Memmert 854 Schwabach™ a 37 °C durante 36 días. El medio de cultivo de las larvas se cambió cada 36 horas. En cada ocasión se observó el protocolo de desinfección descrito.
Medición de las larvas
Para evaluar las diferencias en el crecimiento de las larvas, se midieron la longitud y la anchura iniciales de 10 de los ejemplares y, a los 36 días, se midieron de nuevo en 10 larvas de cada medio de cultivo y del control.
Las larvas se midieron en un microscopio Nikon Eclipse E200™, con una reglilla ocular en los objetivos de 10X y 40X. También, se observaron las características morfológicas y se obtuvieron imágenes con una cámara Sony Cyber-shot Carl Zeiss™, modelo DSC-W35.
Análisis estadístico
Para las variables de anchura y longitud de las larvas cultivadas en los diferentes medios, se calcularon el promedio, la desviación estándar, el valor máximo y el valor mínimo. Se hizo una gráfica de caja de bigotes para comparar la anchura y la longitud de las larvas en cada medio de cultivo.
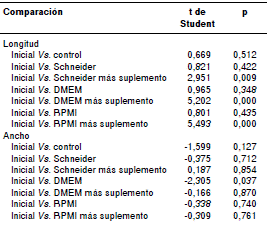
Se hizo una prueba de normalidad de Shapiro- Wilk. Se comparó el promedio de la longitud y de la anchura de las larvas cultivadas en cada medio con las mediciones iniciales mediante una prueba t de Student. Se asumió como significativo un valor de p menor de 0,05.
Los valores de las mediciones se registraron en Microsoft Excel 2010™ y los análisis estadísticos se hicieron con el programa SPSS™, versión 18 (Chicago, Illinoins, USA), licencia amparada por la Universidad de Antioquia.
Resultados
Se cultivaron 140 larvas durante 36 días, de las cuales sobrevivió el 50 % (70). En DMEM sobrevivieron ocho larvas (40%), en Schneider, nueve (45 %), en RPMI, 12 (60 %), en Schneider más SFB al 20 %, diez (50 %), en RPMI más SFB al 20 %, 14 (70%) y en DMEM más SFB al 20 %, 17 (85 %). Las larvas de control solo sobrevivieron diez días.
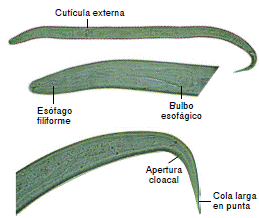
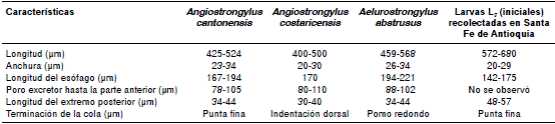
En cuanto a la morfología de las larvas, al inicio del ensayo se observaron la cutícula externa, el esófago filiforme seguido del bulbo esofágico y la apertura cloacal cerca de la cola, la cual es larga y termina en punta (figura 1). Las dimensiones de estas larvas se presentan en el cuadro 1; allí se evidencia que fueron diferentes a las registradas en las larvas L3 de Angiostrongylus cantonensis, A. costaricensis y A. abstrusus21,22.
Cuadro 1 Dimensiones estimadas en larvas L3 de Angiostrongylus cantonensis, A. costaricensis, Aelurostrongylus abstrusus y larvas L3 sin identificar, obtenidas de ejemplares de Lissachatina fulica recolectados en Santa Fe de Antioquia. Todas las medidas están en micras (μm).
Las larvas con 36 días en el medio de cultivo conservaron las características morfológicas de la larva inicial, aunque difirieron por la presencia de puntos pigmentados a lo largo del cuerpo (figura 2).

Figura 2 Morfología de la larva cultivada. Fotografía de Nelly Solfania Heredia. Laboratorio de Malacología Médica y Tremátodos. Microscopio Nikon Eclipse E200®, 10X y 40X.
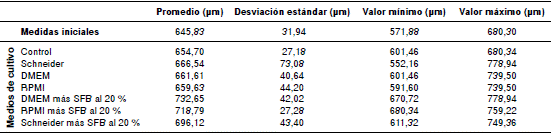
En la figura 3 y el cuadro 2, se observa que las larvas cultivadas en los medios con SFB alcanzaron una longitud promedio mayor que las cultivadas en los medios sin SFB. Asimismo, se aprecia que las larvas cultivadas en DMEM más SFB al 20 % presentaron la mayor longitud promedio, en tanto que la menor se obtuvo en las larvas cultivadas en RPMI. El promedio de la anchura de las larvas en los medios de cultivo evaluados fue similar al registro inicial.
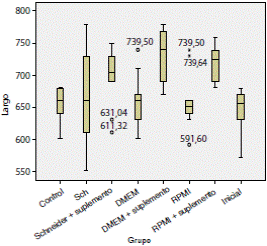
Figura 3 Comportamiento de los datos y promedios de la longitud (μm) de las larvas en los diferentes medios con respecto a la media inicial
Cuadro 2 Promedio, desviación estándar, valor mínimo y valor máximo de la longitud de las larvas de Metastrongiloidea cultivadas durante 36 días en tres medios con SFB y sin este
El test de normalidad demostró que los datos tenían una distribución normal, ya que, en general, todos correspondieron al promedio o fueron cercanos.
En el cuadro 3 se evidencia que hubo diferencias estadísticas entre el promedio de la longitud de las larvas cultivadas en los medios con suplementos y el promedio de la longitud inicial, lo que indica que dichos medios favorecieron el crecimiento de las larvas. No hubo diferencias estadísticas entre la anchura de las larvas cultivadas y la anchura inicial (no se presentan los datos).
Discusión
Las diferencias en algunos caracteres morfológicos y en las dimensiones de las larvas L3 objeto de este estudio, sugieren que no correspondían a las L3 de A. cantonensis, A. costaricensis ni A. abstrusus21,22.
Todos los medios de cultivo evaluados permitieron que las larvas sobrevivieran por 36 días, destacándose el DMEM más SFB al 20 %, con una supervivencia de 85 %. Se obtuvieron resultados similares al cultivar larvas L3 de A. cantonensis durante cuatro semanas en los medios RPMI 1640, NCTC 135, medio de Waymouth MB 752/1 (WYM) y medio mínimo esencial de Eagle (MEM) con SFB al 20 %; en este caso, también se destacó el MEM más SFB al 20 %, con una supervivencia de 87 % 23. En ese mismo estudio, el medio de cultivo sin suplemento más favorable para la supervivencia de las larvas fue el RPMI (57 %), resultado similar al obtenido en el presente experimento (60 %).
En el presente estudio se demostró que el DMEM con SFB al 20 % es el medio de cultivo más adecuado para el cultivo in vitro de las L3 obtenidas en ejemplares de L. fulica en Santa Fe de Antioquia, pues con él hubo un mayor incremento en la longitud de las larvas y un mayor porcentaje de supervivencia. Sin embargo, la anchura de los especímenes no aumentó. Este resultado es congruente con el reseñado para el cultivo de larvas L3 de A. cantonensis en MEM con SFB al 20 %, en el cual las larvas incrementaron su longitud al cabo de 36 días, mas no su anchura, y pasaron al estadio de L4 19, evento este que no se observó durante el presente ensayo, posiblemente porque las larvas correspondían a una especie diferente de nematodo, cuyas necesidades son otras.
En principio, los resultados obtenidos en el medio DMEM con SFB al 20 % posibilitaron el cultivo de los diversos morfotipos de L3 obtenidos en L. fulica, con lo que fue posible comparar sus reacciones en el desarrollo morfológico, el crecimiento y la supervivencia e, incluso, experimentar con el incremento del tiempo de las larvas en el medio para propiciar su paso al estadio L4. Además, se pudieron planear jornadas de trabajo menos exigentes y agobiantes para los investigadores encargados de los helmintos.
El cultivo in vitro de las larvas L3 en DMEM con SFB al 20 % permitirá emplear nuevos enfoques en los estudios sobre los nematodos que se encuentran en L. fulica en Colombia, donde la diversidad de parásitos es un reto que apenas se comienza a vislumbrar y que exige establecer su identidad, y desarrollar herramientas diagnósticas y de eliminación de helmintos, entre otras.