En los últimos años se ha observado un aumento en la prevalencia de micobacteriosis ocasionadas por micobacterias no tuberculosas, las cuales se consideran agentes patógenos emergentes. Su presencia depende de los antecedentes clínicos y el estado de salud de la persona afectada, por ejemplo, inmunosupresión debida al virus de la inmunodeficiencia humana (HIV), alteraciones estructurales del pulmón, como las bronquiectasias, la fibrosis quística y la enfermedad pulmonar obstructiva crónica (EPOC), las cuales favorecen la colonización de las vías respiratorias con estos gérmenes. A estos se suman hoy otros factores, como la gran variedad de entornos geográficos en los que se encuentran estos agentes patógenos y su relación con el medio ambiente, ya que tienen una amplia distribución en el agua, el aire, los suelos y los animales. En muchas ocasiones, los cuadros clínicos que producen se confunden con la tuberculosis, lo que favorece el avance de la enfermedad y el deterioro clínico, el cual puede llevar a la muerte cuando el tratamiento no es el adecuado 1-4.
En muchos de los estudios llevados a cabo a nivel mundial, se reconoce que la micobacteriosis con mayor prevalencia es la pulmonar, y los agentes etiológicos más frecuentes han sido Mycobacterium avium intracellulare, M. chelonae, M. fortuitum, M. abscessus, M. marinum, M. xenopi y M. kansasii1,3,5,6.
En Colombia, el sistema de vigilancia en salud pública no exige el informe de las micobacterias no tuberculosas, lo cual dificulta establecer con qué frecuencia se presentan. En los trabajos a nivel nacional que documentan su presencia como agentes patógenos, se ha evidenciado un incremento en el número de casos, especialmente en personas infectadas con el HIV, o en quienes tienen enfermedad pulmonar o son sometidos a procedimientos cosmetológicos. Las especies identificadas son M. chelonae, M. fortuitum, M. avium intracellulare, M. abscessus, M. gordonae, M. scrofulaceum y M. avium, entre otras 4,7-11.
En este contexto, el objetivo de nuestro estudio fue describir los casos de micobacteriosis diagnosticados en el Laboratorio Nacional de Referencia de Micobacterias del Instituto Nacional de Salud entre el 2012 y el 2016.
Materiales y métodos
Se hizo un análisis retrospectivo de la base de datos del laboratorio que incluía a 273 pacientes en cuyos aislamientos se habían identificado micobacterias no tuberculosas. Para determinar la especie, se utilizaron los estuches comerciales Genotype CM™, que permite la identificación de las especies más comunes, y Genotype AS™ para aquellos casos en los que la prueba de Genotype CM™ no reconoció la especie micobacteriana. La técnica se basa en la extracción, la amplificación con iniciadores marcados con biotina y la hibridación inversa, proceso que se hizo siguiendo las indicaciones del fabricante 12,13.
Como controles internos, se utilizaron las cepas ATCC de M. tuberculosis (25618 TM), M. avium (15769 TM) y M. fortuitum (6841TM), así como los controles de extracción y amplificación establecidos por el Laboratorio Nacional de Referencia.
La fuente de información fue el formato único de vigilancia de las micobacterias, recibido con cada uno de los casos. Las variables analizadas fueron edad, sexo, casos detectados por año, procedencia geográfica, tipo de micobacteriosis (pulmonar, cutánea, diseminada o linfática), agente etiológico identificado y factores predisponentes, entre los cuales se consideraron el tratamiento antituberculoso previo, la infección simultánea con el HIV (en aquellos casos en que se había registrado el resultado de esta prueba), la EPOC, la diabetes, la desnutrición y otros factores inmunosupresores no definidos. Los casos que no disponían de esta información se registraron como sin factor predisponente asociado.
Para el análisis estadístico, se utilizó la prueba z entre las variables de agente etiológico identificado y factor predisponente asociado para las formas pulmonar y extrapulmonar, y el porcentaje de casos recibidos a lo largo de los años de estudio. El área crítica de significación se estableció como p menor de 0,05, con un intervalo de confianza del 95 %.
Resultados
Entre 2012 y 2016, se diagnosticaron 273 casos de micobacteriosis en el Laboratorio Nacional de Referencia: 41 (15 %) casos en el 2012, 28 (10,3 %) en el 2013, 55 (20,1 %) en el 2014, 69 (25,3 %) en el 2015 y 80 (29,3 %) en el 2016. La comparación del número de casos recibido a lo largo de este periodo, tomando como referencia el 2012, evidenció un aumento significativo a partir de 2015 (p<0,05).
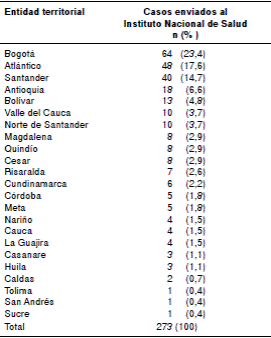
Los casos provenían de 23 entidades territoriales. Las que aportaron el mayor número fueron: Bogotá, con 64 (23,4 %), Atlántico, con 48 (17,6 %), Santander, con 40 (14,7 %), Antioquia, con 18 (6,6 %), y Bolívar con, 13 (4,8 %), casos en los que se encontró el 67 % de las micobacteriosis estudiadas (cuadro 1).
Cuadro 1 Número y porcentaje de casos enviados al Laboratorio Nacional de Referencia del Instituto Nacional de Salud por las entidades territoriales, Colombia, 2012-2016
El 57,1 % de los casos correspondió a micobacteriosis pulmonar, el 26 %, a cutánea, el 10,6 %, a diseminada, el 2,6 %, a linfadenitis, y en el 3,7 % de los casos no se tenía la información para establecer el sistema comprometido (cuadro 2).
Cuadro 2 Tipo de micobacteriosis, agente etiológico identificado, factor predisponente, edad y sexo de los pacientes, Colombia, 2012-2016
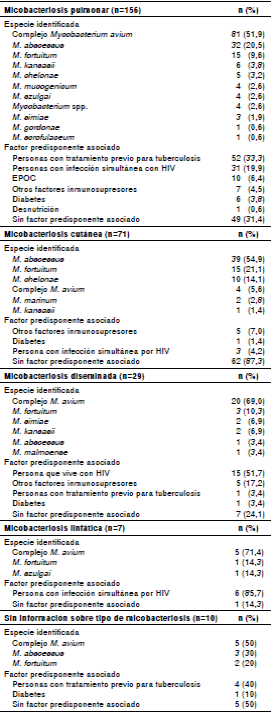
EPOC: enfermedad pulmonar obstructiva crónica
El principal agente causante de la micobacteriosis pulmonar fue el complejo M. avium en 81 casos (51,9 %). Entre los factores predisponentes asociados con esta micobacteriosis, se encontró el tratamiento previo para tuberculosis en 52 (33,3 %) casos; el 81 % de los pacientes era mayor de 40 años, con una mediana de edad de 57, y el 60 % correspondió al sexo masculino.
Mycobacterium abscessus fue la principal causa de enfermedad cutánea, con 39 casos (54,9 %), siendo la inmunosupresión el factor más frecuentemente asociado (7 %); el 76,1 % de estos pacientes tenía entre 21 y 50 años de edad, con una mediana de 34; el 78,9 % correspondió al sexo femenino.
El agente etiológico más frecuente en los casos de micobacteriosis diseminada fue el complejo M, avium con 20 casos; el 51 % de los pacientes con micobacteriosis diseminada era positivo para el HIV. El 82,7 % de estos pacientes tenía entre 21 y 60 años, con una mediana de 43; el 79,3 % correspondió al sexo masculino.
Solo se detectaron 7 (2,6 %) casos de linfadenitis por micobacteriosis, 5 (71,4 %) de ellos secundarios a infección por el complejo M. avium. Seis (85,7 %) fueron seropositivos para el HIV. Las edades de los pacientes oscilaban entre 4 y 39 años y el 71,4 % correspondió al sexo masculino.
En 5 de los 10 casos en que no había suficiente información para establecer la región anatómica afectada, se identificó el complejo M. avium, y el factor predisponente asociado más frecuentemente registrado fue el antecedente de tratamiento antituberculoso, en 4 casos. Las edades oscilaron entre 21 y 70 años y el 7 correspondió al sexo femenino.
Al comparar las formas pulmonares y las extrapulmonares (cutánea, diseminada, linfática), se estableció que el complejo M. avium fue más el frecuente en la micobacteriosis pulmonar, en tanto que M. abscessus y M. chelonae lo fueron en las extrapulmonares (p<0,05) (cuadro 3).
Cuadro 3 Comparación de micobacteriosis pulmonar y extrapulmonar, Colombia, 2012 -2016
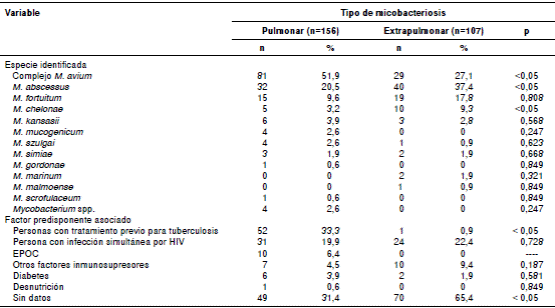
EPOC: enfermedad pulmonar obstructiva crónica
El factor predisponente más frecuente en las formas pulmonares (p<0,05) fue el tratamiento previo para la tuberculosis (cuadro 3).
Discusión
Durante los cinco años analizados, se produjo un aumento de los casos confirmados como micobacteriosis y se observó una diferencia estadísticamente significativa a partir del 2015. Ello podría deberse a que, desde el 2014, el Laboratorio Nacional de Referencia utiliza para la identificación de la especie una técnica molecular más sensible y específica, la cual permite una mejor caracterización de las especies si se compara con las pruebas convencionales usadas en años anteriores.
Por otra parte, en la red de laboratorios se han implementado nuevos métodos, como la inmunocromatografía, y técnicas basadas en la amplificación de ADN, lo cual permite saber de forma rápida si un aislamiento pertenece o no al complejo M. tuberculosis, así como una mayor remisión al Laboratorio Nacional de Referencia de aquellos cultivos en que se sospecha la presencia de micobacterias no tuberculosas. Además, desde el 2009 los lineamientos nacionales establecen el cultivo como método de diagnóstico en personas con sospecha de micobacteriosis 14,15.
El mayor número de casos se registró en Bogotá y en los departamentos de Atlántico y Santander, donde las redes de prestación de servicios de salud tienen más acceso al cultivo como método de diagnóstico.
En la mayoría de los estudios realizados en el país, se ha relacionado la presencia de micobacterias no tuberculosas con la presencia del HIV y con los procedimientos estéticos. No se registran estudios en los que se haya comparado el comportamiento de estas micobacterias como agentes patógenos causantes de la enfermedad pulmonar y de las formas extrapulmonares 4,7-10. En el 2017, Llerena, et al., documentaron que las micobacterias causantes de enfermedad pulmonar entre el 2012 y el 2014 eran del complejo M. aviar (62,7 %) y M. abscessus (30,3 %).
El presente análisis incluyó información de dos años más y se evidenció que la tendencia fue similar. Sin embargo, en este estudio se identificaron como agentes etiológicos M. simiae y M. mucogenicum, los cuales no se habían descrito antes 11.
En el estado de São Paulo en Brasil, Ueki, et al., determinaron que en 48 % de los 1.248 casos con micobacteriosis, esta era de tipo pulmonar, principalmente debida al complejo M. avium, con 51 %, dato similar a lo encontrado en nuestro estudio. Estos autores identificaron M. kansasii como el segundo agente más frecuente. En el presente análisis, se reconoció a M. abscessus como la segunda especie más frecuente, con 20,5 % de los casos. En los artículos consultados se reporta que la presencia de micobacterias no tuberculosas varía según la localización geográfica de los casos 16.
En Estados Unidos, Prevots, et al., describieron las especies causantes de micobacteriosis pulmonar entre el 2004 y el 2006, y lo mismo hicieron Simons, et al., en un análisis de 25 artículos publicados en diferentes países del este de Asia. En los dos estudios se reportaron las bacterias del complejo M. avium como los principales agentes involucrados, seguidas de M. abscessus, lo cual coincide con los datos de este estudio y es relevante si se tiene en cuenta que todos estos análisis corresponden a regiones geográficas diferentes 5,6,17.
En el presente estudio, se comparó la micobacteriosis pulmonar con las extrapulmonares para establecer las diferencias en cuanto a la presencia de los factores predisponentes asociados, y se comprobó que el antecedente de tratamiento antituberculoso fue uno de los más relevantes en las formas pulmonares, lo cual podría deberse a que la primera vez que los pacientes recibieron el tratamiento solo se les hizo una baciloscopia y no se hicieron cultivos en las muestras, por lo cual no se comprobó si se trataba de una micobacteria no tuberculosa; además, la tuberculosis pulmonar deja bronquiectasias como secuela y estas pueden ser colonizadas por dichas micobacterias. De ahí la importancia de utilizar pruebas para identificar las especies en todos los casos sospechosos de micobacteriosis con este antecedente, ya que las micobacterias no tuberculosas tienen la capacidad de colonizar el pulmón cuando se presentan daños estructurales como los producidos por el complejo M. tuberculosis, en especial cuando se hace un diagnóstico tardío 1,3,6,7.
Se encontró que la micobacteriosis pulmonar era más frecuente en personas mayores de 51 años, principalmente en los hombres mayores de 60. En el estudio de Prevots, et al., se evidenció que la prevalencia de la micobacteriosis aumentaba siete veces en hombres y mujeres mayores de 60 años, lo cual coincide con los datos del presente estudio 17-19.
La micobacteriosis cutánea se asocia con traumas, heridas quirúrgicas o inyecciones y, especialmente, con procedimientos estéticos en los cuales usualmente se emplean sustancias sin control sanitario o no se cumplen los protocolos de desinfección, higiene y bioseguridad. Esta situación se ha descrito en varios países de Suramérica y afecta en un mayor porcentaje a las mujeres 8,9,19.
En un estudio realizado entre el 2004 y el 2007 por García, et al., se analizaron 80 casos de problemas en la piel asociados con procedimientos estéticos y, en 33 (41,2 %) de ellos, se identificó alguna micobacteria no tuberculosa como causante de la infección: 57,5 %, M. chelonae, 24,2 %, M. fortuitum, y 18,2 %, M. abscessus. En Venezuela se evaluaron 49 pacientes que desarrollaron infección en la piel y los tejidos blandos después de una mesoterapia y, en 81,6 % de los casos, se identificó una micobacteria: M. abscessus en el 55 % de ellos, M. fortuitum en el 25 % y M. chelonae en el 10 %, datos similares a los de este estudio. Por otra parte, se evidenciaron algunas diferencias porcentuales con el estudio de García, las cuales pueden estar relacionadas con el uso de pruebas de identificación fenotípica que dificultan la diferenciación de especies estrechamente relacionadas, como M. abscessus y M. chelonae, las cuales pueden identificarse con mayor precisión al emplear métodos moleculares 19-23.
La micobacteriosis diseminada y la linfática se deben generalmente al complejo M. avium y se asocian con inmunosupresión. Los especímenes ingresan principalmente por la vía gastrointestinal y se ha demostrado que algunos linajes del complejo son más virulentos y favorecen la invasión de las células HT-29, lo cual permite la diseminación a múltiples órganos, especialmente en personas inmunocomprometidas. En este estudio, la forma diseminada y la linfática presentaban inmunosupresión en 68,9 % y 85,7 % de los casos, respectivamente, lo cual coincide con lo reportado en la literatura mundial 24.
En algunos estudios se han identificado mutaciones en genes implicados en la producción y el control de la interleucina 12 y el interferón gamma, así como en el control de la reacción celular y el desarrollo hematopoyético, lo que hace a los individuos más propensos a padecer micobacteriosis diseminada 25.
En la revisión de Osorio, et al., para caracterizar las complicaciones infecciosas pulmonares en pacientes con HIV tras 20 años del inicio de la terapia antirretroviral combinada, se encontró que las especies de mayor relevancia clínica fueron el complejo M. avium, M. kansasii, M. fortuitum, M. abscessus, M. malmoense y M. simiae, lo cual coincide con lo hallado en el presente estudio. Se ha establecido que los recuentos de CD4 menores de 50 células/μl y las cargas virales mayores de 100.000 copias/ml aumentan el riesgo de presentar micobacteriosis 17,26,27.
Ueki, et al., describieron en su trabajo que el 97,8 % de los casos de micobacteriosis diseminada se debía al complejo M. avium; en los pacientes con infección concomitante con el HIV, esta especie también predominó (80,2 %) 16.
En los últimos años, el diagnóstico de las micobacterias no tuberculosas como agentes etiológicos se ha incrementado con el desarrollo y la introducción de métodos más sensibles en la rutina de los laboratorios, así como con el reconocimiento de nuevas especies asociadas con enfermedades 28-31. En Colombia, Castro, et al., identificaron las siguientes especies de micobacterias utilizando la técnica de análisis de patrones de restricción: M. fortuitum, M. abscessus, M. intracellulare, M. gordonae, M. avium, M. chelonae, M. scrofulaceum, M. szulgai, M. terrae y M. malmoense; al comparar estos datos con los nuestros, se observó que el uso de la metodología Genotype CM/AS™ ha permitido detectar especies como M. kansasii, M. mucogenicum y M. simiae10,14.
Una limitación de este estudio la constituyó el diligenciamiento del formato único de vigilancia de las micobacterias, ya que la información no es completa en cuanto a la presencia de otros factores predisponentes asociados, así que, en los casos en que no se registró la información completa, no fue posible asegurar que estos no existieran, lo cual constituye un sesgo.
En todos los estudios citados, se resalta la importancia del diagnóstico diferencial entre especies del complejo M. tuberculosis y las micobacterias no tuberculosas. Asimismo, es importante que los médicos hagan la correlación con los criterios clínicos, radiológicos y bacteriológicos establecidos por la American Thoracic Society (ATS), mediante los cuales es posible hacer el diagnóstico adecuado y, en consecuencia, prescribir el tratamiento idóneo en estos casos 1,32.
El reto de los servicios de salud es fortalecer la capacidad de los médicos tratantes para sospechar, diagnosticar y tratar los casos de micobacterias no tuberculosas, pues cada vez se describen más especies asociadas con enfermedades. Es fundamental que las fuentes de información proporcionen datos que permitan correlacionar los factores predisponentes asociados ya descritos y documentar otros nuevos, incluidos el entorno ambiental de los pacientes, las actividades laborales y las intervenciones quirúrgicas, entre otros.














