El síndrome de embolia grasa es la alteración que se produce en no o más órganos por el desplazamiento de partículas grasas después de la fractura de uno o más huesos largos del esqueleto apendicular. Generalmente, compromete la microcirculación pulmonar produciendo bloqueo vascular, puede afectar otros órganos como el cerebro, la retina y la piel, y ocurre en las primeras 24 horas de la lesión 1. En términos sencillos, la embolia grasa es la presencia de partículas de grasa en la microcirculación, con consecuencias clínicas o sin ellas 2, y el síndrome de embolia grasa es la manifestación grave y sistémica de los émbolos grasos en la microcirculación 3. Este síndrome se asocia, principalmente, con el traumatismo ortopédico 3, pero se ha reportado también en casos de trasplante de médula ósea, osteomielitis, liposucción, pancreatitis e hígado graso por alcohol 4.
El síndrome de embolia grasa fue descrito por Zenkeren en 1862 en un paciente que sufrió una lesión por aplastamiento grave 3,5. En 1865 Wagner atribuyó el contenido de grasa en los pulmones a la médula ósea y asoció el síndrome de embolia grasa con las fracturas 6. La caracterización clínica del síndrome se atribuye a von Bergmann en 1873 7. En 1914 Tanton propuso la primera medida para prevenirlo: la inmovilización adecuada de las fracturas 5. Entre 1970 y 1974, se establecieron los criterios clínicos de Gurd y Wilson 4,8.
La incidencia del síndrome de embolia grasa es variable debido a la ausencia de criterios uniformes y reproducibles en el campo asistencial. Se reportan incidencias de 0,25 % y hasta de 35 % de síndrome de embolia grasa postraumático 6,9,10. En un estudio en Estados Unidos, en el cual se revisaron 928 millones de registros clínicos de pacientes dados de alta tras hospitalizaciones cortas, se reportó una prevalencia de 0,004 % 11, y en 21 millones de pacientes que presentaron fracturas aisladas de fémur (excepto cuello), tibia, peroné, pelvis, costillas,húmero, radio y cúbito, la incidencia de este síndrome fue de 0,12 % 11. Los pacientes con fracturas múltiples del fémur (excluido el cuello) presentaron una incidencia mayor en comparación con quienes sufrieron fracturas aisladas de fémur (1,29 Vs. 0,54 %)11).
Se ha reportado que el síndrome de embolia grasa es más frecuente en pacientes jóvenes, entre los 10 y los 40 años de edad, que en pacientes mayores de 40 años 11,12. Sin embargo, algunos autores señalan que su incidencia en menores de 10 años es hasta cien veces menor que en adultos13,14.
Las tasas reportadas de mortalidad por síndrome de embolia grasa se encuentran entre 7, 15 y 20 % 14-16. Colombia y Latinoamérica carecen de cifras estadísticas sobre este síndrome. El pronóstico de la embolia grasa cerebral es favorable, la mortalidad fluctúa entre el 5 y el 15 %, y se ha reportado la recuperación cognitiva completa a los cuatro meses17.
La fisiopatología del síndrome de embolia grasa sigue siendo estudiada, y para explicarla se barajan dos hipótesis 3,6: la mecánica y la bioquímica. La hipótesis mecánica postula que el trauma induce una liberación de partículas grasas derivadas de la médula ósea, que tienen potencial protrombótico y proinflamatorio. La obstrucción sistémica, predominantemente en el lecho pulmonar, genera un incremento de la agregación plaquetaria y de la formación de fibrina, lo que lleva a la disfunción pulmonar, compromete el proceso de respiración y perfusión, produce hipoxia o hipoxemia e, incluso, infartos en el parénquima pulmonar.
Por otra parte, la hipótesis bioquímica propone que la liberación de ácidos grasos mediada por la ciclasa del adenilato induce la activación de la lipasa de lipoproteínas que hidroliza triglicéridos, y forma glicerol y ácidos grasos libres. Estos últimos producen daño directo en los neumocitos y en las células endoteliales pulmonares, generando como reacción un incremento en la permeabilidad y la inactivación del surfactante, así como la activación de múltiples cascadas bioquímicas (factor activador de plaquetas, fosfolipasa A2, serotonina y óxido nítrico) que, en última instancia, resulta en dificultad respiratoria.
La presentación clásica de este síndrome cursa con la tríada de hipoxia, petequias y alteración del estado mental 18. El síndrome de dificultad respiratoria es su característica más importante y, a menudo, la única, en tanto que las petequias se observan predominantemente en la región torácica, axilar y en la conjuntiva ocular 19. En el cerebro, las embolias de pequeñas y múltiples partículas de grasa causan hemorragias petequiales extensas e infartos ‘lacunares’ que comprometen la sustancia blanca y la gris y, en algunos casos, logran producir infartos más grandes. Sin embargo, los síntomas neurológicos que se presentan suelen ser transitorios y van desde los focales hasta la encefalopatía global 20. Las complicaciones neurológicas del síndrome de embolia grasa pueden llegar, incluso, hasta el coma con signos de convulsión focal o sin estos.
El diagnóstico del síndrome de embolia grasa es clínico, puesto que no existen exploraciones que permitan otro tipo de diagnóstico más certero. En este sentido, en las últimas décadas se han planteado diversos criterios diagnósticos, siendo los de Gurd y Wilson 8 los más aceptados 21 desde la década de 1970.
Se reporta el caso de una mujer joven que presentó un síndrome de embolia grasa con repercusiones cognitivas y neurológicas (motoras y sensoriales) después de sufrir politraumatismo por fractura del fémur y el húmero izquierdos. La paciente se recuperó tras un largo proceso de rehabilitación neurológica. Si bien en muchos de los artículos especializados se plantea que el pronóstico general es favorable 20,22, la información disponible no es suficiente en cuanto al pronóstico y la recuperación de los déficits neurológicos producidos por este síndrome.
Caso clínico
Se trata de una mujer de 21 años de edad, deportista de alto rendimiento sin antecedentes médicos de importancia, que sufrió un accidente de tránsito cuando conducía bicicleta en el área rural del departamento de Antioquia, Colombia. La paciente no perdió la conciencia tras el accidente y presentó trauma en el brazo, el antebrazo, la pelvis y el muslo izquierdos. Fue trasladada a un centro de salud de primer nivel, en donde se reportó una puntuación de 15/15 en la escala de coma de Glasgow, deformidad en el brazo y el muslo izquierdos, e impresión diagnóstica de fractura de fémur y húmero. Se le administró morfina, tramadol y metoclopramida, y no se hizo una adecuada inmovilización femoral. Posteriormente, fue remitida a un hospital de tercer nivel de Medellín, al cual ingresó en malas condiciones generales, con 4/15 en la escala de Glasgow, disminución de la saturación de oxígeno por pulsioximetría (SpO2) de 87 % y relativa estabilidad hemodinámica (frecuencia cardiaca: 93 latidos por minuto; presión arterial: 120/83 mm Hg; frecuencia respiratoria: 18 respiraciones por minuto). Requirió intubación traqueal y fue internada de urgencia en la unidad de cuidados intensivos por bronco aspiración aguda.
A las dos horas del ingreso a esta unidad, se le hizo una tomografía computarizada (TC) de cráneo, la cual no reveló alteraciones; en la TC de abdomen, se observó fractura del polo inferior del riñón izquierdo con hematoma encapsulado y en los rayos X de las extremidades, se evidenció una fractura cerrada del fémur y del húmero izquierdos, sin compromiso articular.
La paciente fue sometida a cirugía urgente para suturar el polo renal izquierdo y colocar un tutor en su miembro inferior izquierdo. Los resultados de los exámenes de laboratorio evidenciaron leucocitosis con neutrofilia, bandemia mayor de 13 %, proteína C reactiva de 3,4 mg/L, pruebas de coagulación normales, fibrinógeno de 489 mg/dl, ácido láctico de 2,6 mmol/Ly creatinina de 0,6 mg/dl; los gases arteriales revelaron una acidosis metabólica y requirió fármacos vasopresores.
En el primer día en la unidad de cuidados intensivos, la paciente presentó neumotórax izquierdo con enfisema subcutáneo y, 18 horas más tarde, síndrome de dificultad respiratoria del adulto y aumento de los reactantes de la fase aguda, por lo que requirió tratamiento antibiótico. Se le diagnosticó hipertensión pulmonar grave con presión sistólica de la arteria pulmonar de 81 mm Hg, la cual persistió durante toda la hospitalización. En los días siguientes la paciente presentó inestabilidad respiratoria a pesar de la asistencia respiratoria mecánica. En los rayos X de seguimiento se detectaron infiltrados en los cuatro cuadrantes pulmonares, con saturación de oxígeno de hasta 25 %, coagulopatía con trombocitopenia (plaquetas: 49.000 x 109/L), y anemia (hemoglobina de 6,5 g/dl) que requirió transfusión de glóbulos rojos y aféresis de plaquetas. Durante la primera semana en la unidad de cuidados intensivos se contempló la posibilidad de suspender la asistencia respiratoria mecánica, pero la familia insistió en que se mantuviera.
En el día 14 de hospitalización los resultados de los exámenes neurológicos evidenciaron reflejo corneano del lado derecho mas no en el izquierdo, ausencia del reflejo de la tos y de movilidad en las extremidades ante el estímulo, reflejo plantar flexor bilateral neutro, taquicardia, hipertensión arterial y midriasis que no respondió al bolo de fentanilo ni al de manitol, por lo que se sospechó una posible embolia grasa masiva. Se hizo una segunda TC de cráneo que evidenció cambios cerebrales indicativos de embolia grasa y no de encefalopatía hipóxica isquémica.
En el día 19 de hospitalización en la unidad de cuidados intensivos, la condición neurológica y los parámetros respiratorios de la paciente comenzaron a mejorar lentamente, pero de forma notable. En el electroencefalograma de superficie, se observaron ondas alfa y delta sugestivas de encefalopatía hipóxica isquémica. En el día 29 la paciente abrió los ojos de manera espontánea y se inició el tratamiento con oxígeno nebulizado hasta el momento en que ya no requirió asistencia respiratoria mecánica. Fue trasladada a una sala de atención general donde permaneció un mes y diez días, momento en el que se le dio de alta.
En el momento del egreso la paciente solo presentaba respuestas básicas, como la risa social, su nivel de conciencia era mínimo, su lenguaje no era expresivo, podía hacer seguimiento visual pero no podía mover las extremidades de forma voluntaria, y se mantenían la traqueostomía y la gastrostomía.
Pasado el primer mes tras el alta, la paciente fue evaluada medicamente para iniciar el proceso de rehabilitación neurológica y se reportó que permanecía postrada en cama, su interacción con el medio era limitada, seguía sin movimiento voluntario en las extremidades, abría los ojos de forma espontánea y no podía hablar. Se le hizo una resonancia magnética cerebral que sugirió la presencia de daño axonal difuso, pero el hallazgo no fue concluyente dado que fue necesario utilizar secuencias rápidas por las condiciones de la paciente (figura 1).
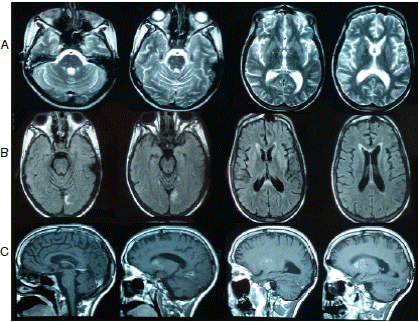
Figura 1 Resonancia magnética posterior a la hospitalización A. De izquierda a derecha: resolución de edema cerebral, infartos ‘lacunares’ en puente, núcleos de la base y tálamos. B. De izquierda a derecha: necrosis cortical laminar bilateral en corteza occipital (mayor compromiso izquierdo) y cambios en la señal del esplenio del cuerpo calloso (con gandolinio). C. De izquierda a derecha: infartos ‘lacunares’ en ganglios de la base y necrosis cortical laminar de predominio occipital izquierdo (con contraste)
Con el apoyo de la familia, de los terapeutas y de los médicos, se inició desde ese momento estimulación sensorial, sensoperceptiva y motora durante dos meses en casa, con lo cual se logró dar comienzo a un proceso de rehabilitación intensivo (cinco horas diarias de lunes a viernes, durante un mes) en un centro de rehabilitación de Medellín, donde se utilizaron técnicas de neurorrehabilitación motora y sensorial a cargo de un equipo interdisciplinario de terapeutas y médicos. Con ellas, la paciente logró recuperar la marcha entre el tercer y el cuarto mes después del egreso hospitalario.
En este primer proceso se utilizaron el entrenamiento conductual, la manipulación de estímulos y la repetición para estimular el cerebro de la paciente de manera que volviera a aprender varias tareas 23. Además, se emplearon tratamientos no farmacológicos, como estimulación periférica y terapia de movimiento inducido por restricción (Constraint-Induced Movement Therapy, CIMT) 24,25. Entre el cuarto mes, cuando la paciente comenzó a caminar nuevamente, y el año a partir del alta hospitalaria, recibió dos ciclos de CIMT con un intervalo de, por lo menos, seis meses. Cada ciclo de CIMT consistió en la restricción mediante un chaleco especial del movimiento voluntario de la extremidad superior derecha (mano, antebrazo y brazo) durante 90 % del tiempo de vigilia a lo largo de 14 días y en una rutina intensiva, supervisada y repetitiva de práctica concentrada de entrenamiento físico y actividades con el lado del cuerpo más afectado, es decir, la extremidad superior izquierda, durante cinco horas al día, por lo menos 24.
Durante el primer año de recuperación, además de la rehabilitación motora, se comenzó la rehabilitación visual intensiva, ya que se detectó compromiso neurológico de la visión. Se empleó la técnica de oclusión óptico-funcional 26, la cual consiste en la utilización de un parche ocular de restricción en el ojo con mejor visión durante 14 días y 50 horas de estimulación visual intensiva y supervisada en el ojo afectado. Con dicho proceso, la paciente mejoró la percepción y la agudeza visuales, así como la coordinación viso-espacial hasta lograr una agudeza visual de cerca de 20/125 con corrección en el ojo izquierdo y de 20/500 en el ojo derecho.
Un año y dos meses después del alta hospitalaria se le hizo una prueba neuropsicológica, la cual evidenció disfunción ejecutiva, trastorno en el almacenamiento y evocación de la información verbal, trastorno de atención (selectiva, visual, auditiva y alternante), apraxia constructiva y alteración viso-perceptual. Además, la paciente presentaba apatía, anosognosia parcial, irritabilidad y limitada capacidad de juicio.
Se iniciaron, entonces, la terapia de rehabilitación neuropsicológica para el déficit cognitivo y la terapia fonoaudiológica centrada en el habla y el lenguaje, y se continuó con las fisioterapias motora y sensorial de soporte. En las sesiones de rehabilitación neuropsicológica, se emplearon rehabilitación viso-espacial, la terapia cognitivo-lingüística, corrección de apraxias, y entrenamiento de la memoria y las habilidades de atención. En la figura 2 se presenta la resonancia magnética de seguimiento.
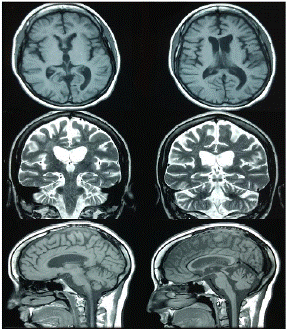
Figura 2 Resonancia magnética de control cinco años después del síndrome de embolia grasa. Se observan cambios retráctiles difusos en el parénquima encefálico, ventriculomegalia compensatoria y malacia occipital izquierda con gliosis
En el examen físico de la paciente, realizado seis años después del accidente, los especialistas en rehabilitación neurológica reportaron una persona consciente, orientada en las tres esferas, con lenguaje comprensivo y coherente. En la evaluación cognitiva de Montreal (Montreal Cognitive Assessment, MoCA) su puntaje fue de 25. Presentaba integridad de los 12 nervios craneales, una leve alteración en la marcha, con dificultad para la movilidad de la extremidad inferior izquierda, aunque sin necesidad de apoyo para caminar, una fuerza de 5/5 en las extremidades superiores y de 4+/5 en las inferiores, así como coordinación, sensibilidad y tono normales, reflejo rotuliano exaltado, reacción plantar neutra bilateral y el fijador de Hoffman se había retirado. La paciente presentaba clonus agotable en la extremidad inferior izquierda, y ya había logrado terminar una carrera tecnológica.
Ocho años después del accidente la paciente fue sometida a evaluaciones de neurología clínica y rehabilitación neurológica, y los resultados indicaron que tenía autonomía para las actividades básicas, aunque requería ayuda para algunas actividades instrumentales (por ejemplo, manejar el computador). Hoy trabaja en el negocio familiar. Su puntaje en el Mini- Mental State Examination es de 29 sobre 30, y de 26 en el MoCA. Persistía un defecto pupilar aferente en el ojo derecho por atrofia óptica de predominio derecho, y su agudeza visual de lejos en el ojo derecho era de 20/400 y de 20/80 con corrección en el izquierdo. Su fuerza en miembros inferiores continuaba siendo de 4+/5 (paraparesia espástica leve de predominio izquierdo), y presentaba hiperreflexia rotuliana y clonus agotable en el pie izquierdo, pero sin temblor en acción ni en reposo. Su coordinación bimanual era normal y no tenía contracturas musculares ni patrón flexor en las extremidades. La paciente lograba caminar en puntas y talones, presentaba taquilalia y disartria central moderadas y, a nivel cognitivo, predominaba una amnesia anterógrada de evocación de la información y un trastorno de leve a moderado de la función ejecutiva.
Consideraciones éticas
Se obtuvo la aprobación y la autorización de la paciente para publicar su caso.
Discusión y conclusiones
El síndrome de embolia grasa es una condición clínica potencialmente mortal que se presenta usualmente entre las 24 y las 72 horas después del trauma 18. En el presente caso fue de rápida aparición (menos de 12 horas).
La enfermedad ocurre generalmente por el efecto oclusivo de los émbolos grasos en las arteriolas de la circulación cerebral y el efecto citotóxico de los ácidos grasos libres que aumentan la permeabilidad capilar. Ambos mecanismos provocan microinfartos que se acompañan con edema y microhemorragias 27. Este síndrome debe sospecharse sobre todo en adultos jóvenes que han sufrido fractura de pelvis o de huesos largos, con un deterioro neurológico rápido en ausencia de trauma craneoencefálico, aunque las lesiones o traumas craneales no descartan esta condición 22.
Se han descrito varios factores de riesgo para el síndrome de embolia grasa 6,11,18: ser de sexo masculino, tener entre 10 y 39 años, haber sufrido fracturas múltiples, cerradas y de origen traumático no tratadas quirúrgicamente o tratadas con demora (en especial, en los miembros inferiores), presentar hipovolemia con el trauma, disminución de la reserva cardiopulmonar, fractura bilateral de fémur, fracturas de diáfisis femorales, lesión pulmonar asociada, fractura femoral reducida con clavo intramedular fresado y no fresado, procedimientos quirúrgicos bilaterales o reemplazo articular con prótesis de gran tamaño.
La paciente de este caso presentó algunos de los factores de riesgo para el síndrome de embolia grasa, pues tenía 21 años, presentaba fracturas múltiples (fractura cerrada de humero y fémur izquierdos sin compromiso articular) y fractura cerrada de origen traumático en miembros inferiores (fractura de diáfisis femoral izquierda). Llama la atención que la paciente no presentó un estado postraumático hipovolémico inicial hasta que fue recibida en el hospital de tercer nivel. Debe señalarse que tenía una elevada reserva cardiopulmonar, pues se trataba de una deportista de alto rendimiento, y el traumatismo inicial no comprometió los pulmones, pero sí el polo renal inferior izquierdo, con un hematoma encapsulado. No obstante, ninguno de los factores de riesgo relacionados con la cirugía se cumplía en la paciente.
La búsqueda de artículos sobre otros casos similares, en especial en mujeres deportistas de alto rendimiento que presentaran fractura renal y fractura femoral unilateral cerrada, no arrojó resultados. En la literatura revisada, tampoco se encontraron datos o explicaciones sobre el posible efecto de los medicamentos recibidos en pacientes con fractura de hueso largo y síndrome de embolia grasa con compromiso neurológico, cuestión pertinente, ya que la paciente recibió morfina, tramadol y metoclopramida.
El diagnóstico del síndrome de embolia grasa es clínico y se ha escrito una tríada clásica de disfunción neurológica, petequias y dificultad respiratoria que no se presenta en todos los pacientes, por lo que su ausencia no lo descarta. La paciente de este caso solo presentó dos de los tres elementos de la tríada (compromiso neurológico y respiratorio). En cuanto al compromiso cerebral debido al síndrome de embolia grasa, este ocurre en 0,9 a 2,2 % de los casos 28. La resonancia magnética es de gran utilidad para ayudar a confirmar el diagnóstico de síndrome de embolia grasa cerebral y para descartar otras causas de deterioro neurológico; los hallazgos se caracterizan por manchas brillantes en un campo oscuro, el llamado ‘patrón en campo de estrellas’ 22.
La paciente se mantuvo consciente desde el momento del accidente hasta el inicio del compromiso neurológico (Glasgow de 4/15 al ingresar al hospital de tercer nivel). La historia del inicio de los síntomas es crítica para diferenciar entre una lesión axonal difusa (deterioro inmediato en el nivel de conciencia después del trauma) y una embolia grasa cerebral (disfunción neurológica después de un intervalo de lucidez), más si se trata de pacientes con politraumatismos en quienes es difícil la extubación, y que presentan taquicardia y fiebre persistentes20.Si bien en el caso reportado la primera resonancia magnética cerebral se tomó en el momento del alta hospitalaria, la literatura médica señala que en la embolia grasa las imágenes muestran inicialmente hemorragias petequiales más extensas y muy pequeñas ubicadas difusamente en la sustancia blanca, la corteza, los ganglios basales y el cerebelo 20.
El tratamiento del síndrome de embolia grasa es principalmente de soporte y, antes de considerar la suspensión de dichas medidas, debe esperarse un mes a partir del momento en que se presenta la lesión y a que en la resonancia magnética cerebral no se observen signos de mejoría 29. Este tiempo no es un criterio único para decidir la terminación del tratamiento, dado que en algunos casos se ha requerido asistencia respiratoria durante un periodo mayor y los pacientes se han recuperado completamente18.
Es fundamental el reconocimiento temprano de este síndrome, puesto que, a pesar de la gravedad que entraña, el pronóstico es favorable con cuidados intensivos y rehabilitación 22. La prevención secundaria del daño neurológico debido a la hipoxia es fundamental durante el manejo en la unidad de cuidados intensivos para evitar déficits permanentes 22. No se encontró información contundente sobre los índices de recuperación visual, cognitiva, motora y psicológica después del síndrome de embolia grasa.
En algunos reportes de caso, se han descrito déficits neurológicos como disartria, alteración de la memoria y la concentración, déficit visual leve, escotoma central, parálisis facial, espasticidad, debilidad muscular e hiperreflexia 18,22,29.
En contraste con otros casos reportados, este fue excepcional en el sentido de que la estancia en la unidad de cuidados intensivos fue prolongada, se consideró desconectar a la paciente durante la primera semana dada su indiscutible gravedad, y las imágenes diagnósticas evidenciaron un espectro de déficits neurológicos centrales, desde infartos ‘lacunares’ y necrosis cortical laminar hasta cambios retráctiles y gliosis del parénquima cerebral. El tiempo de recuperación y de rehabilitación fue mayor de un año, lo que contrasta con lo descrito en otros informes de caso, en los que los procesos se extendieron durante varias semanas y hasta seis meses20,22,29.
Si bien no hay un protocolo estándar de rehabilitación neurológica y cognitiva para pacientes con síndrome de embolia grasa, el equipo responsable del proceso de recuperación de la paciente empleó varias estrategias de neurorrehabilitación intensiva, rehabilitación motora y visual, utilizando técnicas de restricción e intensidad masiva (como la CIMT y la oclusión óptico-funcional) 24,26, de estimulación sensorial periférica, fonoaudiológica y neuropsicológica basadas en principios de intensidad y progresión 30, como la CIMT 31, y de seguimiento continuo de las reacciones del paciente 30. Se emplearon varias técnicas de rehabilitación neurológica no farmacológica 25 orientadas a promover los mecanismos de sustitución cerebral en la fase crónica (seis meses después del síndrome de embolia grasa), los cuales dependen de la práctica, de la reactivación de las redes cognitivas,visualesy propioceptivas,y de los cambios en la eficacia sináptica y la plasticidad reorganizacional con un costo compensatorio físico y mental32.
Todavía no se entiende cabalmente cómo el sistema nervioso central reacciona ante las lesiones, y los pacientes vuelven a adquirir conductas perdidas mediante el entrenamiento y las nuevas terapias de neurorrehabilitación33. En este sentido, debe promoverse un cambio del paradigma: dejar de concebir la recuperación neurológica como algo estático e, incluso, imposible.
El tratamiento y la rehabilitación multidisciplinaria mejoran las posibilidades de recuperación neurológica, cognitiva y física en este tipo de pacientes 18 que, a pesar del pronóstico inicial ominoso, pueden recuperar parcial o completamente sus funciones. En este sentido, hoy la rehabilitación neurológica agrupa todas las evaluaciones y prácticas que incluyen cada aspecto del cuidado de los pacientes con déficits neurológicos agudos o crónicos, con el fin de disminuir las deficiencias y discapacidades, aumentando la capacidad funcional.














