La leche y los productos lácteos son componentes importantes de la dieta humana e, históricamente, se les ha valorado por su aporte nutricional de aminoácidos 1. La leche bovina, la más frecuentemente consumida, está constituida por 3,6 % de proteínas, 4,1 % de grasas, 5,0 % de carbohidratos, menos de 1 % de vitaminas y minerales, y 86,6 % de agua 2.
De la fracción proteica, la caseína es el principal (80 %) componente y está presente en forma de micelas, partículas esféricas de dimensión no uniforme 3. La micela de la caseína está compuesta por cuatro subunidades polipeptídicas denominadas caseínas αs1, αs2, β y κ 4,5. En los últimos años se ha explorado su capacidad para influir en funciones hematopoyéticas normales 6 e, incluso, en la reacción inmunitaria de modelos animales por medio de la producción de citocinas como la IL-1β por parte de los macrófagos; de esta forma, la caseína puede actuar como reguladora del sistema inmunológico 7.
En este sentido, se ha observado que en las ratas alimentadas con caseína se reduce el desarrollo de tumores de colon, y se sugirió que dicho proceso involucraba al sistema inmunológico 8, en tanto que se ha reportado que la ingestión de caseína parece un evento obligado para la maduración del sistema inmunológico en las mucosas 9.
Por otro lado, se sabe que las casomorfinas, derivadas de la degradación proteolítica de las caseínas, inhiben la proliferación de las líneas celulares de cáncer de seno y de próstata 10,11. Además, las caseínas αs1, αs2, β y κ, y el caseinato de sodio, una sal que contiene las subunidades de la caseína, inhibieron la proliferación de las células mieloides 32D clone 3 (32Dcl3) de ratón al promover su diferenciación hacia macrófagos 12,13.
Se evidenció que el caseinato de sodio y las caseínas indujeron la expresión del ARN mensajero (ARNm) del CD115, receptor de membrana para el factor estimulante de colonias de macrófagos (Macrophage-Colony Stimulating Factor, M-CSF) -también conocido como receptor M-CSFR (Macrophage-Colony Stimulating Factor Receptor) o proto-oncogen c-fms (Colony-Stimulating Factor-1 Receptor)-, el cual es un marcador comúnmente asociado a macrófagos, en tanto que la caseína α y el caseinato de sodio promueven la síntesis de M-CSF, una citocina involucrada en la diferenciación y la función de monocitos y macrófagos 13.
Se sabe que la caseína α induce la producción de IL-1β 14 y que esta citocina inhibe la proliferación de las células 32Dcl3 mediante la producción del factor de necrosis tumoral α (TNF-α) 15,16, pero se desconoce si el caseinato de sodio y las caseínas inhiben la proliferación de las células 32Dcl3 mediante la producción de TNF-α.
En este estudio se analizó la posible inducción del TNF-α en las células 32Dcl3 por parte de las caseínas y su intervención en la inhibición de la proliferación. Los resultados indicaron que el caseinato de sodio y las subunidades de caseína inhibieron la proliferación, y que solo el caseinato de sodio y la caseína α estimularon la producción del TNF-α en las células 32Dcl3.
Materiales y métodos
Citocinas y anticuerpos
Se emplearon la interleucina-3 recombinante de ratón (rmIL-3), el factor de necrosis tumoral α recombinante de ratón (rmTNF-α) y el anticuerpo anti-factor de necrosis tumoral α de ratón (anti-TNF-α) (R&D Systems, USA).
Cultivo celular
La línea celular mieloide 32Dcl3 de ratón donada por T. Hoang (Hematopoiesis and Leukemia Laboratory, Montreal, Quebec, Canadá), se mantuvo en medio de cultivo Iscove´s Modified Dulbecco´s Medium (IMDM, Gibco BRL, USA) adicionado con 10 % de suero fetal bovino previamente inactivado con calor (HyClone, Utah, USA), más 0,5 ng/ml de interleucina-3 recombinante de ratón (rmIL-3) como factor de crecimiento, mantenido a una temperatura de 37 °C y con 5 % de CO2.
En estas condiciones, se cultivaron células con caseinato de sodio y sin él (2 mg/ml) (Difco Laboratories, Detroit, MI, USA), y con caseínas α, β o κ (1 mg/ml) (Sigma, México) en placas de 96 pozos (Costar, Cambridge, MA, USA) con una densidad de 2 x 104 células/ml. El medio condicionado se recolectó a las 72 horas de cultivo y se almacenó a -70 °C hasta su uso.
Proliferación celular
Para evaluar la proliferación se cultivaron 2 x 104 células/ml con caseinato de sodio o sin él, y caseína α, β o κ en placas de 96 pozos (Corning NY, USA) en las condiciones antes señaladas durante 56 horas. Posteriormente, se adicionaron 0,5 μCi de [β-3H]dTTP/ml timidina (activity 185 mbq, Amersham Pharmacia Biotech, UK) y las células se cosecharon 16 horas más tarde. Después de lavar y lisar las muestras, se adicionaron 2 ml de líquido de centelleo (Beckman, USA) y se cuantificó la emisión de luz en un contador de partículas beta (beta counter) (Beckman LS6500, USA).
Viabilidad celular
Se determinó la presencia de células viables mediante una prueba con el bromuro de MTT [3-(4,5-dimetiltiazol-2-ilo)-2,5-difeniltetrazol], para lo cual se adicionaron 20 μl de MTT (5 mg/ml de solución salina) al cultivo en placas de 96 pozos, y luego se incubó durante cuatro horas a 37 °C. Posteriormente, las células se lisaron y disolvieron con 100 μl de 0,04 N de ácido clorhídrico (HCl) en isopropanol, estableciendo la absorbancia a 590 nm en un lector de placas (Tecan Spectra, Austria).
Apoptosis
Para detectar la presencia de células positivas para fosfatidilserina como criterio de positividad de las células apoptóticas, se utilizó el estuche PHN1018 de anexina-V-FITC™ (Biosource); la fluorescencia se analizó en un citómetro de flujo (Becton Dickinson, San José, CA), según los procedimientos estándar.
Prueba inmunoenzimática
Para detectar la presencia de TNF-α en el medio condicionado de células con tratamiento de caseinato de sodio o caseínas y sin este, se utilizó el estuche KMC3012 de ELISA (Biosource, USA) conforme a las especificaciones del fabricante y se determinó la absorbancia a 450 nm en un lector de placas (Tecan Spectra, Austria).
Neutralización del TNF-α en cultivos con caseinato de sodio o caseína α
Para neutralizar la actividad del TNF-α en cultivos con caseinato de sodio o caseína α y sin estos, se adicionaron 2 x 104 cel/ml de un anticuerpo neutralizador anti-TNF-α en placas de 96 pozos y se consideraron los controles de rmTNF-α, rmTNF-α más el anticuerpo anti-TNF-α y únicamente anticuerpo anti-TNF-α, evaluando la proliferación como se ha indicado.
Resultados
El caseinato de sodio y las caseínas α, β o κ inhiben la proliferación sin afectar la viabilidad de las células 32Dcl3.
Para mostrar que el caseinato de sodio y las caseínas inhiben la proliferación de las células 32Dcl3, estas se cultivaron en presencia de 0,5 ng/ml de rmIL-3, con o sin caseinato de sodio, y las caseínas α, β o κ durante 72 horas. Los resultados evidenciaron que, a partir de 0,5 mg/ml de caseinato de sodio y de caseína α ο κ y 0,1 mg/ml de caseína β, la proliferación celular se bloqueó significativamente (figura 1) sin afectar la viabilidad que, en todos los casos, fue superior al 90 % (cuadro 1).
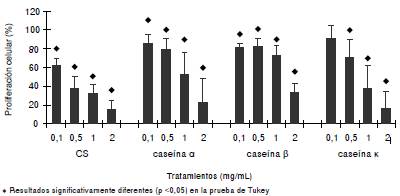
Figura 1 Proliferación de la línea celular 32D cl3 después de 72 horas de incubación en presencia de 0,5 ng/ml de rmIL-3, con o sin el inductor caseinato sódico y las caseínas α, β o κ en diferentes dosis. La proliferación se muestra como el porcentaje incorporado de timidina [3H] con respecto al control.
Cuadro 1 Porcentaje de viabilidad celular determinada mediante pruebas con MTT de la línea celular 32D cl3 tratada con caseinato de sodio y caseínas α, β y κ después de tres días de incubación. Cuantificación del TNF-α mediante ELISA en medios acondicionados de línea celular 32D cl3 sin inductor, caseinato de sodio o caseínas. Los datos muestran el promedio ± desviación estándar (DE).
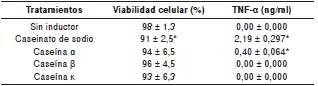
* Resultados significativamente diferentes de la línea 32D sin inductor (p<0,05) en la prueba de Dunnet
Una forma de evaluar el compromiso indicativo de un posible daño celular es la detección de la translocación de la fosfatidilserina de la cara interna a la externa de la membrana celular, lo que indica apoptosis. Los datos obtenidos de la citometría de flujo indicaron que el 23, el 16, el 10 y el 8 % de la población presentó translocación en la región de apoptosis tardía en presencia de caseinato de sodio, y de las caseínas α, β o κ, respectivamente, mientras que en el control esta proporción fue de 4 % (figura 2).
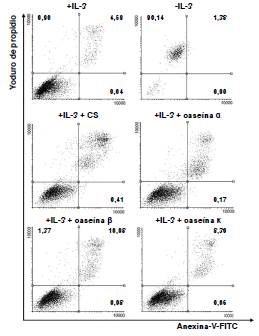
Figura 2 Línea celular 32D cl3 en presencia de 0,5 ng/ml de rmIL-3 incubada con 2 mg/ml de caseinato de sodio y con las caseínas α, β y κ. Se detecta apoptosis por tinción dual de anexina V y yoduro de propidio. Además, se incluye la línea celular 32D cl3 incubada sin rmIL-3 como control de la muerte celular.
El caseinato de sodio y la caseína β indujeron la producción de TNF-α en las células 32Dcl3.
La inducción de la apoptosis puede ser mediada por TNF-α, por lo que al evaluar su presencia en el medio condicionado de células con tratamiento de caseinato de sodio o caseínas, o sin este, la prueba de ELISA evidenció que 2 mg/ml de caseinato de sodio y 1 mg/ml de caseína α inducían la liberación de dicho factor (cuadro 1). En este sentido, aun cuando la adición de la caseína β o la κ redujo de manera significativa la proliferación, los resultados del ELISA indicaron que no inducían la liberación del TNF-α.
El TNF-α fue responsable de la inhibición de la proliferación en cultivos con caseinato de sodio y caseína β.
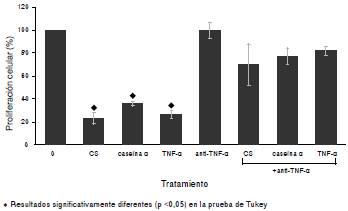
Al constatar que el TNF intervenía en la inhibición de la proliferación de las células 32Dcl3, se procedió a demostrar que estas eran sensibles al efecto del TNF-α recombinante. Los resultados indicaron que sí inhibió la proliferación de 32Dcl3 según la dosis utilizada (figura 3). Una vez se evidenció que el TNF-α recombinante inhibía la proliferación de las células 32Dcl3, se procedió a avaluar si el TNF-α producido por las células 32Dcl3 tratadas con caseinato de sodio o caseína α era el responsable de inhibir la proliferación. El uso de anticuerpos anti-TNF-α de ratón en células 32Dcl3 tratadas con caseinato de sodio y caseína α previno la inhibición de la proliferación en más de 80 % en las células tratadas con caseinato de sodio y en 100 % en las células tratadas con caseína α (figura 4).
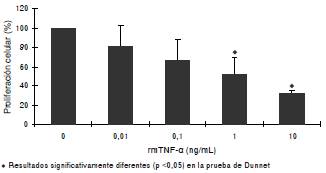
Figura 3 Proliferación de la línea celular 32D cl3 después de 48 horas de incubación en presencia de 0,5 ng/ml de rmIL-3, con o sin inductor rmTNF-α en diferentes dosis. La proliferación se muestra como el porcentaje de incorporación de timidina [3H] con respecto al testigo (0 mg/ml).
Discusión
Se ha demostrado que el caseinato de sodio y la caseína α son capaces de inhibir la proliferación en las células mieloides 32Dcl3 de ratón 12. En este trabajo se muestra que estimulan la liberación del TNF-α, el cual es el principal agente supresor de la proliferación en las células tratadas con caseinato de sodio y el responsable de la inhibición mediada por la caseína α.
En algunos estudios se ha encontrado que la caseína α induce la producción de TNF-α en líneas celulares de monocitos y macrófagos 15,17 e, incluso, en células dendríticas 18. En el presente estudio se evidenció que también lo hace en la línea celular mieloide de ratón dependiente de interleucina-3 32Dcl3, una línea hematopoyética capaz de diferenciarse en eritrocitos, granulocitos y macrófagos 15, lo cual indica que la caseína α, al igual que el caseinato de sodio, regula el funcionamiento de células del sistema inmunológico e, incluso, la generación de células hematopoyéticas.
Es claro que el caseinato de sodio y la caseína α inhiben la proliferación de células 32Dcl3 por medio de la producción de TNF-α; además, ambos inducen la producción del factor estimulador de colonias de macrófagos en la misma línea celular 13. Esto sugiere que pueden activar mecanismos similares, a diferencia de las caseínas β y κ, las cuales inhiben la proliferación, pero no lo hacen por medio del TNF-α, por ello, sería interesante evaluar la participación de otras citocinas inhibidoras de progenitores hematopoyéticos, como el interferón α, que induce la producción de inhibidores de la progresión del ciclo celular en células troncales y progenitoras hematopoyéticas 19.
Se sabe que la caseína activa los macrófagos mediante la unión al receptor TLR4 20 y es probable que en la línea mieloide normal de ratón dependiente de interleucina-3 32Dcl3, que es una progenitora hematopoyética 16, lo haga por medio del mismo tipo de receptores, ya que se sabe que las células troncales y progenitoras hematopoyéticas también expresan los receptores TLR4 21.
Es interesante señalar que, siendo la subunidad de mayor representatividad entre las micelas de la caseína 20, la caseína α en asociación con el caseinato de sodio ejerza efectos similares a este en cuanto a la proliferación e, incluso, la diferenciación y la expresión de citocinas. En este sentido, dado que las caseínas presentan en su estructura péptidos bioactivos, algunos de ellos con características opioides 22,23, sería interesante determinar si alguno de estos es el responsable de la inducción del TNF-α en las células 32Dcl3 tratadas con caseína α.
Nuestros datos revelan que ni las caseínas ni el caseinato de sodio alteran la viabilidad celular detectada mediante el MTT, una prueba que evidencia la actividad metabólica mitocondrial (que solo tiene lugar en células vivas) 24, lo cual no coincide con la ligera inducción de translocación de fosfatidilserina causada por todas las caseínas, especialmente, por el caseinato de sodio (23 %) y la caseína α (16 %), justamente en las condiciones en que se observa la liberación de TNF-α, un promotor de la inducción de la apoptosis 25. La translocación de fosfatidilserina a la cara externa de la membrana es un evento temprano de inducción de la apoptosis y, por lo tanto, es reversible 26. Por ello, bajo estas condiciones es probable que la funcionalidad mitocondrial aún no se encontrara comprometida en el presente estudio 27 y que la viabilidad siguiera intacta. Sin embargo, sabiendo que el TNF-α induce necroptosis 28, sería interesante analizar si las caseínas activan esta ruta de muerte.
Por último, la línea celular 32Dcl3 se considera normal porque no es cancerígena y, habiendo demostrado que las caseínas no inducen la muerte celular en las células hematopoyéticas de médula ósea normal 12, puede decirse que se tienen los modelos para estudiar los mecanismos de eliminación de células en proceso de transformación celular y de aquellas propiamente tumorales, pero no de las verdaderamente normales, tal como lo hace la caseína.
En conclusión, las caseínas α, β y κ inhiben la proliferación de las células 32Dcl3 de manera análoga al caseinato de sodio y el rmTNF-α. El caseinato de sodio y la caseína α, pero no así las caseínas β o κ, inducen la producción de TNF-α en las células 32Dcl3, y este factor es el principal responsable de la inhibición de la proliferación en cultivos con caseína α y caseinato de sodio.