Los casos de tuberculosis resistente en la población infantil reflejan la transmisión reciente de cepas de adultos en la comunidad. Se estima que cada año un millón de niños enferma por el bacilo de la tuberculosis, solo uno de cada tres es diagnosticado, el 99 % de los que inician tratamiento sobrevive y el 22 % de los no tratados muere 1.
En el 2015 la Organización Mundial de la Salud (OMS) notificó 6,1 millones de casos nuevos y recaídas de tuberculosis en el mundo, de los cuales el 6,3 % correspondió a menores de 15 años. Además, se registraron 132.120 casos de tuberculosis multirresistente (Multidrug-resistant TB, MDR-TB) y resistente a rifampicina, de los cuales se estima que 32.000 eran niños 1,2. En ese mismo año en Colombia se notificaron 12.918 casos de todas las formas de tuberculosis al Sistema de Vigilancia en Salud Pública (Sivigila); de estos, 291 (2,2 %) correspondieron a menores de 15 años y tres presentaron tuberculosis multirresistente 3.
En el 2010, Llerena, et al., describieron la situación de la tuberculosis resistente en los menores de 15 años en Colombia; la resistencia global en los niños sin antecedentes de tratamiento fue de 21,1% y en aquellos con tuberculosis multirresistente, de 6,5%; no se encontró resistencia en los previamente tratados 4.
En Colombia son pocos los estudios realizados para conocer la prevalencia de la resistencia a los fármacos en la población infantil. El objetivo del presente trabajo fue actualizar la información obtenida de las actividades de vigilancia por el laboratorio de la farmacorresistencia en personas menores de 15 años en Colombia en un periodo de seis años.
Materiales y métodos
Se llevó a cabo un estudio retrospectivo de corte transversal en menores de 15 años con tuberculosis pulmonar o extrapulmonar entre el 2010 y el 2015 en Colombia.
Se incluyeron 565 menores de 15 años que tenían un cultivo positivo para el complejo Mycobacterium tuberculosis y una prueba de sensibilidad a los fármacos antituberculosis de primera y segunda línea con resultado de sensible o resistente; 35 no pudieron interpretarse o se habían contaminado.
Las fuentes de información fueron el formato único de vigilancia de las micobacterias, que se recibe en el Laboratorio Nacional de Referencia con los datos básicos de cada persona, la base de datos de pruebas de sensibilidad del mismo laboratorio y los informes de tuberculosis del Sivigila.
Para el análisis de los datos, los casos se dividieron en tres grupos: con tuberculosis sensible a la isoniacida y la rifampicina, con tuberculosis resistente a la isoniacida, o con tuberculosis multirresistente, resistente a la rifampicina o ambos. Se analizaron las siguientes variables: procedencia del cultivo según la entidad territorial, sexo, edad, tipo de tuberculosis, muestra procesada, coinfección con HIV y patrón de sensibilidad a los fármacos de primera y segunda línea.
Se calcularon las medidas de tendencia central y dispersión para las variables numéricas y porcentajes para las categóricas, diferenciando entre los tres grupos. Se practicaron las pruebas de diferencia de proporciones y de medias para determinar las diferencias de las variables entre estos grupos, con una confianza del 95 % y una significación estadística de p<0,05.
Para el análisis del perfil de resistencia a los fármacos antituberculosis, se diferenció entre casos nuevos y previamente tratados, se calcularon los porcentajes de los casos con prueba de sensibilidad a los fármacos de primera línea con respecto a lo notificado por el Sivigila, los casos de tuberculosis multirresistente y resistente a la rifampicina con pruebas de sensibilidad a los fármacos de segunda línea, resistencia global a los fármacos de primera (isoniacida y rifampicina) y segunda línea (kanamicina, amikacina, capreomicina y ofloxacina), la resistencia por cada fármaco, la tuberculosis multirresistente y resistente a la rifampicina y la tuberculosis extremadamente resistente (Extensively Drug-Resistant Tuberculosis, XDR-TB) entre los casos multirresistentes.
Las metodologías utilizadas por la Red Nacional de Laboratorios para determinar la sensibilidad a los fármacos antituberculosis fueron: proporciones múltiples en medio de Löwenstein-Jensen y en capa delgada, Bactec MGITTM, Genotype MTBDR plus V2™ y Xpert MTB RIF™.
Los datos se organizaron, se tabularon y se analizaron con las herramientas de Excel™ y Epidat 3.1™.
Aspectos éticos
Según la Resolución 008430 de 1993 del Ministerio de Salud y Protección Social, la información obtenida por el Instituto Nacional de Salud en este estudio hace parte de las actividades de vigilancia de la farmacorresistencia, y el estudio se clasifica como una investigación sin riesgo debido a que es un análisis retrospectivo y no se hizo ninguna intervención intencionada de las variables biológicas, fisiológicas, sicológicas o sociales de los menores.
Resultados
Al comparar los casos notificados al Sivigila de los menores de 15 años y las pruebas de sensibilidad a los fármacos antituberculosis, se encontró que se conocía el perfil de resistencia solo en 82 (13,1 %) de los 624 casos notificados en el 2010, en 83 (11,6 %) de los 714 casos en el 2011, en 96 (15,1 %) de los 636 casos en el 2012, en 104 (18,1 %) de los 575 casos en el 2013, en 110 (18,3 %) de los 600 casos en el 2014 y en 90 (30,9 %) de los 291 en el 2015.
En total, durante los seis años analizados se notificaron 3.440 casos al Sivigila, a 565 (16,4 %) de los cuales se les practicaron pruebas de sensibilidad a los fármacos. Se observó un incremento a partir del 2013 con respecto a lo registrado en los dos años anteriores (p<0,05) y el mayor porcentaje de evaluados se alcanzó en el 2015 (p<0,05) (3,5-9.
De estos 565 casos, 286 (50,6 %) correspondía a mujeres y no se encontraron diferencias estadísticas entre los tres grupos etarios evaluados (cuadro 1).
Cuadro 1 Descripción de variables sociodemográficas en 565 casos de tuberculosis en menores de 15 años, Colombia, 2010 a 2015
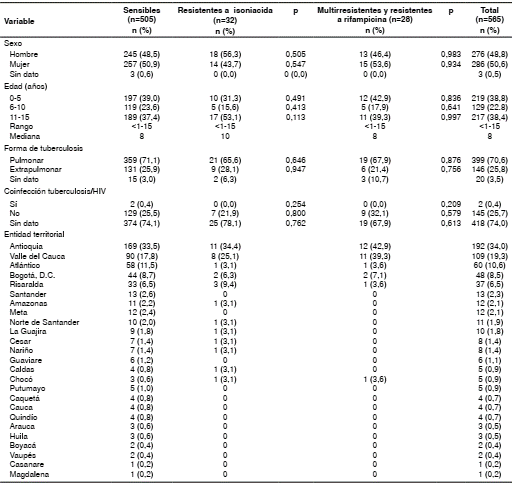
De los menores de 15 años analizados, el menor número de casos de tuberculosis resistente a la isoniacida se presentó en el grupo de los 6 a los 10 años (p<0,05), comparado con el grupo etario de 0 a 5, y el de 11 a 15 años. En los casos de MDR-TB o de resistencia a la rifampicina, no hubo diferencias significativas entre los tres grupos de edad (p=0,081) (cuadro 1).
La tuberculosis fue pulmonar en 399 (70,6 %) casos (cuadro 1). Estos se distribuyeron así: en el grupo de 0 a 5 años, 170 de 219 (77,6 %); en el de 6 a 10 años, 81 de 129 (63 %) y, en el de 11 a 15 años, 172 de 217 (79,2 %). La tuberculosis pulmonar fue menos frecuente en el grupo de 6 a10 años (p<0,05).
De los 146 casos de tuberculosis extrapulmonar, en 89 (61 %) no se informó el origen de la muestra. En 26 (17,8 %), la muestra provenía de la pleura, en 15 (10,3 %), de ganglios, en 7 (4,8 %), de órganos abdominales, en 8 (5,5 %), de la tráquea, y en 1 (0,7 %), del peritoneo.
El registro del resultado de la prueba de HIV solo se obtuvo en 147 (26,0 %) casos, de los cuales 2 (1,4 %) fueron positivos y 418 (73,9 %) no tenían esta información (cuadro 1). Los dos casos positivos eran formas pulmonares de pacientes con edades entre los 11 y 14 años.
En la distribución por entidad territorial de procedencia, se encontró que el mayor aporte provenía de las áreas del país que presentan más casos de tuberculosis y farmacorresistencia; estas son Antioquia con 192 (34,0 %), Valle del Cauca con 109 (19,3 %) y Atlántico con 60 (10,6 %) (cuadro 1).
De los 565 casos analizados, 503 (89,0 %) eran nuevos. En este grupo, 455 (90,4 %) fueron sensibles a la isoniacida y la rifampicina (IC95% 87,8- 93,1), 26 (5,2 %) presentaron resistencia a la isoniacida (IC95% 3,1-7,2), 2 (0,4 %) a la rifampicina (IC95% 0,05-1,4), y 20 (3,9 %) fueron multirresistentes (IC95% 2,2-5,8). En total, se identificaron 48 casos de resistencia, lo que corresponde a una resistencia global de 9,5 % (IC95% 6,9-12,2), sin diferencias significativas entre los años estudiados (cuadro 2).
Cuadro 2 Vigilancia de la resistencia en casos nuevos y previamente tratados de tuberculosis en menores de 15 años, Colombia, 2010 a 2015
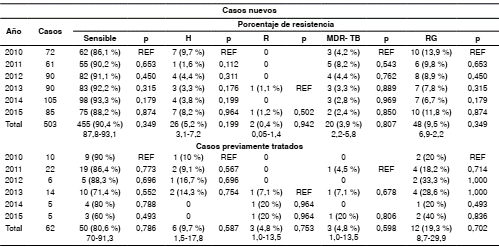
H: isoniacida; R: rifampicina; MDR-TB: tuberculosis multirresistente ; RG: resistencia global; REF: grupo de comparación
Con antecedentes de tratamiento antituberculoso se encontraron 62 (10,9 %) casos. En este grupo, 50 (80,6 %) fueron sensibles a la isoniacida y a la rifampicina (IC95% 70-91,3); 6 (9,7 %) presentaron resistencia a la isoniacida (IC95% 1,5-17,8) y 3 (4,8 %) a la rifampicina (IC95% 1,0-13,5), y hubo multirresistencia en 3 (4,8 %) (IC95% 1,0-13,5). En total, se identificaron 12 casos de resistencia, lo que corresponde a una resistencia global de 19,3 % (IC95% 8,7- 29,9), sin diferencias significativas entre los años estudiados (cuadro 2).
De los 28 casos identificados con MDR-TB o resistencia a la rifampicina, 13 (46,4%) tenían resultado de prueba de sensibilidad a los fármacos antituberculosis de segunda línea. Once casos eran nuevos (39,3 %), de los cuales 9 (81,8 %) fueron sensibles a la kanamicina, la amikacina, la capreomicina y la ofloxacina, y 3 (18,2 %) presentaron resistencia: un niño de dos años de edad a la ofloxacina en Antioquia y otro de 5 años con XDR-TB a la kanamicina, la amikacina y la ofloxacina en el Valle del Cauca. Es decir, de los casos nuevos, uno (9,0 %) presentó resistencia a la kanamicina y la amikacina, y dos (18,2 %) a la ofloxacina, y en uno (9,0%) la tuberculosis era extremadamente resistente XDR-TB. Los dos casos (100 %) previamente tratados fueron sensibles a los cuatro fármacos de segunda línea evaluados.
Discusión
El diagnóstico de tuberculosis y farmacorresistencia en la población infantil es un reto para los sistemas de salud debido a las limitaciones de los métodos diagnósticos por el laboratorio y a la inespecificidad de los síntomas en los niños, lo que favorece el subregistro y hace que no sea clara la magnitud de la enfermedad en ellos.
Algunos estudios indican que la confirmación bacteriológica se logra entre el 20 % y el 50 % de los que ingresan al programa de tuberculosis para tratamiento. Esto puede variar aún más si se tiene en cuenta la sensibilidad de las técnicas diagnósticas empleadas. En Colombia, generalmente son la baciloscopia y el cultivo, métodos con los cuales es difícil detectar la micobacteria debido a la escasa carga bacilar que tienen; además, la obtención de las muestras no es fácil y, en algunos casos, hay fallas en el proceso de recolección y procesamiento que pueden causar falsos negativos 1,10-13.
Otras posibles causas pueden ser las barreras que existen para acceder a las diferentes metodologías, sean convencionales, moleculares o mediante cultivo en medio líquido, las dos últimas con mayor sensibilidad; estos métodos diagnósticos fueron incluidos por el Ministerio de Salud en el plan obligatorio de salud y están disponibles en el país 14,15.
En el 2010, Llerena, et al., reportaron que el porcentaje de casos que contaron con un cultivo de M. tuberculosis y el resultado de la prueba de sensibilidad a los fármacos antituberculosis fue de 3,4 % en el 2007 y de 5,3 % en el 2008. Durante el periodo de estudio del presente trabajo, este porcentaje aumentó al 11,8 % en el 2010, se mantuvo estable hasta el 2014 y aumentó a 30,9 % en el 2015; esto se debe a que para este último año la notificación al Sivigila fue menor 3-9.
No hubo diferencias entre los sexos en lo referente a los casos de tuberculosis pediátrica, tal como se observa en los adultos y similar a lo descrito en otros estudios, en los cuales es claro que lo que sucede en los niños es un reflejo de lo que ocurre en los mayores de edad 4,10,16,17.
Los grupos etarios en los que predominó la tuberculosis infantil fueron de los de 0 a 5 y de 11 a 14 años, semejante a lo publicado por Llerena, et al., quienes observaron que el 62,4 % de los casos pertenecía a los mismos rangos de edad. Otros estudios consultados reportan algunas variaciones en los rangos, sin embargo, todos concuerdan en que existe un mayor riesgo de enfermar en las edades muy tempranas (menores de cinco), el cual disminuye en los niños entre los 6 y los 10 años, y aumenta de nuevo en los mayores de 11 años 4,11,16-20.
La presentación clínica más común es la tuberculosis pulmonar, aunque las formas miliares y extrapulmonares son más comunes que en los adultos y, por ello, siempre se debe mantener la sospecha diagnóstica. En el presente trabajo, el 70,6 % de los casos era de tuberculosis pulmonar, similar a lo reportado por otros autores (4,10,16,20-22.
En Colombia, el mayor porcentaje de los casos de tuberculosis extrapulmonar corresponde a la forma pleural, seguida por la meníngea y la ganglionar. En este estudio, no se encontraron casos de tuberculosis meníngea; predominaron la pleural y la ganglionar, semejante a lo reportado en el país. Es de resaltar el alto porcentaje de casos sin información sobre el origen de la muestra (3.
En este análisis, el porcentaje de coinfección con HIV fue de 1,4 % entre los casos en que se registró el resultado de la prueba. No se reportó esta condición en 74,0 % de los casos, semejante a lo encontrado en el estudio de Morcillo, et al., en el cual se presentó en el 1,6 % de los casos y no se conocía el dato en más del 70 %. Otros trabajos en Colombia indican una coinfección de alrededor del 6 %; sin embargo, esto puede variar según la incidencia de estas dos infecciones. Es evidente que existe un importante subregistro debido a la falta de información. La presencia conjunta de estas enfermedades aumenta el riesgo de diseminación, y las tasas de morbilidad y mortalidad 4,10,11,20,22.
En el año 2010, Llerena, et al., reportaron que el 78,9 % de los casos nuevos eran sensibles a los fármacos antituberculosos, la resistencia global fue de 21,1 % y la MDR-TB de 6,5 %; en el presente trabajo, se evidenciaron menores porcentajes, de 9,5 % y 3,9 %, respectivamente. Esto se puede deber a que solo el 16,4 % de los casos notificados tenía pruebas de sensibilidad en el período estudiado, lo que indica un subregistro. Solo se estudiaron cinco casos previamente tratados, de los cuales uno (20 %) era de MDR-TB; en el presente análisis, la proporción fue de 4,8 %. Las diferencias se podrían deberse al número de casos evaluados con tratamiento previo en cada uno de los estudios.
En teoría, la presencia de resistencia en los menores de 15 años es el reflejo de la transmisión por un caso índice. Sin embargo, cuando ha habido una mala administración del tratamiento antituberculoso, aumenta la probabilidad de que se desarrolle una tuberculosis resistente 4,21.
Es de resaltar que los datos obtenidos no reflejan un aumento de la resistencia comparado con lo reportado previamente en el país 4,23.
Morcillo, et al., encontraron MDR-TB en 5,1 % de los casos nuevos y en 3,7 % de los previamente tratados, y ninguno de XDR-TB. En lo referente a la multirresistencia, los datos son similares a los aquí presentados. Sin embargo, en el presente trabajo se documenta la presencia de resistencia a los fármacos de segunda línea y el primer caso de XDR-TB en un menor de 15 años, el cual provenía del departamento del Valle del Cauca y falleció por esta causa 4,20.
Ante un caso de tuberculosis en un menor de edad, es fundamental garantizar la eficacia de los medicamentos administrados. La resistencia a la isoniacida, además de convertirse en un riesgo de falla terapéutica, hace necesario saber si el paciente recibió profilaxis contra la tuberculosis en algún momento de su vida. En estas circunstancias, es fundamental diferenciar entre la enfermedad latente y la activa. En una revisión sistemática de 2015 sobre la resistencia a la isoniacida, se estimó que el 12,1 % (IC95% 9,8-14,8) de los niños con tuberculosis presentaría resistencia a este medicamento; algo que también se evidenció en el presente estudio en los casos nuevos y los previamente tratados 24.
Como limitaciones del presente estudio están los criterios de exclusión de los casos. Además, se presentó un alto porcentaje de registros sin información de la prueba de HIV en la base de datos utilizada, y no se pudo establecer si los casos previamente tratados correspondían a fracaso terapéutico, pérdida del seguimiento o recaída, ni los riesgos ni las características clínicas, bacteriológicas o epidemiológicas antes del diagnóstico, durante el tratamiento y en su condición final. Todo esto impidió hacer un estudio retrospectivo de cohorte.
Dada la relevancia de la información proporcionada por este estudio, que refleja la gran transmisibilidad de la enfermedad y las fallas de los programas de tuberculosis en todos los niveles de atención, es necesario practicar en estos casos pruebas más sensibles, como las moleculares, que permiten hacer un diagnóstico rápido y oportuno para prevenir formas graves de la enfermedad. Además, se debe mejorar la calidad del estudio de los contactos para detectar las fuentes de contagio y los casos nuevos, y fortalecer la vigilancia de la resistencia en los niños.
El Ministerio de Salud y Protección Social debe normar el uso de estas metodologías, para que a través de las empresas aseguradoras de planes de beneficios se garantice su uso, e incluirlas dentro de las rutas integrales de atención en salud 4,15,16.














