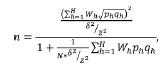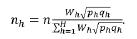La leptospirosis es una enfermedad zoonótica de distribución global e importancia en salud pública 1. La seroprevalencia de la enfermedad en muchas partes del mundo se asocia con la infección renal crónica de una variedad de especies de animales domésticos, peridomésticos y de reservorios silvestres 2. El conocimiento de los serogrupos y los serovares prevalentes en un área es esencial para entender la epidemiología de la leptospirosis y adoptar medidas efectivas de control y erradicación de la enfermedad 3.
Los caballos tienen gran importancia económica y social en algunas partes del mundo por su papel en actividades como el transporte de carga y de pasajeros, el apoyo en las actividades agrícolas, la recreación, la ayuda en tratamientos médicos y el trabajo policial, entre otras actividades 4.
En algunos estudios recientes, se sugiere que la infección por Leptospira spp. en caballos se presenta en todo el mundo e involucra un amplio rango de serovares 2. La mayoría de las infecciones son de carácter subclínico y los animales pueden tener infección crónica de por vida 5. Cuando la enfermedad se manifiesta, los caballos presentan uveítis, abortos, nacimientos prematuros, mortinatos, problemas respiratorios, y disfunción hepática o renal 6. A diferencia de los animales, los seres humanos son huéspedes accidentales y adquieren la bacteria por contacto con fuentes ambientales infectadas (agua o suelo), o con animales silvestres y domésticos y sus secreciones, principalmente orina, o por la exposición ocupacional 7.
Los estudios serológicos en caballos son numerosos y han permitido establecer la exposición a las leptospiras y sus diferentes serovares 8. Además, es posible relacionar la serorreacción con signos clínicos como la uveítis y la inflamación no granulomatosa del iris, así como evaluar el riesgo de desarrollar ceguera 9.
Por su parte el urocultivo, una técnica de poca sensibilidad, pero de gran especificidad, tiene limitaciones por la dificultad de Leptospira spp. para crecer en medios artificiales y la probabilidad de contaminación del cultivo 10, cuyo crecimiento requiere que la bacteria esté presente con suficiente densidad en la muestra biológica, lo cual depende del grado de colonización renal y de la excreción permanente, condiciones que no se cumplen en todos los casos de infección renal 10.
La PCR se considera una prueba de gran sensibilidad y especificidad 11. La amplificación de los genes 16S o 23S rARN se han empleado en estudios de leptospiras patógenas y saprofitas y en la detección rápida de la bacteria en un estadio temprano de la infección por la fácil obtención de los resultados y la posibilidad de usar diversos tipos de muestras (sangre, orina, humor acuoso o tejidos) 12,13. Sin embargo, esta técnica no identifica el serovar causante de la infección, aspecto que tiene un gran valor epidemiológico 14.
En Colombia, la leptospirosis humana es una enfermedad de notificación obligatoria en el Sistema de Vigilancia en Salud Pública (Sivigila) 15. La seroprevalencia de la leptospirosis humana en el país oscila entre el 6 y el 75,8 % en la población general y en la ocupacionalmente expuesta 15,16. En tres estudios de caballos, uno en la Sabana de Bogotá, uno en Santander y otro en la región del Meta y el Guaviare, se registraron seroprevalencias entre el 40,4 y el 76,6 % 17.
Los caballos usados para el trabajo policial viven en estrecho contacto con sus manejadores y con la población general, durante las actividades recreativas, de patrullaje y de control del orden público. Asimismo, son trasladados a diferentes unidades como apoyo en actividades con otros caballos, lo que aumenta el riesgo de exposición a Leptospira spp. y los convierte en una fuente de infección para humanos y otros animales propensos a la infección 18.
En este contexto, el objetivo del presente estudio fue caracterizar la epidemiología de la leptospirosis mediante serología, urocultivo y PCR convencional en caballos de trabajo y en la población con riesgo ocupacional en seis unidades de policía de Colombia, y evidenciar el papel potencial de los caballos en la transmisión de este microorganismo.
Materiales y métodos
Se llevó a cabo un estudio de prevalencia, el cual fue aprobado por el Comité de Ética de la Universidad de Caldas (Acta N° 011 de junio de 2016 del Comité de Bioética y Acta N° 02 de junio de 2016 del Comité de Ética para la Experimentación con Animales). Asimismo, el estudio se ajustó a lo establecido en las normas éticas para el manejo de animales de laboratorio de la Ley 84 de 1989 y el Decreto 2257 de 1986.
Se obtuvo la autorización de la Policía Nacional para la toma de las muestras biológicas de los caballos y el consentimiento informado de los participantes en este mismo sentido.
Localización geográfica
La Policía cuenta con 25 unidades policiales en el territorio nacional, en las cuales se mantienen 2.700 caballos. De estas, se seleccionaron 6 (24 %) cuyas características climáticas (clima cálido y condiciones húmedas) favorecen la supervivencia de las leptospiras y que presentaban antecedentes previos de serorreacción 14.
Se evaluaron las unidades de los municipios de Manizales (altura de 2.170 m.s.n.m., temperatura media anual de 17 oC y precipitación anual de 2.358 mm), Pereira (altura de 1.411 m.s.n.m., temperatura media anual de 28 oC y precipitación anual de 2.750 mm), Armenia (altura de 1.229 m.s.n.m., temperatura media anual de 22 oC y precipitación anual de 2.164 mm), Ibagué (altura de 928 m.s.n.m., temperatura media anual de 24 oC y precipitación anual de 1.691 mm), Tuluá (altura de 960 m.s.n.m., temperatura media anual de 24 oC y precipitación anual de 1.300 mm) y Cali (altura de 985 m.s.n.m., temperatura media anual de 24 oC y precipitación anual de 1.483 mm) (figura 1).
Población de estudio y tamaño de la muestra
La población de estudio incluyó 267 personas (carabineros, preparadores, enfermeros y cuidadores de los caballos) y 263 caballos (machos castrados; en las unidades seleccionadas no había hembras) destinados a las labores de patrullaje rural y urbano y de diferentes razas (silla argentino, percherón, belga, pura sangre inglés, silla francés, criollo colombiano y cruces de estas razas), con edades entre los 4 y los 23 años.
Las muestras se seleccionaron de forma aleatoria, estratificada y proporcional, tomando como referencia seroprevalencias nacionales de infección del 18 % en humanos (n=123) (16,17) y de 40 % en caballos (n=153) 18. En ambos casos, se consideró un error y una significación del 5 %.
Las fórmulas utilizadas para los cálculos se presentan a continuación 19.
Para el tamaño de muestra:
donde z corresponde al valor de Z que deja un área a la derecha, al tamaño del error: al peso del estrato = Nh/N, N el tamaño de la población, n al tamaño de la muestra, ph a la proporción del estrato, y qh a (1 - ph), y para la distribución por estratos:
Los criterios de inclusión de los humanos fueron tener contacto directo con los caballos durante sus labores y llevar laborando en las remontas no menos de tres meses. Se excluyeron aquellos caballos que habían permanecido en la remonta por menos de tres meses, período necesario para que los resultados de las pruebas diagnósticas usadas en el estudio evidenciaran el contacto entre las personas y los caballos de cada unidad policial, ya que los títulos de anticuerpos aparecen en los animales siete días después de los primeros síntomas 14.
Examen clínico
Un médico veterinario especialista en medicina equina examinó detenidamente a los caballos al inicio del estudio y revisó de forma exhaustiva las historias clínicas con los reportes de los últimos dos años para establecer si se habían hecho exámenes de laboratorio y si se habían presentado síntomas relacionados con la leptospirosis 6,9. Esta información se consignó en un formato que fue validado mediante una prueba piloto en la unidad policial de Cali y por expertos en leptospirosis.
Factores de riesgo
Se utilizaron dos formatos estructurados y validados. En el primero, se evaluaron las variables demográficas y sanitarias, el manejo de los caballos y la presencia de especies silvestres, mediante visitas a las instalaciones, observación directa y entrevistas al personal responsable. El segundo fue un cuestionario dirigido a los participantes en el estudio para conocer su edad, el cargo, el contacto con fluidos de los caballos, las normas de bioseguridad y las conductas de manejo de los animales según los parámetros establecidos a partir de consultas con profesores expertos de la Universidad de Caldas, así como de la prueba piloto desarrollada en la unidad policial de Cali.
Muestras sanguíneas y prueba de microaglutinación
Se obtuvieron 5 ml de sangre por punción de la vena yugular de los caballos y de la cefálica de los humanos, que luego se centrifugaron durante cinco minutos a 3.500 rpm. Los sueros se almacenaron a 2 °C para el transporte al laboratorio y se congelaron a -5 °C hasta el momento del análisis, efectuado 15 días después del muestreo.
Las muestras se procesaron en el Laboratorio de Diagnóstico de Leptospirosis de la Universidad del Valle en Cali. En el mantenimiento de las cepas y el manejo de la técnica de microaglutinación (MAT). se siguieron los parámetros convencionales (17), utilizando un cepario de referencia suministrado por el laboratorio internacional de referencia para el diagnóstico de la leptospirosis del Royal Tropical Institute (Ámsterdam, Holanda).
Se consideraron como positivos los sueros de los humanos con títulos iguales o mayores de 1:160 y, para los caballos, aquellos sueros con títulos iguales o mayores de 1:100 20. El grado de reacción se estableció estimando los porcentajes de leptospiras que aglutinaron.
Urocultivo
Las muestras de orina de los caballos se obtuvieron en las remontas siguiendo estrictas normas de bioseguridad. Se indujo la micción, se recolectaron 15 ml y se obtuvo una alícuota de 1 ml que se cultivó de inmediato en el medio Ellinghausen-McCullough-Johnson-Harris (EMJH) 17 (Becton Dickinson and Company, Difco) 21.
Las muestras se mantuvieron a temperatura ambiente en neveras de icopor, para protegerlas de la luz solar. En el laboratorio, se incubaron a 30 °C, durante un período máximo de cuatro meses hasta el momento en que las espiroquetas se observaron al microscopio. Las muestras cultivadas se sembraron de nuevo en el medio de cultivo de EMJH, y se agregaron 500 μl del cultivo primario y 1 % de 5-fluorouracilo.
Sin tener en cuenta el resultado de la lectura, se hicieron siembras para controlar la contaminación bacteriana y favorecer el crecimiento de las espiroquetas. Se hicieron observaciones semanales bajo el microscopio de campo oscuro (Nikon BH2) tomando 10 μl del cultivo y visualizando toda la placa para verificar la presencia de espiroquetas. La prueba se consideró positiva pasadas 16 semanas si se observaban, como mínimo, cuatro espiroquetas por placa en alguno de los urocultivos 2.
Reacción en cadena de la polimerasa
Se obtuvo 1 ml del urocultivo y se siguieron las instrucciones del QIAamp DNA Mini Kit™ (Qiagen). Se hizo una PCR convencional simple utilizando los iniciadores descritos por Levett (11): LipL32/270f (5´-CGCTGAAATGGGAGTTCGTATGATT-3´) y LipL32/692R (5´ -CCAACAGATGCAACGAAAGATCCTTT-3´), dirigidos a una región ubicada entre las posiciones 270 y 692 del gen lipL32, el cual codifica para la lipoproteína de membrana LipL32, siguiendo los lineamientos descritos por Moreno, et al.22.
Se usó como control positivo Leptospira interrogans, serovar Canicola, cepa Hond Utrecht IV (77.8 ng/μl), y como controles negativos, Bacillus cereus, Enterococcus faecalis, Salmonella Typhimurium y Listeria monocytogenes, suministrados por el área de bacteriología del Laboratorio de Microbiología de la Universidad del Valle.
Análisis estadístico
Se hizo un estudio descriptivo para analizar las variables consideradas como factores de riesgo. Se estableció la seroprevalencia de la infección en las dos poblaciones estudiadas y se hizo un análisis de regresión logística bivariada que asumió, como variable de respuesta binomial, los resultados de la prueba MAT, donde 0 correspondió a los sueros con resultados negativos y 1 a los sueros positivos. Además, se hizo la prueba de bondad de ajuste del modelo obtenido mediante la prueba de Hosmer y Lemeshow.
Los efectos de las variables de predicción del resultado positivo o negativo de la prueba, se expresaron mediante razones de disparidad (OR) y sus respectivos intervalos de confianza del 95 %. Los valores de p menores de 0,05 se consideraron como significativos. El modelo para humanos consideró todos los serogrupos positivos en la prueba MAT; en los caballos, se hicieron dos análisis para los serogrupos más prevalentes en las remontas (Shermani y Djasiman). El análisis se efectúo utilizando el programa Stata™, versión 13.0 (College Station, Texas, USA).
Resultados
Examen clínico
El 83,7 % (128/153) de los caballos tenía una condición corporal normal, el 10,5 % (16/153) estaba delgado, el 4,5 % (7/153) tenía sobrepeso y el 1,3 % (2/153) estaba caquéctico.
En el examen clínico, el 10,5 % (16/153) de los caballos presentó alteraciones en el sistema tegumentario, pues se encontraron laceraciones (63 %), costras y alopecia (37 %), además de afecciones oculares (6,5 %, 10/153), como atrofia (10 %), queratitis (10 %), opacidad corneal (50 %), epífora y uveítis (30 %). Por último, se presentaron trastornos en el sistema locomotor en el 5,9 % (9/153) de los ejemplares, y se observaron claudicaciones (44 %), hormiguillos (22 %), linfangitis (11 %) e inflamaciones osteoarticulares (22 %).
Antecedentes clínicos de los caballos
En la evaluación de los antecedentes en las historias clínicas, en el 84,3 % (129/153) de los caballos no se habían reportado signos relacionados con un cuadro clínico de leptospirosis (fiebre, anorexia, anemia petequial, ictericia o intolerancia al ejercicio) 2. El 8,5 % (13/153) había presentado fiebre, el 4,6 % (7/153), decaimiento, el 0,7 % (1/153), pérdida de peso crónica o disuria y el 5,9 % (9/153) había tenido trastornos oculares.
Seroprevalencia en humanos
La seroprevalencia de leptospirosis humana fue de 3,25 % (4/123) (IC95% 2-4,5): dos casos de la remonta de Cali, con títulos de 1:160 (serotipos Canicola, Panamá y Shermani) y los dos restantes de Pereira (serotipos Grippotyphosa, Bataviae, Autumnalis y Sejroe), con títulos entre 1:160 y 1:2.560. Las coaglutinaciones entre los serovares fue de 1,6 % (2/123).
Seroprevalencia en caballos
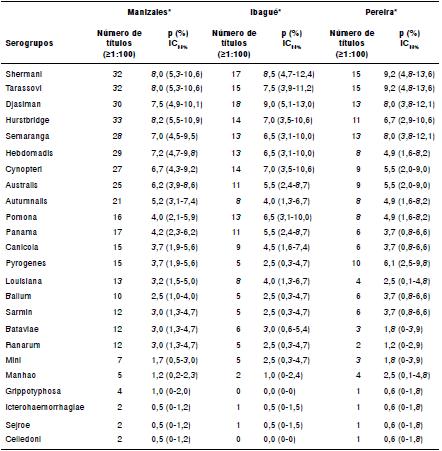
La seroprevalencia general establecida mediante la prueba MAT en los caballos fue del 85 % (130/153) (IC95% 79-91). En la figura 2 se presenta la distribución de la serorreacción de los anticuerpos contra Leptospira spp. de los caballos en las seis unidades policiales estudiadas. El 7,8 % (n=12) de los sueros fue reactivo a un solo serogrupo y el resto presentó títulos frente a dos o más serogrupos. El 62 % de los sueros presentó títulos de 800 o mayores. No se encontraron diferencias significativas entre las seroprevalencias (p=0,979). Los serogrupos encontrados en los caballos se muestran en los cuadro 1 y cuadro 2.
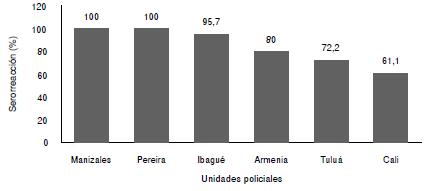
Figura 2 Serorreacción de los anticuerpos de los caballos contra Leptospira spp. en seis unidades de la Policía Nacional de Colombia
Cuadro 1 Seroprevalencia (P) de serogrupos de Leptospira spp. en caballos de las remontas de Cali (n=122), Tuluá (n=88) y Armenia (n=73), Colombia
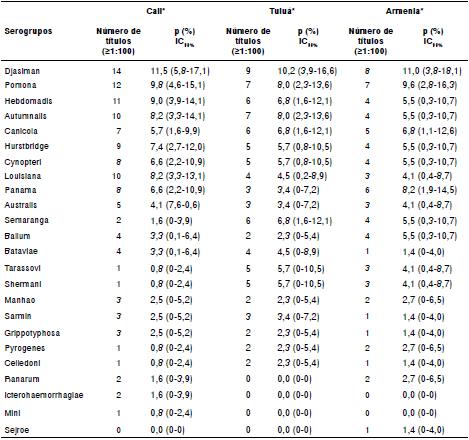
* Número de títulos positivos para todos los serogrupos evaluados (desde 100 hasta 3.200)
IC: intervalo de confianza del 95 %
Reacción en cadena de la polimerasa
Se obtuvo una amplificación de 423 pb para un fragmento de LipL32 en el control positivo de L. interrogans serovar Canicola cepa Hond Utrecht IV, en tanto que las muestras de los controles negativos no tuvieron reacciones. Sin embargo, no se obtuvieron reacciones específicas para el gen LipL32 en ninguno de los urocultivos.
Factores de riesgo en humanos
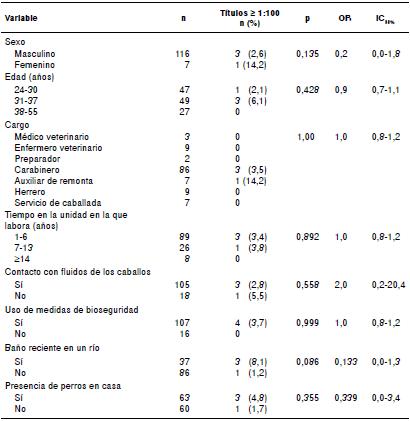
El personal evaluado tenía contacto permanente con los caballos y el 87,6 % (n=108) usaba barreras de protección personal, como guantes, tapabocas y estrictas normas de bioseguridad. Tres de las cuatro personas que presentaron títulos contra Leptospira spp. tenían contacto con fluidos de los caballos, pero no se encontró ninguna asociación entre la infección y las variables incluidas en el análisis (cuadro 3).
Urocultivo
La frecuencia hallada en el urocultivo fue de 64,7 % (99/153) (IC95%: 57- 72). Se observaron espiroquetas en todas las remontas: en Tuluá, 83,3 % (15/18); en Pereira, 80 % (16/20); en Ibagué, 69,5 % (16/23); en Manizales, 63,4 % (26/41); en Armenia, 53,3 % (8/15), y en Cali, 50 % (18/36), sin que se registraran diferencias significativas (p=0,921).
Factores de riesgo en caballos
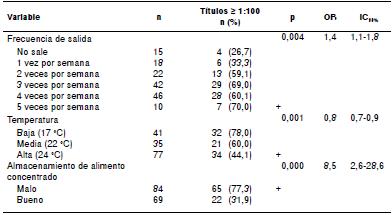
Leptospira Shermani fue el serogrupo más prevalente en las remontas de Manizales, Ibagué y Pereira. Los animales de fauna silvestre reportados por el personal en las remontas fueron zarigüeyas (Didelphimorphia), zorrillos (Mephitidae), armadillos (Dasypodidae), conejos (Oryctolagus cuniculus), ardillas (Sciurus vulgaris), iguanas (Iguana iguana) y serpientes, cuyos ejemplares no se capturaron y no se sometieron a ningún procedimiento. La evaluación de los factores de riesgo asociados al serogrupo Shermani se presenta en el cuadro 4.
Cuadro 4 Análisis de regresión logística binaria de las variables evaluadas en la población humana positiva para Leptospira spp. en remontas de seis municipios colombianos
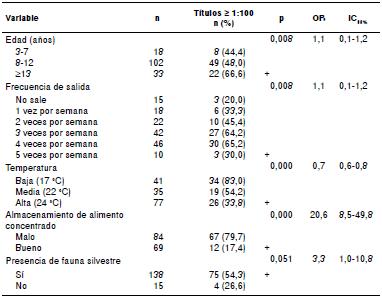
IC: intervalos de confianza, OR: razón de disparidad
+: Variables de las respuestas con un nivel de significación de 0,05 %
El serogrupo de mayor seroprevalencia para las remontas de Cali, Tuluá y Armenia, fue el Djasiman y los resultados del análisis logístico binario de la infección por dicho serogrupo se presentan en el cuadro 5.
Discusión
A pesar de que los reportes de la transmisión de leptospiras patógenas de los caballos a otros animales y al ser humano son escasos, la seropositividad sí es frecuente, con valores altos y títulos variables según los diferentes serotipos (13), lo cual se confirmó en el presente trabajo.
Algunos autores han sugerido que los caballos son huéspedes de mantenimiento y tienen la capacidad de eliminar las leptospiras en la orina durante largos periodos 2,6. Sin embargo, se encontró que el 3,25 % del personal ocupacionalmente expuesto en las remontas, tenía anticuerpos contra Leptospira spp. Esta baja frecuencia podría deberse a la prevención mediante barreras de protección personal al tener contacto con los fluidos de los caballos y a las medidas de bioseguridad, cuya inobservancia representa un riesgo de contraer la enfermedad 7.
En cuanto a la transmisibilidad, no se sabe si las condiciones de supervivencia de las leptospiras en el riñón de los caballos alteran la fisiología de la bacteria reduciendo su patogenia, o si hay diferencias de transmisibilidad entre machos y hembras, lo que no se comprobó dado que no se incluyeron yeguas en el estudio 13.
La seroprevalencia contra Leptospira spp. en los caballos estudiados (85 %) es una de las más altas reportadas en el mundo. En Brasil, se han registrado las siguientes seroprevalencias: en São Paulo, 54 % 23, en Paraibano, 16,2 % 24, en Curitiba, 75,8 % 25, en Río de Janeiro, 47,8 % 8, y en Paraná, 66,8 % 26. En Suecia, se ha registrado 27 % 27, en Corea, 25 % 9, en Irán, 7,77 % 28, en Mongolia, 17,1 % 29, en Alemania, 17,2 % 30, en Portugal, 37 % 31, en Sudáfrica, 39,3 % 32, en Australia, 35 % 33, y en Etiopía, 44 % 4. En la Sabana de Bogotá, se ha registrado una seroprevalencia de 40,4 % 34, en Santander, 66,7 % 35, y en la región del Meta y Guaviare, 76,6 % 17.
En este caso, la alta serorreacción frente a varios serovares podría representar infecciones concomitantes y estar asociada con la frecuencia en que los caballos estudiados salían de las instalaciones, ya que ello favorece el contacto directo con otros caballos, y animales domésticos y silvestres 5. Asimismo, las variadas condiciones de pastoreo y confinamiento de los caballos podrían haber incrementado su exposición a leptospiras diseminadas por roedores, animales silvestres y otros huéspedes de mantenimiento presentes en el suelo, los pastos y las fuentes de agua 3,7.
En este estudio, predominó la presentación subclínica de la leptospirosis: a pesar de que se registró una alta seroprevalencia, los caballos tenían una buena condición corporal y no presentaban los signos clínicos y los antecedentes característicos de la leptospirosis en los caballos adultos 2,6 manejados bajo condiciones de confinamiento 5,15. Asimismo, se encontraron títulos individuales de 1:800 o más en la MAT, hallazgo que, además de la presencia de animales asintomáticos, puede considerarse un indicativo de la presentación endémica de la leptospirosis en la población caballar evaluada 1. Teniendo en cuenta que los caballos del estudio pertenecen a la Policía Nacional, se recomienda el tratamiento antibiótico de los caballos positivos como medida de control de la infección, estrategia que se ha empleado en Croacia en todos los caballos utilizados para deporte y recreación 3.
Algunos mamíferos silvestres pueden actuar como huéspedes de mantenimiento de los serovares Djasiman y Shermani 22,36, aspecto que recientemente fue reportado en chigüiros (Hydrochoerus hydrochaeris) de la región amazónica 37. El serovar Djasiman fue descrito por primera vez en Indonesia y en el sudeste asiático, donde se vinculó con leptospirosis en turistas 31, y también, se aisló de un feto canino abortado en Argentina 38. En este estudio, el serogrupo Djasiman fue el más frecuente en las remontas de Cali, Tuluá y Armenia, lo que coincide con reportes de Sudáfrica y Etiopía 4,32.
En cuanto al serogrupo Shermani, varios autores sugieren que tiene poca importancia en la epidemiología de la leptospirosis 25,28,30. No obstante, los caballos de las remontas en las cuales se reportó la presencia de especies silvestres, presentaron 3,3 veces más probabilidad de ser reactivos a este serogrupo en la prueba MAT. Este serogrupo también se asoció con un caso de leptospirosis humana que cursó con hemorragia intraalveolar, lo cual es indicativo de un cuadro clínico grave 31.
La alta seroprevalencia del serogrupo Shermani en los caballos de mayor edad de este estudio, sugiere su adaptación a estos animales y, tal vez, la persistencia de los títulos durante muchos años, por lo que existe la posibilidad de que los caballos sean huéspedes de mantenimiento de este serogrupo 26.
Algunos investigadores han reportado la presencia de leptospiruria crónica, inclusive, a lo largo de toda la vida en los caballos 8,14. Asimismo, con la inoculación experimental de caballos con L. interrogans serovar Kinnenwicki, se registró la presencia de leptospiremia (entre dos y seis días) y de leptospiruria (durante cuatro semanas) después de la infección, lo cual indica que dichos animales podían diseminar la bacteria 39. En el estudio se obtuvo el crecimiento de espiroquetas en el 65 % de los urocultivos, pero no se puede descartar su ausencia en las muestras negativas, porque la excreción de la bacteria por la orina en los huéspedes de mantenimiento es, en ocasiones, intermitente 20. La gran proporción de urocultivos positivos (64,7 %) sugiere la persistencia de las bacterias en los túbulos renales y la potencial importancia en su diseminación 14. Sin embargo, es conveniente hacer estudios complementarios en la población general de caballos, sobre todo teniendo en cuenta que en el presente estudio la prueba de PCR fue negativa en todos los casos.
Los resultados divergen en cuanto al aislamiento de leptospiras de las muestras de caballos mediante la técnica de PCR. Algunos investigadores de Brasil obtuvieron resultados positivos en una PCR cuantitativa con el gen SecY40,41 y, en una convencional, con el gen LipL328. Sin embargo, otros autores, también en Brasil, no lo lograron utilizando una PCR cuantitativa en caballos carretilleros 24, resultados que concuerdan con los del presente estudio y podrían relacionarse con fallas en el procedimiento de cultivo o de lectura 8, o con el hecho de que el muestreo no se hizo en la fase aguda de la infección 39, o porque se desconocían las rutas naturales de la infección en los caballos evaluados en este estudio (ya que, en una investigación previa, los animales infectados experimentalmente por vía subcutánea y ocular, no presentaron leptospiruria ni leptospiremia) 24, así como con la presencia de inhibidores de la PCR no detectados en la muestra 10.
En un estudio en Colombia, se amplificó el gen LipL32 a partir de muestras de orina humana y de animales domésticos (cerdos y perros), así como de agua y macerado de riñón de roedores sinantrópicos, y los resultados sugirieron que se daba una transmisión de leptospiras entre los animales, el ambiente y los humanos en la región evaluada 42.
Todavía no se ha verificado la idoneidad de los mecanismos celulares y moleculares para establecer la patogenia de las leptospiras 8. La proteína LipL32 representa hasta el 75 % de la membrana externa de las leptospiras patógenas y su estudio ha sido relevante, dada su localización, su conservación y su importancia en la reacción inmunitaria de la bacteria, y porque está ausente en las leptospiras saprofitas 43.
El hecho de que no se detectara el ADN de los cultivos de espiroquetas en el presente trabajo, podría relacionarse con la presencia de leptospiras saprofitas. No obstante, la PCR de control de la extracción reveló que las muestras tenían ADN bacteriano, por lo que también es posible que la cantidad de leptospiras patógenas presentes en la orina fuera inferior a 100.000 bacterias/ml, cantidad necesaria para su detección con la prueba de PCR convencional 10. Además, según la Organización Mundial de Sanidad Animal (OIE), el que no se detecte la presencia de leptospiras en la orina de un animal no es suficiente para descartar la posibilidad de que sea portador renal crónico y solo indica que el caballo no excretaba cantidades detectables de leptospiras en el momento del examen 21.
En futuros estudios, lo ideal sería usar una PCR cuantitativa o técnicas diagnósticas que permitan la identificación completa de cepas de leptospira para establecer si son patógenas o saprofitas, así como la especie de Leptospira a la que pertenece la cepa y su serogrupo o serotipo. Entre dichas pruebas, se cuentan las de virulencia, de resistencia relativa a la 8-azaguanina, de actividad de la lipasa, de tolerancia a la sal, así como las de temperatura y contenido de G+C en el ADN 21, aspecto que no fue objeto de esta investigación.
Se puede concluir que la baja seroprevalencia de leptospirosis en el personal ocupacionalmente expuesto aquí analizado, podría asociarse con la implementación de medidas de prevención y el uso de elementos de protección personal.
Por otra parte, la alta seroprevalencia contra leptospiras en los caballos pone en evidencia la exposición natural a las bacterias, puesto que ningún animal había sido vacunado. Asimismo, los altos títulos hallados, el crecimiento de espiroquetas en el urocultivo y la presentación subclínica de la infección, indican un comportamiento endémico de la leptospirosis en la población evaluada. Los hallazgos sugieren que los caballos pueden comportarse como reservorios de las leptospiras, pero la dinámica de su mantenimiento, de su colonización persistente de los túbulos renales y de la subsiguiente eliminación de la bacteria por la orina, aún se desconoce, por lo que es necesario hacer estudios sistemáticos de detección de anticuerpos contra Leptospira spp. para establecer la exposición, la permanencia de títulos, la dinámica de los niveles de anticuerpos y los serogrupos infecciosos, entre otros aspectos.