Salmonella enterica serovar Typhi es una bacteria Gram negativa intracelular que afecta exclusivamente al ser humano con una enfermedad sistémica denominada fiebre tifoidea 1.
En ratones de la cepa C57BL/6, la infección con S. Typhimurium ocasiona un cuadro clínico muy similar al de la fiebre tifoidea del ser humano, por lo que se utilizan como el modelo estándar para el estudio de diferentes aspectos inmunitarios de esta enfermedad 2-5.
En estos ratones se identificó un epítopo restringido para el complejo mayor de histocompatibilidad (CMH) múrido Kb, derivado de la proteína de la membrana externa OmpC (Outer membrane porin C) y denominado OmpC73 (correspondiente al péptido 73-TRVAFAGL), el cual es capaz de evocar la respuesta efectora de los linfocitos T citotóxicos cuando es presentado por macrófagos 6.
La participación crítica de los linfocitos T citotóxicos en la infección por Salmonella spp. quedó demostrada al emplear ratones knock-out de la β-2 microglobulina, los cuales desarrollaron una sensibilidad exacerbada a las cepas atenuadas de Salmonella spp. comparados con los controles. Además, los ratones knock-out sobrevivientes de una infección primaria con una cepa virulenta de Salmonella spp. presentaron una disminución de la respuesta inmunológica 4.
En varios estudios ya se ha reportado la participación de los macrófagos, los linfocitos B y las células dendríticas convencionales en la relación entre el huésped y Salmonella spp. 7-9. Sin embargo, aún no se ha reportado la participación de las células dendríticas plasmacitoides en la respuesta inmunológica evocada contra Salmonella spp., incluido el modelo de la fiebre tifoidea.
Las células dendríticas plasmacitoides tienen la capacidad de secretar grandes cantidades de interferón de tipo I después de su activación como respuesta a los virus 10-12. Además, cambian su morfología y sobreexpresan el (CMH), así como moléculas estimuladoras de CD80 y CD86, permitiéndoles desarrollar la función efectora de la célula presentadora de antígeno tanto para los linfocitos T CD4+ como los T CD8+ 12,13.
En este contexto, se inició el estudio in vitro de la respuesta de los linfocitos T citotóxicos específicos para Salmonella evocada por las células dendríticas plasmacitoides, para ser analizada posteriormente in vivo y contribuir a dilucidar los mecanismos inmunitarios protectores contra la fiebre tifoidea, enfermedad que sigue afectando a millones de personas en el mundo 1.
Materiales y métodos
Ratones
Se emplearon ratones hembra de 6 a 8 semanas de edad de la cepa C57BL/6, cuyo CMH es el haplotipo H-2b. Los ratones se mantuvieron en cajas especiales con agua ad libitum y alimento estéril, siguiendo todos los protocolos aplicables a estudios con animales. Los procedimientos fueron avalados por el comité de ética local de la Facultad de Ciencias Químico- Biológicas de la Universidad Autónoma de Sinaloa.
Purificación de las células dendríticas plasmacitoides
Las células dendríticas plasmacitoides se purificaron a partir de los bazos de los ratones empleando un estuche comercial de separación magnética (Miltenyi Biotec) y siguiendo las instrucciones del fabricante.
Los esplenocitos se aislaron y se marcaron con anti-mPDCA-1™ (130- 107-093, Miltenyi Biotec); se separaron mediante cromatografía de afinidad usando una columna LS (130-042-401, Miltenyi Biotec) y, por último, las células dendríticas plasmacitoides se recolectaron por selección positiva.
Para evaluar su pureza, se incubaron 5 x 105 células con anti-CD317- PE (BST, PDCA-1) durante 30 minutos antes del bloqueo del FcγR con 2.4G2 (Miltenyi Biotec). Las células dendríticas plasmacitoides se fijaron con p-formaldehído y se analizaron por citometría de flujo (FACS Canto II™, BD). Los resultados se analizaron empleando el programa Cyflogic, versión 1.2.
Salmonella
Se reactivó Salmonella Typhimurium (ATCC 14028) a partir de un vial de cultivo criopreservado, según la descripción previa (7): 100 µl de la bacteria se inocularon en 10 ml de medio Luria Bertani™ (Sigma) y se incubaron en agitación toda la noche a 37° C. Al día siguiente se transfirió una alícuota de 100 µl del cultivo en agitación toda la noche a 5 ml de medio Luria Bertani™ estéril, se incubó en agitación a 37° C y se hizo seguimiento de su crecimiento hasta alcanzar una densidad óptica de 0,6 a 600 nm para homogenizar la multiplicidad de infección.
Las células dendríticas plasmacitoides purificadas, así como los macrófagos múridos de la línea celular IC-21, se infectaron con una multiplicidad de infección de 1:50 y se cultivaron durante 0,5 horas en medio Eagle modificado de Dulbecco™ (DMEM) (Sigma) complementado con 10 % de suero fetal bovino (Biowest, DMEM-10) sin gentamicina (Sigma).
Después de la incubación, las células se centrifugaron a 250 g y se lavaron dos veces con DMEM-10 que contenía 100 µg/ml de gentamicina para inhibir el desarrollo extracelular de la bacteria; las interacciones celulares se suspendieron de nuevo en 1 ml de medio y se incubaron siguiendo una cinética de infección a las 0,5, 2, 4, 6 y 18 horas en presencia o ausencia de 5 µg/ml del oligodesoxinucleótido mCpg TCCATGACGTTCCTGACGTT (Sigma) para el caso de las células dendríticas plasmacitoides.
Al término de la cinética, las interacciones se fijaron con p-formaldehído y se tiñeron con colorante de Wright siguiendo los protocolos estándar para ser analizadas en un microscopio óptico a 100X (Leica DM750™). El rango de infección se determinó contando 10 campos de cada una de las interacciones teñidas.
Citotoxicidad
Los ratones se inmunizaron subcutáneamente en la base de la cola con 100 µg/ml de OmpC73 (TRVAFAGL) siguiendo el protocolo descrito por Díaz- Quiñonez, et al. 6.
Después de 30 días de iniciada la inmunización, se obtuvieron las células efectoras cultivando durante cinco días los esplenocitos del epítopo homólogo en 10 + 25 µg/ml de DMEM. Las células dendríticas plasmacitoides purificadas se marcaron con éster de succinimidil-carboxifluoresceína™ (CFSE) (Invitrogen) y se cultivaron con los esplenocitos en diferentes relaciones de células efectoras y blanco (E:B): 1:1, 10:1 y 100:1 (en adelante, denominadas solo como 1, 10 y 100), en presencia del epítopo OmpC73 o del octapéptido irrelevante T scramble, estos dos últimos utilizados como control negativo.
Además, las células dendríticas plasmacitoides blanco se infectaron previamente con S. Typhimurium 14028 durante 0,5 horas. Todos los cultivos se mantuvieron durante 5 horas a 37° C con 5 % de CO2. Al final, se centrifugaron a 300g y las células se suspendieron de nuevo en p-formaldehído y se analizaron por citometría de flujo como se describió antes.
Análisis estadístico
La citotoxicidad se analizó usando la prueba t de Student. Se compararon las medias entre los grupos y un valor de p de 0,05 o menor se consideró estadísticamente significativo. Todos los análisis se hicieron mediante el programa Stata™, versión 13.
Resultados
Para analizar la respuesta de los linfocitos T citotóxicos específicos para Salmonella spp. evocada por las células dendríticas plasmacitoides, primero se purificaron hasta alcanzar un porcentaje de pureza del 90 % (figura 1A). Posteriormente, se usó una cinética de infección a las 0,5, 2, 4, 6 y 18 horas (figura 1B), obteniéndose un porcentaje de infección que osciló entre el 86,7 y el 91,8 %, definido mediante conteo por microscopía óptica.
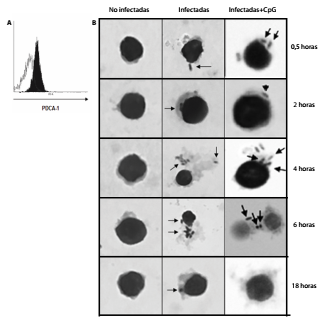
Figura 1 Células dendríticas plasmacitoides infectadas con Salmonella Typhimurium. A. Las células dendríticas plasmacitoides se purificaron mediante cromatografía de afinidad con anti-mPDCA-1 acoplados a esferas magnéticas y su pureza se evaluó por citometría de flujo. El histograma en blanco muestra la población sin marcar, y en negro, las células dendríticas plasmacitoides marcadas con el anticuerpo comercial anti-PDCA-1-PE, evidenciando una pureza del 90 %. B. Cinética de infección de células dendríticas plasmacitoides con S. Typhimurium con una multiplicidad de infección de 1:50; después de su infección estas fueron incubadas a las 0,5, 2, 4, 6 y 18 horas y teñidas con tinción de Wright para su observación bajo el microscopio óptico con un objetivo de 100X. La columna de la izquierda muestra las células dendríticas plasmacitoides no infectadas y monitorizadas en los diferentes tiempos de incubación; las siguientes columnas muestran las células dendríticas plasmacitoides infectadas, o infectadas y estimuladas con CpG (5 μg/ml), con un rango de infección que osciló entre 86,7 y 91,8 %, definido mediante conteo celular por microscopía óptica. A partir de las 2 horas fue posible evidenciar los bacilos intracelulares con mayores cargas bacilares a las 4 y 6 horas de la infección (señalados con flechas). Los resultados son representativos de tres experimentos independientes.
La bacteria se visualizó intracelularmente a las 2 horas de la infección y las mayores cargas de bacilos se apreciaron a las 4 y las 6 horas (figura 1B). A las 18 horas se observó una menor cantidad de bacilos, probablemente debido a su procesamiento.
Esta cinética también se utilizó con macrófagos de la línea IC-21 y se obtuvieron resultados similares en las primeras horas de infección de las células dendríticas plasmacitoides; no obstante, a las 18 horas ya no fue posible observar ningún bacilo intracelular, lo que evidencia una mayor eficiencia en el procesamiento de Salmonella spp. por parte de los macrófagos (figura suplementaria 1).
Al estimular las células dendríticas plasmacitoides con 5 μg/ml de CpG de múridos (TCCATGACGTTCCTGACGTT) fue posible emular el comportamiento de los IC-21 (figura 1B).
En reportes previos se ha puesto de manifiesto la relevancia de los linfocitos T citotóxicos en la infección por Salmonella spp. 2-6. Sin embargo, la participación de las células dendríticas plasmacitoides como una estirpe celular implicada en la evocación de dicha respuesta no se había abordado.
En este contexto, se evaluó la capacidad de las células dendríticas plasmacitoides para evocar la respuesta citotóxica específica para Salmonella spp., para lo cual se generaron células efectoras obtenidas de la inmunización de ratones con el epítopo OmpC73 derivado de la porina de Salmonella y restringido para el CMH múrido de clase I Kb, que luego se estimularon de nuevo in vitro con el péptido homólogo 6.
Una vez obtenidas las células efectoras, se hicieron los ensayos de citotoxicidad empleando una adaptación no radiactiva del ensayo estándar de liberación de cromo mediante la marcación de las células dendríticas plasmacitoides con CFSE para determinar los porcentajes de lisis específica con base en la eliminación de las células dendríticas plasmacitoides así marcadas; luego se sometieron a pulsación con el epítopo OmpC73 o empleando los péptidos irrelevantes TA u OVA (controles negativos).
Las interacciones se hicieron en diferentes relaciones de células efectoras y blanco (figura 2). Los resultados se normalizaron con base en la lisis obtenida del control negativo y se representaron como lisis específica en porcentajes. Sorprendentemente, el mayor porcentaje de degradación, de 86,48 %, se observó en la relación 10 con el epítopo OmpC73 (p=0,0429), en tanto que para las relaciones 1 y 100, los porcentajes fueron de 74,12 % (p=0,0426) y 59,17 % (p=0,0247), respectivamente (figura 2A).
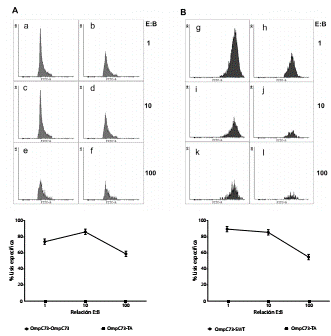
Figura 2 Las células dendríticas plasmacitoides evocan la respuesta inmunológica citotóxica contra epítopos de Salmonella spp. A. En el panel superior se muestran los histogramas representativos de la citotoxicidad en diferentes relaciones de células efectoras y blanco: 1, 10 y 100. Las células dendríticas plasmacitoides marcadas con CFSE fueron pulsadas con el péptido irrelevante TA (scramble) (en a, c y e), o con el epítopo OmpC73, (en b, d y f) y empleadas como blanco. En todos los casos las células citotóxicas efectoras provenían de ratones inmunizados con OmpC73 y estimulados nuevamente in vitro con ese epítopo. En el panel A inferior se muestran los porcentajes de lisis específica obtenidos en las diferentes relaciones de células efectoras y blanco (1, 10 y 100). Los resultados fueron normalizados empleado los valores de lisis obtenidos con los controles negativos. En B, los experimentos son similares a lo mostrado en A, empleando células efectoras provenientes de ratones inmunizados con OmpC73, con la particularidad de que las células dendríticas plasmacitoides blanco fueron marcadas con CFSE e infectadas con S. Typhimurium. En g, i y k, las células dendríticas plasmacitoides blanco no fueron infectadas y, en h, j y l, fueron infectadas con Salmonella spp. En el panel B inferior, se muestran los porcentajes de lisis específica obtenidos en las diferentes relaciones células efectoras y blanco (1, 10 y 100). Los resultados se normalizaron empleado los valores de lisis obtenidos con los controles negativos.
Además, se realizaron ensayos de citotoxicidad similares a los descritos arriba, pero infectando las células dendríticas plasmacitoides con S. Typhimurium 14028 y empleándolas como blanco. En esta ocasión, el mayor porcentaje de lisis, de 89,85 % (p=0,036), se obtuvo empleando la relación 1 de células efectoras y blanco, mientras que en las relaciones 10 y 100 los porcentajes fueron de 85,13 % (p=0,0428) y 54,61 % (p=0,0273), respectivamente, comparados con el control negativo.
Asimismo, los resultados obtenidos en las micrografías a las 18 horas de la infección (figura 1B) sugieren que las células dendríticas plasmacitoides fueron capaces de degradar la bacteria, potenciando su actividad como células presentadoras de antígeno y contribuyendo a evocar la activación de los linfocitos T CD4+ durante la infección con Salmonella en la fiebre tifoidea experimental.
Discusión
Las células dendríticas se dividen en dos linajes principales: las convencionales y las plasmacitoides. En la infección por Salmonella se ha reportado la participación de las convencionales, los macrófagos y los linfocitos B 7-9,14,15, pero no así la de las plasmacitoides. Durante la cinética de infección, la bacteria se visualizó intracelularmente en las células dendríticas plasmacitoides purificadas desde las primeras horas. Por el contrario, a las 18 horas de la infección, la cantidad de bacilos observados fue menor, probablemente debido a su procesamiento. Sin embargo, al ser estimuladas con CpG de múridos, se evidenció una mayor eficiencia en el procesamiento de Salmonella spp.
Un fenómeno similar se observó durante la infección de las células dendríticas plasmacitoides con la bacteria Borrelia burgdorferi16. En otro estudio, la participación de las células dendríticas plasmacitoides durante la infección pulmonar causada por Legionella pneumophila en ratones quedó de manifiesto al eliminar selectivamente dichas células, lo que produjo una mayor carga bacteriana 17.
Las células dendríticas plasmacitoides pueden considerarse como células presentadoras de antígeno debido a la expresión de las moléculas del CMH de clases I y II. Se ha evidenciado que las células dendríticas plasmacitoides pueden incorporar antígenos mediante el receptor Fcγ (CD16/CD32) y activar una respuesta específica de antígeno de linfocitos T citotóxicos y cooperadores (Th). Una respuesta de Th conlleva la producción de IL-4 (subconjunto Th2), mientras que una respuesta de linfocitos T citotóxicos conduce a la producción de IL-10 e IFN-γ (subconjunto Tc1) 18.
Además, se ha descrito que las células dendríticas plasmacitoides tienen la capacidad de estimular una alorrespuesta de linfocitos T CD8+ en pacientes con trasplante de riñón que han sufrido infección por citomegalovirus, promoviendo el rechazo del órgano mediante la señalización de los receptores de tipo toll (toll-like receptors, TLR) endosómicos, TLR7 y TLR9 19.
Se ha señalado que la vía de señalización TLR9-MyD88 es indispensable para una respuesta específica a los linfocitos T citotóxicos de antígenos virales 20; en estudios recientes se ha establecido que el TLR9 es indispensable para la respuesta contra la invasión de S. Typhimurium en un modelo múrido, debido a que regula de manera negativa la vía de NF-κB-NLRP3-IL-1β en las células epiteliales del intestino infectadas con la bacteria 21.
Entre los mecanismos propuestos para la presentación de antígenos exógenos en el contexto del CMH-I, se ha sugerido que las proteínas exógenas degradadas en endosomas son secretadas al medio extracelular, donde se unen a moléculas del CMH-I vacías, o bien que, mediante la activación de TLR9, las células dendríticas plasmacitoides incrementan su capacidad fagocítica de procesar antígenos derivados de células muertas infectadas 20, por lo que los péptidos de agentes patógenos intracelulares, como el OmpC73 de Salmonella spp., se presentan en el contexto del CMH-I y con ello logran evocar una respuesta de los linfocitos T citotóxicos.
Los porcentajes obtenidos en este estudio fueron superiores a los observados por Díaz-Quiñonez, et al., debido probablemente a la diferencia de estirpes celulares empleadas como células blanco en los ensayos, así como a las variantes metodológicas en cada caso, aunque la estrategia para generar las células efectoras in vivo e in vitro, así como los epítopos empleados, fueron iguales.
Es interesante observar que los porcentajes de degradación obtenidos durante la infección de las células dendríticas plasmacitoides con Salmonella spp. fueron superiores a los obtenidos con aquellas pulsadas con el epítopo, resultados que se explicarían por la mayor y más eficiente activación de las células dendríticas plasmacitoides infectadas, lo que posiblemente incrementó la expresión de otras moléculas estimuladoras y la secreción de citocinas, las cuales pudieron haber incrementado la respuesta efectora de los linfocitos T citotóxicos 18.
Los datos obtenidos en este estudio evidencian la participación de las células dendríticas plasmacitoides para evocar la respuesta de los linfocitos T citotóxicos durante la infección con S. Typhimurium, lo que sugiere su posible participación en la fiebre tifoidea, contribuyendo a eliminar células infectadas y permitiendo el control de la infección. Sin embargo, es necesario desarrollar estudios más detallados para confirmar estos datos también en células humanas o en un modelo múrido de fiebre tifoidea in vivo y profundizar en la participación de las células dendríticas plasmacitoides en la respuesta inmunológica celular evocada en una enfermedad que afecta a millones de personas cada año 1.