El género Rhodnius está compuesto por 21 especies de insectos hematófagos, muchas de ellas indistinguibles morfológicamente entre sí 1,2. Todas las especies de este género son vectores de Trypanosoma cruzi, agente causal de la enfermedad de Chagas, y de T. rangeli, el cual es infectivo, pero no patógeno para los vertebrados 3,4. Aunque T. rangeli podría encontrarse en el intestino de cualquier triatomino, solo en las especies de Rhodnius logran infectar las glándulas salivales. Se les considera como los vectores biológicos de este parásito y se ha observado que algunos de sus genotipos son patógenos para algunas especies de Rhodnius4.
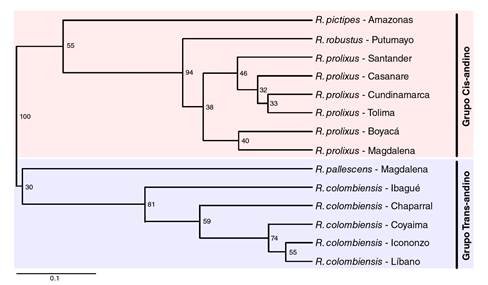
Debido a sus características morfológicas, de comportamiento, biogeográficas y genéticas, el género Rhodnius parece ser un taxón monofilético compuesto por tres grupos: el grupo Prolixus, integrado por R. barreti, R. dalessandroi, R. domesticus, R. milesi, R. marabaensis, R. montenegrensis, R. nasutus, R. neglectus, R. prolixus y R. taquarusuensis; el grupo Pictipes, conformado por R. amazonicus, R. brethesi, R. paraensis, R. piptipes, R. stali y R. zeledoni, y el grupo Pallescens, del cual hacen parte R. colombiensis, R. ecuadoriensis y R. pallescens. Los grupos Prolixus y Piptipes se distribuyen al oriente de la cordillera de los Andes y se les denomina cisandinos, en tanto que el grupo Pallescens se encuentra al occidente de la cordillera de los Andes y recibe el nombre de transandino 5-9.
En estudios previos se ha reportado que con el perfil electroforético de las hemoproteínas (nitroforinas) se pueden diferenciar las especies fenotípicamente similares 10-12. Asimismo, se ha evidenciado que los patrones electroforéticos de las proteínas salivales solubles bajo condiciones desnaturalizantes (SDS- PAGE) permiten diferenciar entre especies de triatominos 13-15. Sin embargo, la información disponible sobre los perfiles electroforéticos unidimensionales de la saliva de las especies de Rhodnius es limitada.
Por esta razón, en el presente estudio se hizo un análisis comparativo de los perfiles electroforéticos bajo condiciones desnaturalizantes de proteínas salivales solubles de R. colombiensis, R. pallescens, R. pictipes, R. prolixus y R. robustus.
Materiales y métodos
Las glándulas salivales se obtuvieron a partir de la disección de ninfas de quinto estadio (N5) de colonias de R. colombiensis, R. prolixus, R. pallescens, R. pictipes y R. robustus establecidas en el insectario del Laboratorio de Investigaciones en Parasitología Tropical de la Universidad del Tolima (cuadro 1). Se emplearon como mínimo 10 ejemplares de cada especie en cada réplica biológica y ensayo electroforético.
Cuadro 1 Colonias de las especies de Rhodnius empleadas según su procedencia
| Especie | Procedencia | Ambiente de captura |
|---|---|---|
| R. colombiensis | Chaparral, Tolima | Silvestre |
| Coyaima, Tolima | Silvestre | |
| Ibagué, Tolima | Silvestre | |
| Icononzo, Tolima | Silvestre | |
| Líbano, Tolima | Silvestre | |
| R. pallescens | San Sebastián de Buenavista, Magdalena | Silvestre |
| R. pictipes | Amazonas, municipio desconocido | Silvestre |
| R. prolixus | Boyacá, municipio desconocido | Doméstico |
| Coyaima, Tolima | Doméstico | |
| Medina, Cundinamarca | Doméstico | |
| Santander, municipio desconocido | Doméstico | |
| Sierra Nevada de Santa Marta, Magdalena | Doméstico | |
| Villanueva, Casanare | Silvestre | |
| R. robustus | Puerto Asís, Putumayo | Silvestre |
Después de la disección, las glándulas se lavaron tres veces en solución fisiológica fría (NaCl 0,9 %), se recolectaron en un microtubo en cama de hielo y se suspendieron de nuevo en solución fisiológica fría en una proporción de 2 µl por cada par de glándulas. Para permitir la extravasación de la saliva, las glándulas se perforaron con un alfiler entomológico, se centrifugaron a 9.000 r.p.m. durante 5 minutos a 4 °C y el sobrenadante se transfirió a un nuevo microtubo. La concentración de proteínas solubles totales se determinó por espectrofotometría mediante el método de Bradford 16.
Se empleó 1 µg de proteína salival soluble para cada electroforesis y estas se corrieron en geles de resolución de poliacrilamida al 12 % acoplados a un gel de 5 % de concentración usando el sistema Mini PROTEAN Tetra Cell™ (Bio-Rad). El corrido electroforético se hizo a 90 V empleando tampón de Tris- glicina (Tris, 25 mM, glicina, 192 mM, SDS 0,1 % p/v) durante 2 horas. Los geles se colorearon con nitrato de plata 17,18. Con el objetivo de comprobar la reproducibilidad del polimorfismo observado en la saliva de R. prolixus, se hicieron seis réplicas biológicas con sus respectivos geles electroforéticos, en tanto que para las demás especies se hicieron tres.
Los geles de SDS-PAGE se digitalizaron empleando un fotodocumentador Gel Doc XR+System™ (Bio-Rad). Los pesos moleculares de las bandas de proteínas visualizadas se calcularon con el programa Image Lab, versión 5.2.1, y una matriz de caracteres y taxones se elaboró con base en la presencia o ausencia de bandas para calcular el coeficiente de similitud de Nei-Li-Dice 19 y construir un fenograma empleando el método UPGMA.
Resultados
Los perfiles electroforéticos de la saliva de R. colombiensis, R. pallescens, R. pictipes, R. prolixus y R. robustus mostraron una compleja composición proteica de bajo peso molecular (figura 1), cuyos perfiles fueron similares a los descritos previamente en otras especies de triatominos 13-15, en tanto que las bandas de proteínas tuvieron pesos moleculares menores a 45 KDa, la mayoría de ellas en un rango de 15 a 25 KDa. Rhodnius pictipes presentó el mayor número de bandas exclusivas y 22 de ellas eran compartidas, por lo menos, por dos especies. Las poblaciones de R. prolixus de Boyacá y Tolima presentaron el mayor número de bandas de proteínas 14, y las de R. colombiensis de Coyaima y Chaparral presentaron el menor número de bandas (cuadro 2).
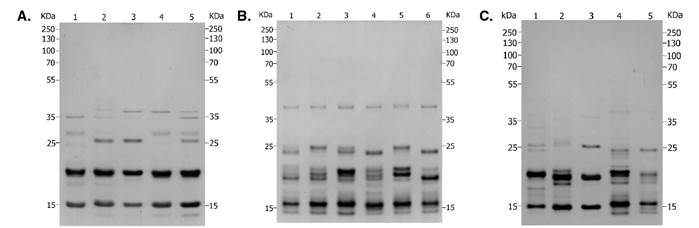
Figura 1 Proteínas salivales en geles de SDS-PAGE al 12 %, coloreados con nitrato de plata. A) Especies del género Rhodnius: (1) R. picitipes, (2) R. pallescens, (3) R. colombiensis (Coyaima, Tolima), (4) R. prolixus (Boyacá), (5) R. robustus (Putumayo). B) Colonias de R. prolixus: (1) Cundinamarca, (2) Tolima, (3) Boyacá, (4) Casanare, (5) Magdalena y (6) Santander. C) Colonias de R. colombiensis: (1) Ibagué, (2) Icononzo, (3) Coyaima, (4) Chaparral y (5) Líbano
Cuadro 2 Pesos moleculares en KDa de las bandas de proteínas salivales de cinco especies del género Rhodnius
| Banda | R. pictipes | R. pallescens | R. colombiensis | R. robustus | R. prolixus | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| N° | MW | Ibagué | Incononzo | Coyaima | Chaparral | Líbano | Boyacá | Magdalena | Santander | Cundinamarca | Tolima | Casanare | |||
| 1 | 42,31 ± 0,37 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 1 |
| 2 | 40,07 ± 0,31 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| 3 | 38,03 ± 0,0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 4 | 37,33 ± 0,38 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 5 | 35,61 ± 0,0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 6 | 34,49 ± 0,07 | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 7 | 32,26 ± 0,0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 8 | 29,63 ± 0,0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 9 | 28,19 ± 0,13 | 0 | 0 | 1 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 10 | 27,26 ± 0,0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 |
| 11 | 26,52 ± 0,0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 12 | 25,89 ± 0,0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 13 | 25,59 ± 0,01 | 0 | 0 | 0 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 14 | 24,62 ± 0,15 | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 1 | 1 | 1 | 0 | 1 | 1 | 0 |
| 15 | 23,8 ± 0,20 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 1 |
| 16 | 23,05 ± 0,18 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 |
| 17 | 21,3 ± 0,11 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 1 |
| 18 | 20,35 ± 0,05 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 |
| 19 | 19,93 ± 0,13 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 0 | 1 |
| 20 | 19,5 ± 0,07 | 0 | 1 | 1 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 1 |
| 21 | 19,1 ± 0,04 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 1 | 1 | 1 | 1 |
| 22 | 18,48 ± 0,08 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 1 | 0 |
| 23 | 18,06 ± 0,22 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 |
| 24 | 17,68 ± 0,13 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 25 | 17,17 ± 0,0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 26 | 16,76 ± 0,19 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 1 | 1 |
| 27 | 16,23 ± 0,28 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 0 |
| 28 | 15,43 ± 0,06 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| 29 | 15,04 ± 0,47 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 0 | 1 | 1 | 1 | 1 | 1 |
| 30 | < 15 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
MW: Molecular weight (peso molecular) en kDa
Significado de los números: 0, banda ausente, 1, banda presente
Con el fenograma construido mediante el método UPGMA se diferenciaron cada una de las especies estudiadas y se evidenció la existencia de dos grupos principales (figura 2): uno conformado por R. robustus, R. prolixus y R. pictipes y, el otro, por R. pallescens y R. colombiensis.
Discusión
Los pesos moleculares de las bandas de las proteínas salivales de R. colombiensis, R. pallescens, R. pictipes, R. prolixus y R. robustus obtenidos mediante SDS-PAGE concordaron con las masas moleculares de las proteínas codificadas por secuencias de ADNc de longitud completa de las glándulas salivales de R. prolixus20, con algunas proteínas de la familia de las lipocalinas caracterizadas como nitroforinas, con proteínas de unión a amina biogénica y con inhibidores de agregación plaquetaria 21-23, así como con los pesos moleculares de la mayoría de las proteínas identificadas en la saliva de R. neglectus, R. prolixus, R. robustus y R. brethesi24-26. La función principal de estas proteínas es contrarrestar los eventos hemostáticos del huésped, tales como la vasoconstricción, la agregación plaquetaria y la coagulación sanguínea, así como la inflamación y las reacciones del sistema inmunitario del huésped, permitiéndole al insecto un flujo constante de sangre durante su alimentación 27,28.
Estos resultados concuerdan con lo reportado por diferentes autores, quienes mencionan que los perfiles electroforéticos de saliva obtenidos mediante SDS-PAGE de proteínas solubles y electroforesis de hemoproteínas salivales permiten identificar los triatominos hasta el nivel de especie 10-12,14,15. La técnica aplicada también puede servir para ayudar a caracterizar las especies del género Rhodnius que son morfológicamente similares.
La variabilidad electroforética de las proteínas salivales en la SDS- PAGE en poblaciones de una misma especie, pero proveniente de áreas geográficas diferentes se ha estudiado en Panstrongylus megistus de Brasil 13 y Triatoma dimidiata de Colombia y Guatemala 14,15. Los resultados de estos estudios concuerdan con lo aquí evidenciado en el sentido de que no fue posible establecer una relación entre el polimorfismo observado y el área geográfica o el grado de asociación con las viviendas humanas. No obstante, se han reportado diferencias en los perfiles electroforéticos de hemoproteínas salivales en R. prolixus provenientes de Venezuela y la región central de Colombia, lo que evidencia que la variación de la composición proteica puede reflejar distancias geográficas entre las poblaciones de una misma especie 10,11. Es probable que esta relación entre el polimorfismo y la región geográfica pueda observarse al aumentar la escala geográfica y comparar los perfiles electroforéticos de diferentes poblaciones de países de Centroamérica y Suramérica.
Por otra parte, la posición de R. pictipes del grupo Pictipes en la misma rama con R. prolixus y R. robustus, del grupo Prolixus, muestra la cercanía entre los dos grupos; sin embargo, la filogenia de R. pictipes y las demás especies del grupo ha sido tema de controversia, ya que debido a su amplia distribución geográfica y a las características ecológicas y las similitudes morfológicas con otros Triatominae y predadores redúvidos no compartidas por la mayoría de las especies de la tribu Rhodniini, R. pictipes podría ser la especie más cercana a la forma ancestral del género Rhodnius8,29,30. En estudios de filogenia molecular basados en marcadores nucleares y mitocondriales, los resultados sobre la posición filogenética de R. pictipes han diferido. Se ha encontrado que el grupo transandino Pallescens está estrechamente relacionado con el grupo Pictipes 30,31, en tanto que otros autores reportan que R. pictipes está más cerca a R. prolixus que a las especies del grupo transandino 1,32,33.
Desde otra perspectiva, en los estudios sobre la interacción de Rhodnius y T. rangeli se ha postulado una asociación entre los grupos del primero y los genotipos del segundo, observándose que el grupo transandino Pallescens transmite KP1(-) únicamente por inoculación a T. rangeli, mientras que el grupo Prolixus solo transmite KP1(+) a T. rangeli4. Recientemente, se ha reportado que las glándulas salivales de R. pictipes pueden ser infectadas por la cepa SC-58 de T. rangeli KP1(-). Por lo tanto, R. pictipes podría transmitir el genotipo KP1(-) de T. rangeli, exhibiendo así características biológicas similares a las evidenciadas en las especies del grupo transandino 34.
Puede concluirse que los perfiles electroforéticos de las proteínas salivales permitieron diferenciar entre R. colombiensis, R. pallescens, R. pictipes, R. prolixus y R. robustus, y que la variabilidad electroforética interespecífica proporcionó datos para la generación de un fenograma congruente con los grupos transandino y cisandino. Asimismo, la información obtenida en este estudio indica que R. pictipes puede compartir características fenotípicas con los grupos Pallescens y Prolixus, lo que respalda el estatus de R. pictipes como la especie más cercana a la forma ancestral del género Rhodnius.