La bacteria Brucella canis es considerada el principal agente causal de la brucelosis canina 1-3, aunque otras especies del género, como B. abortus, B. suis y B. melitensis, pueden infectar de forma transitoria a los perros 4. El cuadro clínico en el perro es variable y se encuentran desde casos asintomáticos 1,5,6, hasta abortos, orquitis, epididimitis, prostatitis 2,7, discoespondilitis 8, endoftalmitis 9 o linfadenomegalia 10. La transmisión a los animales vulnerables suele darse por medio del coito, los aerosoles o por contacto directo de mucosas o piel lesionada con material contaminado con el agente patógeno 2,11.
Se sabe que los fluidos vaginales posteriores a un aborto y el semen de animales infectados podrían constituir algunas de las fuentes más importantes de contagio para otros perros y para las personas, dada la elevada concentración de bacterias presentes en estas secreciones 11,12. Sin embargo, como B. canis puede persistir en secreciones vaginales no asociadas con el período de celo (estro) y en órganos diferentes a los reproductivos, el agente patógeno puede también diseminarse de manera intermitente y en bajas concentraciones en orina, saliva y secreciones nasales, por lo que la castración de hembras y machos no elimina totalmente el riesgo de contagio 2,11-14.
El tratamiento antibiótico para la brucelosis canina no siempre es efectivo para erradicar la bacteria, por lo que pueden presentarse picos recurrentes de bacteriemia después de finalizado el tratamiento 15,16, lo cual podría aumentar el riesgo de diseminación bacteriana a individuos vulnerables.
El contacto directo con semen, secreciones, membranas fetales y cachorros abortados de hembras infectadas, sigue siendo la principal ruta de transmisión al ser humano 17,18. La infección también puede ocurrir por medio de fómites y se sabe que la bacteria puede sobrevivir por largos períodos en el suelo y el agua contaminados 11,19,20.
Es muy probable que la infección por B. canis en los seres humanos se encuentre subdiagnosticada debido a la sintomatología inespecífica 3,4,13, y a que la bacteria no se puede identificar mediante las pruebas serológicas empleadas de rutina para el diagnóstico de otras especies del género 13. Aunque todavía se consideran poco frecuentes, un número creciente de estudios en la última década ha documentado infecciones con B. canis como causa de endocarditis, peritonitis y otros cuadros clínicos 4. En Colombia, la bacteria se aisló por primera vez en el 2009 en la sangre de una mujer asintomática propietaria de un criadero, cuyos perros presentaban problemas reproductivos asociados con la infección por B. canis21. Posteriormente, Sánchez-Jiménez, et al., informaron dos casos no publicados de médicos veterinarios seropositivos y con sintomatología sugestiva de brucelosis 22.
Desde el punto de vista zoonótico, quizá lo más relevante de esta bacteria es el riesgo ocupacional que representa para veterinarios, criadores de perros y empleados de refugios o perreras 18. No obstante, es poco el énfasis en el riesgo de transmisión por perros destinados a la adopción. Aunque B. canis se considera de bajo potencial zoonótico en comparación con otras especies del mismo género, se ha demostrado que el contacto estrecho con perros infectados aumenta el riesgo de contagio 13,17,23, especialmente en adultos mayores, niños e individuos inmunocomprometidos 2,24. La zoonosis por B. canis parece ser un problema emergente en residentes de barrios urbanos marginales y de bajo nivel socioeconómico, en los que sean numerosos los perros callejeros 4.
La seroprevalencia de B. canis en algunos albergues de caninos en Colombia varía entre 0 % en Envigado 25 y Bucaramanga 26, y 6,78 % en Medellín 27. No hay publicaciones recientes de estudios en refugios de Bogotá. En el ámbito mundial, los resultados también varían, pues se han encontrado prevalencias que oscilan entre 0,4 y 20,9 % en perros de refugios o domésticos 10,11,24,28-32.
En el diagnóstico serológico y como prueba de tamización, puede emplearse la detección cualitativa de anticuerpos IgG anti-B. canis mediante inmunocromatografía rápida (Anigen™), con 93,0 % de sensibilidad y 100,0 % de especificidad 33; posteriormente, es posible recurrir a pruebas complementarias como la de aglutinación rápida en placa con 2β-mercaptoetanol (PARP-2ME) 19.
El cultivo de sangre se considera la prueba de referencia, pero tiene poca sensibilidad y los resultados se demoran, por lo que la reacción en cadena de la polimerasa (PCR) puede considerarse una prueba de ayuda diagnóstica complementaria en el seguimiento o vigilancia de la enfermedad, pues detecta pequeñas cantidades del ADN bacteriano. La amplificación de un fragmento del gen bp26, que codifica para la proteína periplasmática e inmunodominante BP26 de Brucella spp. 34, con una sensibilidad de 92,6 % y una especificidad de 90,0 % frente al hemocultivo, puede ser la prueba de elección o complementaria para el diagnóstico de la infección por B. canis35.
Teniendo en cuenta la escasa información epidemiológica sobre esta zoonosis, el objetivo de este estudio transversal fue determinar la seroprevalencia de B. canis en perros de un refugio para animales de compañía ubicado en Bogotá.
Materiales y métodos
Se hizo un estudio descriptivo de corte transversal en un refugio de animales ubicado en Bogotá, que funciona como albergue transitorio de perros abandonados en la zona urbana, donde permanecen hasta su adopción, muerte o eutanasia.
Tamaño de la muestra
Para el cálculo del tamaño de la muestra (n) en una población de 145 perros, se empleó el módulo “Tamaño de muestra: detectar enfermedad (muestreo aleatorio y diagnóstico perfecto”, de la plataforma Working in Epidemiology (WinEpi) (http://www.winepi.net/f101.php). La prevalencia mínima esperada se fijó en 5,0 % con un nivel de confianza del 95,0 % y se obtuvo un número de 51 individuos seleccionados mediante muestreo aleatorio por conveniencia.
Toma de muestras
Después de obtener el consentimiento informado de la propietaria del refugio, se tomaron muestras de sangre por punción de las venas yugular o cefálica de los animales, en tubos al vacío sin anticoagulante (Vacutainer system™); las muestras se rotularon con la respectiva identificación del animal y se refrigeraron hasta su envío al laboratorio. Los sueros se obtuvieron por centrifugación a 1.008g durante 5 minutos y, posteriormente, se congelaron a -20 °C en tubos de polipropileno de 1,5 ml (Eppendorf Tubes™) hasta el momento de su procesamiento.
Diagnóstico serológico
Los anticuerpos (IgG) contra B. canis se detectaron usando un inmunoensayo de cromatografía de flujo lateral (Bionote, Inc., kit de inmunocromatografía Prueba Rápida Anigen™, Gyeonggi-do, Corea) siguiendo las especificaciones del fabricante. Brevemente, se adicionaron 10 μl de suero al pozo de la muestra, a continuación, se agregaron 2 gotas (aproximadamente 80 μl) de solución tampón diluyente y se interpretaron después de 20 minutos de incubación a temperatura ambiente. La presencia de dos bandas de color (banda T y banda C) en la ventana de resultados, se interpretó como un resultado positivo de anticuerpos contra B. canis33.
Las muestras positivas por inmunocromatografía se remitieron a un laboratorio externo de referencia para la detección de IgG mediante la prueba de aglutinación rápida en placa con 2β-mercaptoetanol (PARP-2ME) 19. El procedimiento empleado por el laboratorio fue el siguiente: se mezclaron a partes iguales el 2-mercaptoetanol y el suero problema, y la mezcla se expuso al antígeno de la cepa M de B. canis. La aglutinación indicó que el suero era positivo para IgG contra B. canis.
Diagnóstico molecular
Las muestras de los animales seropositivos se analizaron por PCR para Brucella spp. en ADN extraído a partir de sangre completa previamente recolectada en tubos BD Vacutainer™ con citrato de sodio y los oligonucleótidos BMEI0535F (5'-GCGCATTCTTCGGTTATGAA-3') y BMEI10536R (5'-CGCAGGCGAAAACAGCTATAA-3'), reportados por Sánchez-Jiménez, et al., los cuales amplifican un fragmento de 451 pb del gen bp26 de Brucella35.
Las condiciones usadas fueron las mismas empleadas por Sánchez- Jiménez, et al., y Olivera, et al. 35,36: la solución de reacción contenía 3 μl de MgCl2 (3 mM, Fermentas, Foster City, CA, USA), 2,5 μl de solución tampón Tris- HCl 10 mM; tritón 100X y KCl con pH de 8,8 (Fermentas, Foster City, CA, USA), 0,5 μl de dNTP (10 mM), 3 μl de plantilla de ADN (1 ng/μl), 0,625 μl de cada oligonucleótido (0,25 μM), 0,2 μl de ADN de polimerasa Taq (5 UI/μl, Fermentas Taq DNA polimerasa recombinante, Foster City, CA, USA) y se empleó agua destilada para completar un volumen final de reacción de 25 μl 35.
La amplificación se hizo en un termociclador PTC 100™ (Perkin-Elmer Inc., San José, CA, USA) en un total de 25 ciclos de desnaturalización durante un minuto a 95 °C, alineamiento de los oligonucleótidos a 64 °C durante 45 segundos, y extensión de la cadena a 72 °C durante tres minutos. Finalizados los 25 ciclos, se realizó una extensión final a 72 °C durante seis minutos 36. Los productos de la PCR se visualizaron en una electroforesis en gel de agarosa al 1 % con 0,5 μg/ml de bromuro de etidio y la ayuda de un transiluminador ultravioleta (Transilluminator Mini Benchtop Model M-10E™, UVP, Upland, CA, USA). Se utilizó el marcador de peso molecular de 50 pb (50 a 1.000 pb), Generuler™ (Fermentas Inc., Burlington, Canadá) 35.
Como control positivo de la prueba, se utilizó el ADN extraído de la cepa de B. canis menos mucoide (M-) empleada en la preparación del antígeno para pruebas serológicas. Como control negativo, se emplearon todos los reactivos de la PCR, excepto el ADN 35.
Análisis de los datos
Se elaboró una base de datos en formato Excel™, en la que se registró la información relevante de los perros evaluados: sexo, edad y estado reproductivo (enteros o castrados, sometidos a orquiectomía u ovariohisterectomía). Mediante el inmunoensayo de cromatografía de flujo lateral, se estableció la seroprevalencia para B. canis y se comparó por sexo, grupo etario (grupo I: ≤1 año; grupo II: >1 año y <6 años, y grupo III: ≥6 años) y estado reproductivo (castrados o enteros) en el grupo de estudio.
Consideraciones éticas
El proyecto fue aprobado por el Comité de Ética y Bioética de la Fundación Universitaria Agraria de Colombia, después de verificar que los protocolos propuestos se ajustaran a las normas éticas para toma de muestras clínicas en animales, de conformidad con lo establecido en el Artículo 88 y el literal e) del Artículo 87 de la Resolución 8430 de 1993 (Normas científicas, técnicas y administrativas para la investigación en salud), y los artículos 15 y 16, Capítulo I, Título II de la Ley 576 de 2000 (Código de ética para el ejercicio profesional de la medicina veterinaria, la medicina veterinaria y zootecnia y zootecnia).
Resultados
Se analizaron los sueros de 51 perros procedentes de un refugio para animales de compañía, de los cuales 28 eran hembras y 23 machos, 44 eran castrados y siete eran enteros. La edad de los animales fluctuaba entre los 4 meses y los 15 años (cuadro 1).
Cuadro 1 Prevalencia de anticuerpos contra Brucella canis según, sexo, edad y estado reproductivo de 51 perros de un refugio de mascotas en Bogotá
| Total (n) | Seronegativos n (%) | Seropositivos n (%) | |
|---|---|---|---|
| Sexo | |||
| Macho | 23 | 23 (100) | 0 (0) |
| Hembra | 28 | 27 (96,4) | 1 (3,6) |
| Edad (años) | |||
| Grupo I (≤1) | 10 | 10 (100) | 0 (0) |
| Grupo II (>1 y <6) | 23 | 22 (95,7) | 1 (4,3) |
| Grupo III (≥6) | 18 | 18 (100) | 0 (0) |
| Estado reproductivo | |||
| Castrado | 44 | 43 (97,7) | 1 (2,3) |
| Entero | 7 | 7 (100) | 0 (0) |
| Total | 51 | 50 (98,04) | 1 (1,96) |
La seroprevalencia para B. canis por inmunocromatografía fue de 1,96. Por otro lado, ninguno de los machos analizados fue seropositivo, en tanto que una hembra (3,6 % del total de hembras) fue seropositiva, tanto por inmunocromatografía como por PARP-2ME, aunque sin evidencia de ADN bacteriano en la sangre en la PCR (figura 1). En cuanto al estado reproductivo, la hembra con anticuerpos anti-B. canis estaba esterilizada, lo que se presenta en el 2,3 % de los animales bajo esta condición. Con respecto a la edad, la serorreacción fue de 0,0, 4,3 y 0,0 % para los grupos I, II y III, respectivamente (cuadro 1).
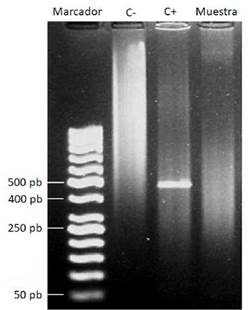
Figura 1 Electroforesis en gel de agarosa al 1 % de la PCR de un fragmento del gen bp26 de Brucella spp. en muestra de sangre completa del perro seropositivo para IgG anti-B. canis. Marcador: marcador de peso molecular (Generuler 50 bp DNA Ladder™); C-: control negativo (agua); C+: control positivo. ADN de una cepa (M-) de B. canis, amplicón de 451 pb, aproximadamente; muestra: muestra de sangre negativa
Discusión
La seroprevalencia de B. canis en el inmunoensayo de cromatografía de flujo lateral en los perros del refugio fue del 1,96 %, correspondiente a una hembra de tres años sin signos clínicos de brucelosis. Esta seroprevalencia difiere de la encontrada en otros estudios en animales de albergues en diferentes regiones de Colombia, y es mayor a la observada en los estudios desarrollados en las ciudades de Envigado 25 y Bucaramanga 26, donde no se encontraron animales seropositivos mediante inmunocromatografía. Por el contrario, la seroprevalencia encontrada en este trabajo fue menor que la reportada en los estudios realizados en animales de albergue en Villavicencio y Medellín, en los que se determinaron valores de 9,3 % 37 y 6,78 % 27, respectivamente, mediante la prueba de aglutinación rápida en placa con 2p-mercaptoetanol (PARP-2ME).
Contrario a esto, la seroprevalencia encontrada en Bogotá fue mayor que la obtenida por Pardo, et al., en un estudio mixto con perros callejeros y domésticos, la cual fue de 1,49 % empleando la prueba PARP-2ME 38.
Por otro lado, cabe resaltar que la seroprevalencia hallada en este estudio fue menor que la reportada en trabajos previos con perros domésticos en tres ciudades colombianas. En Medellín, fue del 2,76 % según la inmunocromatografía 39 y del 6,6 % con la PARP-2ME 40 en perros de asentamientos urbanos de bajo perfil socioeconómico (comunas), y del 11,0 %, en perros de criaderos o de clínicas veterinarias según la prueba de PARP-2ME 23. En Montería, la seroprevalencia encontrada con inmunocromatografía en hembras de entornos urbanos fue de 11,0 % 41. También, vale la pena resaltar que la seroprevalencia hallada es mucho menor que la observada por Castillo, et al., (citado por Giraldo, et al.), la cual correspondió al 20,3 % en una clínica veterinaria universitaria de Bogotá en el 2002 23.
Por otro lado, en el ámbito mundial los reportes de prevalencia de B. canis con base en serología o cultivo también se caracterizan por el alto índice de variabilidad, ya que se encuentran valores entre 0,40 y 20,9 % 10,11,28-32.
El amplio rango de prevalencias reportadas en Colombia y otros países podría atribuirse a múltiples factores, entre ellos, el método de muestreo, las características de la población estudiada 2, y la sensibilidad y especificidad de las pruebas de diagnóstico empleadas 42.
Es importante tener en cuenta que la seroconversión contra B. canis se inicia con el incremento de IgM hacia la tercera o cuarta semana, lo que se puede extender hasta la semana 12 después de la exposición 13,43,44. Entonces, pueden esperarse falsos negativos cuando las pruebas serológicas se hacen antes de la seroconversión o, en infecciones crónicas, cuando los títulos de anticuerpos circulantes se encuentran por debajo de los niveles de detección de las pruebas serológicas 13,44-46. Por consiguiente, dado que la reacción de los anticuerpos a una infección reciente o leve varía según las situaciones que se presenten después de la exposición, la técnica serológica empleada podría no detectar infecciones recientes o infecciones crónicas que se estuviesen presentando en la población de estudio.
Además de la dinámica de la respuesta humoral a la infección por B. canis, es necesario señalar que las características inherentes a toda prueba diagnóstica inciden directamente en el análisis de los resultados. En este caso, la poca probabilidad de encontrar falsos positivos (especificidad del 100 %) contrasta con la posibilidad de obtener falsos negativos (sensibilidad del 93 %) 33. Por consiguiente, debe considerarse que la seroprevalencia en la población de estudio puede ser superior a la encontrada.
No se pudo demostrar la presencia de ADN de B. canis con la prueba de PCR en el individuo seropositivo, pese a ser este un método más sensible para determinar la infección que el hemocultivo y la serología 46. La bacteriemia por B. canis tiende a desarrollarse hacia la segunda a cuarta semana de la infección y es de carácter intermitente 45. Durante la bacteriemia, el agente patógeno coloniza los tejidos diana como órganos reproductivos, hígado, bazo y médula ósea 15,37,38,46-48, o puede localizarse en los ganglios linfáticos 49,50. Por ello, es posible obtener PCR positivas sin seroconversión al inicio de la infección 13, o PCR negativas en animales seropositivos que se encuentren en la fase crónica de la infección con localización de la bacteria en órganos blanco 13,46-48, como posiblemente sucedió en este caso.
No se encontró IgG en otros perros en estrecho contacto con la hembra infectada. Además de la sensibilidad de la técnica diagnóstica, puede haber otros factores asociados con la presencia de animales seronegativos en la población de estudio. Aspectos como la castración del 86,3 % de los animales y la consiguiente ausencia de prácticas reproductivas, pudieron contribuir a minimizar el riesgo de contagio 51,52.
El impacto de esta infección animal en la salud de los seres humanos no ha sido completamente caracterizado porque gran parte de la información proviene de reportes de casos o informes de brotes 11,17,53,55,y, además, porque las pruebas serológicas disponibles en el mercado detectan especies de las cepas lisas de Brucella y no anticuerpos contra B. canis56, lo que ha conducido, finalmente, a que existan pocos estudios de prevalencia. Aunque desde el punto de vista ocupacional se considera que los cuidadores de los perros en los refugios o criaderos, los médicos veterinarios y el personal de laboratorio son los principales grupos de riesgo 18, con la evidencia científica también se destaca como factor de riesgo potencial el tener perros como animales de compañía 11, especialmente para los niños 55,57, las personas inmunocomprometidas 53,54, las de edad avanzada 58 o las mujeres gestantes 59.
El aumento descontrolado de la población canina causa un impacto negativo en la salud pública 60. Los perros callejeros representan un factor de riesgo de infección para las personas y para otros animales 32,60,61. Las enfermedades en perros con tutores responsables son relativamente más fáciles de controlar, en comparación con la población callejera, puesto que esta deambula por la calle y tiene más probabilidades de entrar en contacto con otros perros infectados y luego convertirse en potenciales diseminadores del agente patógeno 32. Por lo tanto, las estrategias de diagnóstico no deberían excluir las poblaciones de perros callejeros, con el fin de determinar la prevalencia e implementar las medidas pertinentes de control de B. canis en estos grupos.
La presencia de perros asintomáticos potencialmente adoptables podría constituir un gran riesgo para la población humana y animal, lo que debe alertar al personal sanitario sobre la importancia de hacer tamizaciones periódicas para detectar la infección en los dos grupos poblacionales.
Los resultados del presente estudio aportan información actualizada de la seroprevalencia de B. canis en un refugio de perros en Bogotá y pueden ser la base para futuras investigaciones de la enfermedad, tanto en perros callejeros como en animales de compañía.














