Las enfermedades cardiovasculares son la principal causa de morbilidad y mortalidad en el mundo 1. Anualmente ocurren, aproximadamente, 17,5 millones de muertes por esta causa y se estima que, para el año 2030, la cifra aumentará a 23,6 millones, en especial, debido a enfermedades como fibrilación auricular, accidente cerebrovascular, infarto agudo de miocardio y miocardiopatías 1. Estas últimas son un grupo de enfermedades que afectan primariamente al músculo cardíaco e incluyen las valvulopatías adquiridas, la cardiopatía hipertensiva, la enfermedad coronaria o la pericárdica. Las miocardiopatías dilatadas de origen familiar se heredan por un mecanismo autosómico dominante 2,3. Entre los fármacos que se utilizan para su tratamiento, se encuentran los cumarínicos o antivitamínicos K (AVK) 3, los cuales tienen un estrecho margen terapéutico asociado a la variabilidad individual en la respuesta terapéutica, por lo que el riesgo de hemorragias puede aumentar durante el inicio del tratamiento debido a los ajustes en la dosis 3,4.
Los antivitamínicos K, como la warfarina y el acenocumarol, actúan inhibiendo competitivamente la vitamina K epóxido reductasa C1 (VKORC1), en tanto que, desde el punto de vista farmacocinético, los antivitamínicos K son metabolizados principalmente por el citocromo P450 2C9 (CYP2C9). Por otro lado, el CYP4F2 es el encargado de metabolizar la vitamina K hidroquinona a hidroxivitamina K, eliminándola del ciclo metabólico. En consecuencia, una disminución en su actividad aumenta la disponibilidad de vitamina K, lo que implicaría la necesidad de mayores dosis de antivitamínicos K 5.
Desde el punto de vista farmacogenético, la Food and Drug Administration (FDA) recomienda analizar tres polimorfismos de nucleótido simple (Single-Nucleotide Polymorphism, SNP) antes de administrar warfarina: el rs1799853, el rs1057910 (ambos en CYP2C9) y el rs9923231 (VKORC1)6; de este último se tiene el mayor nivel de evidencia 7,8 (cuadro 1). Por su parte, el Clinical Pharmacogenetics Implementation Consortium (CPIC) incluyó en su guía clínica del 2018 la eventual necesidad de analizar el rs2108622 (CYP4F2) para el tratamiento con warfarina 9. En un reciente estudio publicado por nuestro grupo en 304 pacientes adultos chilenos en tratamiento con acenocumarol, se estableció que las variables clínicas (edad, peso y sexo) y el INR inicial solo incidían en la variabilidad de la dosis en un 19 %, en tanto que las variantes genéticas rs9923231 (VKORC1), rs1799853 (CYP2C9) y rs1057910 (CYP2C9) daban cuenta de un 37 % de dicha variabilidad 10.
Cuadro 1 Resultado de los genotipos estudiados en la paciente, fenotipo esperado y recomendación de dosis para acenocumarol según la evidencia
| Gen | VKORC1 | VKORC1 | CYP2C9 | CYP2C9 | CYP4F2 |
|---|---|---|---|---|---|
| SNP | rs9923231 | rs7294 | rs1799853 | rs1057910 | rs2108622 |
| Genotipo observado en la paciente | A/A | C/C | C/C | A/A | C/T |
| Homocigoto para el SNP | Homocigoto wt | Homocigoto wt | Homocigoto wt | Heterocigoto | |
| Fenotipo descrito para el genotipo observado* | Bajos niveles de la enzima VKOR | Bajo riesgo de hemorragias | Bajo riesgo de hemorragias | Bajo riesgo de hemorragias | Metabolismo intermedio de vitamina K hidroquinona |
| Recomendación de dosis para ACC* según genotipo observado | Dosis menor de la estándar | Dosis estándar | Dosis estándar | Dosis estándar | Dosis estándar |
| Nivel de evidencia* | Alto | Bajo | Bajo | Moderado | Moderado |
VKORC1: vitamina k epóxido reductasa c1; wt: Wild Type (alelo más frecuente); ACC: acenocumarol
*Obtenido de https://www.pharmgkb.org 14
En este contexto, se presenta el caso clínico de una paciente de 10 años que no mejoró de la manera esperada con el protocolo de ajuste de dosis para el tratamiento con acenocumarol. Tras realizar los estudios farmacogenéticos, esto se explicó por su perfil genético y se correlacionó con las dosis de antivitamínicos K que finalmente lograron la mejoría de la paciente.
Presentación del caso
Se trata de una paciente pediátrica con diagnóstico de miocardiopatía dilatada al nacer e insuficiencia mitral a los 9 años. El equipo de genética del Hospital Pediátrico "Dr. Luis Calvo Mackenna" confirmó que la causa de la miocardiopatía dilatada era genética, de tipo autosómica dominante. Dada la condición clínica de la paciente y por decisión del equipo médico, se inició el tratamiento con acenocumarol (jarabe de 1 mg/ml). En ese momento, la paciente tenía 10 años y su peso era de 29 kg. Antes del tratamiento con acenocumarol había recibido ácido acetilsalicílico (100 mg/día) durante dos meses. Al inicio del tratamiento con acenocumarol, la paciente recibió, además, los siguientes medicamentos: furosemida, captopril, digoxina e inmunoglobulina, ninguno con interacción con el acenocumarol (Micromedex™).
La dosificación de acenocumarol se ajustó a los protocolos del Hospital y a la "Guía práctica para el tratamiento anticoagulante en pediatría" de la Sociedad Chilena de Hematología basada en estudios nacionales e internacionales 11. La administración del acenocumarol comenzó con una dosis de carga de 0,1 mg/kg (2,9 mg/día) y una dosis diaria de 0,05 mg/kg (1,5 mg/día), con lo cual el valor esperado de INR debía haber estado entre 2,5 y 3,5 12,13, según las pautas de tratamiento del Hospital. Cinco días después de iniciado el tratamiento, dicho valor era de 16,0 (incoagulable), razón por la cual se administraron 10 mg de vitamina K (por vía oral) y se suspendió el anticoagulante por ese día. Al día siguiente, el valor de INR fue de 1,6. Posteriormente, la dosis de mantenimiento se ajustó a 1 mg/día y el INR arrojó un valor de 2,6 (figura 1).
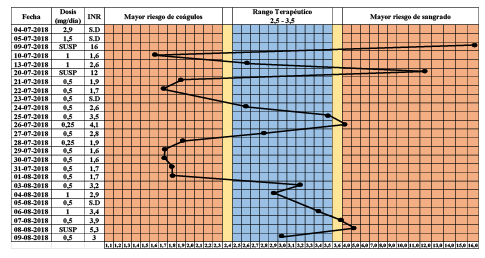
Fecha (DD-MM-AAAA), correspondiente al día en que fue tomada la muestra; INR: International Normalized Ratio; SUSP: dosis suspendida; SD: sin datos Nota: la fecha 04-07-2018 corresponde al día en que se administró la dosis de carga inicial de acenocumarol.
Figura 1 Valores del INR y dosis de acenocumarol administradas a la paciente (10 años de edad; 29 kg de peso) en los primeros 33 días de tratamiento
Siete días después, la paciente ingresó al servicio de urgencias del Hospital con un INR de 12,0. Se ajustó nuevamente la dosis a 0,017 mg/ kg (0,5 mg/día) y, cuatro días después, la paciente alcanzó un INR de 4,1. Los posteriores ajustes consecutivos permitieron alcanzar un INR de 2,3. En la figura 1, se presenta en detalle la dosificación y los valores de INR de la paciente hasta los 33 días de iniciado el tratamiento con acenocumarol.
El 9 de agosto del 2018, la paciente fue trasladada a otro centro asistencial de salud y no se pudo continuar su seguimiento.
Los últimos datos obtenidos datan de agosto del 2019, cuando la paciente asistió a control en el Hospital. En esa fecha, tenía 11 años de edad, pesaba 49 kg, y recibía una dosis de acenocumarol de 0,02 mg/kg (1 mg/día), la mitad de la recomendada para pacientes con esa edad y peso 11. Sin embrago, su INR se mantenía dentro del rango terapéutico 2,5-3,5.
Análisis genético
Para la identificación de los SNP rs2108622 (gen CYP4F2), rs9923231, rs7294 (ambos en el gen VKORC1), rs1799853 y rs1057910 (los dos en el gen CYP2C9), se obtuvo ADN genómico de la paciente a partir de una muestra de sangre venosa periférica, utilizando un estuche comercial (EZNA Blood DNA minikit™ (Omega Bio-tek). La determinación de los genotipos estudiados (cuadro 2) se hizo por discriminación alélica mediante sondas TaqMan™ y PCR en tiempo real. Los reactivos utilizados fueron TaqMan Genotyping Master Mix™ y TaqMan Drug Metabolism Genotyping™ Assay (ThermoFisher Scientific, USA).
Cuadro 2 Genes analizados y secuencias contexto
| Gen (SNP) | Tipo | Secuencia contexto | ID del ensayo |
|---|---|---|---|
| VKORC1 | wt | GATTATAGGCGTGAGCCACCGCACC[C]GGCCAATGGTTGTTTTTCAGGTCTT | C__30403261_20 |
| (rs9923231) | MAF | GATTATAGGCGTGAGCCACCGCACC[T]GGCCAATGGTTGTTTTTCAGGTCTT | |
| VKORC1 | wt | GGCACATTTGGTCCATTGTCATGTG[C]GGGTATGGCAGGAGGAGGGGGTAAT | C___7473918_10 |
| (rs7294) | MAF | GGCACATTTGGTCCATTGTCATGTG[T]GGGTATGGCAGGAGGAGGGGGTAAT | |
| CYP4F2 | wt | CCCCGCACCTCAGGGTCCGGCCACA[C]AGCTGGGTTGTGATGGGTTCCGAAA | C__16179493_40 |
| (rs2108622) | MAF | CCCCGCACCTCAGGGTCCGGCCACA[T]AGCTGGGTTGTGATGGGTTCCGAAA | |
| CYP2C9 | wt | GATGGGGAAGAGGAGCATTGAGGAC[C]GTGTTCAAGAGGAAGCCCGCTGCCT | C__25625805_10 |
| (rs1799853) | MAF | GATGGGGAAGAGGAGCATTGAGGAC[T]GTGTTCAAGAGGAAGCCCGCTGCCT | |
| CYP2C9 | wt | TGTGGTGCACGAGGTCCAGAGATAC[A]TTGACCTTCTCCCCACCAGCCTGCC | |
| (rs1057910) | MAF | TGTGGTGCACGAGGTCCAGAGATAC[C]TTGACCTTCTCCCCACCAGCCTGCC | C__2710492_10 |
wt: Wild Type (alelo más frecuente); MAF: Minor Allele Frequency (alelo menos frecuente); [N]: cambio nucleotídlco que da cuenta del polimorfismo de un solo nucleótldo o SNP. Extraído de TaqMan® SNP Genotyplng Assays (Número de catálogo: 4362691), ThermoFlsher Scientific®
Los resultados y la interpretación de los análisis genéticos se presentan en el cuadro 1, los cuales se recibieron el 9 de agosto del 2018, informando que la paciente era homocigota para el rs9923231 (VKORC1 ) y heterocigota para el rs2108622 (CYP4F2). Este perfil genético implica que las dosis de cumarínicos deben ser menores que las establecidas según criterios clínicos para alcanzar el rango terapéutico deseado (en este caso, un INR entre 2,5 y 3,5).
Discusión
Los polimorfismos genéticos y sus efectos en la dosis de los fármacos, entre ellos los antivitamínicos K, han sido estudiados ampliamente 14. Se han desarrollado diversos algoritmos de dosificación, principalmente para el uso de la warfarina en diferentes etnias, utilizando variables clínicas y farmacogenéticas, con el fin de mejorar la seguridad (evitar el riesgo de hemorragia) y la eficacia (disminuir el tiempo para el ajuste de la dosis) del tratamiento.
El presente caso clínico corresponde a una paciente pediátrica que no respondió de manera adecuada a la dosis estándar de acenocumarol, lo que obligó a constantes modificaciones y ajustes en la pauta de dosificación durante más de 30 días (figura 1). El análisis genético de la paciente evidenció un fenotipo metabolizador normal de la vitamina K hidroquinona (heterocigota para rs2108622, CYP4F2), pero una baja expresión de la VKORC1, enzima blanco de este fármaco (homocigota para rs9923231) (cuadro 1). El rs9923231 está localizado en la región promotora del gen VKORC1 y el cambio nucleotídico (NC_000016.10:g.31096368C>T) reduce la unión de factores de transcripción, desencadenando una disminución en la expresión del mRNA, y con ello, también en la cantidad de la enzima VKORC1 (13). Por otro lado, el SNP rs2108622 (NC_000019.10:g.15879621C>T) produce un cambio en la secuencia de aminoácidos de la CYP4F2 (NP_001073.3:p.Val433Met), reduciendo su actividad. No obstante, en estudios internacionales se ha evidenciado que su efecto es recesivo, por lo que la condición heterocigota en la paciente no implicaría un cambio fenotípico significativo ni se asociaría con la necesidad de modificar la dosis estándar de antivitamínicos K. Es importante señalar que la frecuencia de estos SNP (rs9923231 y rs2108622) en la población chilena es alta: 0,467 y 0,229, respectivamente 10.
El perfil genético observado explicaría los altos valores del INR que la paciente presentó frente a la dosis estándar de acenocumarol, para la que solo se consideraron variables clínicas (principalmente antropométricas). Cabe destacar que la paciente alcanzó cuatro veces una condición de anticoagulación excesiva y, por ende, un gran riesgo de hemorragia (figura 1). Los últimos registros de la paciente (agosto de 2019) muestran que logró alcanzar el rango terapéutico (INR entre 2,5 y 3,5) con la mitad de la dosis recomendada de acenocumarol. De haber tenido los análisis farmacogenéticos aquí descritos en el momento de iniciar el tratamiento con este fármaco, se hubiera podido alcanzar el rango terapéutico en menos tiempo (mayor eficacia) y mejorar sustancialmente la seguridad del tratamiento (evitando episodios de INR sobre 3,5).
Conclusión
Los resultados obtenidos confirman que la paciente presentaba un fenotipo farmacocinético y farmacodinámico que requería dosis de antivitamínicos K menores a las establecidas en los protocolos que consideran únicamente variables antropométricas, tal y como se ha establecido en estudios internacionales y nacionales previos. Es necesario implementar criterios farmacogenéticos en las guías clínicas del tratamiento anticoagulante con antivitamínicos K, siguiendo las recomendaciones de organismos regulatorios como la FDA dada la gran variabilidad observada en la reacción a los antivitamínicos K, su estrecho margen terapéutico y la frecuencia con que estos polimorfismos genéticos se presentan en nuestra población. La incorporación de variables respaldadas por evidencia sólidas en los algoritmos de dosificación permitiría alcanzar una mayor seguridad y eficacia del tratamiento anticoagulante.














