En la actualidad, los perros tienen un papel importante en la sociedad como animales de compañía, para guardia, protección y rescate, así como de apoyo en terapia ocupacional 1; sin embargo, pueden ser huéspedes definitivos de parásitos zoonóticos como Giardia spp., Ancylostoma spp., Toxocara canis, Echinococcus spp., Dipylidium caninum, Strongyloides spp., entre otros 2,3. Además, se consideran esenciales en la epidemiología de las enfermedades transmitidas por vectores, como mosquitos, garrapatas, pulgas y flebótomos, entre las cuales cabe mencionar babesiosis, anaplasmosis, leishmaniasis, borreliosis, ricketsiosis y dipilidiasis 4.
En diversos estudios se han reportado prevalencias variables de endoparásitos en perros domiciliados: en Estados Unidos, se encontró una prevalencia nacional del 12,5 % 5, en Austria, se reporta un 6 % 6, en tanto que en Brasil, una mayor, de 43 % 7. En México, las prevalencias son variables. En Villahermosa, Tabasco, se ha registrado una prevalencia de 26,50 % 8, en Ciudad de México, de 21,3 % y, en Mérida, de 46,2 % 9,10. Esta variación se debe a las características climáticas y las condiciones socioeconómicas de cada región 11. A pesar de esta gran diversidad en las prevalencias reportadas, Toxocara spp., Giardia spp. y Ancylostoma spp. tienen la mayor distribución y afectan a perros de distintos países 11.
Entre los ectoparásitos que afectan a los perros, las garrapatas y las pulgas ocasionan los principales daños y pueden transmitirles agentes patógenos 12-14. En México, las pulgas Ctenocephalides felis y Ct. canis15 y la garrapata Rhipicephalus sanguineus son los ectoparásitos que más frecuentemente afectan a perros de áreas urbanas y rurales 16,17.
En un estudio reciente en el sureste de México, se reportó que los perros pueden estar parasitados con nueve diferentes especies de garrapatas, entre ellas, Ixodes near affinis, Amblyomma mixtum, A. sabanerae, A. parvum, A. ovale, A. auricularium, A. maculatum, Dermacentor nitens y R. sanguineus18. A pesar de estos registros, en el centro del país (Estado de México) hay pocos estudios sobre los endoparásitos y ectoparásitos que afectan a los perros y el riesgo de transmisión a la población humana.
Dados los serios problemas de salud que los endoparásitos y ectoparásitos ocasionan a los perros, y que algunos de ellos pueden ser zoonóticos, es imperante conocer su diversidad y abundancia en áreas geográficas específicas, para establecer medidas tendientes a reducir su impacto negativo en los animales y el riesgo de transmisión a la población humana.
Por estas razones, el objetivo del presente estudio fue estimar la prevalencia de endoparásitos y ectoparásitos, identificarlos en perros domiciliados de la zona metropolitana de Toluca, México, y determinar los factores asociados con la presencia de cada especie parasitaria.
Materiales y métodos
Lugar de estudio
El estudio se hizo en cuatro hospitales veterinarios de municipios de la zona metropolitana de Toluca, México, (Metepec, San Mateo Atenco, Toluca y Zinacantepec). La población humana estimada en esta zona es de 1,85 millones de habitantes, su superficie es de 1.991 km2 y la densidad urbana de 67,1 habitantes/ha. Su altitud promedio es de 2.660 msnm, tiene un clima templado (promedio anual de 15 °C) y una humedad relativa promedio de 70 % 19.
Tamaño de muestra y población de estudio
Mediante la fórmula de Cochran 20, se calculó el tamaño de la muestra considerando una precisión de 0,05, con un nivel de confianza del 95 %, una prevalencia esperada del 20 % 9 y una población considerada de aproximadamente 308.333 perros, según lo sugerido por la WHO-WSPA de un perro por cada seis habitantes 21. El número de animales por muestrear fue de 198 perros domiciliados, cantidad que se duplicó para el estudio considerando dos épocas del año: de lluvias (junio a octubre de 2016) y seca (noviembre de 2016 a mayo de 2017). Se hizo un muestreo estratificado de perros según la densidad poblacional por municipio. Ninguno de los perros estudiados recibió desparasitación interna o externa en los 60 días previos al muestreo.
Toma de muestras
En la consulta se les informó a los propietarios sobre los objetivos del estudio y se solicitó su consentimiento informado para la toma de muestras a sus mascotas. Las personas proporcionaron la siguiente información de los perros: edad, sexo, raza, si tenían acceso a la calle y si permanecían dentro o fuera de la casa. En la inspección general de los animales, se obtuvieron los siguientes datos: condición corporal determinada mediante la escala de Laflamme (se catalogaron como deficientes los grados 1 y 2, y como no deficientes, los grados 3, 4 y 5) 22, consistencia de las heces (firme, diarrea), y otras manifestaciones de enfermedad intestinal (dolor abdominal, borborigmo o líquido en asas intestinales).
A cada perro se le tomó un hisopado rectal para el análisis con la técnica directa en fresco y una impresión de la zona perianal con la ayuda de una cinta adhesiva transparente 23, Además, se solicitó a los propietarios que recolectaran muestras de heces en tres días consecutivos para el análisis coproparasitoscópico.
Se recolectaron las garrapatas y los piojos mediante desprendimiento manual con ayuda de pinzas y un guante de inspección, y las pulgas, con un peine de cepillado y obtención de especímenes 24. Los ectoparásitos se colocaron en etanol al 70 % y se mantuvieron en refrigeración a 4 °C hasta su identificación taxonómica.
Pruebas de laboratorio
Las heces de los perros se procesaron en el laboratorio clínico del Hospital Veterinario para Pequeñas Especies de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Autónoma del Estado de México, usando las siguientes técnicas de diagnóstico de endoparásitos: estudio coproparasitoscópico directo, técnica de flotación en solución de sulfato de cinc y Sheather, técnica de sedimentación y test de Graham 23. Las pulgas, garrapatas y piojos se identificaron de acuerdo con su morfología y siguiendo las llaves taxonómicas correspondientes 4,25.
Se consideraron como positivas para endoparásitos aquellas muestras con huevos, ooquistes, larvas, adultos o proglótidos detectados mediante alguna de las técnicas coproparasitoscópicas mencionadas. De los animales con ectoparásitos, se recolectaron e identificaron especímenes de pulgas, garrapatas o piojos.
Además, en la unidad de diagnóstico molecular de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Autónoma de Yucatán, se hizo el diagnóstico molecular de D. caninum en las pulgas obtenidas en los muestreos, siguiendo la siguiente metodología.
Extracción de ADN. Las pulgas obtenidas de cada paciente fueron analizadas de manera individual para identificar su especie; si un perro presentaba más de dos pulgas, se hacía una mezcla de dos a tres de ellas, de tal manera que se obtuvieran muestras de pulgas individuales y muestras de mezclas de la misma especie. Las pulgas se retiraron del alcohol y se lavaron con agua destilada para luego almacenarlas a -70 °C durante 12 horas. Posteriormente, con la ayuda de un pistilo de plástico estéril, se maceraron y se extrajo el ADN con el estuche Quiagen DNAeasy Blood&Tissue® siguiendo las instrucciones del fabricante. Las muestras se conservaron a -20 °C hasta el momento en que se hizo la PCR.
Amplificación de ADN y electroforesis. Para el diagnóstico de D. caninum en las pulgas, se utilizó la región 28S rDNA del genoma del parásito, cuyo tamaño esperado era de 653 pb. Se utilizaron los siguientes iniciadores para el diagnóstico: C28S-1R:5-CACATTCAACGCCCGACTCCTGTAG-3 y DC28S- 1F:5-GCATGCAATCAAAGGGTCCTACG-3 26. El volumen final de la mezcla para la PCR fue de 25 μl, que contenía 12,5 μl de Gotaq Green Master Mix®, 2,5 μl de cada iniciador, 5 μl de H2O y 5 μl de cada muestra de ADN.
Las condiciones del ciclo fueron: 95 °C por 15 minutos, 40 ciclos a 94 °C por 30 segundos, 56 °C por 30 segundos, 72 °C po 30 segundos y 72 °C por 10 minutos 27. La electroforesis de tos productos de Ια PCR se llevó a cabo en gel de agarosa al 1,5 % teñido con bromuro de etidio. Se utilizaron 7 μl del marcador de peso molecular Thermo Scientific® para 1.000 pb y, para el control positivo y las muestras, se utilizó un volumen de 10 μl a un voltaje de 104 v y 110 mA durante 45 minutos.
Análisis estadístico
Se determinó la prevalencia general y por especie de parásito. Inicialmente, se realizó la prueba de ji al cuadrado con el programa Prisma Graphpad®, considerando como variables dependientes a los endoparásitos con mayor prevalencia: Toxocara spp., Giardia spp., Ancylostoma spp., D. caninum y Cystoisospora spp., y como variables independientes de cada parásito, al municipio (Metepec, San Mateo Atenco, Toluca o Zinacantepec), la estacionalidad (lluvias, sequías), la edad (un año o meses y más de un año), el sexo (machos, hembras), la raza (mestizos, raza pura), el salir a la calle (sí, no), la convivencia con otros animales (sí, no), la estancia en exteriores o interiores, la condición corporal (deficiente o no deficiente), las heces (firme, diarrea), y otros signos clínicos asociados con enfermedad intestinal (sí, no) o presencia de pulgas (sí, no).
Εl análisis de ji al cuadrado en ectoparásitos se hizo unicamente en pulgas porque solo se encontró un animal positivo para garrapatas y otro para piojos. Además de las variables independientes consideradas para los endoparásitos, se consideraron también el prurito (positivos, negativos) y las lesiones en piel (positivos, negativos).
El análisis de regresión logística se hizo con el programa Sigma Plot.11®. Para cada especie o género de parásito, se consideraron aquellas variables independientes con una p menor de 0,2 en la prueba de ji al cuadrado. Se calcularon la razón de momios (Odds Ratio, OR) e intérvalos de confianza de 95 %, y se determinaron los factores asociados con cada especie o género de endoparásitos y ectoparásitos (factores que obtuvieron un valor de p<0,05) 2,28.
Todos los procedimientos descritos fueron aprobados por el Comité Interno para el Cuidado de Ios Animales de Laboratorio - Docencia, Investigación, Servicio y Producción de la FMVZ-UAEM (CICUAL-DISP 17ABRIL12:30)
Resultados
Durante los meses de junio de 2016 a mayo de 2017, se evaluaron 403 perros, de los cuales el 37,2 % (IC95% 32,6-42,0) (150/403) resultó positivo, por lo menos, para un género o especie de parásito gastrointestinal. En el municipio de Metepec, se observó una prevalencia de 32,2 % (IC95% 22,0-44,6) (20/62), en San Mateo Atenco, de 41,4 % (IC95% 27,8-56,6) (17/41), en Toluca, de 37,6 % (IC95% 31,8-43,7) (94/250) y, en Zinacantepec, de 38 % (IC95% 25,951,8) (19/50), No se observó diferencia estadística entre los municipios.
Se identificaron siete géneros o especies de parásitos gastrointestinales. Toxocara spp. Presentó la prevalencia más alta, con 16,6 % (67/403), seguido por Giardia spp., con 13,4 % (54/403), Ancylostoma spp., con 9,2 % (37/403), D. caninum, con 4,7 % (19/403), Cystoisospora spp., con 4,7 % (19/403), Taenia spp., con 0,7 % (3/403), y T. vulpis, con 0,2 % (1/403). Se detectó multiparasitosis en 10,1 % (41/403) de los perros, de los cuales 7,9 % (32/403) presentó dos parásitos y, 2,2 % (9/403), tres parásitos. La asociación más frecuente fue entre un protozoario y un nematodo (cuadro 1).
Cuadro 1 Asociaciones parasitarias y frecuencia de multiparasitosis
Toxocara spp., Giardia spp., Ancylostoma spp., D. caninum, Taenia spp. y T. vulpis, presentaban potencial zoonótico. Todos los perros con multiparasitosis presentaban, por lo menos, una especie zoonótica.
Las variables con un valor de p<0,2 en la prueba de ji al cuadrado incluidas en el análisis de regresión logística, se presentan por género o especie, así: Toxocara spp.(cuadro 2), Giardia spp. (cuadro 3), Ancylostoma spp. (cuadro 4), D. caninum (cuadro 5) y Cystoisospora spp. (cuadro 6). El municipio, la estacionalidad, la convivencia con otros animales y el salir a la calle, no fueron estadísticamente significativos para ninguno de estos parásitos.
Cuadro 2 Prevalencia y resultados de regresión logística (OR, IC95%, p) de Toxocara spp. para conocer sus factores asociados
| Variables | Total | Positivos | Prevalencia | OR | IC95% | p |
|---|---|---|---|---|---|---|
| Edad | ||||||
| Adulto | 219 | 7 | 3,2 | 1 | ||
| <1 año | 184 | 60 | 32,6 | 19,71 | 4,51-86,03 | <0,001* |
| Raza | ||||||
| Raza pura | 309 | 44 | 14,2 | 1 | ||
| Mestizos | 94 | 23 | 24,5 | 1,02 | 0,41-2,55 | 0,956 |
| Sale a la calle | ||||||
| No | 219 | 37 | 16,9 | 1 | ||
| Sí | 184 | 30 | 16,3 | 0,99 | 0,42-2,30 | 0,988 |
| Condición corporal | ||||||
| No deficiente | 299 | 39 | 13,0 | 1 | ||
| Deficiente | 104 | 28 | 26,9 | 1,09 | 0,37-3,19 | 0,874 |
| Heces | ||||||
| Firme | 250 | 23 | 9,2 | 1 | ||
| Diarrea | 153 | 44 | 28,7 | 0,58 | 0,23-1,43 | 0,237 |
| Cuadro clínico asociado | ||||||
| con enfermedad intestinal | ||||||
| Sí | 272 | 26 | 9,5 | 1 | ||
| No | 131 | 41 | 31,3 | 0,31 | 0,08-1,13 | 0,078 |
* Estadísticamente significativo
Cuadro 3 Prevalencia y resultados de regresión logística (OR, IC95%, p) de Giardia spp. para conocer sus factores asociados
| Variables | Total | Positivos | Prevalencia | OR | IC95% | p |
|---|---|---|---|---|---|---|
| Edad | ||||||
| Adulto | 219 | 24 | 10,9 | 1 | ||
| <1 año | 184 | 30 | 16,3 | 1,41 | 0,76-2,64 | 0,272 |
| Sale a la calle | ||||||
| No | 219 | 31 | 14,1 | 1 | ||
| Sí | 184 | 23 | 12,5 | 0,85 | 0,46-1,59 | 0,626 |
| Estancia | ||||||
| Interiores | 210 | 23 | 10,9 | 1 | ||
| Exteriores | 193 | 31 | 16,1 | 1,21 | 0,64-2,26 | 0,544 |
| Heces | ||||||
| Firme | 250 | 23 | 9.,2 | 1 | ||
| Diarrea | 153 | 31 | 20,2 | 3,10 | 1,63-589 | <0,001* |
* Estadísticamente significativo
Cuadro 4 Prevalencia y resultados de regresión logística (OR, IC95%, P) de Ancylostoma spp. para conocer sus factores asociados
| Variables | Total | Positivos | Prevalencia | OR | IC95% | p |
|---|---|---|---|---|---|---|
| Edad | ||||||
| Adulto | 219 | 14 | 6,4 | 1 | ||
| <1 año | 184 | 23 | 12,5 | 2,04 | 1,10-3,77 | 0,023* |
| Sexo | ||||||
| Hembras | 182 | 12 | 6,6 | 1 | ||
| Machos | 221 | 25 | 19,1 | 1,13 | 0,61-2,10 | 0,682 |
| Raza | ||||||
| Raza pura | 309 | 19 | 6,1 | 1 | ||
| Mestizos | 94 | 18 | 19,1 | 0,63 | 0,30-1,33 | 0,232 |
| Sale a la calle | ||||||
| No | 219 | 9 | 4,1 | 1 | ||
| Sí | 184 | 28 | 16,0 | 1,34 | 0,72-2,48 | 0,345 |
| Estancia | ||||||
| Interiores | 210 | 12 | 5,7 | 1 | ||
| Exteriores | 193 | 25 | 14,9 | 2,00 | 1,O8-3,73 | 0,027* |
| Condición corporal | ||||||
| No deficiente | 299 | 17 | 5,7 | 1 | ||
| Deficiente | 104 | 20 | 19,2 | 0,99 | 0,47-2,08 | 0,996 |
| Heces | ||||||
| Firme | 250 | 11 | 4,4 | 1 | ||
| Diarrea | 153 | 26 | 17,0 | 1,89 | 1,00-3,57 | 0,048* |
| Cuadro clínico asociado con | ||||||
| enfermedad intestinal | ||||||
| Sí | 272 | 13 | 4,8 | 1 | ||
| No | 131 | 24 | 18,3 | 6,39 3,76-12,80 <0,001* |
* Estadísticamente significativo
Cuadro 5 Prevalencia y resultados de regresión logística (OR, IC95%, P) de Dipylidium caninum para conocer sus factores asociados
| Variables | Total | Positivos | Prevalencia | OR | IC95% | p |
|---|---|---|---|---|---|---|
| Raza | ||||||
| Raza pura | 309 | 12 | 3,9 | 1 | ||
| Mestizos | 94 | 7 | 7,4 | 1,09 | 0,47-2,52 | 0,841 |
| Estancia | ||||||
| Interiores | 210 | 5 | 2,4 | 1 | ||
| Exteriores | 193 | 14 | 7,2 | 1,74 | 0,81-3,74 | 0,155 |
| Condición corporal | ||||||
| No deficiente | 299 | 11 | 3,6 | 1 | ||
| Deficiente | 104 | 8 | 7,7 | 0,82 | 0,33-2,02 | 0,676 |
| Heces | ||||||
| Firme | 250 | 6 | 2,4 | 1 | ||
| Diarrea | 153 | 13 | 8,5 | 2,57 | 1,17-5,61 | 0,018* |
| Cuadro clínico asociado | ||||||
| con enfermedad intestinal | ||||||
| Sí | 272 | 6 | 2,2 | 1 | ||
| No | 131 | 13 | 9,9 | 4,80 2,25-10,24 | <0,001* | |
| Pulgas | ||||||
| Sí | 351 | 9 | 2,5 | 1 | ||
| No | 52 | 10 | 19,2 | 3.32 | 1,53-7,20 | 0,002* |
* Estadísticamente significativo
Cuadro 6 Prevalencia y resultados de regresión logística (OR, IC95%, p) de Cystoisospora spp. para conocer sus factores asociados
| Variables | Total | Positivos | Prevalencia | OR | IC95% | p |
|---|---|---|---|---|---|---|
| Edad | ||||||
| Adulto | 219 | 5 | 2,3 | 1 | ||
| <1 año | 184 | 14 | 7,6 | 1,60 | 0,03-0,10 | 0,,102 |
| Raza | ||||||
| Raza pura | 309 | 17 | 5,5 | 1 | ||
| Mestizos | 94 | 2 | 2,1 | 1,35 | 0,91-2,84 | 0,347 |
| Heces | ||||||
| Firme | 250 | 4 | 1,6 | 1 | ||
| Diarrea | 153 | 15 | 9,8 | 2,27 | 0,71-2,56 | 0,005* |
| Cuadro clínico asociado | ||||||
| con enfermedad intestinal | ||||||
| Sí | 272 | 5 | 1,8 | 1 | ||
| No | 131 | 14 | 10,7 | 4,98 | 1,28-4,01 | <0,001* |
* Estadísticamente significativo
Los animales de un año o menores tuvieron mayor riesgo de infección con Toxocara spp. (cuadro 2). Aquellos con una edad de un año o menos, con estancia en exteriores, con diarrea o con otros signos clínicos asociados con enfermedad intestinal, tuvieron mayor riesgo de infección con Ancylostoma spp. (cuadro 3). Los perros con diarrea, con signos clínicos asociados con enfermedad intestinal y presencia de pulgas, tuvieron un mayor riesgo de infección por D. caninum (cuadro 4). Los perros con diarrea tuvieron mayor riesgo de infección por Giardia spp. (cuadro 5) y aquellos con diarrea y signos clínicos asociados con enfermedad intestinal tuvieron mayor probabilidad de infección por Cystoisospora spp. (cuadro 6).
De los 403 perros estudiados, el 13,15 % (IC95% 10,2 %-16,8 %), (53/403) fueron positivos a ectoparásitos. En el municipio de Metepec se observó una prevalencia de 11,2 % (IC95% 5,6 %-21,5 %) (7/62), en San Mateo Atenco, de 17,1 % (IC95% 8,5 %-31,3 %) (7/41), en Toluca, de 12 % (IC95% 8,5%-16,6%) (30/250) y, en Zinacantepec, de 18 % (IC95% 9,8 %-30,8 %) (9/50). No se observaron diferencias estadísticamente significativas (p>0,05) entre los municipios.
La prevalencia general de perros con pulgas fue de 12,9 % (52/403) y se recolectaron entre 1 y 8 pulgas por animal. En estos 52 perros, se recolectaron 145 pulgas, de las cuales el 56,6 % (82/145) era Ct. felis y el 43,3 % (63/145), Ct. canis.
Solamente un perro resultó positivo para garrapatas (0,24 %; 1/403), con seis especímenes de R. sanguineus, y un perro (0,24 %; 1/403) fue positivo para T. canis; se recolectaron tres especímenes de este piojo.
Las variables con significación estadística (p<0,05) para pulicosis en el modelo de regresión logística, fueron la condición corporal, el prurito y las lesiones en piel (cuadro 7). Se extrajo ADN de 52 muestras de pulgas, de las cuales 33 correspondieron a la especie Ct. felis y 19 a Ct. canis. En el cuadro 7 se especifica la cantidad de muestras obtenidas de pulgas individuales o en conjuntos por especie. El 9,6 % (5/52) de las muestras resultaron positivas para D. caninum en la PCR (figura 1). Ct. felis fue la especie de mayor prevalencia, con 7,7 % (4/52), en tanto que Ct. canis tuvo una prevalencia de 1,9 % (1/52) (cuadro 8).
Cuadro 7 Prevalencia y resultados de regresión logística (OR, IC95%, P) de pulgas para conocer factores asociados
| Variables | Total | Positivos | Prevalencia | OR | IC95% | p |
|---|---|---|---|---|---|---|
| Edad | ||||||
| Adulto | 219 | 27 | 12,3 | 1 | ||
| <1 año | 184 | 46 | 25,0 | 1,39 | 0,87-2,22 | 0,161 |
| Sexo | ||||||
| Hembras | 309 | 35 | 11,3 | 1 | ||
| Machos | 94 | 18 | 19,1 | 1,12 | 0.54-2.30 | 0,756 |
| Raza | ||||||
| Raza pura | 184 | 18 | 9,8 | 1 | ||
| Mestizos | 219 | 35 | 15,9 | 1,65 | 0,84-3,26 | 0,144 |
| Sale a la calle | ||||||
| No | 168 | 17 | 10,1 | 1 | ||
| Sí | 235 | 36 | 15,3 | 1,55 | 0,81-2,97 | 0,181 |
| Estancia | ||||||
| Interiores | 210 | 20 | 9,5 | 1 | ||
| Exteriores | 193 | 33 | 17,1 | 1,50 | 0,76-2,94 | 0,233 |
| Condición corporal | ||||||
| No deficiente | 294 | 27 | 9,2 | 1 | ||
| Deficiente | 104 | 26 | 25,0 | 2,43 | 1,21-4,86 | 0,012* |
| Cuadro clínico asociado | ||||||
| con enfermedad intestinal | ||||||
| Sí | 272 | 23 | 8,4 | 1 | ||
| No | 131 | 30 | 22,9 | 1,85 | 0,93-3,66 | 0,076 |
| Prurito | ||||||
| Sí | 324 | 32 | 9,8 | 1 | ||
| No | 79 | 21 | 26,6 | 2,11 | 1,02-4,37 | 0,044* |
| Lesiones en piel | ||||||
| Sí | 354 | 36 | 10,1 | 1 | ||
| No | 49 | 17 | 34,7 | 2,98 | 1,32-6,70 | 0,008* |
* Estadísticamente significativo
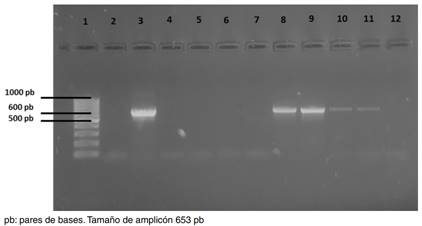
Figura 1 Gel de agarosa al 1,5 % teñido con bromuro de etidio para identificar la presencia de Dipyilidium caninum en pulgas de perros domiciliados de la zona metropolitana de Toluca, México. Carril 1: peso molecular, carril 2: control negativo, carril 3: control positivo, carriles 4 a 7: muestras negativas, carriles 8, 9 y 11: muestras positivos de Ct. felis, y carril 10: muestra positiva de Ct. canis.
Cuadro 8 Resultados del diagnóstico molecular de Dipylidium caninum en pulgas Ct. felis y Ct. Canis, en perros domiciliados de la zona metropolitana de Toluca, México
| Muestras | Positivos | Prevalencia | |
|---|---|---|---|
| Ctenocephalides felis | 9 | 1 | 1,92 % (1/52) |
| ADN individual | 24 | 3 | 5,76 % (3/52) |
| ADN en pools | |||
| Ctenocephalides canis | |||
| ADN individual | 5 | 0 | 0 % |
| ADN en pools | 14 | 1 | 1,92 % (1/52) |
| Total | 52 | 5 | 9,61 % (5/52) |
Discusión
Se encontró una prevalencia de endoparásitos del 37,2 % en la población de perros domiciliados de la zona metropolitana de Toluca, cifra mayor a la reportada en otros estudios nacionales e internacionales de perros con atención médica: en Ciudad de México, las prevalencias registradas han sido de 20 % y 21,3 % 9,29, en Villahermosa, Tabasco, de 26,5 % 8, en sitios en Estados Unidos, de 12,5 % 5, en España, de 25 % 30, y en Austria, de 6 % 6.
La variación en la prevalencia y la intensidad se podría asociar con tres factores. El primero es el uso de cuatro técnicas de diagnóstico con diferentes propiedades de sensibilidad y especificidad, algunas de ellas más propicias para el diagnóstico de especies de parásitos 31,32. El segundo factor es la contaminación con parásitos en espacios públicos. En Toluca se analizaron siete parques y calles aledañas a estos, y se encontraron animales positivos para Toxocara spp. en todos los espacios muestreados 33. La presencia de Toxocara spp. en los espacios públicos en Toluca representa una fuente de reinfección para los animales y de posible transmisión al humano de la larva migrans visceral 11. El tercer factor es la falla en los protocolos de desparasitación; la población estudiada recibe atención médica y administración periódica de fármacos antiparasitarios, por lo que se esperaría una menor prevalencia. Esto podría indicar que, en los perros estudiados, no se están aplicando los antiparasitarios adecuados o su frecuencia de uso no es la correcta 34. En el presente estudio se sentarán las bases de un programa de control de estas parasitosis en los perros.
Se identificaron siete géneros o especies de parásitos, diversidad comparable con el rango reportado en estudios previos, el cual fue de 4 a 16 parásitos 6,8,10,35,36. En el 10,1 % de los perros se encontró parasitismo mixto, sobre todo de dos géneros o especies. En zonas tropicales de México, se han reportado mayores prevalencias de infecciones mixtas. En Yucatán, se reportó 21,3 % de parasitosis dobles y 3,1 % de triples 2; en Veracruz, se ha reportado 37,6 % de parasitosis dobles, 28,9 % de triples y 5,9 % de cuádruples 37; en Argentina y Rumania, la prevalencia de infección de parasitosis mixtas también ha sido mayor, con 16,8 % y 38 %, respectivamente 28-36. Al igual que en otros estudios, se observaron parasitosis mixtas de nematodos y protozoos 26,36,38. La importancia de conocer los géneros y las especies, así como las infecciones mixtas de parásitos, radica en lograr la selección correcta del fármaco antiparasitario, lo que permite tratamientos efectivos que ayuden a controlar estas parasitosis.
Los resultados muestran un predominio de géneros y especies de parásitos zoonóticos. Seis de las siete especies identificadas tienen potencial zoonótico, lo que coincide con otros estudios, como el de Ciudad de México, donde todas (100 %; 3/3) las especies reportadas fueron zoonóticas 9; el de Veracruz, con el 100 % (5/5) 35; el de Mérida, con el 75 % (3/4) 10, y el de Villahermosa, con el 85,7 % (6/7) 8. Este mismo comportamiento se registra a nivel mundial: en Austria, el 50 % (4/8) de los parásitos que afectan a los perros son zoonóticos 6; en Rumania, el 56,2 % (9/16) 36; en Polonia, el 71,4% (5/7) 35, y en Brasil, el 75 % (6/8) 7. La transmisión de estos parásitos al humano depende de distintos factores, pero el hecho de que se hayan identificado en animales que sirven de mascotas implica un mayor riesgo de transmisión debido al contacto estrecho con los humanos. Además, los perros positivos para estos parásitos que tienen acceso a espacios públicos como parques, calles o jardines, son una fuente de contaminación del ambiente 11,39.
El nematodo con mayor prevalencia fue Toxocara spp., con 16,6 %. En otras ciudades de México se reportan prevalencias variables, como en Mérida, 5,7 % y 6,2 % 2,10 y Ciudad de México, 6 % 9; en tanto que, en la ciudad de estudio, Toluca, se ha reportado en suelos y espacios públicos 33.
En el análisis multivariado de regresión logística, los perros menores de un año presentaron la mayor probabilidad de infección con Toxocara spp. Un hallazgo similar se ha reportado en España, Rumania y Argentina 28,36,38, donde los perros jóvenes son los más afectados por este nematodo, probablemente porque, durante la gestación y la lactancia, las larvas infectivas (L3) se reactivan y se transmiten a los cachorros por medio de la placenta y la leche 40. Asimismo, los animales jóvenes tienen una inmunidad poco desarrollada, lo que se refleja en una reacción inmunitaria insuficiente frente a los parásitos 41.
El segundo parásito con mayor prevalencia fue Giardia spp., con 13,4 %, la más alta reportada en perros domiciliados de México. En Villahermosa, Tabasco, se reportó en el 1 % de los perros 8, en tanto que, en estudios de perros callejeros, la prevalencia ha sido mayor: en Ciudad de México, 46,5 % 42 y en Veracruz, 42,6 % 37. En el 2008 en Australia, Palmer, et al., observaron un aumento en la prevalencia de este protozoario en perros y una tendencia a la disminución de helmintos, lo que asociaron al uso generalizado de antihelmínticos. Los perros con diarrea tenían 3,1 veces más probabilidades de tener parasitosis por Giardia spp.; este parásito daña las vellosidades del intestino delgado, lo que resulta en deficiencias en la absorción de nutrientes y aumento de la permeabilidad intestinal y, al final, genera destrucción de enterocitos 43. Lo mismo hallaron Bouzid, et al., en pacientes sintomáticos comparados con los asintomáticos 44.
El género Ancylostoma fue el tercero con mayor prevalencia en la población estudiada (9,2 %); además, es el parásito zoonótico con mayor prevalencia en los estudios de Ciudad de México (7,5 %) 29, Villahermosa, Tabasco (15,9 %) 8, Mérida, Yucatán (32,6 %) 10, Argentina (13,4 %) 28, Brasil (37,8 %) 7, Polonia (36 %) 35 y Rumania (33 %) 36.
Los perros menores de un año tienen 2,04 veces más probabilidades de infección con este nematodo, probablemente asociada con la transmisión lactogénica del parásito en los primeros días de vida 40. Asimismo, la permanencia en exteriores se asoció con la infección, probablemente porque los animales en contacto con el suelo en exteriores, patios y jardines son propensos a adquirir Ancylostoma spp. por vía oral y cutánea; llegan a ser parasitosis graves en el intestino delgado, donde producen los principales efectos en su fase adulta 40,45.
La diarrea y las manifestaciones clínicas intestinales también se asociaron con la infección de Ancylostoma spp. El nematodo se alimenta de la mucosa del intestino delgado y genera daño mecánico al adherirse a la misma mediante su cápsula bucal, y la diarrea suele acompañarse de sangre 46. Este parásito es uno de los más reportados en estudios internacionales y, según nuestros resultados, fue el que presentó más factores asociados con la infección.
El cestodo con mayor prevalencia fue D. caninum, con 4,7 %. La prevalencia de este parásito ha sido menor en estudios similares, como los llevados a cabo en Mérida, Yucatán (2,3 %) 2, en Villahermosa, Tabasco (0,3 %) 8, en Argentina (1,5 %) 28, en Rumania (1,4 %) 34, en Brasil (2,5 %) 7 y en Australia (0,1 %) 47.
La diarrea (OR=4,80) y las manifestaciones clínicas intestinales (OR=3,32) fueron factores asociados con la infección con D. caninum. El cestodo se adhiere a la pared intestinal por medio del escólex, lo que genera daño en la mucosa e inflamación del intestino 46; sin embargo, la diarrea se asocia poco con este parásito, cuyo síntoma característico es el prurito anal 48, el cual no se valoró en este estudio. La presencia de pulgas también fue un factor (OR=3,32) que favoreció la infección con D. caninum, ya que las pulgas Ct. felis, Ct. Canis, Pulex irritans y T. canis son huéspedes secundarios de este cestodo.
Cystoisospora spp. fue el segundo protozoo con mayor prevalencia (4,7 %), y la única especie encontrada que no se considera zoonótica. Este género se reporta en la mayoría de estudios epidemiológicos con prevalencias bajas comparadas con las de los nematodos u otros protozoos como Giardia spp. El 1,9 % de los perros estudiados en Mérida, Yucatán, resultaron positivos para Cystoisospora spp. 10; en Villahermosa, Tabasco, el 6,9 % 8; en Argentina, el 11,9 % 28; en Brasil el 3,5 % 7, y en Austria, el 2 % 6.
Los factores asociados con la infección por este género fueron la diarrea y las manifestaciones clínicas intestinales. El parásito destruye la lámina propia de todo el intestino delgado del perro hasta producir atrofia de las vellosidades. Se considera un patógeno primario de diarrea en animales jóvenes 49.
Otros parásitos identificados cuya prevalencia estuvo por debajo de 1 %, fueron Taenia spp. (0,74 %) y T. vulpis (0,24 %), ambas especies zoonóticas; el cestodo es el que posee mayor capacidad patógena en el humano 50, en tanto que T. vulpis solo se ha reportado como causante de zoonosis de manera excepcional 51. La poca prevalencia de este último contrasta con las altas cifras en otros estados de México o en estudios internacionales: Yucatán, 25,4 % y 5,7 % 2,10, Campeche, 9,2 % 52, Veracruz, 18,8 % 37, Brasil, 7,1 % 7, y Rumania, 16,6 % 36.
La prevalencia de ectoparásitos (13,1 %) fue menor a la reportada en otros estudios; en dos provincias de Brasil fue de 100 % y 89,7 % 32, y en Etiopía, 99,5% 53. Esta menor prevalencia se asocia con las características ambientales y de altitud en esta zona, las cuales no presentan cambios considerables entre las temporadas de lluvia y las secas. En la zona de estudio, el promedio de la temperatura es de 15 °C y la humedad del 70 % 19. A menor altitud, pero con temperatura y humedad mayores, los ciclos parasitarios se completan en un tiempo menor y puede haber hasta cuatro generaciones en un año 53, por lo cual, en zonas más elevadas, las prevalencias se incrementan.
Las pulgas fueron el ectoparásito más prevalente, 12,9 %, similar a lo reportado en Italia, 17,6 % 12. En el contexto nacional, en el estado de Aguascalientes, la prevalencia en perros domiciliados es de 12 %, cifra considerablemente menor de la encontrada en Yucatán, 48 %, o en Cuernavaca, 30,3 %. La especie predominante fue Ct. felis, lo que coincide con los reportes mencionados, con excepción del de Aguascalientes, donde Ct. canis fue la especie más prevalente 13,15,54,55.
Los perros con condiciones corporales deficientes presentaron mayor prevalencia de infección (OR=2,43). Debido a su hábito hematófago, los ectoparásitos pueden producir anemia y, en consecuencia, un déficit nutricional crónico 46. El prurito y las lesiones dérmicas se asociaron con las infestaciones por pulgas, con OR de 2,11 y 2,98, respectivamente. Al alimentarse, las pulgas inoculan saliva, la cual es muy alergénica, y ocasionan una dermatitis con intenso prurito; y al rascarse, los perros exacerban las lesiones en la piel 55.
Solo un perro presentó garrapatas de la especie R. sanguineus, la de mayor distribución en distintos estados de México 16-18. Este perro era originario de Yucatán, donde se reporta gran prevalencia de este ectoparásito 18, el cual es responsable de la transmisión de agentes como Ehrlichia canis y Babesia canis56.
Trichodectes canis fue el único piojo identificado en un perro. Este piojo no es común en perros; en México, Brazil y Etiopía, se reporta Heterodoxus spiniger como el piojo de mayor importancia en perros, con prevalencias del 2 al 67,4 % 30,53,57. Los resultados indican que los piojos, al igual que las garrapatas, no parasitan de manera importante a la población de perros de la zona de estudio.
En el presente estudio y mediante PCR, se verificó que el 9,6 % de las pulgas se encontraban infectadas con D. caninum, resultado similar al obtenido en países de Europa (8,3 %) y en Malasia (10 %). La especie de pulga con mayor prevalencia (5,7 %) de D. caninum fue Ct. felis, la más importante en la transmisión de este cestodo en Europa y Malasia 26,58. La importancia de esta especie radica en que es un parásito zoonótico cuya transmisión al humano ocurre principalmente en infantes que ingieren accidentalmente pulgas infectadas 59-61, por lo cual es importante un control de este vector en la región.
En conclusión, la prevalencia de endoparásitos en perros domiciliados de Toluca, México, se considera alta, dado que la población estudiada recibe atención médica periódica. Se observó un predominio de especies parasitarias con potencial zoonótico, lo cual puede representar un riesgo para los dueños de mascotas de la zona. Según el análisis de regresión logística, se debe hacer un diagnóstico parasitológico exhaustivo en los perros jóvenes, pues es el grupo con la mayor prevalencia de parásitos y que más cercanía tiene con los propietarios. También, se encontraron asociaciones de las parasitosis con la presencia de diarrea o semiótica intestinal, el tener acceso a espacios exteriores y la presencia de pulgas.
Por el contrario, la prevalencia de ectoparásitos en Toluca fue baja, siendo las pulgas las más prevalentes. La condición corporal, el prurito y las lesiones en piel, se asociaron con las infestaciones de ectoparásitos. La presencia de D. caninum en los perros y en las pulgas pone de manifiesto la importancia de un control integral de endoparásitos y ectoparásitos en la región, para disminuir las infecciones e infestaciones en los perros y reducir el riesgo de transmisión a los humanos














