Los virus del dengue (DENV) son transmitidos por dos especies de mosquitos, Aedes aegypti y Aedes albopictus, que se crían y distribuyen en ambientes urbanos. Por esta razón, el dengue es una enfermedad predominantemente urbana. Según estimaciones recientes, unos 390 millones de personas se infectan anualmente con los virus del dengue y 96 millones llegan a manifestar clínicamente la infección 1. El virus del chikungunya (CHIVK) y el virus del Zika (ZIKV), otros dos virus causantes de arbovirosis, son transmitidos por los mismos vectores y en las últimas décadas han tenido un gran impacto en los brotes epidémicos urbanos de las Américas, África y Polinesia 2.
Una epidemia generalizada de infección por ZIKV fue reportada en 2015 en Centroamérica, Suramérica y el Caribe 3. En mayo del 2015, la Organización Mundial de la Salud (OMS) registró la primera transmisión local de ZIKV en el continente americano y se identificaron casos autóctonos en Brasil 4,5. El ZIKV se ha confirmado con transmisión local en 51 países y territorios de América 6,7. En Panamá, desde la reemergencia del dengue en 1993 hasta el 2021, se han registrado 98.581 casos acumulados de dengue, 219 casos de dengue grave y 79 defunciones. Desde que emergió en el 2014, el chikungunya ha registrado 410 casos acumulados hasta el 2021, mientras que desde que se registraron los primeros casos de Zika en el 2015 hasta el 2021, se han registrado 1.371 casos acumulados 8.
En los últimos años ha ocurrido un incremento significativo de los casos de dengue en algunos países de las Américas, que unido a la introducción de ZIKV y CHIKV, han generado una situación epidemiológica más compleja y representan un desafío adicional para los sistemas de salud pública 9.
El principal vector de DENV en todo el mundo son los mosquitos Aedes aegypti. Esta especie se ha adaptado a las zonas urbanas, en las áreas del peridomicilio, se cría a menudo en recipientes artificiales y pica casi exclusivamente a los humanos 10,11. La circulación de la enfermedad va emparejada con la distribución geográfica de Ae. aegypti12. El control vectorial es el método principal disponible para controlar las infecciones transmitidas por vectores y tiene como objetivo limitar la transmisión de agente patógenos al reducir o eliminar el contacto hombre-vector 13. Este es el método utilizado para controlar el CHIKV y el ZIKV y proteger así a las poblaciones humanas. Para algunas enfermedades, como el dengue, existe una vacuna que está autorizada, pero no ampliamente utilizada debido a problemas de seguridad 14.
Algunos programas de control de Ae. aegypti se centran en la vigilancia y en la eliminación de los sitios de cría, y en campañas de saneamiento ambiental para minimizar los riesgos de proliferación del vector. No obstante, enfrentan desafíos operativos por la presencia de múltiples tipos de criaderos en los sitios donde se aplican estas estrategias.
Por esta razón, y ante la presencia de elevados índices de infestación de Ae. aegypti y riesgos potenciales de transmisión, se lleva a cabo una etapa intensiva basada fundamentalmente en el uso de insecticidas 15,16. Las aplicaciones de insecticidas en aerosol a volumen ultrabajo son utilizadas para controlar los mosquitos en estadio adulto cuando están en vuelo o en reposo. Durante más de 60 años, la aspersión de insecticidas en forma de aerosol ha sido una herramienta crucial para combatir los mosquitos. Dos tecnologías han dominado su aprovechamiento y uso continuo en todo el mundo: la nebulización térmica 17, y los aerosoles de niebla fría 18. De este modo, se ha logrado prevenir y controlar la transmisión viral. Sin embargo, la mayoría de las veces, quedan poblaciones sobrevivientes de Ae. aegypti que, junto con los riesgos ambientales y sociales, representan un peligro potencial para la ocurrencia de nuevos brotes o epidemias.
Los estudios llevados a cabo en numerosos lugares del mundo han demostrado la capacidad que tiene Ae. aegypti para desarrollar resistencia a los insecticidas, lo que se constituye en el principal problema que afecta las estrategias de los programas de control de vectores 19,20. La resistencia de Ae. aegypti a los insecticidas piretroides y organofosforados representa una amenaza creciente para la sostenibilidad de las estrategias de los programas de control vectorial 21,22. Desde la introducción de los insecticidas sintéticos en los programas sanitarios de las Américas, la presión selectiva ejercida contra poblaciones de Ae. aegypti ha generado el desarrollo de resistencia a varios de ellos, además de la aparición de resistencia cruzada y múltiple con otros insecticidas, lo cual reduce el número de alternativas efectivas y adecuadas para el control del vector 16,23.
En Panamá, desde el inicio del programa de control de vectores en 1956, las poblaciones de mosquitos transmisores de agentes patógenos han estado sometidas a una continua presión selectiva de insecticidas organoclorados, carbamatos, organofosforados y piretroides 24. El Programa Nacional de Control de Aedes del Ministerio de Salud, debido al registro constante de elevados índices de infestación, casos de dengue y la circulación de sus cuatro serotipos, y la emergencia de CHIKV y ZIKV en el país, ha mantenido el uso constante de los insecticidas piretroides deltametrina y ciflutrina para tratar de controlar la transmisión de estas entidades virales.
Durante el registro del primer brote epidémico de Zika en el país, ocurrido en la comarca de Kuna Yala en el 2015, con el registro de 38 de los 39 casos (97,4 %) de la enfermedad registrados a nivel nacional, la comunidad de Ustupo reportó 29 casos de Zika, el 74,4 % de los registrados a nivel nacional 25. En consideración a esta situación, el Gobierno Nacional declaró una “alerta sanitaria en todo el territorio nacional” y se declaró el territorio de la comarca Kuna Yala como “zona epidémica” sujeta a control sanitario, ante el riesgo de propagación de la enfermedad por tratarse de un evento de salud pública de importancia nacional e internacional 26.
La principal acción antivectorial que se llevó a cabo fue la aplicación de los insecticidas deltametrina y ciflutrina con equipo de nebulización térmica de volumen ultrabajo en áreas peridomésticas o perifocales de las casas donde se sospechaba o se habían reportado infecciones humanas. También, se realizaron intervenciones de control físico para reducir las fuentes de transmisión que consistieron en la eliminación de criaderos activos y potenciales con participación comunitaria, y en la ejecución de actividades educativas. El control químico larvario se realizó mediante la aplicación de diflubenzurón y temefós en depósitos de agua de uso doméstico 25.
El Programa Nacional de Control de Aedes ha manifestado la necesidad de determinar el estado actual de la sensibilidad y la eficacia biológica de los insecticidas aplicados contra las poblaciones de Aedes en las distintas regiones endémicas del país. Lo anterior con el propósito de generar nuevas estrategias para evitar o retrasar el desarrollo de la resistencia en las poblaciones de Aedes.
El objetivo de este estudio fue evaluar la eficacia biológica y la sensibilidad de poblaciones de Ae. aegypti de la región de Ustupo a los insecticidas piretroides deltametrina y ciflutrina durante el brote de Zika en la comarca indígena de Kuna Yala.
Materiales y métodos
Descripción del área de estudio
La comarca-división política o territorio asignado a una población indígena definida dentro de Panamá-de Kuna Yala comprende alrededor de 2.341 km2 de superficie continental; está conformada por bosques tropicales intervenidos y áreas costeras de tierras bajas utilizadas por la población indígena kuna para cultivar principalmente palma de coco, plátano, banana y yuca, entre otros. Esta región cuenta con un archipiélago constituido por cerca de 365 pequeñas islas de coral, cuya ecología ha sido fuertemente modificada por acciones antropogénicas 27,28.
Kuna Yala está subdividida políticamente en cuatro corregimientos con 49 comunidades oficialmente reconocidas, la mayoría ubicadas en islas cercanas a la costa continental. En el 2015, la población de Kuna Yala estaba estimada en unos 42.395 habitantes 29. Cada comunidad está regida por autoridades tradicionales representadas por un líder político y espiritual llamado “Sahila” y por el Congreso General Kuna 30.
En general, las comunidades mantienen un saneamiento básico, pero carecen de un suministro de agua entubada las 24 horas. Debido a esto, la población tiene que almacenar agua en diferentes tipos de depósitos que se convierten en criaderos de Ae. aegypti. La temperatura promedio mensual en la región es de 26 a 27 °C, con una humedad relativa entre el 78 y el 90 % y una precipitación anual que oscila entre los 1.600 y los 3.000 mm3 (31. Esta región tiene normalmente un patrón de lluvia unimodal con una temporada seca que inicia generalmente a mediados de diciembre y va hasta abril, y una temporada lluviosa que inicia a mediados de mayo y va hasta diciembre.
Sitio seleccionado
El Programa Nacional de Control de Aedes, considerando la magnitud del problema de salud pública que representa el registro continuo de brotes de los virus dengue, Zika y chikungunya, y la reciente emergencia de Zika en la comarca de Kuna Yala, planteó la necesidad de determinar el comportamiento de la eficacia biológica de los insecticidas piretroides deltametrina y ciflutrina, utilizados en aplicaciones de volumen ultrabajo, contra poblaciones de Aedes en las principales regiones endémicas 25.
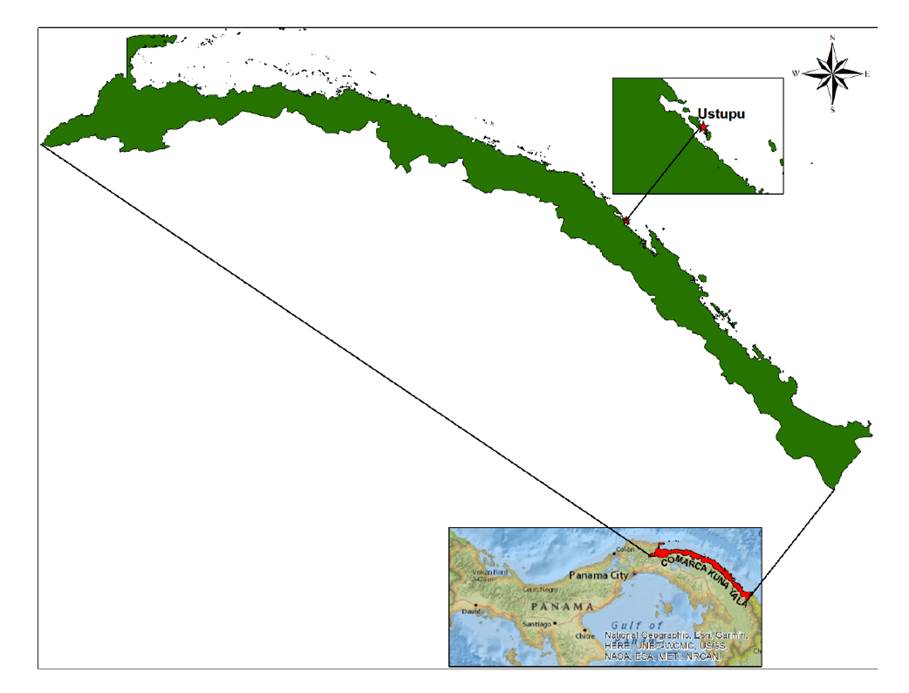
Para la evaluación de la sensibilidad y de la eficacia biológica de los insecticidas se seleccionó, en conjunto con el Ministerio de Salud de Panamá, la comunidad de Ustupo ubicada a los 9° 07’ 48.44” N y 77° 55’ 38.21” O, que cuenta con 120 viviendas y 2.300 habitantes (figura 1). Esta comunidad tiene reportes frecuentes de casos de dengue, altos índices de infestación, aplicaciones frecuentes de insecticidas y registro de la mayoría de los casos de zika en Kuna Yala 25.
Recolecta de individuos de Aedes aegypti en Ustupo
Las muestras de Ae. aegypti de Ustupo en fases inmaduras (larvas y pupas) se recolectaron en criaderos activos localizados en el domicilio y en el peridomicilio de las viviendas entre las 08:00 y las 16:00 horas con ayuda del personal técnico del Programa Nacional de Control de Aedes. Todo el material biológico recolectado se colocó en envases especiales debidamente codificados y se transportó al Departamento de Entomología Médica del Instituto Conmemorativo Gorgas de Estudios de la Salud para su identificación, a nivel de especie, mediante el uso de claves taxonómicas de larvas de mosquitos 32.
Cría y mantenimiento de cepas de mosquitos en condiciones de laboratorio
Una vez identificada la especie del material biológico recolectado en el campo, se obtuvieron los mosquitos adultos a partir de las larvas y las pupas de Ae. aegypti recolectadas en Ustupo. A estos se les denominó la generación F0. A partir de las posturas producidas de la F0 se obtuvo la primera generación (F1) de la cepa denominada “Ae. aegypti Ustupo” con la cual se levantó una colonia que fue criada y mantenida en condiciones controladas de laboratorio: con una temperatura promedio mínima de 28,5 °C (desviación estándar: DE = 0,5703) y máxima de 30,0 °C (DE = 0,0912), humedad relativa del 70 al 80% (DE = 0,3939) y con fotoperíodo de 12 horas día y 12 horas noche 33. El material biológico de la cepa Ae. aegypti Ustupo fue utilizado posteriormente para realizar los bioensayos de sensibilidad y pruebas de eficiencia biológica. Bajo las mismas condiciones se mantuvo la cepa de referencia sensible Ae. aegypti Rockefeller.
Insecticidas utilizados
Deltametrina: (s)-a-cyano-3-phenoxybenzyl cis-(IR)-3-(2,2-dibromovinyl)- 2,2-dimethyl cyclopropane carboxylate. Tiene un 96,8 % de pureza y fue suministrada por Bayer, S. A. Central América, Costa Rica, y la presentación comercial K-Othrine® CE 0,27 % w/v (Deltametrina), producto formulado en Guatemala por Bayer, S. A.
Ciflutrina: (RS;SR)-alpha-cyano-4-fluoro-3- phenoxybenzyl (1 RS,3RS;1 RS,3SR) -3-(2,2-dichlorovinyl) -2,2-dimethylcyclopropanecarboxylate del 98 % de pureza, suministrada por Bayer, S. A. Central América, Costa Rica y el formulado comercial Solfac® UBV 1,5% w/v (Cyflutria), producto formulado en Guatemala por Bayer, S. A.
Nebulización térmica con piretroides en el intradomicilio y el peridomiciiio
Como medida de control de calidad, las aplicaciones de las nebulizaciones térmicas de volumen ultrabajo de los insecticidas piretroides en el intradomicilio y en el peridomiciiio estuvieron a cargo de un mismo operario técnico del Programa Nacional de Control de Aedes de la comarca de Kuna Yala, con el fin de disminuir los sesgos inducidos por la manera de aplicar la técnica de nebulización dentro de las viviendas y fuera de ellas.
El equipo utilizado en las aplicaciones fue un nebulizador térmico portátil de volumen ultrabajo, marca Dyna-Fox Super Hawk II®, previamente calibrado de acuerdo con las normas de la OMS 34. El promedio de la temperatura y la humedad relativa durante los bioensayos fue de 27 ± 2 °C y del 70 al 80%m respectivamente. La velocidad del viento durante la aplicación fue de 5 a 8 km/h. Luego de terminar la jornada de aplicación, el equipo se recalibró para garantizar una aplicación adecuada en días subsiguientes.
Para la aplicación de la deltametrina se hizo una mezcla de un litro del formulado comercial K-Othrine CE 0,27% en cuatro litros de diésel (1:4) para una concentración final de 0,068 %. Por su parte, para la solución de ciflutrina se mezcló un litro del formulado comercial Solfac 1,5 % en 12 litros de diésel (1:12) para una concentración final de 0,125 % 35. La descarga para ambos insecticidas con el nebulizador térmico fue de 177 ml/min.
Se seleccionaron 60 viviendas para la aplicación de los insecticidas piretroides durante tres días consecutivos. La mayoría de las viviendas estaban construidas de acuerdo con el modelo de la cultura kuna (techo vegetal de hojas de palma, paredes de pequeños troncos de árboles colocados verticalmente, sin ventanas y piso de tierra) 36.
Para la selección de las casas se tuvo en consideración la accesibilidad y el permiso de los propietarios para poder ingresar y realizar los trabajos en las viviendas 37. Se seleccionaron seis sectores y diez viviendas por cada sector. Tres sectores fueron tratados con deltametrina durante tres días consecutivos y tres sectores con ciflutrina durante tres días consecutivos.
Las viviendas utilizadas como control estaban ubicadas a una distancia aproximada de 500 m de las viviendas tratadas. Las nebulizaciones térmicas de volumen ultrabajo se realizaron durante las primeras horas de la mañana (07:00 - 09:00), para evitar altas temperaturas y vientos variables, siguiendo la metodología de la OMS 34.
Antes de las aplicaciones de los insecticidas en el intradomicilio y el peridomicilio se solicitó a los dueños de las viviendas que cubrieran todos los alimentos, utensilios y agua, mantuvieran cerradas las ventanas y las puertas y, salieran de las casas por 30 minutos después de la nebulización térmica con el insecticida. El tiempo de aplicación de los insecticidas en el intradomicilio fue de cinco a diez segundos según el tamaño de la vivienda, mientras que el tiempo de aplicación promedio en el peridomicilio fue de 10 a 15 segundos, según el tamaño del peridomicilio (figura 2, imágenes A y B).
Bioensayos de sensibilidad en mosquitos adultos Aedes aegypti
Las muestras de hembras adultas de la primera generación (F1 ) de Ae. aegypti Ustupo fueron expuestas a bioensayos de sensibilidad mediante papeles impregnados con los insecticidas piretroides deltametrina (0,1 %) y ciflutrina (0,1 %), usando la dosis diagnóstica y los tiempos de exposición establecidos por las normas estandarizadas de la OMS 38,39. Se utilizaron lotes de 25 hembras de dos a cuatro días de emergidas y alimentadas con sangre de equino preservada. Los bioensayos se hicieron una hora después de alimentar a los mosquitos.
La temperatura promedio registrada durante los bioensayos fue de 27 ± 2 °C y 70 ± 80% de humedad relativa. Cada prueba con los insecticidas evaluados contó con cuatro réplicas y sus respectivos controles. El tiempo de exposición fue de 60 minutos, durante los cuales se registró el número de mosquitos caídos a los 15, 30, 45 y 60 minutos.
Después del período de exposición, los mosquitos se trasladaron a las cámaras de recuperación y se colocó algodón humedecido en solución al 10 % de sacarosa como alimento durante el período de recuperación. El porcentaje de mortalidad se registró a las 24 horas. Se utilizó como patrón estándar de sensibilidad la cepa de referencia Ae. aegypti Rockefeller.
Se define como mosquitos resistentes a los insecticidas a aquellos que sobreviven 24 horas después de finalizar el bioensayo, y mosquitos sensibles, a los que murieron durante los 60 minutos siguientes al tiempo de exposición o dentro de las 24 horas del período de recuperación.
Evaluación de la eficacia biológica de los insecticidas piretroides
En cada una de las 60 viviendas seleccionadas se realizaron aplicaciones para cada uno de los insecticidas (deltametrina y ciflutrina), durante tres días consecutivos.
En el estudio se colocaron un total de 360 jaulas codificadas, cada una con 15 hembras adultas de la cepa Ae. aegypti Ustupo (n=5.400). Se ubicaron tres jaulas en el intradomicilio y tres en el peridomicilio e igual cantidad de jaulas y mosquitos de la cepa sensible Ae. aegypti Rockefeller, colocadas a diferentes alturas (0,6 -1,2 m).
En el intradomicilio se colocó una jaula en el dormitorio, una en la sala y otra en la cocina. En el peridomicilio las tres jaulas se colocaron en los costados de las viviendas o lugares que se prestaban como sitios de reposo para los mosquitos que estuvieran a la sombra, frescos y húmedos (figura 2C y 2D).
Los mosquitos utilizados en este estudio tenían tres o cuatro días de emergidos. Las jaulas se colocaron en las viviendas 15 minutos antes de la aplicación del insecticida y las viviendas tratadas permanecieron cerradas durante 30 minutos después de la aplicación para evitar el escape de insecticida y lograr así el efecto deseado.
Posteriormente, se procedió a extraer las jaulas de las viviendas y se anotó el número de mosquitos caídos en cada una. Las jaulas con mosquitos fueron llevadas a la base y allí los mosquitos fueron trasladados a envases de reposo limpios, con algodón humedecido en solución al 10 % de sacarosa como alimento durante el período de recuperación. Los individuos se mantuvieron hasta las 24 horas en condiciones adecuadas de temperatura de 27 ± 2 °C y 70 - 80% de humedad relativa. El porcentaje de mortalidad de las muestras de Ae. Aegypti, expuestas a la aplicación de insecticidas piretroides, se registro 24 horas después.
Análisis
La nebulización térmica con equipo de volumen ultrabajo se considera eficaz cuando la mortalidad de los mosquitos expuestos y la cobertura de aplicación del insecticida de las viviendas de un área son del 80 al 100 % 40.
Las poblaciones de mosquitos se clasificaron como resistentes o sensibles considerando los resultados de los bioensayos de adultos estandarizados por la OMS. Estos indican que indican que entre el 98 y el 100% de mortalidad es senstible; entre el 90 y el 97 % de mortalidad sugiere que puede estar desarrollándose resistencia, y menos del 90 % de mortalidad, indica resistencia 38. Se tuvo en cuenta la fórmula de Abbott, para corregir la mortalidad de los mosquitos expuestos a insecticidas, cuando esta osciló entre el 5 y el 20 % 41.
Los datos de porcentaje de mortalidad de Ae. aegypti Ustupo y Ae. aegypti Rockefeller, expuestos a deltametrina y ciflutrina, fueron analizados usando un modelo lineal binomial generalizado que consideró las siguientes variables: sitio de aplicación (intradomicilio o peridomicilio), exposición al insecticida (control, ciflutrina o deltametrina) y tiempo de exposición (1 y 24 horas).
Consideraciones éticas
Antes de realizar el trabajo, se contactaron las autoridades tradicionales del Congreso Indígena de Ustupo para obtener el permiso para realizar el estudio.
Antes del inicio del trabajo de investigación se contó con el apoyo del personal técnico local de la etnia kuna, perteneciente al Programa Nacional de Control de Aedes. Ellos estaban acostumbrados a recibir a la población en sus casas durante las actividades de vigilancia y control del Aedes que se llevan a cabo entre dos y seis veces al año y fueron los encargados de dar a cada residente de las viviendas seleccionadas, una explicación completa, en su lengua, relacionada con el trabajo que se realizaría. Dicha esta explicación señalaba la relevancia y el objetivo del estudio. Sólo después de recibir el consentimiento verbal de los dueños de las viviendas se inició el estudio.
No se solicitó la aprobación del Comité de Bioética del Instituto Conmemorativo Gorgas, porque no se obtuvo ninguna información personal de los responsables de las viviendas. La aplicación de la nebulización fue realizada con la colaboración y participación del personal de control de vectores de la Región de Salud de Kuna Yala, quienes se ocupan de realizar los trabajos antivectoriales de rutina en las comunidades, siguiendo las directrices del Programa Nacional de Control de Aedes del Ministerio de Salud de Panamá.
Resultados
Bioensayos de sensibilidad con mosquitos adultos
Según los resultados obtenidos en los bioensayos de sensibilidad, la cepa Ae. aegypti Ustupo mostró una posible resistencia a la deltametrina con 95,3 % de mortalidad promedio y a la ciflutrina con 94 %. Los resultados de los bioensayos de sensibilidad se presentan en la figura 3 y en el cuadro 1.
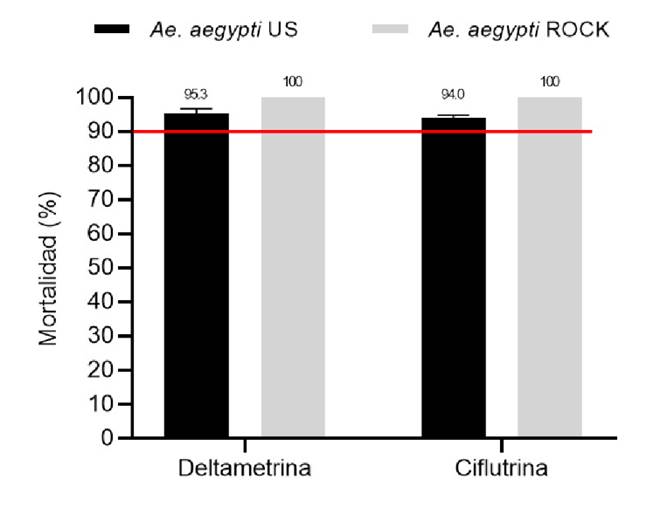
Figura 3. Porcentaje de mortalidad en bioensayos de sensibilidad con adultos de Aedes aegypti de Ustupo y de la cepa Rockefeller. La línea roja marca el umbral del 90 %, por debajo de este valor se considera que la población es resistente a los insecticidas. Los porcentajes de mortalidad están expresados como media geométrica más o menos el intervalo de confianza del 95 %.
Cuadro 1. Estado de la resistencia a insecticidas piretroides de adultos de Aedes aegypti de Ustupo, Comarca Kuna Yala, Panamá
| Insecticida | Mosquitos (n) | Efecto knock-down 1 h expuestos después de la exposición n (%) | Mortalidad 24 h después de la exposición n (%)* | Sobrevivientes 24 h después de la exposición n (%) | Estado de la sensibilidad |
|---|---|---|---|---|---|
| Deltametrina | 400 | 341 (85,3) | 381 95,3 (93,1-97,4) | 2 (0,5) | Posible resistencia |
| Ciflutrina | 400 | 329 (82,3) | 376 94,0 (91,6-96,4) | 4(1,0) | Posible resistencia |
* Los porcentajes de mortalidad están expresados como media geométrica ± el intervalo de confianza del 95 %.
Pruebas de eficacia biológica con insecticidas piretroides deltametrina y ciflutrina
Durante la evaluación de los insecticidas piretroides, aplicados mediante nebulización térmica de volumen ultrabajo, la velocidad del viento no superó los 10 km/h y su dirección fue de norte a sur; la variación de la temperatura se mantuvo entre los 25 y los 31 °C y la humedad relativa osciló entre el 70 y el 80 %.
Los resultados del experimento se reportaron en términos de porcentaje de mortalidad para la cepa Ae. aegypti Ustupo y para los controles con la cepa sensible Ae. aegypti Rockefeller. El rango del porcentaje de mortalidad registrado en las pruebas de eficacia biológica en el intradomicilio para la cepa Ae. aegypti Ustupo con deltametrina en los tres días de aplicación fue entre el 74 y el 76 % de mortalidad y para ciflutrina entre el 31 y el 39,1 % (figura 4 y cuadro 2. El rango del porcentaje de mortalidad en el peridomicilio para la Ae. aegypti Ustupo con deltametrina en los tres días de aplicación estuvo entre el 63,6 y el 63,9 % y para ciflutrina entre el 25,2 y el 27,1 %. El rango del porcentaje de mortalidad en los controles con la cepa Ae. aegypti Rockefeller estuvo entre el 99,2 y el 100 %. Estos resultados muestran una baja eficacia biológica de la ciflutrina, y más baja para la deltametrina, contra mosquitos de la cepa Ae. aegypti Ustupo en comparación con la cepa control (Rockefeller), cuando son aplicadas con nebulización térmica de volumen ultrabajo (figura 5 y cuadro 3).
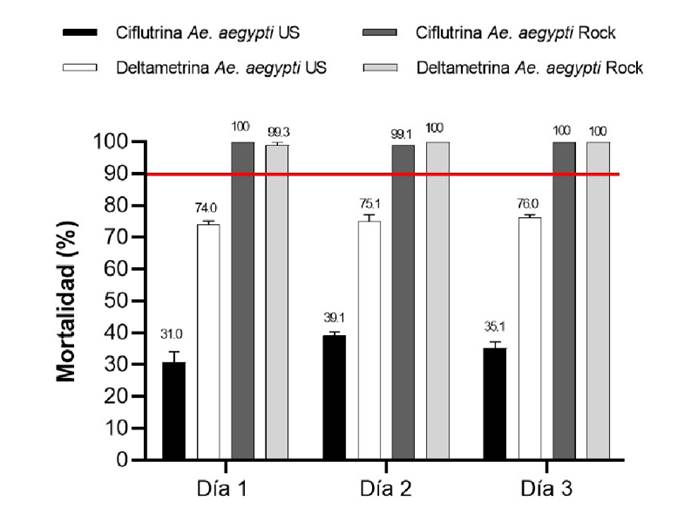
Figura 4. Porcentaje de mortalidad en el intradomicilio de Aedes aegypti de Ustupo y de la cepa Rockefeller, 24 horas después de su exposición a piretroides con nebulización térmica de volumen ultrabajo. La línea roja marca el umbral del 90 %, por debajo de este valor se considera que la población es resistente a los insecticidas. Los porcentajes de mortalidad están expresados como media geométrica más o menos el intervalo de confianza del 95 %.
Cuadro 2. Porcentaje de mortalidad registrada para Aedes aegypti en jaulas colocadas en el intradomicilio durante la nebulización con insecticidas piretroides en Ustupo, Kuna Yala, Panamá
| Insecticida | Concentración | Replica n | Jaulas n | Mosquitos expuestos n | Efecto knock Mortalidad 1 h down 1 h (%) | Mosquitos muertos 24 horas n | Mortalidad 24 horas (%) | |
|---|---|---|---|---|---|---|---|---|
| Deltametrina | 0,54% | 2 | 30 | 450 | 281 | 62,4 | 333 | 74,0 |
| 2 | 30 | 450 | 286 | 64,0 | 338 | 75,1 | ||
| 2 | 30 | 450 | 275 | 61,1 | 342 | 76,0 | ||
| Ciflutrina | 0,12% | 2 | 30 | 450 | 125 | 27,8 | 139 | 31,0 |
| 2 | 30 | 450 | 131 | 29,1 | 176 | 39,1 | ||
| 2 | 30 | 450 | 128 | 28,4 | 158 | 35,1 | ||
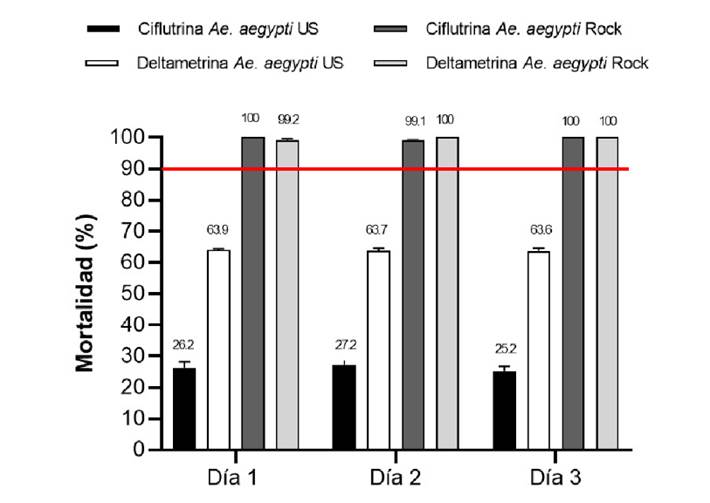
Figura 5. Porcentaje de mortalidad en el peridomicilio de Aedes aegypti de Ustupo y de la cepa Rockefeller, 24 horas después de su exposición a piretroides con nebulización térmica de volumen ultrabajo. La línea roja muestra el umbral del 90 %, por debajo de este valor se considera que la población es resistente a los insecticidas. Los porcentajes de mortalidad están expresados como media geométrica más o menos el intervalo de confianza del 95 %.
Cuadro 3 Porcentaje de mortalidad registrada de Aedes aegypti en jaulas colocadas en el peridomicilio durante la nebulización con insecticidas piretroides en Ustupo, Kuna Yala, Panamá
| Insecticida | Concentración | Replica n | Jaulas n | Mosquitos expuestos n | Efecto knock Mortalidad 1 h down 1 h (%) | Mosquitos muertos 24 horas n | Mortalidad 24 horas (%) | |
|---|---|---|---|---|---|---|---|---|
| Deltametrina | 0,54% | 2 | 30 | 449 | 256 | 57,0 | 286 | 63,7 |
| 2 | 30 | 449 | 261 | 58,1 | 287 | 63,9 | ||
| 2 | 30 | 448 | 253 | 56,4 | 285 | 63,6 | ||
| Ciflutrina | 0,12% | 2 | 30 | 450 | 103 | 23,0 | 118 | 26,2 |
| 2 | 30 | 449 | 99 | 22,0 | 122 | 27,2 | ||
| 2 | 30 | 449 | 105 | 23,4 | 113 | 25,2 | ||
El cuadro 4 muestra el cociente de probabilidades de mortalidad de los mosquitos después de la exposición a ciflutrina y deltametrina. Con este modelo, se ajustaron los datos (DE = 42,636; gl = 43, p = 0,487). El nivel de referencia es el control de mosquitos Rockefeller en el ambiente domiciliario, una hora después de la exposición al insecticida. Los mosquitos en el peridomicilio tenían 32 % menos de probabilidades de morir que los que estaban dentro de los domicilios. Mientras tanto, la mortalidad de los mosquitos aumentó en casi 21 y 102 veces, cuando se expusieron a ciflutrina y deltametrina respectivamente. Independientemente del insecticida y el lugar de aplicación, 24 horas después de la aplicación del insecticida, los mosquitos tenían casi 14 veces más probabilidades morir.
Cuadro 4. Proporción de las probabilidades de mortalidad de individuos Aedes aegypti de Ustupo, después de ser expuestos a los insecticidas piretroides ciflutrina y deltametrina
| Variable | Proporción de probabilidad | Estimación | Error estándar | Valor z Pr(>|z|) |
|---|---|---|---|---|
| Control intradomicilio 1 h | - | -6,264 | 0,166 | 37,67 < 2x10-16* |
| Peridomicilio | 0,681 | -0,384 | 0,050 | 7,62 < 2x10-14* |
| Ciflutrina | 20,640 | 3,027 | 0,161 | -18,83 <2x10-16* |
| Deltametrina | 102,427 | 4,629 | 0,161 | -28,84 <2x10-16* |
| 24 h | 13,890 | 2,631 | 0,060 | -44,07 < 2x10-16* |
* Estadísticamente significativo (P<0,005); valor z: coeficiente de regresión dividido entre el error estándar; Pr(>|z|): p valor asociado al valor z
Discusión
Bioensayos de sensibilidad
La deltametrina y la ciflutrina han sido utilizadas por el Programa Nacional de Control de Aedes desde 1996 contra las poblaciones de Ae. aegypti mediante aplicaciones de volumen ultrabajo con equipo pesado, portátil en frío y térmico. A pesar del uso de estos insecticidas desde hace 25 años, son pocos los trabajos que se han hecho para determinar la eficacia biológica y la sensibilidad de estos insecticidas piretroides en las poblaciones de Aedes de Panamá.
En la actualidad, los insecticidas piretroides siguen siendo los más utilizados, por lo que la resistencia de mosquitos vectores de arbovirus, altamente competentes como Ae. aegypti, está muy extendida 42. También se ha confirmado la resistencia de Ae. albopictus a estos compuestos 43.
Hasta 1962 se había logrado en las Américas, por medio del programa de erradicación, una efectiva lucha contra las poblaciones de Ae. aegypti, mediante la aplicación de dicloro-difenil-tricloroetano (DDT) 44. Sin embargo, el fracaso de las medidas implementadas y su seguimiento contribuyó a la repoblación del vector y la generación de poblaciones de mosquitos resistentes 45. En un gran número de países de las Américas, se ha estudiado la resistencia de Ae. aegypti a los insecticidas comúnmente utilizados para el control vectorial 22, como parte de las estrategias para evaluar la eficacia de los programas implementados y generar estrategias adicionales de control.
Los resultados de este estudio muestran por primera vez que la cepa de Ae. aegypti Ustupo presenta una posible resistencia a los adulticidas deltametrina y ciflutrina. La posible resistencia obervada en los bioensayos estandarizados por la OMS puede deberse a las aplicaciones continuas de estos insecticidas piretroides por parte del Programa Nacional de Control de Aedes. Generalmente las aplicaciones de estos insecticidas contra Ae. aegypti se hace a nivel de perifocos, alrededor de los casos reportados, en áreas delimitadas donde se registran los brotes de las enfermedades arbovirales y en áreas con altos índices de infestación.
Es importante indicar que la cobertura de aplicación de insecticidas no se realiza a gran escala y esto hace que las poblaciones de mosquitos de Ae. aegypti no estén expuestas continuamente a los insecticidas aplicados. Es posible que, por esta razón, la cepa Ae. aegypti Ustupo no presente una resistencia confirmada o establecida. La comunidad de Ustupo está ubicada en una isla, regiones que se consideran menos expuestas al uso excesivo de insecticidas o agroquímicos 46.
En consideración a lo observado en las pruebas biológicas de campo, que registraron poca eficacia biológica de los insecticidas deltametrina y ciflutrina, versus los bioensayos de sensibilidad que registraron una posible resistencia, cabe mencionar que la posible resistencia encontrada para deltrametrina y ciflutrina registró porcentajes de mortalidad (95,3 y 94 %, respectivamente) que pueden considerarse eficaces para el control de las poblaciones de Aedes spp. Sin embargo, debe mantenerse una vigilancia del comportamiento de dicha resistencia para que no se intensifique.
También debe considerarse que las diferencias observadas pueden deberse a las bajas concentraciones utilizadas de deltametrina (0,068 %) y ciflutrina de (0,167 %) para las nebulizaciones térmicas de volumen ultrabajo y, por ello, no se obtuvieron porcentajes de mortalidad más altos en las poblaciones de Ae. aegypti evaluadas.
Las concentraciones operativas probadas tienen más de 25 años de uso y no han sido evaluadas en el transcurso del tiempo. Por esta razón, el control de calidad de las aplicaciones de volumen ultrabajo y las pruebas de resistencia a los insecticidas deben ser un componente integrado a los programas nacionales de control de vectores 47.
Por otra parte, con este estudio se ha podido establecer que las poblaciones de Ae. aegypti de las zonas urbanas y semiurbanas muestran una resistencia, moderada a muy alta, a los insecticidas piretroides permetrina y deltametrina, y con una prevalencia mucho menor, también se ha detectado resistencia en sitios rurales 48.
La comarca de Kuna Yala es una de las principales regiones endémicas de malaria en el país, incluyendo Ustupo. El Programa Nacional de Malaria utiliza como una de las intervenciones, durante el registro de casos o brotes, las aplicaciones de deltametrina o ciflutrina con equipo termonebulizador de volumen ultrabajo, portátil, igual a las realizadas por el Programa Nacional de Control de Aedes, de manera que etas continuas aplicaciones pueden llegar a ejercer una presión selectiva contra las poblaciones de Ae. aegypti.
Varios trabajos indican que el uso intensivo de insecticidas es una fuerte presión de selección para los mosquitos y puede favorecer el aumento de las frecuencias alélicas asociadas con resistencia en poblaciones naturales. La resistencia ofrece una gran ventaja selectiva en entornos bajo presión de selección de insecticidas y, como consecuencia, los alelos resistentes a los insecticidas generalmente aumentan su frecuencia muy rápidamente en poblaciones de mosquitos naturales expuestas a aplicación intensa de insecticidas 49,50. En otro estudio se reportó que las nebulizaciones realizadas por los programas de malaria también pudieron haber afectado el estado de la resistencia de Ae. aegypti a insecticidas piretroides en las tres localidades estudiadas y que el uso de insecticidas domésticos también puede constituir una fuente importante de selección 51,52.
Es importante considerar los antecedentes genéticos de Ae. aegypti de diferentes lugares ya que podrían presentar distintos perfiles y mecanismos de resistencia a los insecticidas, según la región geográfica. Esta posible multiplicidad de situaciones justifica la importancia de monitorear la dinámica de resistencia a insecticidas de las poblaciones naturales de vectores, ya sea que estén expuestas a la presión de un determinado insecticida o para su intervención en el campo 53.
Considerando los resultados obtenidos en este estudio, es muy importante que el Programa Nacional de Control de Aedes desarrolle un programa que regularmente haga evaluaciones de la sensibilidad y la eficacia biológica de los insecticidas aplicados con nebulizaciones de volumen ultrabajo, pero en condiciones de campo para determinar el estado de la resistencia de las poblaciones de Ae. aegypti. Estos trabajos son de crítica importancia para los programas de control de vectores.
El conocimiento del nivel de sensibilidad y la eficacia biológica de los insecticidas aplicados en las intervenciones antivectoriales es esencial, especialmente en aquellas que buscan una reducción rápida de las densidades de las poblaciones de Ae. aegypti y la intensidad o el riesgo de transmisión de virus como CHIKV, DENV y ZIKV durante brotes epidémicos. Uno de los grandes problemas que limita la vigilancia y el control eficaz y efectivo de las poblaciones de Ae. aegypti, y en consecuencia la transmisión de las arbovirosis, es la pérdida de la capacidad de respuesta para prevenir y controlar estas enfermedades por parte de los programas sanitarios nacionales, lo cual constituye otro determinante de la expansión de esta enfermedad 54-56. Basado en estos hechos, en general los programas sanitarios y los sistemas de vigilancia son reactivos al reporte de actividades relacionadas con enfermedades como el dengue, por ende, el control es tardío y muy poco efectivo 57.
Eficacia biológica de los insecticidas piretroides contra Aedes aegypti
Los estudios sobre la eficacia biológica de las aplicaciones de insecticidas con nebulizadores de volumen ultrabajo varían sustancialmente 58,59, ya que hay múltiples factores involucrados. Por ejemplo, cuando se aplican insecticidas con el equipo montado en un vehículo, la disponibilidad, las condiciones de las calles, la presencia y la altura de las paredes o muros, la ubicación de las casas dentro de los lotes y la presencia y el estado de las puertas y ventanas (abiertas o cerradas), todos influyen en la eficacia. Cuando se utiliza un equipo manual o portátil para este tipo de nebulizaciones, la eficacia puede variar en función del tiempo de aplicación en una casa, la minuciosidad de la aplicación y la presencia de sitios de reposo del mosquito inaplicables. Se sabe que Ae. aegypti reposa en lugares apartados e inalcanzables, como dentro de los armarios y debajo de las camas 60,61. Los factores relacionados con los insecticidas (tipo, dosis, tamaño de las gotas) y los factores ambientales (temperatura, dirección y velocidad del viento) también influyen en la eficacia de las aplicaciones 58,61.
Ustupo es una pequeña isla donde no existe ningún tipo de vehículo al igual que en todas las islas de la comarca de Kuna Yala. Tiene una sola calle principal y numerosas veredas, situación que hace imposible utilizar equipo pesado para la aplicación de nebulizaciones de volumen ultrabajo y en frío. Lo anterior, considerando que este tipo de aplicación no logra realizar una cobertura completa en sitios donde las calles son muy estrechas o no existen.
En los estudios realizados con equipo pesado de volumen ultrabajo se menciona que la nube del insecticida no logra penetrar en los sitios que sirven de refugios a Ae. aegypti, particularmente en zonas urbanas, donde los muros, edificios y otras estructuras obstruyen la deriva de las partículas de insecticidas. Asimismo, la nube de insecticida no logra penetrar eficazmente dentro de las viviendas y sitios que sirven de refugios para el Ae. aegypti en el peridomicilio 61.
Las aplicaciones de insecticidas a volumen ultrabajo con equipos portátiles, en frío o térmicas, son consideradas mucho más eficaces que las del equipo pesado, debido a que el personal técnico puede entrar a las viviendas y aplicar la nube de insecticidas, de forma más directa, en el interior de las viviendas y en diferentes sitios del peridomicilio que sirven de refugio a los mosquitos.
Este estudio presenta por primera vez evidencia de la baja eficacia biológica registrada de los insecticidas deltametrina y ciflutrina en Ae. aegypti Ustupo. Esta puede estar asociada a la limitada efectividad de las aplicaciones de piretroides con equipos de nebulizaciones de volumen ultrabajo y su capacidad para disminuir o controlar las poblaciones de mosquitos como medida para reducir la transmisión de los arbovirus. Los bioensayos con las jaulas de exposición demostraron que las dosis operativas utilizadas con el equipo de nebulización portátil, para deltametrina y ciflutrina, no lograron un porcentaje de mortalidad efectivo contra las muestras de Ae. aegypti Ustupo mientras que la totalidad de mosquitos de Ae. aegypti Rockefeller mueriron bajo las mismas condiciones experimentales.
Como se ya mencionó, estas dosis operativas para deltametrina y ciflutrina han sido utilizadas por 25 años y no se han evaluado periódicamente para determinar su eficacia biológica por parte del Programa Nacional de Control de Aedes, lo que puede constituir una falla en el control de las poblaciones de Aedes. La falta de efectividad de la deltametrina y la ciflutrina fue confirmada por los datos obtenidos a partir del análisis de las jaulas de exposición colocadas en el intradomicilio y en el peridomicilio. En estos bioensayos se obtuvo que, después de tres rondas diferentes de aplicación de los insecticidas piretroides, en días diferentes, no se tuvo un efecto acentuado en el número de hembras muertas de Ae. aegypti.
Teniendo en cuenta la mortalidad por encima del 90 % de los bioensayos de sensibilidad, que indicaba una posible resistencia a los insecticidas piretroides evaluados, y la baja eficacia biológica de las dosis operativas probadas, podemos asumir que el porcentaje de mortalidad registrado en los bioensayos de sensibilidad puede resultar eficaz para disminuir y controlar hasta cierto nivel las poblaciones de Ae. aegypti. No obstante, es necesario mantener una vigilancia estrecha del comportamiento de la resistencia para prevenir que se intensifique.
Además, se requiere que el Programa Nacional de Control de Aedes evalúe aplicar nuevas dosis o diferentes concentraciones operativas para ambos insecticidas, que puedan aplicarse en nebulizaciones de volumen ultrabajo, y que resulten más eficaces y efectivas para controlar las poblaciones de Aedes. Esto permitiría, al mismo tiempo, mantener una vigilancia y monitoreo de la eficacia biológica de las nuevas dosis operativas mediante investigaciones técnicas.
Por otra parte, la mortalidad total de las hembras de Ae. aegypti Rockefeller mantenidas en las jaulas de exposición, colocadas en el intradomicilio y el peridomicilio, demuestra que el insecticida pudo penetrar en los diferentes sitios de las casas. Sin embargo, estos resultados deben tomarse con precaución ya que, en condiciones naturales, parte de la población de mosquitos reposa en lugares confinados y protegidos (por ejemplo, debajo de las camas y muebles, dentro de armarios) donde es posible que el insecticida no siempre entre en contacto con los mosquitos.
A pesar de que la deltametrina registró una mayor eficacia biológica en comparación con la ciflutrina, este porcentaje de mortalidad puede considerarse bajo para lograr un impacto en la reducción de las poblaciones de Ae. aegypti. Se puede considerar entre un 80 y un 90 % de mortalidad como un porcentaje capaz de causar un impacto para lograr disminuir significativamente las poblaciones de mosquitos y prevenir la transmisión de los ZIKV, CHIKV y DENV. Esto debe ir acompañado por una buena cobertura espacial y frecuencia de aplicación.
Aedes aegypti es una especie endofílica que pasa gran parte de su tiempo en sitios protegidos, en el interior de las viviendas como, por ejemplo, entre la ropa en los armarios. En un estudio realizado en México se encontró que la mayoría (99 %) de las hembras de Ae. aegypti reposaban en dormitorios, salas, baños y cocinas, donde los individuos predominantemente (82 %) descansan a menos de 1,5 m del piso, y no necesariamente en las paredes, por lo cual el rociado residual intradomiciliario no es una opción adecuada para su control 62,63. Por el contrario, Ae. albopictus muestra una preferencia por sitios extradomiciarios 64.
En experimentos a pequeña escala, cuidadosamente controlados, se realizaron nebulizaciones de volumen ultrabajo con el equipo portátil en espacios interiores. Como resultado se obtuvo que a menudo las poblaciones de adultos de Ae. aegypti disminuían en más del 80 %. Las aplicaciones de aerosoles espaciales en interiores logran altos niveles de mortalidad de adultos a pesar del comportamiento de reposo de Ae. aegypti65,66. Sin embargo, las densidades poblacionales se recuperaban rápidamente 60 debido a la aparición de hembras nulíparas que migran desde el hábitat fuera de las áreas nebulizadas y hembras que sobrevivieron en casas donde se nebulizó con insecticidas 67.
En un trabajo similar con Ae. aegypti en Venezuela, la mortalidad fue superior al 90 % en mosquitos que estaban en jaula en sitios abiertos, pero fue cerca de cero en sitios del intradomicilio donde los mosquitos están frecuentemente en reposo 68. Por su parte, Andis et al. registraron una mortalidad del 90 % de mosquitos expuestos en jaulas y entre el 34 y el 67 % en mosquitos que se encontraban reposando sobre la vegetación 69.
El reporte de Bonds indica que hay una probabilidad 100 veces mayor de que una gotita aplicada con un equipo térmico portátil para aplicación de volumen ultrabajo entre en contacto con un mosquito colocado en una jaula versus una aplicación del mismo tipo, pero con equipo pesado. Esto se debe a que el personal técnico de vectores puede entrar a las viviendas con el equipo portátil y hacer la aplicación del insecticida en los diferentes sitios del intradomicilio y el peridomicilio, mientas que el equipo pesado, montado en un vehículo, realiza la aplicación del insecticida desde la calle y no penetra con gran efectividad en el intradomicilio 70.
En muchos países, la aplicación de insecticidas con equipo de nebulización de volumen ultrabajo, pesado y portátil, se considera el método primario de elección durante las emergencias de salud pública 71. La estrategia principal para el control del dengue consiste en controlar las poblaciones de los vectores mediante la nebulización con insecticidas como una intervención reactiva a la transmisión local en curso. Sin embargo, esta práctica rara vez se ha evaluado en términos de su impacto en la transmisión de dengue en situaciones de la vida real 62,72. Dicha evaluación se dificulta por las interacciones intrínsecamente complejas entre las poblaciones de mosquitos, la transmisión viral, la absorción de insecticidas en espacios estructurados y las condiciones ambientales variables en el tiempo 70.
En una revisión sobre la efectividad del control de vectores para el dengue 73, se concluyó que, aunque la nebulización espacial de volumen ultrabajo es la respuesta de salud pública estándar a un brote de dengue en todo el mundo, y que la OMS 74 recomienda para este fin, existe poca evidencia disponible que evalúe este método. En otro trabajo realizado, se indica que los ensayos de campo con aplicaciones de volumen ultrabajo no han demostrado un impacto significativo contra poblaciones de Ae. aegypti en ambientes urbanos y que no hay evidencia del impacto favorable de estas aplicaciones sobre la disminución de la transmisión viral 68.
Además, incluso si la aplicación de insecticidas con nebulizaciones de volumen ultrabajo lograra una reducción importante en las poblaciones de mosquitos, el efecto sería probablemente transitorio en la reducción de la transmisión viral por la recuperación rápida de las poblaciones 72.
Con el análisis realizado mediante el uso del modelo lineal binomial generalizado, se pudo confirmar que la cepa Ae. aegypti Ustupo fue significativamente más sensible a la interacción de la deltametrina aplicada en el intradomicilio que con la ciflutrina. Estudios que utilizaron este mismo método de análisis señalaron que cuando se monitorea la aparición de resistencia en una población, es importante mantener las variables constantes para hacer comparaciones sólidas entre las réplicas de la prueba e identificar cambios reales en los resultados a lo largo del tiempo 75,76. En un estudio previo con Ae. aegypti, en el que se realizó la prueba estándar de senesibilidad de la OMS, las hembras de mosquitos de diez días de emergidas fueron significativamente más sensibles a la deltametrina que las de tres a cinco días 77.
Reportes previos registraron que las densidades de Ae. aegypti disminuyen significativamente después del primer ciclo de rociado y luego fluctúan a niveles relativamente bajos durante los ciclos de rociado restantes. En tres intervenciones realizadas, las poblaciones adultas se recuperaron parcialmente dentro de las dos semanas posteriores al cese del rociado 78,79. Estudios realizados en Honduras y Costa Rica demostraron una reducción, aproximadamente, del 90 % de mosquitos adultos en la primera semana después de la nebulización, pero el efecto de la aplicación no fue significativo después de la semana seis a siete 80,81.
Un aspecto técnico para destacar es que, por lo general, en los sitios donde se hacen aplicaciones de insecticidas con equipo de nebulización de volumen ultrabajo, se desconoce o no se tienen datos sobre los niveles de resistencia a los insecticidas aplicados en la zona 82. Dado el fuerte efecto negativo que la resistencia a los insecticidas puede tener sobre la eficacia de las intervenciones 83, es crucial que las nebulizaciones de volumen ultrabajo y cualquier otra intervención con insecticidas se implementen dentro de un plan de manejo de la resistencia a estos insecticidas. La aplicación de emergencia exitosa durante los brotes requeriría mecanismos para la adquisición de insecticidas que sean rápidos y basados en el perfil de resistencia de las poblaciones locales de Ae. aegypti.
Con base en los resultados de este estudio, se puede concluir que el estado de la resistencia en las distintas regiones de importancia epidemiológica y entomológica representa un desafío que debe enfrentar el Programa Nacional de Control de Aedes para mantener el control de las poblaciones de Ae. aegypti con los insecticidas regularmente utilizados. Es necesario que el Programa Nacional de Control de Aedes establezca unos lineamientos de vigilancia y manejo de la resistencia para evaluar su distribución e intensidad. Esto con el propósito de garantizar la sostenibilidad de las intervenciones antivectoriales contra las poblaciones de Ae. aegypti.