La debilidad adquirida en la unidad de cuidados intensivos es un síndrome de debilidad muscular simétrica que afecta comúnmente a pacientes que han sobrevivido a enfermedades críticas. Se estima que su prevalencia oscila entre el 26 y el 65 % en pacientes que han recibido ventilación mecánica invasiva por un período mayor a cuatro días 1,2. La presencia de este tipo de debilidad está asociada con mal pronóstico durante la hospitalización y después del alta, aumento en la duración de la respiración mecánica asistida, mayor mortalidad hospitalaria, deterioro cognitivo a corto y mediano plazo, necesidad de institucionalización después del alta y disminución de la calidad de vida hasta dos años después de haber sufrido un síndrome de dificultad respiratoria aguda 3,4. Los factores de riesgo identificados para la debilidad adquirida en la unidad de cuidados intensivos incluyen edad avanzada, inmovilidad, sedación, falla orgánica múltiple, hiperglucemia y ventilación mecánica invasiva 1,5,6.
La Society of Critical Care Medicine (SCCM) ha recomendado la aplicación de un paquete de medidas llamado The ICU Liberation ABDCE Bundle. Este paquete consiste en intervenciones basadas en la evidencia para reducir la mortalidad a corto y largo plazo, disminuir la ventilación mecánica invasiva prolongada, mejorar la pérdida funcional y aminorar la necesidad de institucionalización 7. A pesar de su eficacia demostrada, su implementación a gran escala sigue siendo limitada 8.
Por lo tanto, en este estudio se propone la implementación de un modelo de atención multicomponente y protocolizado basado en el ABCDEF Bundle de la SCCA, que incluya la movilidad activa temprana, el uso limitado de sedantes, adecuada analgesia, medidas no farmacológicas para prevenir el delirium, estimulación cognitiva y compromiso-empoderamiento de los familiares. Con esta propuesta probablemente se pueda lograr un impacto positivo en la disminución de la incidencia de debilidad adquirida en las unidades de cuidados intensivos al egreso de esta.
Materiales y métodos
Se trata de un ensayo clínico no aleatorizado, comparativo de dos modelos de atención detallados en el anexo 1. Se llevó a cabo en dos unidades mixtas de cuidados intensivos de un hospital académico de tercer nivel con 476 camas de hospitalización y tres unidades de cuidados intensivos, dos de 14 camas y una de 12 camas.
La duración del estudio fue desde el 1 ° de diciembre del 2018 hasta el 31 de mayo del 2019, con seguimiento hasta el egreso del hospital. Las fisioterapeutas y el personal de enfermería no cambiaron de unidad durante el periodo de estudio. No fue posible limitar la movilidad de los médicos entre las dos unidades de cuidados intensivos del ensayo.
La intervención consistió en la aplicación de un modelo multicomponente y protocolizado durante la estancia en la unidad y consistió en rondas diarias de lunes a viernes por un grupo multiprofesional (médico intensivista no tratante, intensivista tratante, fisiatra, fisioterapeuta, terapeuta respiratorio, químico farmacéutico y enfermería), donde se verificaba:
control adecuado del dolor;
pacientes despiertos con RASS de 0 a -1 (9) y evasión del midazolam en infusión continua;
medidas no farmacológicas para prevenir el delirium (estimulación cognitiva, orientación espacio-temporal por parte del personal tratante y la familia);
iniciación de la movilidad activa temprana en las primeras 48 horas del ingreso del paciente a la unidad de cuidados intensivos y su aplicación guiada por un protocolo (la fisioterapeuta estaba a cargo de 12 pacientes), y
participación de los familiares en el cuidado del paciente con acompañamiento las 24 horas del día.
El control del estudio fue el manejo estándar que se estaba aplicando en todas las unidades de cuidados intensivos antes de julio de 2018 y consistió en:
Evaluación, prevención y tratamiento del dolor, por medio de la aplicación de una escala de dolor y un protocolo de manejo adoptado por el hospital tiempo atrás.
Sedación a los pacientes con ventilación mecánica invasiva con midazolam en infusión continua. El nivel de sedación, cuantificado por la escala RASS, era decidido por el intensivista tratante.
Tamización de delirium con la aplicación de las escalas UCI-CAM (durante la respiración mecánica asistida) o CAM-S (posterior al retiro de la respiración mecánica asistida) por parte de enfermería, lo cual fue implementado años atrás. La confirmación del diagnóstico de delirium fue realizado por psiquiatría y se manejó con medicamentos antipsicóticos.
La fisioterapia o movilidad se iniciaba cuando el intensivista tratante decidiera. El tipo de ejercicio y movilización eran definidos por la fisioterapeuta sin seguir ningún protocolo. La fisioterapeuta estaba a cargo de dos UCI (28 pacientes);
Los familiares de los pacientes no se comprometían con el cuidado del paciente y podían permanecer 16 horas acompañándolo.
La población incluyó pacientes consecutivos, mayores de 14 años, hospitalizados en las unidades de cuidados intensivos con ventilación mecánica invasiva por más de 48 horas. Se excluyeron pacientes con dificultad para comunicarse, secuelas neurológicas graves, demencia previa y aquellos que egresaron en las primeras 48 horas o se esperaba su fallecimiento en las próximas 24 horas.
La investigación fue aprobada por el comité de ética del hospital. La recolección de los datos se llevó a cabo en un formulario diseñado previamente. La implementación del modelo multicomponente y protocolizado en la unidad de cuidados intensivos del grupo de intervención fue liderada por un equipo multiprofesional y comenzó con la educación del personal en los cinco meses previos.
Variables: se registraron variables demográficas como la edad y el sexo, así como el puntaje APACHE II y el índice de comorbilidades de Charlson. Se registró el diagnóstico de ingreso y se llevó a cabo un tamizaje del delirium en la unidad de cuidados intensivos usando las escalas ICU-CAM en pacientes con ventilación mecánica invasiva y CAM-S en pacientes sin ventilación mecánica invasiva 10,11. Además, se midió la fuerza muscular con la escala del Medical Research Council (MRC-SS) 12 al egreso de la unidad de cuidados intensivos y se registró diariamente el grado de movilidad con la escala IMS 13, donde los valores más altos indican una mayor movilidad.
Para estandarizar la medición con la escala de movilidad en unidad de cuidados intensivos (IMS) y MRC-SS, las fisioterapeutas encargadas de realizarlas y registrarlas recibieron una capacitación por parte del fisiatra. Como desenlace primario se consideró la reducción de la incidencia de debilidad adquirida en la unidad de cuidados intensivos al momento del egreso, que se determinó mediante la escala de fuerza muscular MRC-SS con un valor menor de 48 (en una escala que va desde 0 a 60) 12.
Los desenlaces secundarios incluyen: el nivel de movilidad al egreso de la unidad de cuidados intensivos según la IMS (valores de 0 a 10), el valor de fuerza muscular al egreso de la unidad de cuidados intensivos medido por la MRC-SS, la frecuencia y los días de delirium durante la hospitalización en la unidad de cuidados intensivos, los días transcurridos desde el ingreso a UCI hasta la primera sesión de fisioterapia, la frecuencia de sesiones de fisioterapia y terapia ocupacional por paciente en la unidad de cuidados intensivos, eventos adversos graves durante la movilización en la unidad de cuidados intensivos y mortalidad hospitalaria.
Análisis estadístico
Se usó estadística descriptiva para las variables cuantitativas y estadística de resumen con medidas de tendencia central y de dispersión, de acuerdo con la distribución de las variables. Para las distribuciones no paramétricas, las variables se expresaron en medianas y rangos intercuartílicos, y para la comparación entre grupos se utilizó la prueba de rangos de Wilcoxon. Cuando la distribución fue normal, se reportaron las medias y las desviaciones estándar, y la comparación entre grupos se hizo con la prueba t de Student.
La prueba de normalidad para las variables numéricas fue la de Shapiro-Wilk. Para las variables cualitativas se aplicaron estadísticas de resumen como frecuencias relativas y la comparación entre grupos se realizó con prueba de ji al cuadrado o test exacto de Fisher, según la naturaleza de la variable y su distribución.
Se hizo análisis multivariado, tipo regresión lineal múltiple y logística, donde la variable dependiente fue, en el primer caso, el valor numérico de las escalas de fuerza muscular y, en el segundo, la variable de fuerza muscular categorizada como la presencia de debilidad muscular adquirida en unidad de cuidados intensivos. La selección de las variables de ingreso a la regresión logística binaria se hizo según el estudio de asociación de análisis univariado con un valor de p menor de 0,2 y otras variables clínicas exploradas como factores de riesgo, identificados en la revisión de la literatura. En el resultado de la regresión binaria se muestra la razón de probabilidades y el valor de p (significancia estadística cuando p < 0,05). Todos los análisis fueron realizados con Stata/IC 16™ (Stata Co., College Station, TX, USA).
Resultados
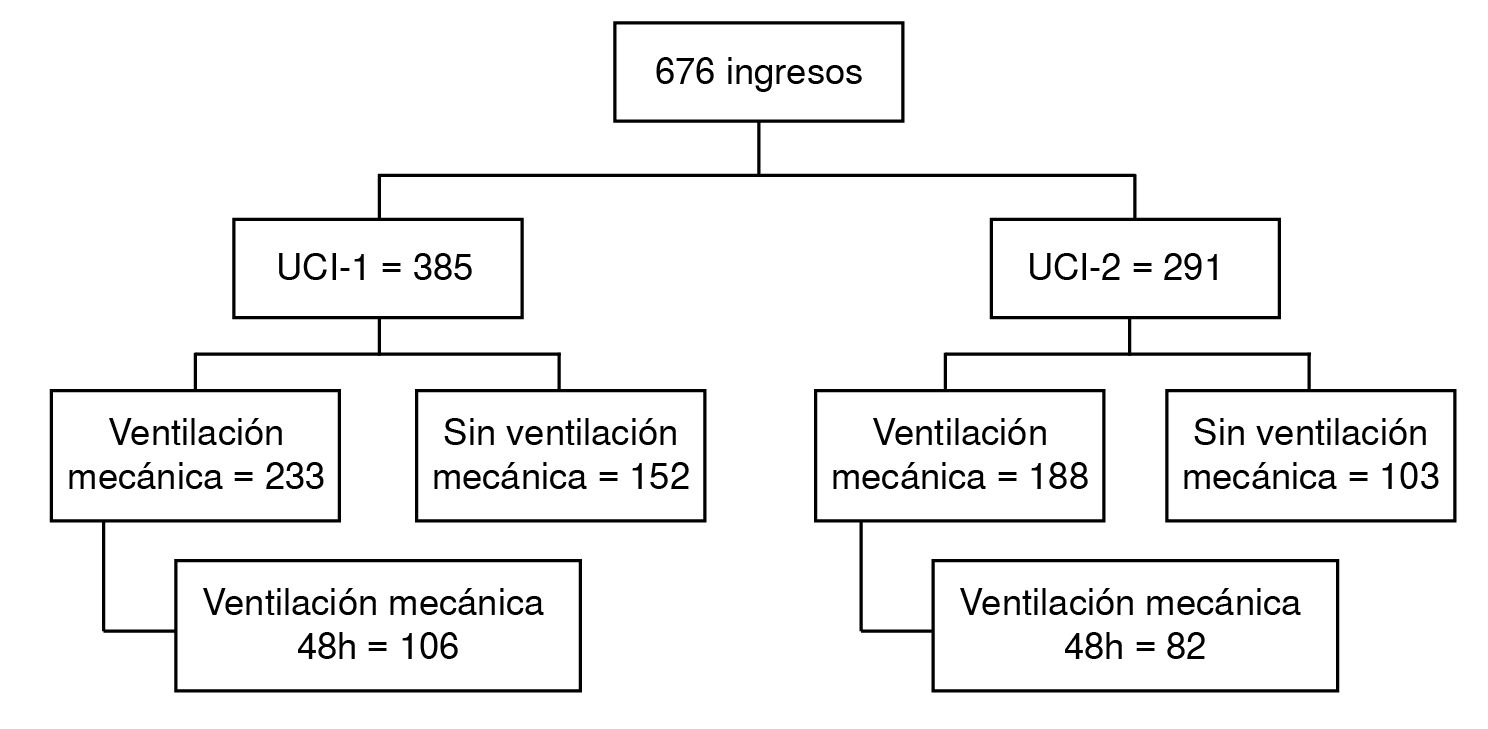
Durante el estudio, 676 pacientes fueron ingresados a las dos unidades de cuidados intensivos. De ellos, 188 tuvieron ventilación mecánica invasiva durante 48 horas o más (figura 1). En el cuadro 1 se presentan las variables demográficas y clínicas de los pacientes.
Cuadro 1 Datos demográficos
| Variable | Grupo control | Grupo intervención | P |
|---|---|---|---|
| (UCI-1) | (UCI-2) | ||
| n=106 | n=82 | ||
| Edad, [mediana (RIC)] | 56 (39-75) | 56 (33-66) | 0,83 |
| Sexo masculino, [n (%)] | 58 (55) | 48 (59) | 0,65 |
| APACHE II, [mediana (RIC)] | 19 (16-25) | 21 (14-26) | 0,80 |
| Escala de Charlson, [mediana (RIC)] | 2 (0-4) | 3(0-5) | 0,185 |
| Comorbilidades [n (%)] | 48 (45) | 46 (56) | 0,185 |
| Diabetes mellitus | 20 (18,7) | 12(14,6) | 0,705 |
| EPOC | 18 (16,8) | 16(19,5) | 0,705 |
| Insuficiencia cardíaca congestiva | 10 (9,4) | 6(7,3) | 0,793 |
| Falla renal crónica | 11 (10,4) | 12(14,6) | 0,381 |
| Neoplasias sólidas | 5 (4,7) | 12(14,6) | 0,022 |
| Tipo de patología | 0,369 | ||
| Médica | 70 (66) | 46 (56) | |
| Quirúrgica | 13 (12,3) | 12(14,6) | 0,664 |
| Trauma | 23 (21,7) | 24 (29,3) | |
| Causas de ingreso a la unidad de cuidados intensivos | |||
| Falla respiratoria aguda | 34 (32,1) | 29 (35,3) | |
| Alteración del estado de consciência | 28 (26,4) | 23 (28) | |
| Falla circulatoria (choque) | 14(13,2) | 8(9,8) | |
| Postoperatorio de cirugía mayor | 7 (6,7) | 8(9,8) |
RIC: rango intercuartílico; EPOC: enfermedad pulmonar obstructiva crónica
En el grupo de intervención se realizó mayor movilización temprana (97,6 % vs 55,7 %), iniciada en menos tiempo (dos días versus cuatro días); también se realizó un mayor número de sesiones por paciente (cuatro versus tres) (cuadro 2). En el 34,1 % de los casos, los pacientes del grupo de intervención realizaron ejercicios en un cicloergómetro, mientras que solo el 9,4 % de los pacientes del grupo control lo hicieron. La debilidad adquirida en unidad de cuidados intensivos al egreso de fue significativamente menor en el grupo de intervención (41 % versus 79 %), lo cual se correlaciona con una mayor fuerza muscular al egreso de la unidad de cuidados intensivos por MRC-SS (48 versus 36) y mayor movilidad al egreso de la unidad de cuidados intensivos (IMS 3,5 versus 2) (cuadro 2).
Cuadro 2 Intervenciones de movilidad y principales resultados
| Variable | Control | Intervención | P | |
|---|---|---|---|---|
| Fisioterapia, movilización temprana o ambas, [n (%)] | 59 | (55,7) | 80 (97,6) | <0,00001 |
| Días al inicio de la fisioterapia o movilidad, [mediana (RIC)] | 4 | (2-7) | 2 (1-3) | <0,00001 |
| Número de sesiones por paciente, [mediana (RIC)] | 3 | (2-6) | 4 (3-8) | 0,041 |
| Número de sesiones de terapia ocupacional, [media (DE)] | 0,2 | 0,5 | 0,059 | |
| Debilidad adquirida en UCI MRC-SS <48, [n/N (%)] | 15/19 | (79) | 19/46(41) | 0,003 |
| Fuerza muscular al egreso, (escala MRC), [mediana (RIC)] | 36 | (36-40,5) | 48 (36-48) | 0,0045 |
| Escala de movilidad al egreso: mediana (RIC) | 2 | (0-4) | 3,5 (0-5) | 0,0138 |
| Escala de movilidad ≥ 4, [n (%)] | 11 | (23) | 33 (50) | 0,082 |
RIC: rango intercuartílico; n/N: evento en el que se realizó la escala MRC-SS; UCI: unidad de cuidados intensivos; DE: desviación estándar
La mediana de días libres de respiración mecánica asistida, unidad de cuidados intensivos y hospitalización a los 28 días fue mayor en el grupo de intervención. También se observó una disminución en la mortalidad general en el grupo de intervención en comparación con el grupo control (18,2 % versus 29 %), pero estas diferencias no fueron estadísticamente significativas (cuadro 3).
Cuadro 3 Resultados secundarios
| Variable | Control | Intervención | p |
|---|---|---|---|
| Días libres de respiración mecánica asistida al día 28, [mediana (RIC)] | 15 (0-24) | 18 (0-23) | 0,496 |
| Días libres de UCI al día 28, [mediana (RIC)] | 14 (0-21) | 14,5 (0-21) | 0,97 |
| Días libres de hospitalización al día 28, [mediana (RIC)] | 0 (0-12) | 0 (0-11) | 0,462 |
| Días libres de hospitalización al día 28, [media (DE)] | 5,3 (8) | 5,9 (7,4) | 0,462 |
| Mortalidad general, [n (%)] | 29 (27,3) | 15 (18,2) | 0,167 |
RIC: rango intercuartílico; DE: desviación estándar
Durante la movilización activa en el grupo de intervención, un paciente experimentó el evento adverso de desalojo de la sonda nasogástrica. Durante los seis meses de duración del estudio, un paciente del grupo de intervención y tres pacientes del grupo control fueron diagnosticados con neumonía asociada al respirador. La incidencia de delirium fue del 14,5 % en el grupo control y del 15,8 % en grupo de intervención, con un promedio de 2 y 1,8 días de duración, respectivamente. Un paciente de cada grupo fue remitido a una institución por ventilación mecánica invasiva crónica.
En el análisis multivariado, tipo regresión logística múltiple, para la variable categorizada de debilidad muscular (menor de 40 y mayor o igual a 48) se encontró una asociación significativa entre la disminución de la debilidad adquirida en la unidad de cuidados intensivos y la movilidad activa temprana (OR = 7,00, IC 95 % = 3,6-13,7) (cuadro 4).
Cuadro 4 Análisis multivariado de la debilidad adquirida en la unidad de cuidados intensivos
| Odds ratio | Error estándar | z | p | IC95 % | ||
|---|---|---|---|---|---|---|
| Sexo | 0,75 | 0,26 | -0,82 | 0,415 | 0,38 | 1,50 |
| Edad | 1,005 | 0,011 | 0,50 | 0,62 | 0,98 | 1,02 |
| APACHE II | 1,002 | 0,019 | 0,15 | 0,87 | 0,96 | 1,041 |
| CHARLSON | 1,05 | 0,087 | 0,66 | 0,51 | 0,90 | 1,24 |
| Intervención | 7,00 | 2,40 | 5,68 | <0,0001 | 3,57 | 13,7 |
| Constante | 0,16 | 0,109 | 2,68 | 0,007 | 0,041 | 0,61 |
IC: intervalo de confianza
Regresión logística de la variable dependiente (debilidad adquirida en la unidad de cuidados intensivos definida como una escala de fuerza motora menor o igual a 48 al egreso de la unidad) y las independientes a probar: la intervención, la estilísticamente asociada -CHARLSON- y las variables clínicas de relevancia APACHE II, sexo y edad. Número de observaciones: 188. LR X2 (4 = 39,19; p=0,0000; log likelihood = -104,52; Pseudo R2: 0,157
Discusión
En este estudio, por medio de la implementación de un protocolo multicomponente, se encontraron diferencias estadísticamente significativas a favor del grupo de intervención, tanto en alcanzar una mayor cantidad de movilizaciones activas en la unidad de cuidados intensivos (97,6 % versus 55,7 %), como en la disminución de la incidencia de la debilidad adquirida en la unidad de cuidados intensivos al egreso de la unidad (41 % versus 79 %); mejor movilidad al egreso de la unidad de cuidados intensivos (IMS: 3,5 versus 2) y mayor fuerza muscular al egreso de la unidad de cuidados intensivos (MRC-SS = 48 versus 36).
Nuestro hallazgo es similar a lo reportado en la revisión sistemática y metanálisis de Wang y colaboradores 14, donde encontraron que la movilidad temprana disminuye la debilidad adquirida en la unidad de cuidados intensivos (RR = 0,49, IC 95% = 0,32-0,74, p=0,0008]) y mejora el puntaje de la MRC-SS. En otro metanálisis más reciente, al comparar movilidad temprana sistemática versus temprana estándar, no encontraron diferencias significativas tanto en la debilidad adquirida en la unidad de cuidados intensivos (RR = 0,90; IC 95% = 0,63-1,27), como en la MRC-SS (mediana = 5,8; IC 95% = -1,4-13). Igualmente, al comparar movilidad temprana sistemática versus movilidad tardía para la debilidad adquirida (RR = 0,62; IC 95% = 0,381,03) 15.
Este estudio también halló una incidencia baja en la presentación del delirium, y las diferencias entre los grupos de intervención y control fueron mínimas. Esto coincide con los resultados de la revisión sistemática y el metanálisis de Wang y colaboradores, quienes no encontraron una reducción significativa en la incidencia de delirium (RR = 0,52, IC 95% = 0,19-1,44, p=0,21) 14.
Los resultados contradictorios de los estudios de movilidad temprana 5,11,16-18 podrían ser parcialmente explicados por la falta de uniformidad en las definiciones. En la revisión sistemática realizada por Menges y colaboradores 15, la definición de movilización temprana fue cualquier terapia física u ocupacional para la activación muscular aplicada sistemáticamente dentro de los primeros siete días de ingreso a la unidad de cuidados intensivos, mientras que la utilizada en el metanálisis de Wang y colaboradores 14 fue la iniciada en un tiempo de ventilación mecánica invasiva menor de 72 horas. A diferencia de los estudios que iniciaron tardíamente (más de 48 horas con respiración mecánica asistida), la mayoría de los estudios de movilidad temprana (menos de 48 horas) han demostrado mejor pronóstico en cuanto a recuperación de la independencia funcional al egreso del hospital, menos delirium y más días libres de ventilación mecánica invasiva 19-21.
En un ensayo clínico aleatorizado reciente 22, la movilidad activa temprana no logró disminuir de manera estadísticamente significativa la mortalidad. En este estudio, la movilidad activa se realizó de manera aislada, a diferencia de lo propuesto por la SCCM en The ICU Liberation ABDCE Bundle, donde la movilidad activa temprana debe ser aplicada en conjunto con las otras medidas, ya que tiene una relación de interdependencia con la sedación, el dolor no controlado y el delirium7,8,23.
En el presente estudio, además de aplicar unos criterios de inclusión más parecidos a los estudios del metanálisis de Wang, se implementaron varias estrategias al tiempo, cinco de las seis recomendadas por la intervención multicomponente ABCDEF Bundle7. Con esta estrategia se han obtenido mejores resultados en 15.000 pacientes con la aplicación de un número mayor de componentes en resultados, como mayor supervivencia, menos días de ventilación mecánica y menos delirium y coma 7.
Las fortalezas de este estudio incluyen su diseño con controles concurrentes, la base en un modelo de atención multicomponente y la creación de un grupo multiprofesional para la implementación del protocolo que permitió una mayor coordinación y eficacia en la aplicación de este.
Como debilidades se reconocen la falta de aleatorización, su realización en un solo centro y la imposibilidad de limitar la movilidad de los médicos tratantes entre las dos unifdades de cuidados intensivos del estudio. Otra debilidad podría ser la falta de evaluación del impacto económico y la viabilidad de la implementación en otros centros. Finalmente, la ausencia de información sobre el pronóstico a largo plazo puede limitar la comprensión completa de los efectos de la intervención en el paciente y su posterior calidad de vida.
En conclusión, la implementación de un modelo de atención multicomponente protocolizada, basado en el ABCDEF Bundle y que incluyó: movilidad activa temprana, uso limitado de sedantes, analgesia adecuada, medidas no farmacológicas para prevenir el delirium, estimulación cognitiva y empoderamiento de familiares, disminuyó de manera significativa la debilidad adquirida en la unidad de cuidados intensivos al momento del egreso.
Archivos suplementarios
Anexo 1.
Protocolo de movilización temprana en pacientes de cuidados intensivos
Cuidados de enfermería en la implementación de la movilización temprana en pacientes
Verificar que los pacientes que ingresen a la unidad de cuidados intensivos tengan la interconsulta con fisioterapia.
La movilidad se debe iniciar en las primeras 48 horas de hospitalización en la unidad de cuidados intensivos, si no hay contraindicaciones. Los criterios de inclusión para el inicio de la movilización se deben verificar en compañía del médico intensivista y el grupo de fisioterapia.
Realizar seguimiento de los pacientes a los que se les aplican los ejercicios de movilización y las posibles complicaciones que puedan presentar.
Verificar en el plan de cuidados de enfermería la realización de la meta de cuidado por parte del grupo de fisioterapia.
Verificar que las recomendaciones brindadas por parte del grupo de fisioterapia sean realizadas por el grupo de enfermería y el cuidador principal.
Incentivar al cuidador principal del paciente y su familia, la participación en la realización de los ejercicios propuestos por parte del grupo de fisioterapia.
Brindar al paciente medidas de confort y control del dolor que le permitan observar el plan de ejercicios implementado por parte del grupo de fisioterapia.
Contraindicaciones de movilidad activa
Dosis significativas de vasopresores (norepinefrina mayor a 0,15 µg/ kg/minuto) para mantener la presión arterial media mayor a 60 mm Hg
Paciente con respiración mecánica asistida que requiera una fracción de oxígeno inspirado mayor a 0,6 o presión positiva al final de la espiración mayor de 10 mm Hg, o que tenga un deterioro agudo de la insuficiencia respiratoria.
Evento neurológico agudo (accidente cerebrovascular, hemorragia subaracnoidea, hemorragia intracraneal) en las primeras 24 horas del paciente. La movilidad activa se debe iniciar después de 24 horas y en caso de hemorragia subaracnoidea espontánea, 12 horas después de la exclusión.
Edema cerebral
Estatus epiléptico
Muerte cerebral
Proceso hemorrágico activo
Paciente con columna vertebral inestable o fracturas de extremidades
Paciente con un pronóstico grave de final de vida, transferido a cuidados de confort
Paciente con abdomen abierto (riesgo de dehiscencia)
Primeras 72 horas de nueva trombosis venosa profunda (solo aplicable para la rehabilitación de la extremidad afectada y para la deambulación)
Catéter arteria femoral
Lista de chequeo antes de iniciar la movilización de pacientes en la unidad de cuidados intensivos
Verificar:
Cumplimiento de criterios de inclusión
Sin contraindicaciones
Aprobación del médico tratante
Se avisó a todo el personal necesario de la hora de inicio de la movilización.
Verificar que todo esté listo antes de movilizar.
Desenredar los cables y dejarlos holgados, y retirar los que no se necesitan.
Dejar el espacio necesario por el lado de la cama por donde se sentará el paciente (lado donde tenga el catéter y preferir el siguiente orden de importancia: central, arterial y periférico).
Traer el monitor de transporte, si va a caminar fuera de la habitación o la unidad de cuidados intensivos.
Traer el maletín de transporte, si va a caminar fuera de la unidad de cuidados intensivos.
Traer silla de ruedas, si va a caminar fuera de la habitación o fuera de la unidad de cuidados intensivos.
Procedimiento antes de cada sesión de movilidad
El médico se encargará de ajustar la sedación.
El personal de enfermería debe encargarse de suministrar los medicamentos para el dolor (30 minutos antes), si el paciente lo requiere.
Se debe realizar limpieza de secreciones, ajustar los parámetros de la respiración mecánica asistida y disminuir el trabajo respiratorio 30 minutos antes de la terapia respiratoria.
Antes de la movilidad del paciente, el fisioterapeuta deberá aplicar cada día la escala de movilidad en la unidad de cuidados intensivos.
Una vez aplicada la escala de movilidad, el fisioterapeuta deberá realizar con cada paciente, según las condiciones clínicas de cada uno discutidas con el grupo de médicos y enfermeros, ejercicios de movilidad pasiva, fisioterapia asistida activa, libre, resistida o ambas de sus extremidades para mejorar la fuerza muscular y la movilidad de manera progresiva.
El fisioterapeuta deberá realizar la meta de cuidado y definir su plan de movilidad que será consignado en el plan de cuidado integral en la historia clínica.
El último día de hospitalización en la unidad de cuidados intensivos se debe realizar la evaluación de fuerza muscular con la escala MRC-SS. Esta actividad la realiza el fisioterapeuta.
Al ingreso y al egreso de la unidad de cuidados intensivos se debe aplicar la escala de funcionalidad.
Consideraciones para la fisioterapeuta con cada sesión de rehabilitación física o movilidad en la unidad de cuidados intensivos
Determinar que el nivel de actividad sea terapéutico.
Programar un tiempo para trabajar en la actividad física con el paciente, la familia del paciente, la enfermera y el terapeuta respiratorio. Determinar si la sedación debe ser suspendida.
Evaluar y controlar el dolor del paciente antes, durante y después de la movilidad.
Optimizar el trabajo de respiración y el nivel de alerta del paciente para que el tratamiento sea beneficioso.
Crear actividades que estén orientadas a los objetivos del paciente.
No demorar ni retrasar la actividad física y la rehabilitación porque el paciente debe ser extubado ese día.
No demorar ni retrasar la actividad física debido a la agitación, si la enfermera y el terapeuta pueden manejarla con seguridad. En pacientes que estén agitados o que experimenten un pensamiento desorganizado y delirio, una tarea enfocada brinda la oportunidad de reorientar la conversación.
Personal necesario para las transferencias
Transferencia de la cama a la silla sin caminar, de supino a sedente, y de sedente a bípedo, en pacientes con respiración mecánica asistida y catéter venoso central
Personal responsable: fisioterapeuta, terapeuta respiratorio, auxiliar de enfermería o enfermera jefe
Caminata dentro de la UCI
Personal responsable: fisioterapeuta, terapeuta respiratorio, auxiliar de enfermería o enfermera jefe y familiar (lleva la silla de ruedas)
Caminata fuera de la la unidad de cuidados intensivos.
Personal responsable: fisioterapeuta, terapeuta respiratorio, enfermera jefe o auxiliar de enfermería, médico y familiar
Responsabilidades de vigilancia para la movilidad
Terapeuta respiratorio en pacientes con respiración mecánica asistida: revisar vía aérea, monitor y respirador en caso de tubo orotraqueal, traqueostomía o respiración mecánica no asistida.
Enfermera jefe: catéteres vasculares centrales
Auxiliar de enfermería: catéteres venosos, periféricos, vesicales, sonda a tórax, bombas de infusión
Familiar o acompañante: silla de ruedas
Fisioterapeuta: movimientos del paciente y verificación de su estado clínico
Médico: estado clínico del paciente y verificación de todo
Pasos para la movilidad en la unidad de cuidados intensivos
Paso 1: sentar al paciente en la cama; mirar al paciente, el monitor y las líneas.
Paso 2: sentar al paciente en el borde de la cama, evaluar el dolor y la presión arterial ortostática.
Paso 3: asistir al paciente para pasar de sentado a de pie. Si no puede caminar, sentarlo en la silla.
Paso 4: la deambulación debe ser con la ayuda de un caminador y se debe mantener una silla cerca del paciente. Contar con apoyo de familiares, asistentes, voluntarios y estudiantes para empujar la silla y los atriles.
Paso 5: sentar al paciente cuando sea necesario.
Consideraciones en pacientes en aislamiento
Si el paciente está aislado por infección por SARS-CoV-2, se debe realizar movilización por parte de fisioterapia y personal de enfermería dentro de la habitación, sin acompañante, hasta que cumpla el periodo de aislamiento que son 15 días. Una vez cumplido este periodo se puede iniciar el programa de movilización establecido.
Si el paciente tiene aislamiento de contacto, puede salir de la habitación en compañía del personal que se requiera según su estado, con los elementos de protección personal evitando el contacto con superficies y, de ser así, se debe realizar limpieza de estas superficies de acuerdo con la guía de limpieza y desinfección.
Si son pacientes con aislamiento de gotas o aislamiento aéreo, se debe realizar la movilización dentro de la habitación o según la consideración del médico tratante.
Tabla anexo 1. Niveles de actividad según la condición clínica (adaptado del consenso de expertos y las recomendaciones en los criterios de seguridad para la movilización activa)
Definición de códigos de colores:
Bajo riesgo de un evento adverso. Proceder como de costumbre de acuerdo con los protocolos y procedimientos de cada UCI.
El riesgo potencial y las consecuencias de un evento adverso son más altos que el verde, pero pueden verse compensados por los beneficios de la movilización. Las precauciones o contraindicaciones deben aclararse antes de cualquier episodio de movilización. Si se moviliza, se debe considerar hacerlo de manera gradual y con cautela.
Riesgo potencial significativo o consecuencias de un evento adverso. La movilización activa no debe ocurrir a menos que esté específicamente autorizada por el médico especialista, tratante, de cuidados intensivos; en consulta con el fisioterapeuta y el personal de enfermería 8,9.