Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.10 no.2 Bogotá Dec. 2005
METABOLISMO ÁCIDO DE LAS CRASULÁCEAS
Crassulacean Acid Metabolism
THOMAS DAVID GEYDAN y LUZ MARINA MELGAREJO
Laboratorio de Fisiología Vegetal, Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia. Sede Bogotá.
Presentado abril 1 de 2005, aceptado junio 23 de 2005, correcciones octubre 10 de 2005.
RESUMEN
Se presenta una revisión del metabolismo ácido de las Crasuláceas, caracterizado por la ocurrencia, actividad y plasticidad del mecanismo desde un punto de vista fisiológico, bioquímico y molecular, enmarcado por la presencia de las denominadas cuatro fases de dicho metabolismo y su repercusión y expresión por diversas restricciones hídricas a nivel ecológico. Se presentan las principales enzimas y metabolitos básicos para el funcionamiento del metabolismo CAM, así como su modo de acción y control celular. Finalmente, se muestra que la plasticidad fenotípica en patrones de expresión CAM se encuentra mediada por condiciones ambientales y por señalizaciones moleculares.
Palabras clave: metabolismo ácido Crasuláceas, fosfoenol piruvato carboxilasa, plasticidad metabólica.
ABSTRACT
A review of Crassulacean acid metabolism is presented, characterized by showing the occurrence, activity and plasticity of these complex mechanism at the physiological, biochemical and molecular level, framed by the presence of the denominated four phases in CAM and its repercussion and expression due to different stresses in an ecological context. The basic enzymes, and metabolites necessary for the optional functioning of CAM are presented as well as their mode of action and cellular control. Finally, it is shown how environmental conditions and molecular signalling mediate the phenotypic plasticity.
Key words: Crassulasean acid metabolism CAM, phosphoenolpyruvate carboxylase, metabolic plasticity.
INTRODUCCIÓN
CAM: ORIGEN POLIFILÉTICO
El (CAM) ocurre en aproximadamente el 7% de las plantas vasculares (Cushman, 2001). Se piensa que las angiospermas terrestres CAM se diversificaron de forma polifilética a partir de ancestros C3 en algún punto durante el mioceno como una consecuencia de la disminución del CO2 atmosférico (Raven y Spicer, 1996). Existe evidencia que indica que la dirección evolutiva ha sido de intermedios C3-CAM a CAM totales (revisado por Cushman, 2001). Paralelamente, por especialización y colonización de nuevos ecosistemas progresivamente más áridos, la plasticidad fotosintética llevó a la especiación (Bastide et al., 1993; Lüttge, 2002). El metabolismo CAM se encuentra en pteridófitos, gimnospermas y angiospermas, presentándose en este último grupo tanto en dicotiledóneas como en monocotiledóneas, abarcando 33 familias y 328 géneros (Winter y Smith, 1996).
Evolución molecular: la maquinaria bioquímica necesaria para CAM se encuentra pre-sente en todas las plantas superiores, y está involucrada en un gran número de funciones metabólicas (Cushman, 2001). Teniendo en cuenta esto, ¿qué mecanismos moleculares fueron los responsables para la evolución de CAM? Una posibilidad, es que CAM surgió de células del mesófilo que se apropiaron de la expresión génica perteneciente a elevadas tasas de síntesis de malato y decarboxilación del mismo; este mismo patrón se encuentra en células acompañantes (Cockburn, 1983). Por tanto, variaciones en el metabolismo fotosintético del carbono pudieron haber evolucionado directamente de cualquier célula (Cushman y Bohnert, 1997). Además, serían necesarios cambios evolutivos en mecanismos de transducción de señales dirigidos a la regulación diurna de las actividades enzimáticas. Actualmente, la carencia de secuencias de nucleótidos de varias especies CAM y de sus genes específicos, ha impedido construir filogenias moleculares confiables (Cushman y Bohnert, 1997) y aunque el metabolismo ácido de las crasuláceas es una adaptación a la sequía por parte de especies vegetales terrestres, éste se manifiesta en un gran y diverso conjunto de especies y formas de vida, por lo que generalizaciones sobre el camino evolutivo deben ser realizadas con precaución.
¿QUÉ ES CAM?
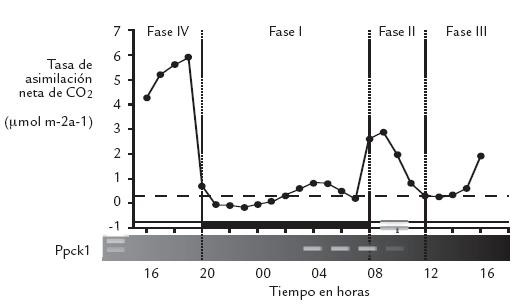
Figura 1. Toma de CO2 atmosférico por hojas de M. crystallinum tratadas previamente con NaCl 500 mol.m-3 durante 6 días (Adaptada de Dodd et al., 2002).
PLASTICIDAD
La plasticidad en la expresión de estas fases es una característica ubicua de la mayor parte de las plantas CAM. CAM está íntimamente ligado al medio ambiente, y puede ser modificado o perturbado por temperatura, intensidad lumínica, estatus nutricional, humedad ambiental relativa y disponibilidad de agua (Dodd et al., 2002). A nivel específico, las cuatro fases anteriormente mencionadas proveen un marco referencial conveniente para describir a CAM, pero se debe tener en cuenta que este esquema es probablemente el modelo ideal y en muchos casos no el real para dicho metabolismo, por lo que muchas modificaciones han sido referenciadas (Tabla 1). Con notables excepciones, incluso las especies con menor plasticidad responderán a cambios en el ambiente ajustando su expresión CAM. Por ejemplo, bajo condiciones de buena humedad relativa, disponibilidad de agua y luz constante, Kalanchoë daigremontiana exhibe las cuatro fases clásicas de CAM; sin embargo, luego de un período corto de sequía, el patrón de las fases es ajustado de tal manera que la fase II se ve seriamente reducida a 1 h y la fase IV no se presenta. Después del riego se restablecen las cuatro fases nuevamente (Griffiths et al., 2002). Las especies C3-CAM son probablemente las de mayor plasticidad en la expresión de CAM porque poseen una capacidad inherente de inducir CAM dependiendo de los factores medioambientales presentes (Dodd et al., 2002). Por ejemplo, en la especie Mesembryanthemum crystallinum el cambio de C3 a CAM se observa cuando se induce estrés por déficit hídrico u osmótico (Adams et al., 1998). Las plantas “CAM-cíclico” muestran toma diurna de CO2 durante las primeras horas del día más refijación nocturna de CO2 respiratorio, acompañado por una pequeña fluctuación de ácidos orgánicos de cuatro carbonos (Dodd et al., 2002; Lüttge, 2004). En especies CAM obligadas, la toma de CO2 ocurre predominantemente en la fase I con alguna toma en las fases II y IV (dependiendo del estatus hídrico) y con una gran fluctuación de ácidos orgánicos de cuatro carbonos (Dodd et al., 2002, Lüttge, 2004). Bajo condiciones de estrés hídrico severo ciertas especies mostrarían “CAM inútil” en donde los estomas permanecen cerrados día y noche previniendo la toma de CO2 y la pérdida de agua; aun así, las plantas continuarían mostrando pequeñas fluctuaciones de ácidos de cuatro carbonos debido a la fijación de CO2 respiratorio. En general, la inducción de CAM es considerada como una respuesta al estrés que mantiene un balance positivo del carbono (Dodd et al., 2002).
| Variación CAM | Toma neta de CO2 | CO2 refijado respiratorio | Comportamiento estomático (apertura) | Flujo de ácidos de cuatro carbonos | Impacto ontogénico/ambiental | Funciones propuestas |
|---|---|---|---|---|---|---|
| C3 | Diurno | No | Diurno | - | -/- | - |
| CAM cíclico | Diurno | Sí | Diurno | + | +/+ | Mantenimiento positivo de balance del carbono; ¿mejoramiento en WUE? ¿fotorrespiración reducida? |
| C3-CAM (CAM Facultativo) | Diurno /nocturno | Sí | Diurno /nocturno | ++ | +/++ | Mantenimiento positivo de balance del carbono; ¿mejoramiento en WUE? ¿fotorrespiración reducida? |
| CAM (CAM obligado) | Fases I, II y IV | Sí | Diurno /nocturno | +++ | +/+++ | ¿Mejoramiento en WUE? ¿fotorrespiración reducida? |
| Fase II CAM | Fases I y II | Sí | Amanecer /nocturno | ++++ | +/+++ | ¿Mejoramiento en WUE? ¿fotorrespiración reducida? |
| Fase I CAM | Fase I | Sí | Nocturno | +++ | +/+++ | ¿Mejoramiento en WUE? ¿fotorrespiración reducida? |
| CAM "inútil" | Ninguno | Sí | Siempre cerrados | + | +/+++++ | Protección del aparato fotosintético de fotoinhibición; mantenimiento positivo de balance del carbono. |
| CAM latente | Diurno | Sí | Diurno | - (elevado) | ?/? | Progresión C3 a CAM? |
| CAM cíclico rápido | Total | ? | ? | - (rápido) | ?/? | ? |
Tabla 1. Plasticidad CAM. Modos de relaciones medioambientales e influencia ontogénica (Adaptado de Cushman, 2001). Los signos negativos indican efecto sustancial no ocurrente. Las interrogaciones indican información no disponible.
PUNTOS DE CONTROL Y PARÁMETROS PRESENTES EN CAM
La separación temporal de la toma de CO2 en las cuatro principales fases, con actividad carboxilasa discreta, presenta un sistema complejo que requiere un control metabólico preciso para prevenir ciclos fútiles del CO2. La clara separación temporal de metabolitos y procesos de transporte debe ser mantenida; aun así, este sistema debe incorporar una flexibilidad significativa para modular el suministro y consumo de CO2 en respuesta a perturbaciones ambientales (Dodd et al., 2002). El enigma del control metabólico en plantas CAM se manifiesta por la inclusión de enzimas de tres y de cuatro carbonos en una misma célula fotosintética. Separación temporal de la actividad carboxilasa
1. Regulación de PEPC: la fosfoenol piruvato carboxilasa (EC 4.1.1.31) es una enzima alostérica inhibida por L-malato y activada por glucosa-6-fosfato. La actividad de la PEPC es regulada por fosforilación nocturna en los residuos de serina, aumentando su actividad in vivo y reduciendo su sensibilidad al malato. Además, es regulada por defosforilación diurna, que aumenta su sensibilidad al L-malato disminuyendo su actividad in vivo (Nimmo, 2000). Esta enzima cataliza la carboxilación de PEP para producir oxaloacetato y Pi. La regulación de la PEPC por fosforilación reversible tiende a restringir la asimilación de CO2 a ácidos de cuatro carbonos en la fase I y fase II temprana, inhibiendo, (o reduciendo en gran medida), el ciclaje fútil del CO2 para síntesis y decarboxilación simultánea del malato durante el día (Dodd et al., 2002). La enzima responsable de la fosforilación de la PEPC y por tanto de su actividad, es la fosfoenol piruvato carboxilasa quinasa, cuya actividad cambia notablemente durante el ciclo diario (día /noche): la actividad es alta hacia la mitad del período nocturno cuando la PEPC es fosforilada, y baja o nula durante el período luminoso (Nimmo, 2000). En Kalanchoë fedtschenktoi la enzima responsable de la defosforilación de la PEPC ha sido identificada como una proteína fosfatasa 2A (PP2A), cuya actividad no cambia durante el ciclo diario, llevando a la conclusión de que el estado de fosforilación de la PEPC está regulado mayoritariamente por la actividad de la PEP carboxilasa quinasa (Nimmo, 2000).
2. Regulación de la PEPC quinasa: la actividad PEPC quinasa está regulada por control circadiano de la expresión del gen quinasa (Ppck1) y por tanto, exclusivamente a nivel de abundancia transcripcional. De este modo, la abundancia de transcriptos PEPC quinasa regulan la tasa de asimilación nocturna de CO2; dicho control puede ser alterado por cambios en niveles de ciertos metabolitos. El efecto principal del oscilador circadiano en este sistema puede ser a nivel de permeabilidad del tonoplasto, (dado por cambios principalmente en la temperatura) y los cambios de la expresión quinasa pueden ser secundarios a cambios circadianos en la concentración de metabolitos, probablemente por niveles de malato citosólico (Nimmo, 2000). De esta forma, el malato citosólico puede actuar como un regulador de la expresión quinasa a manera de retroalimentación y así, mantener en parte el control circadiano de la fosforilación (Borland et al., 1999). Alternativamente, un metabolito tal como PEP puede actuar como un activador de la expresión quinasa (Dodd et al., 2002). Recientemente, una proteína ha sido identificada en K. fedtschenkoi que reversiblemente inhibe la actividad de la PEPC quinasa (Nimmo et al., 2001). El patrón circadiano de expresión génica de la PEPC quinasa muestra un alto grado de flexibilidad, lo cual podría explicar la plasticidad de la toma de CO2 durante la fase I y II en respuesta a condiciones ambientales (Dodd et al., 2002).
3. Regulación de la Rubisco: la actividad de la Rubisco se encuentra modulada por carbamilación de sitios activos y en muchos casos por la unión de inhibidores específicos a sitios carbamilados (Portis, 1992). La activación de sitios específicos de la Rubisco requiere la unión reversible de CO2 activador, que a su vez se estabiliza por la unión de Mg2+para formar un complejo ternario activo (Lorimer y Miziorko, 1980). La carbamilación puede ser inhibida por la unión fuerte de ribulosa-1,5-bifosfato (RuBP) a sitios inactivos. La remoción de este ligando y la regulación de la carbamilación requieren la actividad de la proteína estromal Rubisco activasa, mediante una reacción que precisa de ATP y de la cadena transportadora de electrones del sistema fotosíntetico, la cual a su vez, se encuentra inhibida por ADP (Portis, 1992; Maxwell et al., 1999). Según trabajos realizados en K. daigremontiana (Maxwell et al., 1999), la carbamilación de la Rubisco se incrementa durante la fase II mientras la actividad de PEPC decae a un mínimo, sugiriendo una coregulación compleja de ambas carboxilasas con la mínima posibilidad de que Rubisco y PEPC compitan por CO2 durante la madrugada. A su vez, el estado de carbamilación de la Rubisco aumenta linealmente con el incremento de la concentración de CO2 intracelular durante la decarboxilación, alcanzando un máximo de actividad al final del fotoperíodo, cuando la toma de CO2 atmosférico ocurre bajo niveles limitantes de CO2 (Maxwell et al., 1999). Tanto la Rubisco como la PEPC se encuentran fuertemente influenciadas por concentraciones de sustratos; así, el suministro de RuBP demanda suficientes electrones en la cadena transportadora de la fotosíntesis para generar sustrato de manera lineal con la demanda enzimática.
Almacenamiento y movilización de ácidos de cuatro carbonos
La fijación nocturna de CO2 resulta en la formación de cantidades considerables de malato y otros ácidos de cuatro carbonos que deben ser almacenados en la vacuola para prevenir acidificación del citoplasma e inhibición por retroalimentación negativa de la PEPC. Para acomodar las cantidades crecientes de malato y su almacenamiento a nivel vacuolar, la capacidad de transporte de dicho metabolito debe incrementarse. Este transporte es llevado a cabo por el mantenimiento de un gradiente electroquímico positivo al interior de la vacuola, energizado por una V0V1-H+-ATPasa del tonoplasto y por actividades H+ de ortofosfatasas inorgánicas. El malato es transportado a través del tonoplasto en forma de anión divalente vía canales iónicos o por un transportador específico, una vez en la vacuola el malato es protonado (Fig. 2). El transporte del malato dentro y fuera de la vacuola debe ser fuertemente regulado para generar fluctuaciones de ácidos de cuatro carbonos en el ciclo diario. Así, canales iónicos selectivos de malato que rectifican la entrada nocturna del malato se activan de noche, mientras que durante el día el flujo hacia adentro, al parecer, se torna inactivo, resultando en un flujo de malato hacia el citoplasma por medio de un segundo canal o por difusión pasiva a través de la membrana del tonoplasto (Lüttge et al., 1995).
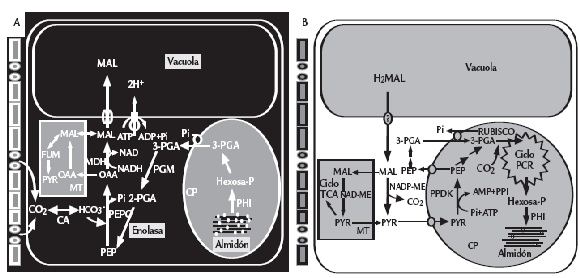
Figura 2. Flujos de carbono en una célula CAM (Tipo ME) durante el ciclo diurno. Durante la fase I (A),toma nocturna de CO2 a partir de la apertura estomática y rompimiento de carbohidratos de reserva resultando en la formación de PEP, que sirve como sustrato para la fijación de CO2 por parte de la PEPC, llevando así a la producción (OAA) y a la reducción a malato por la MDH. La PEP es suministrada por la formación y exportación glicolítica de 3-fosfoglicerato del cloroplasto vía transportadores Pi. El malato es transportado dentro de la vacuola por un canal iónico selectivo ubicado en el tonoplasto. A medida que la planta es expuesta al efecto de la luz, los estomas se cierran gradualmente y la fijación de CO2 externa cesa. En la fase III (B), el malato es liberado de la vacuola de forma pasiva y decarboxilado por ME llevando a la liberación de CO2 y la formación de piruvato por parte de la PPDK. La decarboxilación del malato ocurre concurrentemente con un incremento de CO2 intracelular suprimiendo en parte, la fotorrespiración. El CO2 liberado es reasimilado por la Rubisco mediante el ciclo fotosintético de reducción del carbono (PCR). Piruvato y PEP abastecen la gluconeogénesis para regenerar el conjunto de carbohidratos de reserva. En la fase IV, las concentraciones internas de CO2 decaen y los estomas pueden abrirse permitiendo la fijación de CO2 exógeno por parte de la Rubisco. La PEPC puede tornarse activa durante esta fase a medida que las concentraciones de malato citoplasmático disminuyen. La figura también muestra la contribución mitocondrial a la formación y decarboxilación de malato. MT: mitocondria, CP: cloroplasto, CA: anhidrasa carbónica, PGM: fosfogliceromutasa (catalizador de 3-fosfoglicerato en 2-fosfoglicerato), PHI: fosfohexosa isomerasa (catalizador de Fru-6-P en Glu-6-P), Mal: malato, PYR: pyruvato, FUM: fumarato, TCA: ácido tricarboxílico, PEPC: fosfoenol piruvato carboxilasa (catalizador de PEP y HCO-3 en oxalacetato), MDH: (cataliza oxalacetato y NADH en malato y NAD+), enolasa: (cataliza 2-fosfoglicerato en PEP, adaptado de Cushman y Bohnert, 1997).
Refijación de CO2 por decarboxilación de ácidos de cuatro carbonos Las plantas CAM pueden ser divididas en dos grandes grupos con base en la decarboxilasa predominante que libera PEP y CO2 para la refijación durante el período luminoso. Un primer grupo posee suficiente actividad PEP carboxiquinasa (PEPCK; EC 4.1.1.49) para ser tomada como la enzima decarboxiladora predominante. Un segundo grupo no posee actividad PEPCK, pero si suficiente actividad de la enzima málica dependiente de NADP (NADP-ME; EC 1.1.1.40) y de la enzima mitocondrial dependiente de NAD (NAD-ME; EC 1.1.1.39) para ser tomadas en cuenta como las responsables de la decarboxilación de ácidos de cuatro carbonos (Christopher y Holtum, 1996). Las plantas con PEPCK o con ME como la mayor decarboxilasa pueden ser agrupadas taxonómicamente a nivel de familia. Plantas con PEPCK como la mayor decarboxilasa ocurre en las familias Asclepiadaceae, Bromeliaceae, Euphorbiaceae y Portulacaceae, mientras que especies con ME como la mayor decarboxilasa ocurren en las familias Aizoaceae, Cactaceae, Crassulaceae y Orchidaceae (Dittrich et al., 1973). Finalmente, el PEP resultante de la decarboxilación de los ácidos de cuatro carbonos sufre gluconeogénesis y se almacena durante el día ya sea en forma de almidón en el cloroplasto o en forma de hexosas solubles fuera del mismo.
Control de los carbohidratos de reserva Las plantas CAM también pueden ser divididas en dos grandes grupos dependiendo de los carbohidratos de reserva sintetizados en el ciclo diario, los formadores de almidón cloroplástico y los formadores de carbohidratos extracloroplásticos (Chen et al., 2002). Estas especies usan polisacáridos (almidón) almacenados en el cloroplasto o hexosas solubles no almacenadas en el cloroplasto, como precursores de la formación de PEP por glicólisis en la fase nocturna. Winter (1985) demostró que, cantidades considerables de carbohidratos son translocados de noche y que el crecimiento de las plantas CAM se encuentra abastecido por translocación selectiva de azúcares solubles formados durante la fase IV. La separación de asimilados derivados de la fotosíntesis C3 y los derivados de la decarboxilación de ácidos orgánicos de cuatro carbonos en acervos discretos de carbohidratos durante el día, ha sido sugerido como un posible mecanismo que facilita el control del metabolismo de los carbohidratos en plantas CAM. Esta compartimentación puede promover los medios por los cuales las rutas que constituyen a CAM y aquellas que abastecen el crecimiento puedan ser reguladas independientemente una de la otra (Borland et al., 1994). En general, las reacciones oscuras de CAM requieren tasas elevadas de degradación de carbohidratos en comparación con las plantas C3. Por ejemplo, la inducción de CAM en M. crystallinum va acompañada de incrementos sustanciales (10-10 veces) en las actividades de varias enzimas amilolíticas y fosforilolíticas que degradan almidón (Paul et al., 1993). Los patrones de expresión génica son consistentes con patrones de actividad enzimática (degradación de almidón), sugiriendo que la regulación circadiana de la degradación del almidón puede permitir el control preciso de la glicólisis, que a su vez, determinará el flujo a través de PEPC (Dodd et al., 2002).
GENÉTICA MOLECULAR DE CAM
La maquinaria enzimática requerida para desempeñar CAM se encuentra presente en todas las plantas superiores (Cushman y Bohnert, 1997). Sin embargo, en plantas CAM y C4 la actividad de enzimas claves tales como PEPC, PPDK, NAD(P)-ME y PEPCK es mucho más alta que en plantas C3. Aun así, la compartimentación celular de dichas enzimas difiere entre plantas CAM y C4. En las plantas CAM han evolucionado patrones diurnos y nocturnos específicos de expresión y regulación para acomodar el flujo de carbono a través de gluconeogénesis y glicólisis necesarios para satisfacer la demanda nocturna de PEP y decarboxilación diurna de ácidos orgánicos de cuatro carbonos (Paul et al., 1993). La caracterización de ciertos genes CAM específicos y sus patrones de expresión en plantas CAM facultativas han dado luces sobre los mecanismos moleculares sujetos a la evolución y expresión de dichas enzimas.
Regulación de la expresión génica CAM específica La inducción de CAM implica la regulación y el ensamblaje de enzimas y transportadores de metabolitos, haciéndola una de las adaptaciones metabólicas más complejas al estrés de diferentes ambientes (Cushman y Bohnert, 1997). La inducción de genes específicos CAM en respuesta a salinidad, déficit hídrico, estrés osmótico, intensidades lumínicas o tratamiento con ácido abscísico se encuentran controladas principalmente a nivel de trascripción, iniciado a través de una cascada de señalización que parece requerir de actividades de proteínas quinasas dependientes de calcio (Cushman, 2001). En general, la acumulación de transcritos y proteínas se ven bien correlacionados; sin embargo, discrepancias entre abundancias de transcritos y proteínas han sugerido que cambios en la estabilidad, la utilización y la eficiencia en la traducción del ARNm, también son factores que gobiernan la expresión génica durante la transición C3-CAM (DeRocher y Bohnert, 1993). Se ha demostrado que en especies CAM facultativas como M. crystallinum existen elementos reguladores cis que gobiernan la expresión de ciertos patrones (Cushman y Bohnert, 1997). La naturaleza exacta de los factores trans actuando y controlando patrones específicos de la actividad CAM permanece sin resolver (Cushman, 2001). Aparte de la regulación transcripcional, existen mecanismos de regulación post-transcripcional. Dichos mecanismos gobiernan las respuestas a corto plazo tales como modulación de la traducción, de la degradación de proteínas, y de las actividades enzimáticas en sincronía con los patrones diurnos de CAM (Cushman y Bohnert, 1997). Entre estos mecanismos de regulación post-transcripcional se encuentra el de la PEPC por la PEPC quinasa, el control de la actividad enolasa posiblemente por fosforilación reversible y actividades de varias enzimas cloroplásticas y citoplásmicas tales como NAD-GAPDH, NADP-MDH y Fru-1,6-bifosfatasa, entre otras.
TRANSDUCCIÓN DE SEÑALES
Los mecanismos implicados en la conversión de señales ambientales y ontogénicas a distintas expresiones génicas de CAM, (plasticidad), permanecen en gran medida inexploradas. Una gran multitud de factores tales como concentraciones intracelulares de Ca2+, CO2, malato y carbohidratos; estado redox, o pH citosólico pueden participar en la señalización durante la inducción a CAM (Cushman y Bohnert, 1997). La reducción de las reservas de malato trae como consecuencia la reducción de concentraciones de CO2 y Ca2+, iniciando la apertura estomática hacia el final del período lumínico. En las células acompañantes, los niveles altos de ABA o CO2 intercelular resultan en cierre estomático (Sharkey, 1993); por ello se espera que cambios en las concentraciones de Ca2+ actúen para mediar el cierre estomático durante las fases diurnas del ciclo CAM. Sin embargo, las plantas CAM parecen sufrir una inactivación de los fotorreceptores para luz azul y roja que normalmente median la reapertura estomática diurna, de tal forma que la apertura y cierre estomático se encuentre modulado por factores tales como ABA o CO2 (Lee y Assman, 1992).
CAM se encuentra controlado por una compleja red de señalización independiente pero relacionada (Cushman y Bohnert, 1997). Por ejemplo, expresiones fisiológicas y génicas producidas por ABA persisten en M. crystallinum incluso cuando el ABA es suprimido usando lovastatina (Thomas et al., 1992). Evidencia reciente sugiere que grupos específicos de proteínas quinasas y fosfatasas catalizan la fosforilación reversible de una serie de pasos y modulan eventos tales como movimientos estomáticos y cambios en la expresión génica (Cushman y Bohnert, 1997). En M. crystallinum, el tratamiento en las hojas con ácido okadaico (inhibidor específico de proteínas fosfatasas tipo 1 y 2A), inhibe la acumulación de transcritos Ppc1 inducidos por deshidratación, estrés salino, ABA y metil jasmonato, sugiriendo que estas fosfatasas blanco participan en la señal de transducción que lleva a la inducción de CAM. En contraste, el tratamiento con W-7, un antagonista de la calmodulina, inhibe específicamente la acumulación de transcritos Ppc1 en respuesta a estrés osmótico, mas no por déficit hídrico (revisado por Cushman y Bohnert, 1997), lo cual sugiere que mecanismos de señalización independientes operan en respuesta a distintos estres ambientales, y que por lo menos un mecanismo compromete cambios en la concentración citoplasmática de Ca2+ .
PERSPECTIVAS
CAM es una adaptación muy exitosa que permite a ciertas plantas habitar o competir en ambientes con limitaciones de agua o CO2. Aspectos ecofisiológicos, anatómicos, taxonómicos, bioquímicos y evolutivos han sido extensamente estudiados. Estos estudios demuestran que CAM y su inducción por estrés medioambientales proveen uno de los ejemplos más complejos e interesantes de rutas de regulación fisiológica y genética. Sin embargo, quedan grandes áreas sin resolver con respecto a CAM, por lo que en un futuro las investigaciones se deben dirigir hacia el desarrollar de programas en el área de bioquímica, fisiológica y genómica en modelos selectos de plantas CAM. Estas aproximaciones proveerán una visión más integrada de las dinámicas de regulación implicadas en las respuestas a factores ambientales cambiantes de la plasticidad observada en CAM.
AGRADECIMIENTOS
Al personal de Fisiología Vegetal del Departamento de Biología de la Universidad Nacional de Colombia por el apoyo brindado.
BIBLIOGRAFÍA [ Links ]
BASTIDE B, SIPES D, HANN J, TING P. Effect of Severe Water Stress on Aspects of Crassulacean Acid Metabolism in Xerosicyos. Plant Physiol. 1993;103: 1089-1096.
[ Links ]BORLAND AM, GRIFFITHS H, BROADMEADOW MSJ, FORDHAM MC, MAXWELL C. Carbon Isotope Composition of Biochemical Fractions and the Regulation of Carbon Balance in Leaves of C3-Cam Plant Clusia Minor Growing in Trinidad. Plant Physiol. 1994;106:493-501.
[ Links ]_______________, HARTWELL J, JENKINS JI, WILKINS MB, NIMMO HG. Metabolite Control Overrides Circadian Regulation of Pepc Kinase and CO2 Fixation in Crassulacean Acid Metabolism. Planta. 1999;205:342-351.
[ Links ]CHEN LS, LIN Q, NOSE A. A Comparative Study on Diurnal Changes in Metabolite Levels in the Leaves of Three Crassulacean Acid Metabolism Species, Ananas Comosus, Kalanchoe Daigremontiana and K. Pinnata. J Exp Bot. 2002;3:341-350.
[ Links ]CHRISTOPHER J, HOLTUM J. Patterns of Carbohydrate Partitioning in Leaves of Crassulacean Acid Metabolism Species During Deacidification. Plant Physiol. 1996;112:393-399.
[ Links ]COCKBURN W. Stomatal Mechanism as the Basis of the Evolution of CAM and C4 Photosynthesis. Plant Cell Environ. 1983;6:275-179.
CUSHMAN J, BOHNERT HJ. Molecular Genetics of Crassulacean Acid Metabolism. Plant Physiol. 1997;113:667-676.
[ Links ]CUSHMAN J. Crassulacean Acid Metabolism. A Plastic Photosynthetic Adaptation to Arid Environments. Plant Physiol. 2001;127:1439-1448.
[ Links ]DEROCHER EJ, BOHNERT HJ. Developmental and Environmental Stress Employ Different Mechanisms in the Expression of a Plant Gene Family. Plant Cell 1993;5:1611-1625.
[ Links ]DITTRICH P, CAMPBELL WH, BLACK CC. Phosphoenolpyruvate Carboxykinase in Plants Exhibiting Crassulacean Acid Metabolism. Plant Physiol. 1973;52: 357-361.
[ Links ]DODD A, BORLAND A, HASLAM R, GRIFFITHS H, MAXWELL K. Crassulacean Acid Metabolism: Plastic, Fantastic. J Exp Bot. 2002;53:559-580.
[ Links ]GIBSON AC, NOBEL PS. The Cactus Primer. Harvard University Press. England; 1986.
[ Links ]GRIFFITHS H, BROADMEADOW MSJ, BORLAND AM, HETHERINGTON CS. Regulation of the Rubisco Activity in CAM Plants: Better Later than Never. Funct. Plant Biol. 2002;29:689-696.
[ Links ]HERPPICH W, PECKMANN K. Influence of Drought on Mitochondrial Activity, Photosynthesis, Nocturnal Acid Accumulation and Water Relations in the CAM Plants Prenia sladeniana (me-type) and Crassula lycopodioides (pepck-type). Ann Bot. 2000;86:611-620.
[ Links ]KEELEY JE. Crassulacean Acid Metabolism in the Seasonally Submerged Aquatic Isoetes howellii. Oecologia. 1983;58:57-62.
[ Links ]LEE DM, ASSMAN SM. Stomatal Responses to Light in the Facultative Crassulacean Acid Metabolism Species, Portulacaria afra. Plant Physiol 1992;85:35-42.
[ Links ]LORIMER G, MIZIORKO H. Carbamate Formation on the Amino Group of a Lysyl Residue as the Basis for the Activation of Ribulosa Biphosphate Carboxilase by CO2 and Mg2+. Biochemistry. 1980;19:5321-5328.
[ Links ]LÜTTGE U, FISHER-SCHLIEBS E, RATAJCZAK R, KRAMER D, BERNDT E, KLUGE M. Functioning of the Tonoplast in Vacuolar C-Storage and Remobilisation in Crassulacean Acid Metabolism. J Exp Bot. 1995;46:1377-1388.
[ Links ]LÜTTGE U. Co2 Concentrating: Consequences in Crassulacean Acid Metabolism. J Exp Bot. 2002;53:2131-1142.
LÜTTGE U. Ecophysiology of Crassulacean Acid Metabolism. Ann Bot. 2004;93:629-652.
[ Links ]MAXWELL K, BORLAND AM, HASLAM RP, HELLIKER BR, ROBERTS A, GRIFFITHS H. Modulation of Rubisco Activity During the Diurnal Phases of the Crassulacean Acid Metabolism Plant Kalanchoe daigremontiana. Plant Physiol. 1999;121:849-856. [ Links ]
NIMMO HG. The Regulation of Phosphoenolpyruvate Carboxylase in CAM Plants. Trends in Plant Sci. 2000;5:75-80. [ Links ]
_______________, NIMMO GA, WILKINS MB. Partial Characterization and Purification of a Proteine Inhibitor of Phosphoenolpyruvate Carbaxilase Kinase. Planta. 2001;213:250-157.
PAUL MJ, LOOS K, ZIEGLER P. Starch Degradatin Enzymes During the Induction of CAM in Mesembryanthemum crystallinum. Plant Cell Environ. 1993;16:531-538. [ Links ]
PORTIS AR. Regulation of Ribulose 1-5-Biphosphate Carboxilase/Oxigenase Activity. Annual Rev Plant Physiol Plant Mol Biol. 1992;43:415-437.
[ Links ]RAVEN JA, SPICER RA. The Evolution of Crassulacean Acid Metabolism. In: Winter K, Smith JAC, Editores. Crassulacean Acid Metabolism. Biochemistry Ecophysiology and Evolution. Berlin: Springer-Verlag 1996. p. 360-385.
[ Links ]SHARKEY T. Fotosíntesis. En: Azcon-Bieto J, Talon YM. Fisiología y bioquímica vegetal. España: Editorial Macgraw-Hill; 1993. p. 81-85.
[ Links ]THOMAS JC, MCELWAIN EF, BOHNERT HJ. Convergent Induction of Osmotic Stress Responces: Abscisic Acid, Cytokinin and the Efect of NaCl. Plant Physiol. 1992;100:416-423.
[ Links ]WINTER K. Crassulacean Acid Metabolism In: Barber J, Barber NR, Editors. Photosynthetic Mechanisms and the Environment. Amsterdam: Elsevier; 1985. p. 329-387.
[ Links ]_______________, SMITH JAC. Crassulacean Acid Metabolism. Biochemistry, Ecophysiology and Evolution. Berlin: Springer-Verlag; 1996. p. 360-385.
[ Links ]