Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.10 no.2 Bogotá Dec. 2005
INDUCCIÓN DIFERENCIAL DE POLIFENOLOXIDASA Y beta-1,3-GLUCANASA EN CLAVEL (Dianthus caryophyllus) DURANTE LA INFECCIÓN POR Fusarium oxysporum f. sp. dianthi RAZA 2
Polyphenoloxidase and beta-1,3-Glucanase Differential Inductionin Carnation (Dianthus caryophyllus) Infected by Fusarium oxysporum f. sp. dianthi race 2
HAROLD ARDILA, BLANCA LIGIA HIGUERA
Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia. Sede Bogotá.
Presentado abril 6 de 2005, aceptado junio 17 de 2005, correcciones agosto 19 de 2005.
RESUMEN
Se evaluó el cambio en el comportamiento de las enzimas polifenoloxidasa (PFO) y beta-1,3-glucanasa (Glu) en tallos de plantas de clavel inoculadas con el patógeno Fusarium oxysporum f. sp. dianthi (Fod) raza 2, con el fin de determinar su posible participación en la respuesta defensiva y en la resistencia de la planta al marchitamiento vascular. Se evaluaron parámetros para la extracción y determinación de actividad de dichas enzimas. Las condiciones que proporcionaron los mejores resultados de extracción fueron: obtención de polvos de acetona previa al tratamiento con buffer de fosfatos pH 6,5 con 3% de PVPP para PFO y con buffer de fosfatos pH 6,5 para Glu. La cuantificación de PFO se llevó a cabo usando catecol a pH 7,0 y 37 ºC y midiendo los productos de reacción a 420 nm, y la de Glu usando laminarina digitata a 37 ºC y pH 5,5. Una vez establecidos los métodos, esquejes de clavel de una variedad altamente tolerante (Carolina) y de una susceptible (Uconn) fueron inoculados con el patógeno y sometidos al análisis de las enzimas a diferentes tiempos post-inoculación. Mientras que en la variedad susceptible la actividad PFO no se vio afectada, en la tolerante se presentó una importante y significativa inducción de esta enzima a las 12 h y 24 h, indicando que puede desempeñar un papel clave en la defensa de la planta, en fenómenos metabólicos probablemente relacionados con lignificación y síntesis de fenólicos. La enzima Glu presentó inducción en ambas variedades, aunque a diferentes tiempos, lo cual hace parte de una respuesta metabólica inespecífica, no relacionada con mecanismos de defensa activa del clavel contra el patógeno causal del marchitamiento vascular.
Palabras clave: clavel, Fusarium oxysporum, polifenoloxidasa, beta-1,3-glucanasa, defensa vegetal.
ABSTRACT
We evaluated the changes on the dynamics of polyphenoloxidase (PFO) and beta-1,3-glucanase (Glu) enzymes in carnation steems, which had been previously inoculated with the pathogen Fusarium oxysporum f. sp. dianthi race 2 (Fod). We established the experimental conditions in order to obtain the extract of the enzymes from the carnation steems with the aim to evaluate their enzymatic activity. The best results for PFO were obtained when acetone powder formation, before the extraction with phosphate buffer pH 6,5 aditionated with 3% PVPP, was used, and for Glu, phosphate buffer pH 6.5. The PFO activity quantification was done using catecol at pH 7.0, 37 ºC and measuring the products on 420 nm and, for Glu activity using “laminarina digitata” at 37 ºC and pH 5.5. Then, carnation’s cutting from a highly tolerant variety (Carolina) and a susceptible (Uconn) to Fod race 2, were inoculated with the pathogen, then submitted to the enzymes analysis at different post-inoculation time-lapses. For the susceptible variety, the PFO activity was not affected, whereas in the highly illness resistant variety, there was an important inducement 12 h and 24 h post-inoculation, meaning that this enzyme could be playing a significant rol in the defense response, in metabolisms related with the lignification and synthesis of phenolic precursors. Alternatively, the Glu enzyme showed activity inducement in both varieties which seems to comprise a fraction of a non-specific response, uncorrelated with the active defense mechanisms of the carnation against this pathogen.
Key words: Carnation, Fusarium oxysporum, polyphenoloxidase, beta-1,3-glucanase, plant defense.
INTRODUCCIÓN
El marchitamiento vascular causado por Fusarium oxysporum f. sp. dianthi (Fod) es la enfermedad de mayor relevancia para el cultivo del clavel alrededor del mundo. En Colombia, país que se ubica como el segundo exportador de esta flor a nivel mundial, la raza 2 de este patógeno ataca los cultivos, generando pérdidas económicas considerables. Para su control se ha implementado un plan integrado de manejo que comprende diversas medidas que evitan la entrada y diseminación del patógeno en los invernaderos (Pizano, 2000). Sin embargo, considerando los costos económicos y el impacto ambiental que conlleva la ejecución de dicho plan, la búsqueda de alternativas como el desarrollo de variedades resistentes, el control biológico y el uso de elicitores bióticos, se constituyen como campos de particular interés investigativo para el adecuado desarrollo de este cultivo. Para entender los mecanismos de defensa involucrados en este modelo, se han llevado a cabo diversos estudios histopatológicos y bioquímicos. Es así como se conoce que la respuesta defensiva del clavel contra este patógeno involucra procesos como: la acumulación de fenólicos incluídas algunas fitoalexinas (Baayen y Niemann, 1989; Niemann et al., 1991(b); Higuera y Montes, 1996); la formación de gomas para la oclusión del patógeno (Baayen et al., 1996; Higuera y Nesbat-Ebrahim, 1999), y el fortalecimiento de las paredes celulares por lignificación (Baayen, 1988; Niemann et al., 1991(a)) y por acumulación de calosa (Trillas et al., 2000). Sin embargo, dichos mecanismos no han sido elucidados completamente y son aún desconocidos aspectos clave en la respuesta defensiva del clavel. Las polifenoloxidasas son enzimas ampliamente distribuidas en la mayoría de los tejidos vegetales y cumplen un papel muy importante en diversos procesos fisiológicos. Participan en la oxidación de polifenoles a quinonas (compuestos con actividad antimicrobiana) y en la lignificación de paredes celulares durante el ataque por algunos microorganismos (Thipyapong et al., 1995; Beckman, 2000; Constabel et al., 2000). Diversos estudios han sugerido que ésta, así como otras enzimas, pueden estar relacionadas con resistencia a enfermedades causadas por hongos, bacterias y virus (Beckman, 2000). Sin embargo, aunque algunos estudios han propuesto la participación de esta enzima en procesos metabólicos relacionados con defensa contra patógenos del género Fusarium (Ray y Hammerschmidth, 1998; Mohammadi y Kamesi, 2002), a la fecha no existen estudios que permitan determinar su papel en la defensa del clavel contra Fusarium oxysporum f. sp. dianthi. Por otro lado, dentro de las proteínas relacionadas con patogénesis (PRs), las β-1,3-glucanasas han presentado particular interés teniendo en cuenta que pueden llegar a presentar actividad antifúngica in vitro contra algunos patógenos (Stintizi et al., 1993; Lawrence et al., 1996) y que su acción sobre la pared celular fúngica puede generar moléculas con actividad elicitora de respuestas de resistencia (Okinawa et al., 1995). Teniendo en cuenta las diferencias en el patrón de acumulación de esta enzima en tejidos de tomate infectados con Fusarium oxysporum f. sp. Lycopersici radisici, entre variedades con diferentes niveles de resistencia, se postula su papel en defensa vegetal, en el caso de enfermedades del tipo marchitamiento vascular (Benhamou et al., 1989). Aunque se ha tratado de determinar su probable inducción en el modelo clavel-Fod (Van Pelt Heerschap y Smit-Bakker, 1999), los estudios realizados hasta la fecha no han involucrado la raza 2 del patógeno, de mayor virulencia y de distribución a nivel nacional y mundial. Por tal razón, en este trabajo se evaluó el comportamiento de las enzimas polifenoloxidasa y β-1,3-glucanasa en esquejes de clavel, que presentan diferentes niveles de resistencia al marchitamiento vascular, a diferentes tiempos de post-inoculación, buscando con ello establecer si dichas enzimas intervienen en los procesos defensivos del clavel contra este patógeno y contribuir al esclarecimiento de los mecanismos de resistencia en este modelo.
MATERIALES Y MÉTODOS
MATERIAL BIOLÓGICO
Se utilizó un aislamiento de Fusarium oxysporum f. sp. dianthi raza 2, obtenido a partir de plantas de clavel con la sintomatología típica de marchitamiento vascular, transferido y mantenido en medio PDA (Papa, Dextrosa, Agar). El inóculo se preparó a partir de este aislamiento, transfiriéndolo a medio líquido Czapek-Dox-Broth por 10 días a 25 ºC con agitación de 80 rpm. Después de filtrar con gasa estéril, se preparó una suspensión de 1,0 x 107 conidias/mL. Se usaron esquejes de clavel con 15 días de enraizamiento, de las variedades Uconn (susceptible) y Carolina (tolerante) al marchitamiento vascular causado por este patógeno. Este material biológico fue suministrado por la empresa América Flor S. A.
PUESTA A PUNTO DE LAS CONDICIONES PARA EXTRACCIÓN DE LAS ENZIMAS PFO Y β-1,3-GLUCANASA
Con el fin de establecer las mejores condiciones de extracción para las enzimas, se evaluaron, para el caso de la enzima PFO, tratamientos para la eliminación de fenólicos interferentes, como es la formación de polvos de acetona y la extracción con buffer utilizando polivinilpolipirrolidona (PVPP) al 10% (Mazzafera y Robinson, 2000). Ambas extracciones se ensayaron utilizando maceración de tallos de clavel de las dos variedades con el buffer Na2HPO4-NaH2PO4 pH 6,5 100 mM. Considerando los resultados así obtenidos, se ensayó la utilización de PVPP al 3% en el buffer de extracción y con el uso de ultrasonido (Deutscher, 1990). La cuantificación de la actividad de la enzima extraída se controló usando catecol como sustrato (Chunhua et al., 2001), piruvato de sodio para la eliminación de la actividad peroxidasa, y realizando seguimiento espectrofotométrico a 420 nm. La actividad se expresó como A 420 nm/sxmg proteína. De acuerdo con los resultados obtenidos, el protocolo de extracción establecido consistió en maceración de 0,2-0,3 g de tallos de clavel y la formación de polvos de acetona a -20 ºC. Después de agitar por 30 s se centrifugó a 10.000 x g por 10 min y se retiró el solvente. Este proceso se repitió dos veces más para la completa eliminación de fenólicos y clorofilas. La extracción se llevó a cabo durante una hora con el buffer Na2HPO4-NaH2PO4 pH 6,5 100 mM a 4 ºC, con 3% de PVPP. Después de centrifugar a 11.000 x g por 30 min a 4 ºC, los extractos se guardaron a -20 ºC para ser analizados al otro día de la extracción.
Para la enzima Glu, se ensayaron diferentes técnicas reportadas para la eliminación de interferentes (azúcares reductores), como son diálisis contra agua a baja temperatura (4 ºC) posterior a la extracción con el buffer pH 5,5 y extracción con buffer pH 5,5 y posterior tratamiento con acetona (Van Pelt y Smit-Bakker, 1999). Una vez seleccionadas las mejores condiciones, se evaluó el efecto del pH en la extracción usando los buffers acetato-acético 100 mM pH 5,2 y Na2HPO4-NaH2PO4 100 mM pH 6,5. Para determinar la actividad Glu extraída en cada ensayo, se usó Laminarina digitata con un ensayo discontinuo a 30 min, 37 ºC y pH 5,5 (Mauch et al.,1984). La cuantificación de los azúcares generados se realizó por el método de Nelson–Somogyi (Somogyi, 1945), usando glucosa como patrón. Se expresaron los resultados de actividad como nkat/mg proteína, en donde un kat hace referencia a una mol de glucosa generada por la acción de la enzima en un minuto. Los extractos obtenidos se mantuvieron a -20 ºC hasta determinar la actividad enzimática.
ESTABLECIMIENTO DE CONDICIONES PARA LA CUANTIFICACIÓN DE LAS ENZIMAS PFO Y β-1,3-GLUCANASA
Usando las condiciones de extracción, seleccionadas según se describió anteriormente, se determinaron luego las mejores condiciones para la cuantificación de la actividad de las dos enzimas. Para PFO, se evaluaron sustratos frecuentemente usados con esta enzima, como catecol, ácido clorogénico y L-DOPA, bajo las condiciones mencionadas y a una concentración 15 mM en cada caso. Con el fin de evaluar el tipo de PFO extraída de clavel, se realizaron ensayos con inhibidores específicos para catecolasas (ácido ferúlico, ácido cinámico y PVP) a una concentración final de 15 mM para cada caso (Mazzafera y Robinson, 2000). Para determinar la mejor relación enzima-sustrato, bajo las condiciones de pH previamente descritas y a Tamb, se evaluaron concentraciones de sustrato desde 25 mM hasta 150 mM. Para seleccionar el pH se usaron soluciones amortiguadoras citrato-fosfato (pH 4,0 a 6,0), fosfatos (pH 6,0 a 8,0) y Tris HCl (pH 8,0 a 10,0) y concentración de sustrato 100 mM a Tamb. Para determinar la temperatura, se llevaron todas las soluciones y la celda a la temperatura deseada (intervalo entre 5 y 55 ºC) varios minutos antes del ensayo. En todos los casos la actividad se expresó como A 420 nm/sxmg proteína. Para Glu se evaluó la mejor relación enzima-sustrato variando para ello la concentración final de laminarina en la mezcla de reacción dentro del intervalo de 1 a 4 mg. Para determinar el efecto del pH se utilizaron soluciones amortiguadoras acetato de sodio ácido acético (4,0-5,5) y ácido cítrico-citrato de sodio (5,5-6,5), con la concentración de sustrato previamente determinada. Se evaluó el efecto de la temperatura en el intervalo de 4 a 70 ºC y tiempo de reacción entre 5 y 120 min, usando los valores previamente seleccionados para los otros parámetros.
CUANTIFICACIÓN DE PROTEÍNA
La determinación de la concentración de proteína para todos los extractos se realizó de acuerdo con el método de Bradford (Bradford, 1976), con la linealización reportada por Zor y Sellinger (1996), usando albúmina bovina sérica (BSA) como patrón.
EVALUACIÓN DE LA INDUCCIÓN DE LAS ENZIMAS
Con el fin de evaluar el efecto de la infección del clavel por Fusarium oxysporum f. sp. dianthi raza 2 en la actividad de PFO y Glu a nivel del tallo, esquejes de clavel de una variedad altamente tolerante (Carolina) y de una variedad susceptible (Uconn) fueron inoculados por inmersión de las raíces durante 20 s en una suspensión de conidias del patógeno de 1 x 107 conidias/mL (Higuera y Montes, 1996), y sometidos al análisis de las enzimas a diferentes tiempos post-inoculación. Se dispuso de un diseño experimental con cuatro tratamientos (T1: variedad susceptible control, T2: variedad susceptible inoculada, T3: variedad tolerante control y T4: variedad tolerante inoculada), con muestreos por triplicado de cada tratamiento a las 0, 6, 12, 24, 48, 96 y 192 h. Los controles fueron esquejes sometidos al mismo tratamiento, pero usando agua estéril en vez de la suspensión de conidias. Una vez inoculados, los esquejes se mantuvieron a las condiciones ambientales (18-20 ºC y 70-85% hr promedio). La extracción de las muestras tomadas a los diferentes tiempos se realizó usando las condiciones seleccionadas según se describió anteriormente. La cuantificación de la actividad de cada enzima se hizo por duplicado en cada uno de los extractos obtenidos, bajo las condiciones de actividad seleccionadas. El análisis estadístico de los resultados se llevó a cabo por ANDEVA con ayuda de la herramienta Statgrafics 6.0. La evaluación de la incidencia de síntomas de la enfermedad en plantas mantenidas como control, se determinó cuatro semanas después de la inoculación en cada tratamiento, como: (No. plantas con sintomatología típica de marchitamiento/No. plantas totales) x100.
ELECTROFORESIS EN GELES DE POLIACRILAMIDA (SDS-PAGE) Y TINCIONES ESPECÍFICAS PARA PFO
La electroforesis en condiciones desnaturalizantes de los diferentes extractos, se llevó a cabo de acuerdo con Laemmli (1970). Para ello, los extractos fueron desalinizados usando columnas de sephadex G-25, liofilizados y resuspendidos en agua. El análisis se realizó con geles del 12,5% a 150 V. Los análisis en condiciones nativas se realizaron con protocolo similar pero sin agentes desnaturalizantes. Para la tinción específica de PFO, el gel se sumergió a 37 ºC en una solución de L-DOPA 1 M, hasta la aparición de las bandas (Rubio, 1999).
RESULTADOS Y DISCUSIÓN
PUESTA A PUNTO DE LAS CONDICIONES DE EXTRACCIÓN DE LAS ENZIMAS
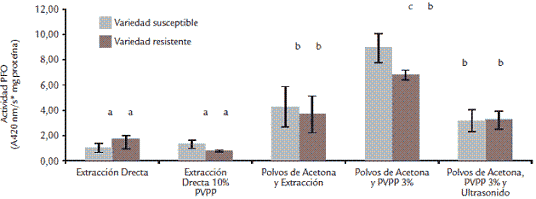
La evaluación de los diversos procedimientos de extracción de PFO pretendía principalmente mantener su estabilidad y eliminar interferencias durante la cuantificación, con el fin de disponer de métodos que garantizaran medidas confiables de su inducción por efecto del patógeno. Los resultados obtenidos para la extracción usando polvos de acetona, técnica frecuentemente usada para la extracción de proteínas que pueden ser afectadas por la presencia de compuestos de tipo fenólico, indicaron que para tallos de clavel dicha técnica permitió obtener los mayores valores de actividad respecto a los otros procedimientos usados (Fig. 1). Por tanto, la extracción de PFO a partir de tallos de clavel se realizó durante toda la investigación usando la formación previa de polvos de acetona y posterior extracción con el buffer de fosfatos pH 6,5. Con el fin de evaluar si se podían obtener mejores resultados, se ensayaron otras condiciones que, de acuerdo con diversos reportes (Mayer, 1987; Mazzafera y Robinson, 2000), permiten obtener niveles más altos de actividad, ya sea porque favorecen la estabilidad de la enzima (uso de PVPP), o porque permiten una mayor extracción de la misma (uso de ultrasonido; Deutscher, 1990; Fig. 1).
Figura 1. Selección de las condiciones de extracción para PFO a partir de tallos de clavel. Actividad expresada como A 420 nm/s x mg proteína. Se realizaron triplicados de extracción y duplicado de la actividad para cada extracto. Los tratamientos que presentan diferencias significativas (0,5% ANDEVA), aparecen con diferentes letras.
Los resultados indicaron que la formación de polvos de acetona y el uso de PVPP al 3% en el buffer de extracción generaron mayores valores de actividad, expresados como actividad específica. Esto se debe posiblemente a la efectiva eliminación de compuestos fenólicos y a la retención de otras proteínas diferentes a la PFO que realiza la PVPP, indicando que bajo dichas condiciones el proceso de extracción se hizo más selectivo.
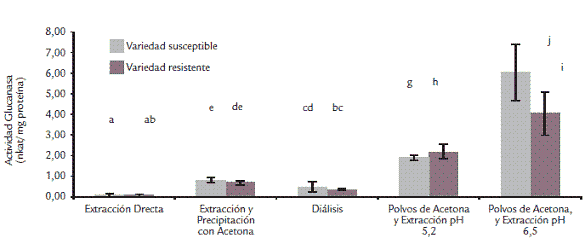
Se determinó también que el tiempo de tratamiento con acetona debe ser 30 s y que el uso de ultrasonido no mejora la extracción (Fig. 1). Detergentes como el SDS o el tritón X-100 no aumentaron los niveles de actividad extraída (resultados no mostrados) por su conocido efecto desnaturante. Por otro lado, considerando que con la adición de PVPP la actividad Glu disminuía de manera considerable (resultados no mostrados), debido posiblemente a la alta cantidad de residuos aromáticos que ésta puede presentar, se vio la necesidad de realizar un proceso de extracción independiente para cada enzima. Al evaluar los tratamientos para la eliminación de azúcares reductores, los resultados indicaron que la formación de polvos de acetona y posterior extracción con buffer pH 5,2, permitieron obtener, hasta este punto, los niveles mayores de actividad de la enzima (Fig. 2).
Figura 2. Selección de las condiciones de extracción para β-1,3-glucanasa a partir de tallos de clavel. Actividad expresada como n Kat/mg proteína. Se realizaron triplicados de extracción y duplicado de la actividad para cada extracto. Los tratamientos que presentan diferencias significativas 95% (ANDEVA), aparecen con diferentes letras.
Una vez seleccionadas estas condiciones, se determinó el pH más adecuado de extracción. Los altos niveles de actividad obtenidos a pH 6,5 comparados con los correspondientes a pH 5,2 (Fig. 2), indican que probablemente alrededor de este pH se podrían encontrar los puntos isoeléctricos de las β-1,3-glucanasas presentes en esta matriz vegetal, tal y como ha sido reportado en otros casos (Akiyama et al., 1997; Caruso et al., 1999).
ESTABLECIMIENTO DE CONDICIONES PARA LA CUANTIFICACIÓN DE LAS ENZIMAS POLIFENOLOXIDASA Y β-1,3-GLUCANASA
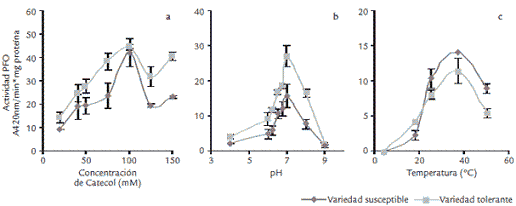
Los resultados obtenidos indicaron que la enzima PFO extraída de clavel presenta una mayor afinidad por el sustrato catecol, al comparar con otros sustratos como L–DOPA y ácido clorogénico. El uso de catecol es un procedimiento ampliamente reportado para el estudio de PFO de diversas fuentes vegetales (Jharna et al.,1997; Chunhua et al., 2001; Mohammadi y Kamesi, 2002). Se determinó además que algunos inhibidores específicos para catecolasas como el ácido cinámico, el ácido ferúlico y PVP inhiben la actividad de manera significativa (resultados no mostrados), indicando que la PFO extraída de clavel presenta características típicas de catecolasa, tal y como se ha reportado en otras fuentes vegetales (Mazzafera y Robinson, 2000). Una vez establecido el sustrato adecuado, se evaluaron parámetros como la concentración de éste (Figs. 3A y 4A), pH (Figs. 3B y 4B) y temperatura (Figs. 3C y 4C) que dieran los mejores resultados de actividad de las enzimas.
Figura 3. Establecimiento de los parámetros para la determinación de la actividad PFO. Actividad expresada como A 420nmλ/min x mg proteína. Cada valor es el promedio de dos determinaciones.
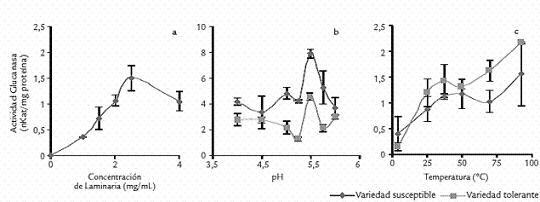
Figura 4. Establecimiento de los parámetros para la determinación de la actividad β-1,3-glucanasa.Actividad expresada como n Kat/mg proteína. Cada valor es el promedio de dos determinaciones.
Como se observa en la figura 3, para la enzima PFO la concentración de catecol que generó los mejores resultados fue 100 mM usando 50 µL de extracto enzimático en una mezcla de reacción de volumen total 450 µL. El pH y la temperatura en los que PFO presentó los mayores niveles de actividad fueron 7,0 y 40 ºC, respectivamente, coincidiendo con el pH y la temperatura óptimos reportados para PFO obtenidas de otras fuentes vegetales (Jharna et al.,1997; Mazzafera y Robinson, 2000; Chunhua et al., 2001). Para Glu se determinó que la concentración de laminarina que generó los mejores niveles de actividad es 2,5 mg/mL, mientras que el pH fue 5,5 y la temperatura 37 ºC (Fig. 4). β-1,3-glucanasas de otras fuentes vegetales han mostrado parámetros similares a los encontrados en el presente estudio para el clavel (Van Pelt et al., 1999; Ramachandra et al., 2000; Salles et al., 2002). Además, se observó la estabilidad que presenta esta enzima a altas temperaturas, un hecho que ha sido también destacado en otras fuentes vegetales (Ramachandra et al., 2000).
EVALUACIÓN DE LA INDUCCIÓN DE LAS ENZIMAS PFO Y β-1,3-GLUCANASA DE CLAVEL DURANTE LA INFECCIÓN CON EL PATÓGENO Fusarium oxysporum f. sp. dianthi RAZA 2
Con el fin de evaluar la viabilidad y virulencia del patógeno, se determinó la incidencia de síntomas del marchitamiento vascular en plantas mantenidas como control de la enfermedad. El tratamiento T2, correspondiente a la variedad susceptible inoculada fue altamente afectado por el patógeno (incidencia de 100%). Para T4, solo algunas plantas (< 30%) mostraron síntomas al término de dicho control. La variedad tolerante no mostró ninguna sintomatología a los tiempos de evaluación de las enzimas. Los controles, T1 y T3, se mantuvieron sanos durante todo el experimento.
En cuanto a la evaluación de la actividad de las enzimas durante el proceso infectivo, se determinó que a las 12 h post-inoculación se presentó una inducción significativa (p > 0,5) de la actividad PFO en la variedad de clavel tolerante, inducción que se mantuvo hasta las 48 horas (Tabla 1). Para la variedad susceptible no se presentó aumento significativo de la actividad de esta enzima, respecto a los controles.
| Tiempo post-inoculación (h) | T1 Susceptible control | T2 Susceptible inoculada | T3 Tolerante control | T4 Tolerante inoculada |
| 0 | 31,40a | 31,40a | 42,65b | 42,65b |
| 6 | 19,74a | 25,44a | 19,49a | 22,40a |
| 12 | 17,90c | 22,80b | 29,97a | 60,09d |
| 24 | 21,05c | 16,44b | 7,33a | 34,16d |
| 48 | 20,65a | 22,82ab | 24,91bc | 29,14c |
| 96 | 15,17a | 16,99a | 10,82a | 13,49a |
| 192 | 11,32a | 15,68a | 22,95ab | 10,35a |
Tabla 1. Comportamiento de la actividad polifenoloxidasa durante el ensayo in vivo de inoculación de esquejes de clavel con Fusarium oxysporum f. sp. dianthi raza 2. Se realizaron triplicados de extracción para cada tratamiento en cada uno de los tiempos y duplicado de la actividad para cada extracto. Los tratamientos que presentan diferencias significativas (p < 0,5) aparecen con letras diferentes.
La inducción de la actividad PFO observada en la variedad tolerante, después de la inoculación con el hongo, indica que dicha respuesta metabólica puede estar correlacionada con resistencia del clavel ante el patógeno Fusarium oxysporum f. sp. dianthi raza 2, tal y como ha sido reportado en otros modelos que involucran patógenos del género Fusarium (Goodman et al., 1986; Ray y Hammerschmidt, 1998; Mohammadi y Kamesi, 2002). Considerando la importancia que tienen para la biosíntesis de fenoles enzimas como la PFO (Beckman, 2000), es probable que dicho aumento en la actividad esté correlacionado con el aumento en el metabolismo de los fenoles, proceso éste que ha sido sugerido como relacionado con defensa para este modelo (Niemann et al., 1991), dado el aumento que se observó en la cantidad de fenólicos en trabajos previos realizados por nuestro grupo de investigación (Higuera y Montes, 1996). El aumento en la actividad PFO, ya sea por la liberación de formas latentes o por activación transcripcional, puede estimular vías clave del metabolismo secundario y generar incremento en los niveles de los compuestos fenólicos presentes en las células parenquimáticas del xilema. Estos compuestos, a su vez, pueden diversificarse para generar especies con actividad antifúngica, así como participar en la biosíntesis de ligninas, otra respuesta que ha sido sugerida como relacionada con defensa en el presente modelo (Baayen et al., 1996, Higuera y Nesbat-Ebrahim, 1999). Dado que la participación de la PFO en procesos relacionados con el fortalecimiento de paredes celulares es un fenómeno que ha sido bastante documentado (Mayer, 1987; Beckman, 2000), es probable que dicha enzima también desempeñe un papel central para lograr este efecto durante el evento mismo de la interacción del clavel con el patógeno causante del marchitamiento vascular. Es importante destacar que con la evidencia experimental del presente estudio se propone la participación de la enzima PFO en los mecanismos de defensa del clavel contra Fod raza 2, el patógeno que afecta mayormente el cultivo de esta flor en Colombia y en el mundo, siendo éste el primer reporte de dicha inducción.
En lo que respecta a la actividad β-1,3-glucanasa, durante la infección con el patógeno se presentó una inducción temprana en la variedad susceptible a las 12 h y 24 h horas post-inoculación, mientras que para la tolerante dicha inducción se presentó a un menor nivel, 12 horas mas tarde. Este comportamiento indica que, aunque esta enzima ha sido propuesta en ocasiones como clave en mecanismos de defensa vegetal que actúan contra patógenos causantes de marchitamientos vasculares (Benhamou et al., 1989), en el presente modelo no se encontró evidencia que indique que participe en defensa activa (Tabla 2).
| Tiempo | T1 Susceptible | T2 Susceptible | T3 Tolerante | T4 Tolerante |
| 0 | 4,26a | 4,26a | 3,42a | 3,42a |
| 6 | 6,23c | 1,75a | 3,23b | 2,16ab |
| 12 | 1,64a | 4,95ab | 3,50bc | 2,40c |
| 24 | 2,60a | 7,16b | 2,74a | 1,49a |
| 48 | 1,76a | 4,18b | 2,28a | 3,81b |
| 96 | 1,14a | 1,43a | 0,98a | 4,13b |
| 192 | 0,63a | 2,48b | 0,44a | 1,05a |
Tabla 2. Comportamiento de la actividad β-1,3-Glucanasa durante el ensayo in vivo de inoculación de esquejes de clavel con Fusarium oxysporum f. sp. dianthi raza 2. Se realizaron triplicados de extracción para cada tratamiento en cada uno de los tiempos y duplicado de la actividad para cada extracto. Los tratamientos que presentan diferencias significativas (p < 0,5) se presentan con letras diferentes.
Estos resultados indican que, más que relacionado con resistencia, dicho aumento en la actividad puede corresponder a una respuesta inespecífica, presentada en ambas variedades por el estrés biótico causado por el patógeno. La modulación espaciotemporal de dicha activación estaría determinada en cada una de las variedades por la velocidad de colonización del patógeno. Por ejemplo, para la variedad susceptible la inducción se observa a tiempos menores, ya que en esta variedad la colonización del patógeno es mucho más rápida que en la variedad resistente. Por otro lado, la cantidad de patógeno que se establece en los tejidos de la planta susceptible a las 12 h, es mucho mayor que la presente en la resistente a las 24 h, por lo que los niveles de inducción en la primera son superiores que en la segunda. Este modelo está de acuerdo con lo propuesto por Van Pelt-Heerschap y Smit-Bakker, (1999), quienes al estudiar la inducción de algunas proteínas relacionadas con patogénesis en tallos de una variedad holandesa de clavel durante la interacción con Fod raza 1 y 8, encontraron que se presenta una inducción no específica para enzimas como glucanasas, quitinasas y peroxidasas, tanto en interacciones compatibles como incompatibles. Este comportamiento nos permite concluir que los fenómenos bioquímicos relacionados con resistencia en este modelo son bastante complejos, y deben estar determinados por el reconocimiento efectivo del patógeno invasor por parte de la planta.
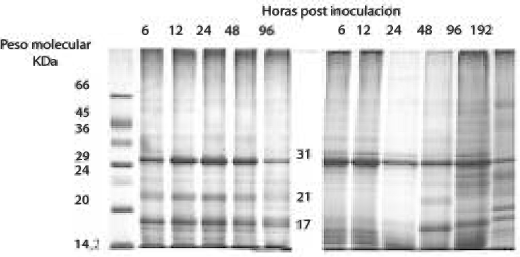
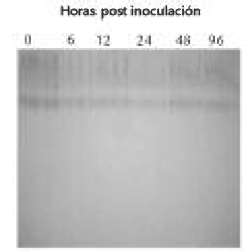
PERFILES ELECTROFORÉTICOS DE LOS EXTRACTOS A DIFERENTES TIEMPOS POST - INOCULACIÓN
Con el fin de buscar correlación con la inducción de actividad observada para las enzimas, se evaluaron los perfiles electroforéticos de extractos de las dos variedades a los diferentes tiempos post-inoculación. Para las electroforesis en condiciones desnaturalizantes, es importante destacar que existe un conjunto de bandas (31, 21 y 17 KDa) que presentan un aumento en su intensidad, únicamente en los extractos obtenidos a partir de la variedad tolerante “Carolina” inoculada con el hongo (Fig. 5). Dichas bandas deben corresponder a proteínas que hacen parte del conjunto de las que se inducen durante la activación de los mecanismos de defensa del clavel contra este patógeno. Por otro lado, la tinción específica para PFO (Fig. 6) indicó que, al parecer, el número de isoenzimas de ésta permanece constante durante todo el proceso infectivo, y que la inducción de la actividad está probablemente dada por la modulación de isoformas presentes. Sin embargo, considerando que se pueden presentar diferentes isoenzimas en esta misma banda, este resultado debe ser confirmado a través de experimentos de isoelectroenfoque.
Figura 5. SDS-PAGE de extractos de tallos de la variedad tolerante “Carolina” (izquierda) y susceptible “Uconn” (derecha), inoculados con Fusarium oxysporum f.sp. dianthi raza 2.
Figura 6. Tinción específica para PFO de extractos de la variedad tolerante “Carolina” inoculada con Fusarium oxysporum f. sp. dianthi raza 2.
El conjunto de evidencias experimentales aportadas con este estudio contribuyen a la elucidación de los mecanismos de defensa que actúan en el clavel contra Fusarium oxysporum f. sp. dianthi raza 2. El conocimiento de dichos mecanismos dará las bases para el desarrollo de nuevas alternativas de control de esta enfermedad y obtener así condiciones económicas favorables para la producción del clavel.
AGRADECIMIENTOS
Los autores agradecen el importante apoyo financiero y de infraestructura otorgado por COLCIENCIAS (proyecto código 1101-05-11440), el Departamento de Química de la Universidad Nacional de Colombia y la empresa América Flor Ltda.
BIBLIOGRAFÍA
AKIYAMA T, SHIBUNA N, HRMONA M, FINCHER G. Purification and Characterization of a beta-1,3-D-Glucan Endohydrolase From Rice (Oryza sativa) Bran. Carbohydr Res. 1997;297:365-374.
[ Links ]BAAYEN RP. Responses Related to Lignification and Intravascular Epiderm Formation on Carnations Resistant to Fusarium Wilt. Can J Bot. 1988;66:784-792.
[ Links ]_______________, NIEMANN G. Correlations Between Accumulation of Dianthramides, Dianthalexin and Unknown Compounds, and Partial Resistance to Fusarium oxysporum f. sp. dianthi in Eleven Carnation Cultivars. J Phytopathol. 1989;126:281-292.
[ Links ]_______________, OUELLETTE G, RIOUX D. Compartimentalization of Decay in Carnations Resistant to Fusarium oxysporum f. sp. dianthi. Phytopathology 1996; 86: 1018-1031.
[ Links ]BECKMAN CH. Phenolic-Storing Cells: Keys to Programmed Cell Death and Periderm Formation in Wilt Disease Resistance and in General Defence Responses in Plants? Physiol Mol Plant Pathol. 2000;57:101-110.
[ Links ]BENHAMOU N, GRENER J, ASSELIN A, LEGRAND M. Immunogold Localization of beta-1,3-Glucanases in Two Plants Infected by Vascular Wilt Fungi. Plant Cell. 1989;1:1209-1221.
[ Links ]BRADFORD MA. A Rapid and Sensitivity Method for Detection of Binding-Dye Proteins. Anal Biochem. 1976;72:248-254.
[ Links ]CARUSO C, CHILOSI G, CAPORALE C, LEONARDI L, BERTINI L, MAGRO P, et al. Induction of Pathogenesis-Related Proteins in Germinating Wheat Seeds Infected with Fusarium oxysporum. Plant Sci. 1999;140:107-120.
[ Links ]CHUNHUA S, YA D, BINGLE X, XIAOLONG X, YONGSHU X, QINGLIANG L. The Purification and Spectral Properties of Polyphenol Oxidase I from Nicotiana tabacum. Plant Mol Biol Rep. 2001;19:381a-381h.
[ Links ]CONSTABEL C, YIP J, PATTON L, CHRISTOPHER M. Polyphenol Oxidase from Hybrid Poplar Cloning and Expression in Response to Wounding and Herbivory. Plant Physiol. 2000;124:285-295.
[ Links ]DEUTSCHER MP. Guide to Protein Purification, Methods in Enzimology. San Diego California: Academic Presss, Inc.; 1990:182 p. 153, 161, 267, 296-298.
[ Links ]HIGUERA BL, MONTES V. Contribution of HPLC to the Study of the Defence Mechanisms Acting in Carnation (Dianthus caryophyllus L.) Roots on Infection with Fusarium oxysporum f. sp. dianthi. J High Resolut Chromatogr. 1996;19:706-708.
[ Links ]_______________, NESBAT-EBRAHIM F. Study of Vascular Root Responses as Defense Mechanisms in Carnation Resistant or Susceptible to Fusarium oxysporum f. sp dianthi by Transmission Electron Microscopy. Acta Hortic. 1999;482:101-108.
[ Links ]JHARNA R, SANTHOOR G, LALITHA R. Purification and Characterization of a Polyphenol Oxidase From the Kew Cultivar of Indian Pineapple Fruit. J Agric Food Chem. 1997;45:2031-2035.
[ Links ]LAEMMLI UK. Cleavage of Structural Proteins During the Assembly of the Head of Bacteriophage T4. Nature. 1970;27:680-683.
[ Links ]LAWRENCE CB, JOOSTEN M, TUZUN S. Differential Induction of Pathogenesis-Related Proteins in Tomato by Alternaria solani and the Association of a Basic Chitinase Isozyme whit Resistance. Physiol Mol Plant Pathol. 1996;48:361-377.
[ Links ]MAUCH F, HADEWIGER L, BOLLER T. Ethylene Induction of Chitinases and beta-1,3-Glucanases in Pea Pods and Elicitors. Plant Physiol. 1984;76:607-611.
[ Links ]MAYER A M. Polyphenol Oxidases in Plants-Recent Progress. Phytochemistry. 1987;26:11-20.
[ Links ]MAZZAFERA P, ROBINSON S. Characterization of Polyphenol Oxidase in Coffee. Phytochemistry. 2000;55:285-296.
[ Links ]MOHAMMADI M, KAMESI H. Changes in Peroxidase and Polyphenol Oxidase Activities in Susceptible and Resistant Wheat Heads Inoculated with Fusarium graminearum and Induced Resistance. Plant Sci. 2002;162:491-498.
[ Links ]NIEMANN G, BOON J, PUREVEEN J, EIJKEL G, VAN DER HEIJDEN E. A Microanalytical Approach to Plant Tissue Characterization: A Comparative Study of Healthy and Fungus-Infected Carnation by Pyrolysis-Mass Spectrometry. J Anal Appl Pyrolysis. 1991;19:213-236.
[ Links ]_______________, VAN DER KERK A, NIESSEN W, VERSLUIS K. Free and Wall-Bound Phenolics and Other Constituents From Healthy and Fungus-Infected Carnations Dianthus caryophyllus L. Stems. Physiol Mol Plant Pathol. 1991;38:417-432.
[ Links ]OKINAWA Y, MIMORI K, TAKEO K, KITAMURA S, TAKEUCHI Y, YAMAOKA N, et al. A Structural Model for the Mechanisms of Elicitor Release From Fungal Cell Walls by Plant beta-1,3-Endoglucanase. Plant Physiol. 1995;109:839-845.
[ Links ]PIZANO DE MM. Clavel (Dianthus caryophyllus L). 1ª ed. Bogotá: Editorial Hortitecnia Ltda.; 1995.
[ Links ]RAMACHANDRA K, VASANTHI N, UMESH-KUMAR S, SECAR SHETTY H. Purification and Properties of Major Isoform of beta-1,3-Glucanase From Pearl Millet Seedlings. Plant Sci. 2000;150:139-145.
[ Links ]RAY H, HAMMERSCHMIDT R. Responses of Potato Tuber to Infection by Fusarium sambucinum. Physiol Mol Plant Pathol. 1998;53:81-92.
[ Links ]RUBIO E. Estudio del cambio de la actividad polifenol oxidasa durante el proceso de maduración del lulo (Solanum quitoense L). [Tesis de maestría]. Bogotá: Facultad de Ciencias. Universidad Nacional de Colombia. 1999.
[ Links ]SALLES II, BLOUNT J, DIXON R, SCHUBERT K. Phytoalexins Induction and beta-1,3-Glucanase Activities in Colletotrichum trifolii Infected Leaves of Alfalfa (Medicago sativa L.) Physiol Mol Plant Pathol. 2002;61:89-101.
[ Links ]SOMOGYI M. A New Reagent for the Determination of Very Small Amounts of Sugars. J Biol Chem. 1945;160:61-67.
[ Links ]STINTIZI A, HEITZ T, PRASAD V, WIEDERMANN MERDINOGLU S, KAUFFMAN S, GREOFFROY P, et al. Plant “Pathogenesis-related” Proteins and Their Role in Defence Against Pathogens. Biochimie. 1993;75:687-706.
[ Links ]THIPYAPONG P, JOEL D, STEFFENS J. Systemic Wound Induction of Potato (Solanum tuberosum) Polyphenol Oxidase. Phytochemistry. 1995;40:673-676.
[ Links ]TRILLAS ML, COTXARRERA L, CASANOVA E, CORTADELLAS N. Ultraestrucutural Changes and Localization of Chitin and Callose in Compatible and Incompatible Interactions Between Carnation Callus and Fusarium oxysporum. Physiol Mol Plant Pathol. 2000;56:107-116.
[ Links ]VAN PELT HEERSCHAP H, SMIT-BAKKER O. Analysis of Defence-Related Proteins in Stem Tissue of Carnation Inoculated with a Virulent and Avirulent Race of Fusarium oxysporum f. sp. dianthi. Eur J Plant Pathol. 1999;105:681-691.
[ Links ]ZOR, SELLINGER. Linearization of the Bradford Protein Assay Increases its Sensitivity: Theorical and Experimental Studies. Anal Biochem. 1996;236:302-305.
[ Links ]