Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.11 no.1 Bogotá June 2006
EFECTO DE INOCULANTES MICROBIANOS SOBRE LA PROMOCIÓN DE CRECIMIENTO DE PLÁNTULAS DE MANGLE Y PLANTAS DE Citrullus vulgaris SAN ANDRÉS ISLA, COLOMBIA
Microbial Inoculantes Effects on Growth Promotion of Mangrove and Citrullus vulgaris San Andrés Isla, Colombia
TANIA GALINDO1, JAIME POLANÍA2, JIMENA SÁNCHEZ1, NUBIA MORENO3, JAVIER VANEGAS1, GINA HOLGUÍN4
1Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia, Sede Bogotá.
2Instituto de Estudios Ambientales, Universidad Nacional de Colombia, Sede Medellín.
3Laboratorio de Bioprocesos, Instituto de Biotecnología, Universidad Nacional de Colombia, Sede Bogotá.
4Centro de Investigaciones Biológicas del Noreste de México. La Paz. Baja California Sur, México.
Presentado agosto 23 de 2005, aceptado octubre 6 de 2005, correcciones febrero 14 de 2006.
RESUMEN
Con el fin de probar la efectividad de dos inoculantes microbianos (aislados a partir de raicillas de mangle rojo y negro) en el crecimiento y establecimiento de plántulas de mangle y de patilla, se realizaron cuatro pruebas en campo en San Andrés Isla, Colombia. Se aplicaron dichos inoculantes en: propágulos de Avicennia germinans colectados en un área de manglar y sembrados en macetas sobre sustrato solarizado (con el fin de disminuir la carga microbiana), plántulas de A. germinans y Rhizophora mangle colectadas en cercanía de árboles semilleros, plántulas de A. germinans y R. mangle sembradas y mantenidas en vivero y en semillas de patilla (Citrullus vulgaris) sembradas en un cultivo libre de fertilizantes químicos. Las variables tomadas como indicativo de crecimiento y desarrollo vegetal fueron: número de nodos, número de hojas y longitud del tallo. Los inoculantes (microorganismos solubilizadores de fosfatos -MSF- y bacterias fijadoras de nitrógeno -BFN-) se aplicaron en el material vegetal mencionado, efectuando mediciones durante tres meses. Los resultados muestran un efecto positivo de estimulación de crecimiento medido en longitud del tallo en las plantas tratadas con los inoculantes, específicamente en patilla y propágulos de A. germinans mantenidos en vivero.
Palabras clave: manglares, microorganismos promotores de crecimiento vegetal, restauración, biofertilizantes, solubilizadores de fosfato, fijadores de nitrógeno.
ABSTRACT
In order to test the effect of two microbial inoculants (obtained from red and black mangrove roots) on the growth and stability of mangrove and watermelon plants, four treatments were carried out in San Andres Island, Colombia. The treatments consisted in the application of the inoculants in: A. germinans propagules collected in a mangrove area, and then individually planted in gavels with sun-pasteurized soil (in order to decrease the microbial load), A. germinans and R. mangle plants collected in the proximity of nursery trees, A. germinans and R. mangle planted and maintained in nursery, and in Citrullus vulgaris seeds planted in a traditional cultivar without chemical fertilizers. The growth and vegetative development variables were: number of nodes, number of leaves and steam length. The inoculants (phosphate solubilizing microorganisms -PSM- and nitrogen fixing bacteria -NFB-) were applied in the mentioned vegetable material, doing measures during three months. The results show a positive effect on growth measured by steam length in plants treated specifically with the inoculants in C. vulgaris and A. germinans seedlings maintained in nursery.
Key words: Mangroves, Plant Growth Promoting Microorganisms, Restoration, Biofertilizers.
INTRODUCCIÓN
Los manglares son ecosistemas de zonas litorales tropicales y subtropicales compuestos por varias especies de árboles y arbustos dominantes, donde las especies más abundantes en Colombia son Rhizophora mangle (mangle rojo) y Avicennia germinans (mangle negro) las cuales están adaptadas a aguas salobres y suelos fangosos deficientes en oxígeno (Sánchez et al., 2000). La importancia de estos ecosistemas radica en que albergan gran diversidad de microorganismos e invertebrados en sus sedimentos y son lugar de cría, refugio y zona de alimentación de peces, moluscos, tunicados, poliquetos, algas, crustáceos y aves. De estos ecosistemas dependen diferentes especies de peces para su desarrollo y maduración, así como muchas especies de camarones de importancia comercial que pasan parte de su estado juvenil dentro del manglar. Los manglares son sistemas altamente productivos y se considera que exportan materia y energía a ecosistemas adyacentes (Holguín et al., 2001; Sánchez et al., 2000). Sin embargo, el impacto que han generado actividades humanas tales como alteración de flujos hídricos, turismo, construcciones civiles, contaminación y sobreexplotación, han provocado un estado crítico en los manglares alrededor del mundo y del Caribe colombiano (Sánchez et al., 2000; Alongi, 2002). Cerca de 40.000 ha de manglar en el Caribe colombiano han sido alteradas y deterioradas, al punto de perder su arbolado y en la actualidad, se presentan como zonas de alta salinidad con componentes faunísticos bastante disminuidos (Polanía et al., 2001).
Dentro de las estrategias para la restauración de los manglares en Colombia se ha encontrado que el mejor método para repoblar zonas deterioradas es el de transplante de plántulas germinadas y mantenidas por un tiempo (2-4 meses) en vivero, en donde se ha sugerido que las razones principales de la efectividad son la consolidación de un sistema radicular capaz de soportar las condiciones propias de la costa y un mejor estado fitosanitario en las plantas germinadas en vivero (Cañón y Rodríguez, 1994; Chan, 1995; Guevara, 1998; Rodríguez, 1998; Sánchez et al., 2000).
De otro lado, la participación de microorganismos en el funcionamiento y transformación de nutrientes dentro de los ecosistemas de manglar ha sido bien documentada por Holguín et al. (1992, 2001) y Vázquez et al. (2000), quienes han aislado y aplicado microorganismos obtenidos de rizósfera de mangle en plántulas de mangle, obteniendo un aumento en la incorporación de nitrógeno foliar, siendo aún mayor al inocular una mezcla del microorganismo solubilizador de fosfatos (MSF) Bacillus licheniformis y la bacteria fijadora de nitrógeno (BFN) Phyllobacterium sp. La aplicación de microorganismos promotores de crecimiento vegetal (MPCV) en plántulas de mangle, representa una alternativa adicional de mejoramiento con respecto a las técnicas ya utilizadas de restauración de ecosistemas de mangle, ya que permiten mejorar la sanidad de las plántulas, aumentar el aporte de nutrientes y fortalecer su sistema radicular, lo cual resulta útil en el establecimiento de manglares artificiales en zonas deterioradas por deforestación. Adicionalmente, se ha demostrado que estos microorganismos son útiles en el aumento de la productividad de plantas de interés comercial (Vanegas, 2004) y por lo tanto podrían suplir las deficiencias de nutrientes de forma eficiente de cultivos estratégicos que deben crecer en suelos salinos como la patilla o sandía (Citrullus vulgaris), fruta cucurbitácea muy comercializada en el mercado isleño, con una producción de 231 toneladas en 17,1 hectáreas para el año 2001 en la isla de San Andrés (Secretaria de Agricultura, 2001). El objetivo del presente trabajo fue establecer el efecto de la aplicación de microorganismos aislados de rizósfera de manglar, con actividad fijadora de nitrógeno y solubilizadora de fosfatos comprobada previamente in vitro (Vanegas et al., en prensa), sobre el crecimiento de plántulas de mangle (A. germinans y R. mangle) y patilla (Citrullus vulgaris), relacionando los resultados obtenidos con el potencial biotecnológico de los inoculantes en procesos de restauración, reforestación y uso como biofertilizantes.
MÉTODOS
ZONA DE MUESTREO
Tanto los microorganismos rizosféricos como el material vegetal se obtuvieron a partir de zonas de manglares en San Andrés Isla, Colombia. La isla abarca 25 km2, está situada al oeste del mar Caribe, a 800 km de la costa colombiana y 150 km de la de Nicaragua y se encuentra entre los 12°29 y 12°36 latitud norte y 81°41 y 81°43 longitud oeste (IGAC, 1986; Fig. 1). La zona de muestreo se encuentra descrita en detalle en Vanegas (2004). La extracción de material vegetal se hizo en el manglar de Bahía Hooker de 34,4 ha, descrito como manglar de borde, cuyas especies más importantes son R. mangle distribuida hacia la franja exterior del lado de la costa, A. germinans hacia la parte más alejada de la costa y Laguncularia racemosa de ubicación intermedia entre las otras dos especies (Buitrago y Cuartas, 2003).
Figura 1. Localización de la isla de San Andrés y los manglares de muestreo.
INOCULANTES MICROBIANOS
Los microorganismos que se utilizaron para los ensayos de inoculación en el presente estudio, fueron aislados en el Laboratorio de Microbiología del Suelo del Departamento de Biología de la Universidad Nacional de Colombia, Sede Bogotá, a partir de raicillas de 1 cm de plántulas de R. mangle y A. germinans lavadas con agua de mar estéril e incubadas a 30° C por siete días en medios selectivos para cada grupo funcional. Para su aislamiento y evaluación de la actividad fijadora de nitrógeno se siguió la metodología propuesta por Holguín et al. (1992). Con el grupo de solubilizadores de fosfato se desarrolló la metodología propuesta por Vázquez et al. (2000). La caracterización y evaluación de la actividad de los microorganismos se encuentra consignada en Vanegas (2004) y Galindo (2005). Las cepas con mayor actividad fijadora de nitrógeno (Azotobacter vinelandii) y solubilización de fosfato (cepa BSF2 con identificación presuntiva: Aquaspirillum sp. y Penicillium sp.) en pruebas in vitro, fueron seleccionadas para llevar a cabo las pruebas de crecimiento vegetal. Se realizó la estandarización de condiciones óptimas de crecimiento de los microorganismos mediante la evaluación del efecto de factores fisicoquímicos y cinética de crecimiento con el fin de obtener información previa del comportamiento de las cepas para establecer las condiciones de fermentación. (Valencia, 2004), así como pruebas cualitativas de antagonismo entre los tres microorganismos mediante la técnica de enfrentamiento (Madigan et al., 2000) para determinar posibles efectos de inhibición del crecimiento entre las cepas. Posteriormente, se procedió a la obtención de inoculantes microbianos de la siguiente manera: A. vinelandii (extracto de levadura 4 g/L, NaCl 1g/L, KH2PO4 4 g/L, pH 7), BSF2 (caldo nutritivo 8 g/L, pH 8), Penicillium sp. (extracto de malta 10 g/L pH 6). El volumen de fermentación fue de 1 L en condiciones de agitación constante a 180 rpm por 24 horas. Estos inoculantes se envasaron asépticamente en recipientes de vidrio color ámbar, herméticamente sellados y se mantuvieron en condiciones de refrigeración hasta el momento de su aplicación. Se efectuó control de pureza mediante siembra en agar papa dextrosa para Penicillium sp., en agar nutritivo para la bacteria solubilizadora BSF2 y A. vinelandii. Para los ensayos de campo en San Andrés isla, se utilizaron dos tipos de inoculantes: 1) BFN (A. vinelandii); 2) MSF (Penicillium sp. y BSF2), cada uno fermentado independientemente con una concentración de 108 ufc/mL y mezclado en el momento de la aplicación en igual proporción.
EXPERIMENTOS CON PLÁNTULAS
Inoculación de plántulas de A. germinans y R. mangle bajo condiciones de vivero. Se colectaron propágulos de A. germinans y R. mangle en el manglar de bahía Hooker y se sembraron durante el mes de octubre de 2003 en macetas de capacidad aproximada de 0,015 m3, conteniendo un sustrato consistente de 25 partes de suelo comercial (proveniente de un vivero de la isla), por seis partes de arena, regadas con agua dulce tres veces y una vez con agua de mar (diluida al 50% con agua dulce), cada semana y se mantuvieron en la sombra con radiación solar directa en las mañanas hasta el día de la inoculación. A partir del quinto mes de siembra se mantuvieron 60 plántulas con riego en mañana y tarde con el agua de mar diluida una vez por semana. Al cumplirse el sexto mes de siembra se aplicaron 10 mL de cada uno de los inóculos microbianos (MSF y BFN) a una distancia de 10 cm del tallo con ayuda de una jeringa: se registraron durante tres meses datos de altura, número de hojas y número de nodos. La altura se midió desde el anillo cotiledonar hasta el final del tallo (base de la yema apical principal) en R. mangle y en A. germinans desde el primer nodo (correspondiente al anillo cotiledonar), hasta la base de la yema apical de la rama principal. El número de nodos se midió en la rama principal y en las ramificaciones (registrando el número total de nodos por plántula).
Inoculación de propágulos de A. germinans bajo condiciones de vivero. Para disminuir la carga microbiana del sustrato utilizado en este experimento, con alteración mínima de sus condiciones naturales (Holguín, comunicación personal), éste fue sometido a solarización durante dos semanas: 200 kg de cieno extraído del manglar de bahía Hooker se extendieron sobre plástico negro de 1 x 2 m, se humedeció y se cubrió con otro plástico de igual tamaño. Este suelo se pulverizó al cabo de dos semanas y se conservó en lonas estériles máximo por un día antes de ser utilizado. Los tratamientos a los que no se les aplicó inoculantes se denominaron arbitrariamente control positivo (sustrato solarizado) y negativo (sustrato no solarizado). 80 propágulos de A. germinans colectados en el manglar de bahía Hoocker en buen estado fitosanitario, se lavaron con agua de mar y se mantuvieron con abundante agua destilada hasta el siguiente día cuando se sembraron los propágulos en cinco grupos, cada uno con 12 réplicas: i) inoculados con MSF, sobre sustrato solarizado; ii) inoculados con A. vinelandii, sobre sustrato solarizado; iii) inoculados con la mezcla de A. vinelandii y MSF, sobre sustrato solarizado; iv) control positivo, que consistió en sustrato solarizado, sin inoculación alguna; v) control negativo, con sustrato no solarizado, sin inoculación. Los inoculantes se aplicaron asépticamente a los propágulos antes de ser sembrados, sumergiendo los propágulos en las suspensiones bacterianas respectivas durante 2 h en matraces de 100 mL (Holguín, comunicación personal). El sustrato se preparó con arena de playa y cieno (50:50; sensu Ulloa et al., 1998). Las plántulas sembradas se mantuvieron con riego de agua dulce diario y agua de mar diluida al 50% una vez por semana, registrando semanalmente los datos de germinación y mortalidad de las plántulas.
Establecimiento de plántulas silvestres de A. germinans y R. mangle a partir de colectas cerca de árboles semilleros. Se extrajeron 60 plántulas de A. germinans con bola de suelo mediante tubos de plástico de 5,1 cm de diámetro y 60 cm de longitud, enterrándolos de 15 a 20 cm con la plántula centrada. Con una pala de jardinería se cortó el pan de tierra y se extrajo el tubo. Luego se colocó todo el conjunto sobre la boca de una bolsa de 20 x 8 cm y con la ayuda de una pala, se empujó el pan de tierra hacia la bolsa. Las plántulas se mantuvieron en vivero con riego diario con agua de mar diluida al 50% y luz solar natural, permitiendo la consolidación del pan de tierra. Luego de 30 días, se sembraron las plántulas a 1 m de distancia una de la otra, en suelo firme (Sánchez et al., 2000), en terrenos del colegio CEMED, al sur de la isla, en donde se suministró riego cada dos días con agua salobre. En el momento de la siembra se aplicaron 10 mL de los inoculantes (MSF y BFN) con jeringa en cada bola de tierra. De la misma manera, se extrajeron y sembraron plántulas de R. mangle separándolas 1 m para individuos del mismo tratamiento y con un periodo previo de permanencia en vivero de ocho días, teniendo en cuenta que el tubo utilizado para la extracción fue de cinco pulgadas y tenía incorporada la bolsa, con el fin de evitar el maltrato de las raíces al trasplantar la plántula. Semanalmente y por espacio de tres meses, se realizaron mediciones de crecimiento y mortalidad, manteniendo las plántulas con riego de agua salobre cada dos días.
Tratamientos sobre plantas de patilla (C. vulgaris) en cultivo tradicional. Semillas de patilla (C. vulgaris), lavadas con abundante agua estéril durante 15 min, se sumergieron en 50 mL de cada inóculo microbiano (MSF y BFN) durante 2 h antes de la siembra. Cada grupo de semillas se sembró por separado en terrenos agrícolas del sur de la isla (Elsy Bar, South End), empleando tres semillas por hoyo en un cultivo que es alternado con yuca (Manihot sculenta) y flor de Jamaica (Hibiscus sabdariffa), en parcelas de 9 x 9 m. Una vez germinadas, se registraron datos de crecimiento de la planta de mayor tamaño de cada hoyo, así como porcentaje de germinación y mortalidad durante la fase vegetativa. Se efectuó riego mínimo (dos veces por semana con agua dulce) durante los tres meses de duración del experimento.
Tratamiento estadístico. Se registraron tasas de crecimiento mensual para las plantas de mangle y diario para las de patilla, utilizando la última y primera lectura de cada variable para cada planta y el número de días o meses trascurridos. Con el fin de determinar diferencias entre tratamientos para las tres variables medidas (altura o longitud del tallo, número de hojas y número de nodos), se aplicó un diseño ANDEVA (análisis de varianza) a una vía de clasificación, en donde el factor fue el inoculante con cuatro niveles: MSF, BFN, mezcla MSF+BFN y control sin tratamiento. Las medias de los tratamientos fueron separadas usando LSD (mínima diferencia significativa) a una p<0,05.
RESULTADOS Y DISCUSIÓN
INOCULACIÓN DE PLÁNTULAS DE MANGLE Y SU DESARROLLO EN VIVERO
El mayor incremento en altura se dio en las plantas de A. germinans con la mezcla de inoculantes (4,4 ± 5,6 cm/mes) y el menor incremento fue registrado para el tratamiento MSF con 2 ± 1,4 cm/mes. La mayor producción en número de hojas la presentaron los tratamientos BFN y control con 0,9 hojas/mes, mientras que el tratamiento MSF presentó el menor valor (0,7 ± 0,7 hojas/mes). El incremento en número de nodos no superó los 1,2 nodos/mes para ningún tratamiento, obteniendo el menor valor para el control con 0,7 ± 0,7 nodos/mes. Los cambios en el parámetro altura fueron menores para plántulas de R. mangle, encontrando que el control registró 0,8 ± 0,8 cm/mes y fue mínimo para la mezcla (0,3 ± 1,5 cm/mes, Tabla 1). Lo anterior se podría explicar en parte por la pérdida de hojas en la zona apical de las plántulas, con el consecuente retoño en nodos basales (presuntamente y sin comprobación, por deficiencias en micronutrientes en el sustrato) y la clorosis intervenal en hojas jóvenes, algunas con necrosis en la yema apical y bordes de la hoja, síntomas de deficiencia de calcio y manganeso (Salisbury y Ross, 1992).
| Tratamiento | Número de plántulas | Cambio/mes | Número de hojas | Número de nodos |
| Altura (cm) | ||||
| A. germinans |
|
|
|
|
| BFN | 12 | 4,1 ± 2,6 | 0,9 ± 0,8 | 1,2 ± 0,5 |
| R. mangle |
|
|
|
|
| MSF | 10 | 1,0 ± 3,8 | 1,0 ± 2,6 | 0,4 ± 1,1 |
Tabla 1. Tasas de crecimiento en plántulas de A. germinans y R. mangle inoculadas con tres diferentes tratamientos microbianos y un control sin tratamiento, registrados durante tres meses (marzo-junio/ 2004) en San Andrés Isla, Colombia. Se presentan valores promedio de al menos 10 réplicas con sus respectivas desviaciones estándar. Los valores negativos indican pérdida de hojas. Al aplicar la prueba LSD no se obtuvieron grupos con diferencias estadísticamente significativas (p > 0,05; todos pertenecieron al grupo A). BFN: Bacteria fijadora de nitrógeno; MSF: Microorganismos solubilizadores de fosfatos; Mezcla: BFN+MSF.
Para las tres variables medidas, excepto en la variable número de hojas con el tratamiento mezcla para A. germinans y número de nodos en BFN para R. mangle (donde el tratamiento fue menor al control), el control se mantuvo por debajo de los tratamientos mezcla y BFN en las dos especies de mangle durante las mediciones semanales. Dadas las condiciones de vivero, los resultados para las plantas de A. germinans tratadas con MSF pudieron verse posiblemente afectados por el ataque de una larva de un díptero no identificado que consumió el interior de algunas hojas jóvenes, así como el ataque de homópteros sobre toda la parte emergida de algunas de las plantas de mayor porte. Este tipo de plagas han afectado experimentos similares en manglar, como lo expone Elster (2000), cuyas tasas de mortalidad aumentaron en A. germinans y L. racemosa a causa de la polilla Junonia evarete. Debido a que solamente este tratamiento fue afectado por estos fitopatógenos, se decidió excluirlo del análisis estadístico y de los resultados expuestos en la tabla 1, ya que ésto pudo haber afectado considerablemente los resultados incluyendo un factor más de variabilidad que no se presentó en los demás tratamientos, lo cual imposibilita la comparación. A los 82 días de iniciado el experimento no se encontraron diferencias significativas, ni grupos estadísticos diferenciales según el análisis de varianza y la prueba de LSD respectivamente, para ninguna de las variables (Tabla 1). La aplicación de microorganismos rizosféricos en este punto del crecimiento vegetal y bajo estas condiciones, al parecer no tuvo efecto en el desarrollo. Cabe resaltar que los datos de la tabla 1 muestran valores altos de desviación estándar, lo que puede ser explicado por la alta variabilidad genética intraespecífica reflejada en los procesos fisiológicos relacionados con el crecimiento de las diferentes especies de manglares (Kathiresan y Bingham, 2001); valores igualmente variables de crecimiento se han documentado en experimentos de reforestación de manglares colombianos, con desviaciones estándar que superan el promedio, aún utilizando grandes tamaños de muestras (entre 100 y 300 plántulas), tal como lo expone Elster (2000). Adicionalmente, el muestreo fue realizado de forma aleatoria en el campo y los propágulos no provenían todos de un mismo árbol; la naturaleza misma del experimento a campo abierto, conlleva una alta variabilidad.
INOCULACIÓN DE PROPÁGULOS DE A. germinans Y CULTIVADOS BAJO CONDICIONES DE VIVERO
Los propágulos sembrados en sustrato no solarizado (control negativo) presentaron mayor porcentaje de mortalidad con respecto a los demás tratamientos, alcanzando un valor de 75% de propágulos muertos frente a 25, 33, 50 y 58% en los tratamientos con MSF, mezcla, BFN y control positivo, respectivamente. Al respecto, Ulloa et al. (1998) registraron mortalidades relativamente bajas para esta especie (33% a los 94 días de siembra en vivero), con valores similares a los obtenidos en los tratamientos con inoculantes del presente trabajo, mientras que Elster (2000) obtuvo altas mortalidades en siembra directa sin fase de vivero (100%); por lo tanto los resultados presentados sugieren que posiblemente esta sea la forma (vivero) más eficiente de mantener propágulos de A. germinans. Los mismos autores exponen que la principal causa de mortalidad de plántulas de mangle son fitopatógenos ocasionales. Este hecho puede cobrar relevancia en el caso particular de San Andrés, donde los manglares presentan notable grado de deterioro (Polanía, comunicación personal), hecho que los hace más vulnerables al ataque de patógenos como bacterias, hongos, virus e insectos (Alongi, 2002), lo que aumentaría la tasa de mortalidad, como se evidenció en los resultados del tratamiento con suelo no solarizado con su carga microbiana nativa normal. Se observaron diferencias significativas en la altura final de las plantas tratadas con inoculantes (Tabla 2). La prueba LSD separó en dos grupos estadísticos diferentes a los controles y a los tratamientos con inoculante: a los 77 días la altura promedio de las plantas con inoculantes alcanzó valores de hasta 13,2 ± 4,8 cm con mezcla, mientras que los valores más bajos se presentaron en los tratamientos control positivo y negativo, con 10,8 ± 4,2 cm y 5,9 ± 1,6 cm, respectivamente. Estos valores ponen en evidencia un aumento de la tasa de crecimiento de las plantas tratadas con inoculantes y en aquellas con suelo solarizado. El establecimiento de propágulos (entendido como supervivencia, crecimiento y desarrollo de un sistema foliar y radicular) en el tiempo evaluado, fue más rápido con MSF (9 propágulos /77 días), mientras que el menor fue el control negativo (3 propágulos/77 días).
| Tratamiento | Número de | Mortalidad | Número de | Promedio de |
| BFN | 12 | 50 | 6 | 11,3 ± (4,8) A |
| MSF | 12 | 25 | 9 | 11,8 ± (5,0) A |
| Mezcla MSF + BFN | 12 | 33 | 8 | 13,2 ± (4,8) A |
| Control + | 12 | 58 | 5 | 10,8 ± (4,2) AB |
| Control - | 12 | 75 | 3 | 5,9 ± (1,6) B |
Tabla 2. Efecto de los tratamientos microbianos sobre la supervivencia, establecimiento y crecimiento de propágulos de A. germinans inoculados y dos controles no inoculados: sustrato solarizado (+) y sin solarizar (-), durante 77 días (marzo-junio/2004) en San Andrés, Isla. BFN: Bacteria fijadora de nitrógeno; MSF: Microorganismos solubilizadores de fosfatos; Mezcla: BFN+MSF. Las letras en mayúscula indican grupos con diferencias estadísticamente significativas según LSD (p<0,05). Para la variable altura se muestra la desviación estándar en paréntesis.
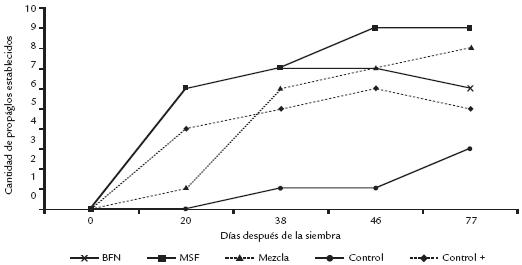
Adicionalmente, dicho proceso fue más rápido en los propágulos tratados con cada inoculante por separado, que en los controles y en la mezcla (Fig. 2). En propágulos con BFN con suelo solarizado, en un período de 20 días se observó establecimiento del 50% de las plantas, mientras que el control con suelo solarizado y la mezcla tardaron 46 y 38 días respectivamente. Así mismo, la supervivencia de los propágulos del tratamiento control fue estadísticamente menor como se evidenció en los valores obtenidos para los porcentajes de mortalidad mencionados anteriormente. Estos resultados sugieren que los inoculantes microbianos son potencialmente útiles en la agilización de procesos de restauración, ya que permitieron un establecimiento más rápido y disminuyeron el porcentaje de mortalidad. Los mecanismos principales de promoción de crecimiento por parte de microorganismos benéficos se han descrito ampliamente (Alexander, 1981; Sylvia et al., 1998; Glick et al., 1999; Rodríguez y Fraga, 1999) e incluyen el establecimiento de los microorganismos por efecto rizosférico de las plantas, gracias a la producción de exudados radicales ricos en fuentes de carbono que aumentan el crecimiento de microorganismos asociados, lo que puede favorecer el crecimiento vegetal al aumentar la toma de nitrógeno y fósforo en particular en estado plantular, protección contra el ataque de posibles fitopatógenos mediante mecanismos de antagonismo y promoción del crecimiento por la actividad de algunos de ellos como reguladores de crecimiento vegetal. Cualquiera de estas causas o la interacción de todas ellas pudieron agilizar el establecimiento y mejor porte de las plántulas tratadas. Específicamente, la protección contra fitopatógenos o microflora que ataca al propágulo retardando su desarrollo parece ser importante en este caso. La diferencia entre el control negativo y el control positivo, indica que probablemente la muerte en propágulos puede estar relacionada con el ataque de microorganismos heterótrofos o fitopatógenos, que descomponen y/o provocan su necrosis y pudrición (síntomas evidentes en el tratamiento con suelo sin solarizar).
Figura 2. Cantidad de propágulos de A. germinans establecidos en el período marzo-junio/2004 en San Andrés isla, con aplicación de tratamientos microbianos antes de la siembra. Tratamientos: BFN: Bacteria fijadora de nitrógeno; MSF: Microorganismos solubilizadores de fosfatos; Mezcla: BFN+MSF; dos controles: sustrato solarizado (+) y fresco sin solarizar (-).
La diferencia entre el tratamiento control con suelo solarizado y los tratamientos con adición de inoculantes demuestra que al aumentar la proporción de BFN y MSF, se pueden generar interacciones en la rizósfera que posiblemente conlleven a la protección de la plántula frente a fitopatógenos. En cuanto a la acción supresiva de patógenos por MSF, se ha demostrado actividad en los hongos Fusarium oxysporum y Penicillium spp., entre otros, y en las bacterias Bacillus subtilis y Pseudomonas fluorescens. Estos microorganismos producen metabolitos o toxinas tales como bulbiformina, fenazina y ácidos orgánicos que pueden inhibir la infección causada por hongos (revisado por Khan y Khan, 2002). De otro lado, un factor que redunda en la promoción de crecimiento por parte de los MSF es la producción de reguladores de crecimiento vegetal. Valero (2003) y Sánchez et al. (2005), encontraron una producción de ácido indolacético, AIA, entre 51 mg/L y 23 mg/L, en cultivos de MSF (Pseudomonas sp.) a las 72 horas de incubación. Sin embargo, desconocemos si nuestras cepas producen AIA y si este factor influyó en el establecimiento y/o promoción del crecimiento de las plántulas de mangle.
Los resultados obtenidos en inoculación de plántulas ya establecidas (apartado anterior), comparado con los resultados de inoculación de propágulos, indican que la aplicación de los inoculantes para fines de reforestación es más efectiva en una etapa prematura del desarrollo, justo antes del desarrollo de las raíces; de tal manera que se fortalece desde el inicio del crecimiento el sistema radical, permitiendo una colonización temprana que competitivamente pueda resultar ventajosa frente a otros microorganismos nativos-heterótrofos, patógenos y benéficos. Es bien sabido que la rizósfera es una zona de estimulación del crecimiento microbiano, encontrando mayor diversidad de microorganismos respecto al suelo no rizosférico, muchos de ellos benéficos (Glick et al., 1999; Vázquez et al., 2000). Al aplicar microorganismos que si bien son nativos, han sido manipulados en el laboratorio para su crecimiento, esto puede generar condiciones metabólicas diferentes a las dadas para estos en su nicho ecológico, por lo cual es posible inferir que al ser aplicados en rizósferas con poblaciones microbianas consolidadas, estos deban competir en el periodo inicial de su aplicación, ganando espacio y recursos frente a las especies presentes dentro del nicho, lo que puede retardar su efectividad o disminuir su efecto en los experimentos con plántulas transplantadas y en las plántulas pregerminadas y mantenidas por un tiempo en vivero. Otro factor que se aprovecha al aplicar los inoculantes en etapa de propágulo es que A. germinans crece relativamente rápido en los primeros meses (Ulloa et al., 1998), lo que permite que la plántula se consolide sana y fuerte durante esta etapa de mayor mortalidad y fragilidad (Elster, 2000).
PLÁNTULAS TRANSPLANTADAS
La inoculación de los microorganismos a las plántulas de A. germinans y R. mangle que fueron transplantadas no arrojó diferencias significativas en los parámetros de crecimiento registrados. No obstante, se observó que el control estuvo por debajo de los tratamientos BFN y MSF en las plántulas de A. germinans (datos no mostrados). Se observa en la tabla 3 que la mortalidad en el transplante de A. germinans supera en todos los casos el 10% y que los mayores valores de mortalidad se presentaron para los propágulos inoculados con MSF o BFN. Es posible que para esta especie la aplicación de los microorganismos en el momento del transplante sea un factor desestabilizante de la rizósfera ya consolidada naturalmente en el manglar. También es necesario tener en cuenta el estrés del transplante que de hecho incluye un alto porcentaje de mortalidad, como se ve en el control positivo y al comparar este experimento con el que se realizó con plántulas desarrolladas en vivero, donde la aplicación de inoculantes no provocó mortalidad alguna en los tratamientos. Con estos resultados se corrobora que la aplicación de inoculantes es más efectiva sobre propágulos que sobre plántulas.
| Tratamiento | Número | Mortalidad | Tasa de | Número de | Número de |
| Altura (cm/día) | |||||
| A. germinans |
|
|
|
|
|
| MSF | 10 | 50,0 | 0,3 | 0,6 | 0,5 |
| R. mangle |
|
|
|
|
|
| MSF | 12 | 8,3 | -1,8 | 0,0 | -0,7 |
Tabla 3. Respuesta en el transplante de plántulas de A. germinans y R. mangle colectadas en cercanías de árboles semilleros y sembradas en campo abierto e inoculadas con MSF, BFN, mezcla MSF + BFN y dos controles: sustrato solarizado (+) y fresco sin solarizar (-), durante el período de marzo-junio/ 2004 en San Andrés isla. BFN: Bacteria fijadora de nitrógeno; MSF: Microorganismos solubilizadores de fosfatos; Mezcla: BFN+MSF.
INOCULACIÓN DE PATILLA SEMBRADA EN CULTIVO TRADICIONAL
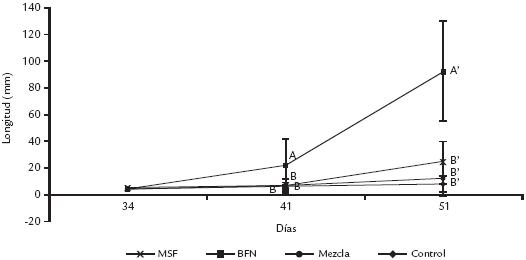
Después de 51 días de haber inoculado y sembrado semillas de patilla (C. vulgaris), se observaron diferencias significativas en la longitud promedio de las plantas tratadas con BFN; aquellas tratadas con MSF y la mezcla se mantuvieron por encima del control (Fig. 3), sin embargo, no presentaron diferencias estadísticas significativas al compararse con éste. La prueba LSD agrupó las medias de longitud total del tallo en dos grupos: A) BFN, B) MSF, mezcla y control. Estos resultados sugieren que la inoculación de patilla con microorganismos benéficos es potencialmente útil en la germinación y primera etapa de desarrollo vegetativo de esta planta. Dicha potencialidad también fue observada por Vanegas (2004), quien obtuvo incrementos significativos en longitud de vástago en tomate (Lycopersicon esculentum) respecto a plantas no inoculadas, aplicando la misma cepa de BFN probada en el presente trabajo. Los porcentajes de germinación también fueron mayores con tratamientos microbianos, alcanzando valores superiores al 50% (58, 53, y 62% para MSF, BFN y mezcla respectivamente), en tanto que el control tan solo alcanzó el 22%. El efecto sobre la germinación puede estar asociado a la producción de diversos reguladores de crecimiento vegetal por parte de las cepas evaluadas (Kumar y Narula, 1999).
Figura 3. Resultados de la tasa de cambio en la longitud del tallo de plantas de patilla con los tratamientos microbianos evaluados. Cada punto es el promedio de 13 réplicas, excepto en el control donde la alta mortalidad no permitió tener el mismo número de réplicas al final del experimento. Las barras corresponden al error estándar; las letras indican grupos estadísticamente diferentes al aplicar la prueba LSD (mínima diferencia significativa) en los días 34 y 51 del experimento. Tratamientos: BFN: Bacteria fijadora de nitrógeno; MSF: Microorganismos solubilizadores de fosfatos; Mezcla: BFN+MSF; control sin inóculo microbiano.
Finalmente, las tendencias generales observadas para los resultados de los diferentes ensayos indican que los inoculantes son potencialmente útiles en procesos de restauración de ecosistemas de manglar en San Andrés isla, si la estrategia utilizada fuese mantenimiento de plántulas en vivero. Ésto fue demostrado con disminución del porcentaje de mortalidad y aumento de longitud promedio del tallo en propágulos de A. germinans inoculados y cultivados en vivero. La utilidad de los inoculantes en especies cultivables, específicamente patilla, puede verificarse teniendo en cuenta que en este estudio aumentó notablemente la longitud final del tallo en plantas tratadas con inoculantes, al igual que los porcentajes de germinación. Estos resultados, sumados a los obtenidos por Vanegas (2004), ofrecen perspectivas para implementar ensayos con otras especies cultivadas en la isla de San Andrés, o en regiones donde los suelos presenten altos niveles de salinidad sódica. De esta manera se aportan herramientas que podrían ser incluidas dentro de programas de manejo para la implementación de cultivos que solucionen problemas de seguridad alimentaria en regiones costeras e insulares. Futuros estudios similares llevan a un fortalecimiento de las técnicas de conservación y restauración de ecosistemas de manglar, no solo por los efectos benéficos de los microorganismos asociados sobre el crecimiento de plantas, sino porque el conocer la biodiversidad microbiana asociada aumenta el valor de estos ecosistemas, justificando su protección y buen uso. De acuerdo con los resultados se concluye que la aplicación de estos inoculantes es más efectiva en propágulos y semillas que en plántulas, pero no resulta efectiva en plantas transplantadas. Se recomienda evaluar la actividad productora de reguladores de crecimiento asociados con la germinación (giberelinas), así como el efecto diferencial en la biomasa y contenido tisular de nitrógeno y fósforo en plantas inoculadas.
AGRADECIMIENTOS
Este trabajo se realizó gracias al apoyo financiero y académico dado por el programa de Trabajos Académicos en la Universidad Nacional de Colombia, Sede San Andrés durante el primer semestre de 2004 y en el marco del proyecto Caracterización y determinación de la actividad biológica de microorganismos del manglar, financiado por la Dirección de Investigación (DIB) de la Universidad Nacional de Colombia, sede Bogotá; al igual que por la financiación otorgada al proyecto en ejecución por CONACYT-COLCIENCIAS. Gina Holguín agradece el apoyo brindado por CONACYT con el proyecto 41367 y a través del programa México-Colombia con el proyecto J200.733/2004. Igualmente, manifestamos nuestro agradecimiento a la profesora Amanda Lozano de Yunda por su aporte académico y a los estudiantes Camila Sánchez, Eder García, Jorge García, Javier Martínez, Sandra Campos, Carolina Mora de la Universidad Nacional de Colombia Sedes San Andrés-Bogotá por su colaboración, así como al señor Luis Cabuyo por prestar sus predios para la investigación.
BIBLIOGRAFÍA
1. ALEXANDER M. Introducción a la microbiología del suelo. México: AGT Editor S.A.; 1981. [ Links ]
2. ALONGI D. Present state and future of the worlds mangrove forests. Environ Conserv. 2002;29(3):331–349. [ Links ]
3. BUITRAGO M, CUARTAS L. Caracterización y zonación de manglar en San Andrés isla, Caribe Colombiano [Trabajo de grado] Medellín: Ingeniería Forestal, Universidad Nacional de Colombia, Sede Medellín; 2003. [ Links ]
4. CAÑÓN G, RODRÍGUEZ H. Ensayos de repoblamiento con Rhizophora mangle en la isla Arena en el parque Nacional Natural Corales del Rosario, Caribe colombiano [Trabajo de grado] Bogotá: Universidad Jorge Tadeo Lozano; 1994. [ Links ]
5. CHAN H. Reforestación en manglares en Malaysia Peninsular. Estudio de caso Matang. En: ISME/ITTO. Restauración de ecosistemas de manglar. Japón: ISME/ITTO; 1995. [ Links ]
6. ELSTER C. Reasons for Reforestation Success and Failure with Three Mangrove Species in Colombia. For Ecol Manage. 2000;131:201-114.
7. GALINDO T. Capacidad solubilizadora de fosfatos de microorganismos rizosféricos en dos manglares del Caribe colombiano. [Trabajo de Grado] Bogotá: Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia, Sede Bogotá; 2005. [ Links ]
8. GLICK B, PATTEN C, HOLGUÍN G, PENROSE M. Biochemical and Genetic Mechanisms Used by Plant Growth Promoting Bacteria London: Imperial College Press; 1999. [ Links ]
9. GUEVARA O. Restauración de las áreas de manglar en el Pacífico continental de Colombia. Proyecto pd 171/91 rev 2 (F) Fase II etapa I Conservación y manejo para el uso múltiple y el desarrollo de los manglares en Colombia. Bogotá: Ministerio del Medio Ambiente/Asociación Colombiana de Restauración/Organización Internacional de Maderas Tropicales; 1998. [ Links ]
10. HOLGUÍN G, GUZMAN M, BASHAN Y. Two New Nitrogen fixing Bacteria from The rhizosphere of Mangrove Trees: Their Isolation, Identification and in vitro Interaction with Rhizosphere Staphylococcus sp. FEMS Microbiol Ecol. 1992;101:207-116.
11. HOLGUÍN G, VÁZQUEZ P, BASHAN Y. The Role of Sediment Microorganisms in the Productivity, Conservation, and Rehabilitation of Mangrove Ecosystem: An Overview. Biol Fertil Soils. 2001;33:265-178.
12. INSTITUTO GEOGRÁFICO AGUSTÍN CODAZZI (IGAC). San Andrés y Providencia. Aspectos Geográficos. Bogotá: IGAC. 1986. [ Links ]
13. KATHIRESAN K, BINGHAM B. Biology of Mangroves and Mangrove Ecosystems. En: Southward A, Young C, Fuiman L, Tyler P. Editores. Advances in Marine Biology. London: Academic Press; 2001;40:82-151.
14. KHAN M, KHAN S. Effects of Root-Dip Treatment with Certain Phosphate Solubilizing Microorganisms on the Fusarial Wilt of Tomato. Bioresour Technol. 2002;85:213–215. [ Links ]
15. KUMAR V, NARULA N. Solubilization of Inorganic Phosphates and Growth Emergence of Wheat as Affected by Azotobacter choroococcum mutants. Biol Fertil. 1999;28:301-305. [ Links ]
16. MADIGAN M, MARTINKO J, PARKER J. Brock Biología de los microorganismos. 8 ed. Madrid: Prentice Hall; 2000. [ Links ]
17. POLANÍA J, SANTOS A, MANCERA J, BOTERO L. The Coastal Lagoon Ciénaga Grande de Santa Marta, Colombia. En: Seeliger U, Kjerfve B. Editores. Coastal Marine Ecosystems of Latin America. Ecological Studies 144. Berlín y New York: Springer Verlag; 2001;33-46. [ Links ]
18. RODRÍGUEZ H. Restauración de las áreas de manglares en el Caribe continental de Colombia. Proyecto pd 171/91 rev 2 (F) Fase II etapa I Conservación y manejo para el uso múltiple y el desarrollo de los manglares en Colombia Bogotá: Ministerio del Medio Ambiente/Asociación Colombiana de Restauración/Organización Internacional de Maderas Tropicales; 1998. [ Links ]
19. RODRÍGUEZ H, FRAGA R. Phosphate Bacteria and Their Role in Plant Growth Promotion. Biotechnol Adv. 1999;17:319-339. [ Links ]
20. SALISBURY F, ROSS C. Fisiología vegetal. México: Editorial Iberoamericana; 1992. [ Links ]
21. SÁNCHEZ J, VALENCIA H, VALERO N. Producción de ácido indolacético por microorganismos solubilizadores de fosfatos presentes en la rizósfera de Espeletia grandiflora y Calamagrostis effusa del páramo El Granizo. En: MA, Bonilla. Editor. Estrategias adaptativas de plantas del páramo y del bosque altoandino en la cordillera Oriental de Colombia. Bogotá: Unibiblos; 2005;177-193. [ Links ]
22. SÁNCHEZ H, ULLOA G, ÁLVAREZ R, GIL W, SÁNCHEZ A, GUEVARA O, et al. Hacia la recuperación de los manglares del Caribe de Colombia. En: Sánchez H, Ulloa G, Álvarez R. Editores. Proyecto PD 171/91 Rev. 2 Fase II (Etapa 2) Conservación y Manejo para el Uso Múltiple y Desarrollo de los Manglares en Colombia. Bogotá: Ministerio del Medio Ambiente/Acofore/OIMT; 2000. [ Links ]
23. SECRETARÍA DE AGRICULTURA DE SAN ANDRÉS ISLA. Informe técnico de la situación agropecuaria en San Andrés Isla. San Andrés: Secretaría de Agricultura; 2001. [ Links ]
24. SYLVIA D, FUHNRMANN J, HARTEL P. Principles and Applications of Soil Microbiology. New Jersey: Prentice Hall; 1998. [ Links ]
25. ULLOA G, SÁNCHEZ H, GIL W, PINO J, RODRÍGUEZ H, ÁLVAREZ R. Conservación y uso sostenible de los manglares del Caribe colombiano. En: Sánchez H, Ulloa G, Álvarez R. Editores. Proyecto PD 171/91. Rev. (f) fase II (etapa I) Conservación y manejo para el uso múltiple y el desarrollo de los manglares en Colombia. Bogotá: MMA/ACOFORE/OIMT; 1998. [ Links ]
26. VALENCIA H. Manual de prácticas de microbiología básica. Notas de clase. Bogotá: Universidad Nacional de Colombia, Sede Bogotá. Facultad de Ciencias. Departamento de Biología; 2004. [ Links ]
27. VALERO N. Potencial biofertilizante de bacterias diazotróficas y solubilizadoras de fosfatos asociadas al cultivo de arroz (Oryza sativa L.) [Tesis de maestría]. Maestría interfacultades Microbiología, Universidad Nacional de Colombia; 2003. [ Links ]
28. VANEGAS J, SÁNCHEZ J, GALINDO T, LOZANO A, POLANÍA J, VALENCIA H, et al. Evaluación in vitro de la fijación de nitrógeno y solubilizadora de fosfato de microorganismos asociados a plántulas de manglar. Suelos Ecuatoriales. En prensa 2006. [ Links ]
29. VANEGAS J. Determinación de la actividad fijadora de nitrógeno de diazótrofos asociados a plántulas de Rhizophora mangle y Avicenia germinans en manglares del Caribe colombiano [Trabajo de grado] Bogotá: Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia, Sede Bogotá; 2004. [ Links ]
30. VÁZQUEZ P, HOLGUÍN G, PUENTE M, LÓPEZ A, BASHAN Y. Phosphate-Solubilizing Microorganisms Associated with the Rhizosphere of Mangroves in a Semiarid Coastal Lagoon. Biol Fertil Soils. 2000;33:265-178.