Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.11 no.2 Bogotá June 2006
CAMBIOS EN LOS ÁCIDOS GRASOS DE MEMBRANA E Microbacterium esteraromaticum GNP5 CON DIFERENTES TEMPERATURAS Y OSMOLARIDADES
Changes in Membrane Fatty Acids of Microbacterium esteraromaticum GNP5 with Changes of Temperature and OsmolarityGRACIELA NATALIA PUCCI, OSCAR HÉCTOR PUCCI .CEIMA Centro de Estudios e Investigación en Microbiología Aplicada Facultad de Ciencias Naturales, Universidad Nacional de la Patagonia, San Juan Bosco, Argentina.
Presentado abril 28 de 2005, aceptado octubre 25 de 2005, correcciones enero 30 de 2006.
RESUMEN
Microbacterium esteraromaticum es un microorganismo que se aísla con frecuencia de landfarming o procesos de biorremediación de hidrocarburos en la meseta de la Patagonia central (Argentina) y se halla sometido a variaciones de temperatura y a cambios de salinidad que se producen naturalmente. Su adaptabilidad a esos cambios climáticos indujo al estudio de las modificaciones que se producen en su membrana celular para resistirlos. En este trabajo se estudió el efecto conjunto de la temperatura y la concentración de cloruro de sodio sobre la composición de los ácidos grasos de membrana en la cepa de Microbacterium esteraromaticum GNP5b. M. esteraromaticum utiliza, frente al incremento de la temperatura, la estrategia es aumentar la longitud de sus ácidos grasos de cadenas ramificada impar (17 átomos de carbono) con disminución de 15:0 anteiso, así como el porcentaje de ácidos grasos 15:0 iso (de mayor punto de fusión) a partir del respectivo anteiso. El aumento de la salinidad modifica la composición de ácidos grasos siguiendo patrones diferentes según sea la temperatura de incubación. A 14 y 28 °C incrementa los 15:0 iso y 17:0 iso en detrimento de sus homólogos anteiso. A 37 °C este grupo de ácidos grasos no sigue los mismos patrones anteriores. La longitud de cadena, expresada como el índice C15/C17, es errática con el aumento de la salinidad.
Palabras clave: Microbacterium esteraromaticum, ácidos grasos, temperatura, salinidad.
ABSTRACT
Microbacterium esteraromaticum is a microorganism that is frequently obtained of cultivations coming from landfarming or hydrocarbons biorremediation processes in the central Patagonia (Argentina) and it is subjected to variations of temperature and changes of salinity that take place naturally. Its adaptability to these climatic conditions took us to study the changes of adaptation that take place in the fatty acids of its membranes. This work studied the combined effect of temperature and salt concentration on the membrane fatty acids composition of Microbacterium esteraromaticum GNP5b strain. M. esteraromaticum, as a result of temperature increases, elongated the fatty acids chains (17 atoms of carbon), decreased 15:0 anteiso, and modified the percentage of fatty acids 15:0 iso starting from the respective anteiso. With salinity increases it modifies its composition of fatty acids according to incubation temperature. At 14 and 28 °C it increases the 15:0 iso and 17:0 iso in detriment of their homologous anteiso. At 37 °C this group of fatty acids does not follow the same previous patterns. The chain length, expressed as the index C15/C17, is erratic with salinity increases.
Key words: Microbacterium esteraromaticum, fatty acids; temperature; salinity.
INTRODUCCIÓN
El género Microbacterium fue propuesto por OrlaJensen (1919) y su descripción fue concluída por Collins et al. 1983; recientemente Takeuchi y Hatano (1998) han propuesto la unión de este género con el género Aureobacterium en una nueva definición del género Microbacterium. M. esteraromaticum, descrito por Omelianski (1923) como
A. esteraromaticum, es un bacilo Gram positivo, móvil por flagelos laterales con pigmento amarillo con una temperatura óptima de desarrollo de 28 °C, y metabolismo respiratorio. La cepa tipo no se desarrolla con concentraciones de NaCl superiores al 2%. Los ácidos grasos mayoritarios son ramificados de carbono impar, mayoritariamente de 15 y 17 átomos de carbono. Es una bacteria que se encuentra con alguna frecuencia en suelos de la Patagonia y que posee capacidades para utilizar hidrocarburos como fuente de carbono y energía.
Los lípidos de las membranas biológicas de las bacterias se mantienen generalmente en estado líquido cristalino para que la temperatura de la fase de transición sea menor que la temperatura ambiente (Suutari y Laakso, 1994) y de esta forma evitar daños en la membrana que llevarían a la muerte celular. El uso del análisis de ácidos grasos de membrana por cromatografía gaseosa para la identificación de bacterias desde la introducción inicial de este método por Abel et al. 1963, han estado de acuerdo con datos obtenidos por métodos que utilizan hibridación DNADNA (Huys et al., 1994; Rainey et al., 1994; Yang et al., 1993), y se usan ampliamente para la identificación de aislamientos clínicos y ambientales (Bousfield et al., 1983; Guckert et al., 1991; Henningson y Gudmestad, 1991; Osterhout et al., 1991; Stead, 1992; Stead et al., 1992). Esta técnica tiene ventajas prácticas, tales como la simplicidad del método analítico, rapidez del análisis, y el bajo costo de los materiales. Además el contenido de todos los ácidos grasos de membranas celulares es una expresión directa y estable del genoma celular. En efecto el patrón de ácidos grasos es un carácter fenotípico que difícilmente es afectado por mutaciones o adquisición o pérdida de plásmidos. Las condiciones de crecimiento tales como la composición del medio de cultivo, la fase del crecimiento o edad de las células, la temperatura de incubación a la que se desarrolla la bacteria y el pH afectan en gran medida la composición de la membrana lipídica, y su fluidez (Annous et al., 1997; Kadner, 1996; Lechevalier y Moss, 1977; McGarrity y Armstrong, 1981; Russell, 1984; Russell et al., 1995; Schweizer, 1989; Sinensky, 1974; Suutari y Laakso, 1994; Dennis y Yatvin, 1981; Rees et al., 1995; Yatvin et al., 1986). Se piensa que estos cambios ocurren para mantener la integridad y funcionalidad de la misma ante las modificaciones de las condiciones externas (Suutari y Laakso, 1994). El principal mecanismo por el cual las bacterias mantienen esta fluidez ideal de la membrana es cambiando la composición de los ácidos grasos (Annous et al., 1997; Russell, 1984; Suutari y Laakso, 1994). En este trabajo se estudió el efecto conjunto de la temperatura y la concentración de cloruro de sodio sobre una cepa de M. esteraromaticum GNP5b aislada de un suelo contaminado con hidrocarburos.
MATERIALES Y MÉTODOS
MICROORGANISMO
Microbacterium esteraromaticum GNP5b se aisló durante el control de un landfarming donde se trataban residuos de la industria petrolera. La ubicación geográfica del aislamiento fue en Comodoro Rivadavia. Este microorganismo se identificó por su perfil de ácidos grasos de membrana utilizando el sistema MIDISherlock. La composición de ácidos grasos aparece en la tabla 1 y los datos de incubación que figuran son los recomendados por el sistema usado para la identificación (medio caldo tripteina soya con el agregado de 15 g/L de agar (TSBA), temperatura 28 °C tiempo de incubación 24h).
TRATAMIENTOS TÉRMICOS Y OSMÓTICOS
Para determinar las modificaciones en los ácidos grasos de membrana la cepa en mención fue cultivada en cada una de las condiciones de este ensayo (temperaturas de 14, 28 y 35 °C y concentraciones salinas de 0,5, 1,5, 2,5 y 3,5% de NaCl para cada una de las temperaturas), en medio TSBA.
EXTRACCIÓN DE ÁCIDOS GRASOS
La extracción de ácidos grasos se realizó por tratamiento de aproximadamente 40 mg (peso húmedo) del microorganismo, efectuando una saponificación con 1 mL de alcohol metílicohidróxido de sodioagua (150 mL:45 g:150 mL) seguida de una metilación a 80 °C con 2 mL ácido clorhídrico 6N y alcohol metílico (325 mL:275 mL) y a continuación una extracción con 1,25 mL de nhexanometil terbutil eter (1:1) y lavado con 3 mL hidróxido de sodioagua (10,8 g 900 mL) de acuerdo con el procedimiento del sistema de identificación SHERLOCK (MIDI Newark, Del., USA).
ANÁLISIS DE ÁCIDOS GRASOS
Los ácidos grasos se determinaron como metil ésteres por cromatografía gaseosa, usando una columna capilar Ultra 2 de 25 m de longitud y 0,2 mm de diámetro. El análisis se llevó a cabo con un cromatógrafo HP 5890 series II GC (inyección splitless; presión inicial 10 psi; programa de temperatura: 170250 °C a 5 °C/min, 260310 °C a 40 °C/min, 1,5 min de permanencia a 310 °C, detector por ionización de llama) controlado por HP 3365 (Hewlett Packard). La integración de los picos se efectuó mediante HP 3365 Chem Station. Los ácidos grasos fueron identificados con estándares Agilent calibration standards kit for the microbial identification system. La composición en ácidos grasos fue calculada como porcentaje del área de pico. La nomenclatura adoptada para los ácidos grasos es: el número anterior a los dos puntos indica el número total de carbonos de la molécula, el número posterior indica el número de dobles ligaduras, el número que sigue a w (en caso de existir) indica el carbono inicial de la doble ligadura seguido de la palabra cis o trans para la correspondiente configuración, el número antes de la palabra metil indica la posición de éste, y la indicación iso o anteiso indica la posición del metilo terminal o subterminal.
| Ácido graso | % |
|---|---|
| 14:0 iso | 0,77 |
| 14:0 | 0,34 |
| 15:0 iso | 3,73 |
| 15:0 anteiso | 50,18 |
| 15:0 | 0,49 |
| 16:0 iso | 20,17 |
| 16:1 w9c | 0,40 |
| 16:0 | 7,38 |
| 17:0 iso | 0,68 |
| 17:0 anteiso | 15,69 |
| 17:0 | 0,17 |
Tabla 1: Composición ácidos grasos de M. esteraromaticum GNP5b a 28 °C y 0,5% NaCl.
TRATAMIENTO DE DATOS
El análisis de agrupamiento se realizó mediante el programa NTSyS usando coeficiente de distancia euclidiana y ligamiento promedio (Rolf FJ, Numerical taxonomy and multivariate analysis system. Version 2.00 (1997), Exeter Softwear, New York).
RESULTADOS
La composición en ácidos grasos de la membrana celular de M. esteraromaticum (a 28 °C y 0,5 g % NaCl) contiene un 70,28% de ácidos ramificados de cadena impar (Tabla 1). El aumento de la temperatura a 35 °C, con concentración de 0,5% NaCl (condiciones de identificación del sistema SherlockMIDI; Fig. 1A), induce modificación de los ácidos grasos, disminuye el 15:0 anteis y aumenta de 17:0 anteiso, ambos con alto porcentaje de participación. Disminuyen también los 14:0 iso, 15:1 anteiso, 15 anteiso (que tienen baja participación en membrana). Aumenta su porcentaje el
15:0 iso y el 17:0 iso. Los 16:0 iso, 16:0 y el porcentaje de la sumatoria de n:0 iso tienen un comportamiento con tendencias variables, teniendo un máximo a 28 °C. En el caso n:0 anteiso se produce un mínimo a la misma temperatura al igual que con el índice anteiso/iso. El índice C15/C17 disminuye en forma importante y proporcional al aumentar la temperatura.
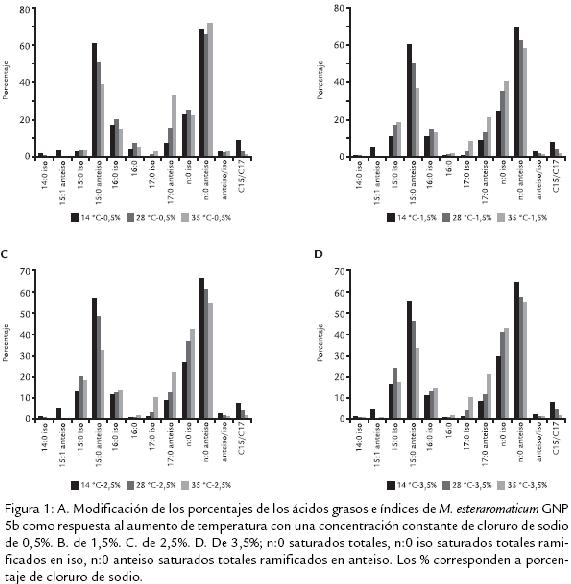
5b como respuesta al aumento de temperatura con una concentración constante de cloruro de sodio de 0,5%. B. de 1,5%. C. de 2,5%. D. De 3,5%; n:0 saturados totales, n:0 iso saturados totales ramificados en iso, n:0 anteiso saturados totales ramificados en anteiso. Los % corresponden a porcentaje de cloruro de sodio.
Cuando la salinidad aumenta a 1,5% NaCl (Fig. 1B) la temperatura a 28 °C y 35 °C producen un aumento proporcional importante en los ácidos grasos 15:0 iso (10,89 a 18,09%); 17:0 iso (0,92 a 8,36); 17:0 anteiso (10 a 18%). Además se observa una disminución, proporcional con el incremento de la temperatura, de los 15:0 anteiso (59,91 a 36,68%), y hay aumento en la sumatoria de los porcentajes de los ácidos grasos n:0 y n:0 iso (del 24 al 40%), con disminución de n:0 anteiso y el índice anteiso /iso de 3,07 a 1,44. El índice C15/C17 disminuye en forma importante y proporcional al aumentar la temperatura.
La acción del aumento de la temperatura con una salinidad del 2,5% de NaCl (Fig. 1C), induce el aumento de 17:0 iso y 17:0 anteiso con disminución de 15:0 anteiso. Los ácidos grasos n:0 iso aumentan desde el 26,73% al 42,79%, los n:0 anteiso disminuyen del 66,22% al 54,96% y las relaciones anteiso/iso y el índice C15/C17. La acción de la temperatura a una salinidad del 3,5 % NaCl (Fig. 1D) repite el comportamiento del tratamiento con 2,5% NaCl. La acción del aumento de la salinidad a temperatura constante se puede observar en la figura 2. A la temperatura de 14 °C funciona un sistema anteiso/iso, cuyo índice disminuye con el aumento de salinidad. Este índice refleja una variación más compleja, que incluye la disminución de 15:0 anteiso y 16:0 iso, con un incremento de 15:0 iso (Fig. 2A). Los ácidos grasos a 28 °C con las diferentes salinidades (Fig. 2B) muestran las mismas tendencias que con la concentración 0,5% NaCl, a los que se le agrega una disminución más notoria de 17:0 anteiso, disminuyen en menor proporción los 15:0 anteiso y en forma genérica los n:0 anteiso. Estas disminuciones van acompañadas de un incremento de los n:0 iso representados por los 15:0 iso y los 17:0 iso. La figura 2C muestra el comportamiento a 35 °C. Este tratamiento incrementa las diferencias entre 0,5% NaCl y las otras tres salinidades, que toman valores muy similares.
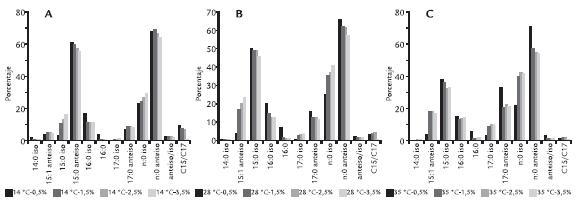
Figura 2 A. Modificación de los porcentajes de los ácidos grasos e índices de M. esteraromaticum GNP 5b como respuesta al aumento de la concentración de cloruro de sodio a temperatura constante de 14 °C. B. A temperatura constante de 28 °C. C. A temperatura constante de 35 °C. Los % corresponden a porcentaje de cloruro de sodio.
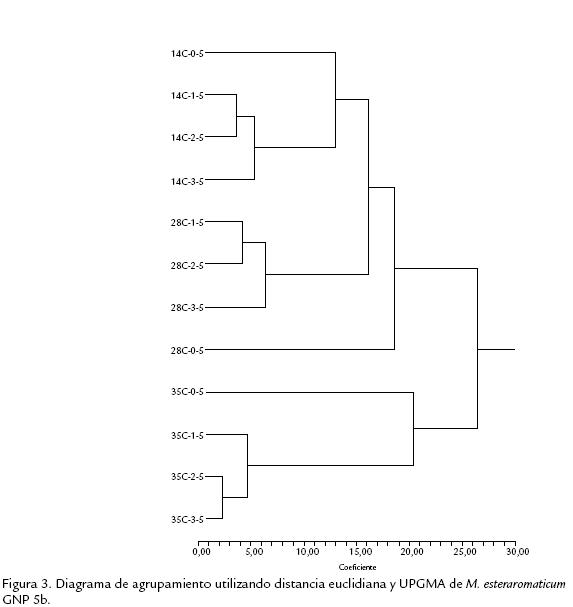
En el análisis de agrupamiento (Fig. 3) se observa la formación de dos grupos, uno formado por las muestras de 14 y 28 °C y el otro por la muestra de 35 °C. En los grupos se halla una distancia euclidiana de 26. En las tres temperaturas se presentó un mismo patrón, en donde la concentración salina de 0,5% NaCl se encuentra apartada del resto de las concentraciones salinas. En el primer grupo, formado por la temperatura de 35 °C, se presentó una separación entre la salinidad de 0,5% y las de 1,5, 2,5 y 3,5% NaCl, correspondiendo a una distancia euclidiana menor a 22,5. El desarrollo en la concentración de 1,5% NaCl, el tratamiento 14 °C 1,5%, se encuentra separado del desarrollo en 2,5 y 3,5% NaCl con una distancia euclidiana de 5 y 2,5 respectivamente. El segundo grupo, formado por las temperaturas de 14 y 28 °C, el desarrollo en 28 °C y 0,5% NaCl, el tratamiento 28 °C 0,5%, se encuentra separado del resto de los desarrollos en una distancia euclidiana de 18,5; este desarrollo corresponde a las condiciones estándar usadas para la identificación por medio de metil ésteres de ácidos grasos. Para el resto de los desarrollos a 28 °C, se presentó la muestra de 3,5% NaCl separada de los desarrollos en 1,5 y 2,5% NaCl por distancias euclidianas de 6 y 4 respectivamente. La temperatura de 14 °C presentó una separación entre los desarrollos de 0,5% y el resto de las concentraciones salinas; 3,5 y 1,5 2,5 con una distancia euclidiana de 13, 5 y 3,5 entre desarrollos.
DISCUSIÓN
Cada grupo bacteriano responde al estrés de diferentes formas pero siempre actuando sobre la composición de los ácidos grasos de membrana. Se han propuesto mecanismos tales como desaturación, ramificación, isomerización cistrans, elongación de la cadena de ácidos grasos y formación de ciclo propano (Russell y Sandercock, 1980). En Bacillus subtilis se ha comunicado la activación del gen de una desaturasa de ácidos grasos por el frío (Aguilar et al., 1998), que actúa in situ sobre los fosfolípidos de membrana. Las modificaciones in situ se efectúan generalmente con respuesta inmediata cuando el microorganismo no tiene posibilidades de síntesis de novo de ácidos grasos. En las condiciones de este ensayo la bacteria se cultivó a una temperatura y salinidad constantes por lo que se permitió en los 12 tratamientos, de osmolaridad y temperatura, la síntesis de novo de ácidos grasos. En estas condiciones M. esteraromaticum GNP 5b, se adaptó a las condiciones ambientales modificando los porcentajes de los ácidos grasos iso y anteiso que en conjunto superan el 70% de los ácidos grasos.
En M. esteraromaticum GNP 5b el incremento de temperatura con 0,5% NaCl implica la síntesis de novo de 17:0 anteiso. Ésta es la principal modificación, pero existe otra que es el incremento del 17:0 iso, que según Russell su síntesis se iniciaría con los aminoácidos isoleucina y leucina respectivamente (Russell, 1984). Ambos, según el mismo autor implican síntesis de novo. Este comportamiento difiere de Bacillus GNPOHP8b que comparte con M. esteraromaticum un alto porcentaje de ácidos grasos ramificados, que modifica su relación anteiso/iso con el incremento de temperatura y no aumenta la longitud de los ácidos grasos (Pucci y Pucci, 2003). Otro género que se caracteriza por tener ácidos grasos ramificados es Rhodococcus. La estrategia de la cepa Rhodococcus rodochrous GNPOHP38r frente al incremento de temperatura, es el aumento del porcentaje de los ácidos grasos saturados totales (n:0), ácidos grasos ramificados en el carbono terminal con grupos oxidrilo en posición 2 (n:0 iso 2 OH) y saturados con grupo metilo en carbono 10 (n:0 10 metil), a expensas de la disminución del porcentaje de los n:1 cis (Pucci y Pucci, 2004).
Los mecanismos de mantenimiento de la homeostasis de membrana en concentraciones de 1,5% NaCl, implican una disminución de 15:0 anteiso, siguiendo varias direcciones: una el aumento de la cadena de carbono pasando por la síntesis de novo a 17:0 anteiso, otra un cambio en el patrón de síntesis incrementando el 15:0 iso (de mayor punto de fusión). Esta estrategia se confirma por las modificaciones de la sumatoria de los n:0 iso (aumento de 24 a 40% y una disminución n:0 anteiso 69,15 a 57, 56%; Fig. 1B). Cuando la salinidad se incrementa a 2,5 y 3,5% NaCl se utilizan ambos mecanismos, elongación de cadena y aumento del porcentaje de n:0 iso pero en este caso se involucra de manera más importante un ácido graso par 16:0 iso. No está presente su homólogo anteiso.
Micrococcus cryophilus (Russell y Sanderock, 1980)es un microorganismo psicrófilo que tiene el mecanismo de adaptación a la temperatura por elongación de las cadenas de ácidos grasos; este microorganismo involucra cadenas de número par de carbono (C16 a C18) y los cambios los efectúa mediante una elongasa ubicada en la membrana con un intermedio de C14 (Russell, 1984). Coincidiendo con los resultados de este trabajo varios autores han comunicado una disminución de los ácidos grasos 15:0 anteiso y aumento de los 17:0 anteiso con la temperatura, en Listeria monocitogenes, una bacteria que en su composición de membrana celular tiene un alto porcentaje de ácidos grasos anteiso (Julák et al., 1989; Juneja y Davinson, 1993; Püttman et al., 1993; Raines et al.,1968). Los ácidos anteiso tienen menor punto de fusión que los respectivos iso y las respectivas cadenas de ácidos grasos saturados (Annous et al., 1997). La estrategia que utiliza M. esteraomaticum GNP5b con el aumento de la osmolaridad, tiene diferencias cuali y cuantitativas con la temperatura de desarrollo. A 14 °C, se producen variaciones importantes entre 0,5 y 1,5% NaCl y salinidades superiores. Las variaciones mínimas se explicarían por el hábitat que ocupa M. esteraromaticum GNP5b que posee muy baja humedad por lo que la concentración inicial de cloruro de sodio está por debajo de la que soporta normalmente. En otras bacterias aisladas de hábitat patagónicos con y sin contaminación con hidrocarburos se ha observado mejor y más rápido desarrollo con 1,5% NaCl que con 0,5. Los índices anteiso/iso indican qu>e el aumento de salinidad se compara con el aumento de los ácidos grasos anteiso. La longitud de cadena sólo se modifica en el pasaje de 0,5 a 1,5% y se mantiene constante en las otras tres salinidades. A 28 °C el incremento de la osmolaridad induce dos tipos de estrategias, una es la disminución de la relación anteiso/iso en forma similar a la que acontece con el aumento de temperatura y la otra es la disminución de la longitud de cadena que se contrapone con lo que ocurre con la temperatura. A 35 °C actúa en forma similar a como lo hace a 14 °C, presentando variaciones importantes entre 0,5 y 1,5% NaCl y con porcentajes e índices similares para las tres salinidades más altas.
En Bacillus, decrece el porcentaje de ácidos grasos ramificados cuando aumenta la osmolaridad del medio (Pucci y Pucci, 2003). Esta modificación no se presenta en M. esteraromaticum GNP 5b, en donde un aumento de la osmolaridad, a 14 °C, produce una disminución de 15:0 anteiso y un aumento del 15:0 iso (de 3,31%, con una concentración de 0.5% NaCl, a 16,08% a 3,5% NaCl). Se mantiene prácticamente constante del anteiso. Estas variaciones y tendencias permanecen a 28 ºC. En Rhodococcus rodochrous GNPOHP38r, aislado del mismo hábitat, la salinidad juega un papel importante como inductora de disturbios a nivel de membrana celular al incrementarse la temperatura a niveles cercanos a la de inhibición del crecimiento (35 °C; Pucci y Pucci, 2004). Una conducta similar a esta cepa de Microbacterium se ha encontrado para algunas bacterias halotolerantes como Planococus sp. (Miller, 1985), Staphylococcus epidermidis (Komaratat y Kates, 1975) y Staphylococcus aureus (Kanamesa et al., 1972). Una conducta contrapuesta tienen dos cepas de L. monocitogenes que incrementan la cantidad de 17:0 anteiso en medios hiperosmóticos (Chihib et al., 2003). También tiene un comportamiento contrapuesto Bacillus subtilis, que en medios hiperosmóticos aumentan significativamente los ácidos grasos no ramificados y el 18:1 w9, bajando los ramificados (López et al., 2000).
Cuando las mediciones se efect úan a 35 ºC, el comportamiento difiere entre 0,5% NaCl y el resto de las salinidades, habiendo un aumento significativo 15:0 iso en la primera, pero en las 3 salinidades mayores no hay diferencias significativas, manteniéndose el mismo comportamiento para el 17:0 iso. Estos dos ácidos grasos (15 y 17:0iso) aumentan en detrimento 15:0 anteiso y 17:0 anteiso que lo hacen con el mismo patrón. Se sabe que los ácidos grasos iso tienen mayor punto de fusión que sus respectivos anteiso, por lo que a la temperatura de este ensayo el incremento de salinidad implicaría una mayor fluidez de la membrana que se compensaría con un aumento de los ácidos grasos iso. La temperatura de 35 ºC es superior a la que estas bacterias soportan en su hábitat (suelo de la meseta central de la Patagonia central) y produciría en ellas un desequilibrio que se complementaría con el que producen cantidades crecientes de sal, los índices anteiso/iso (3,23 para 0,5% y de 1,44; 1,29 y 1,31 para 1,5; 2,5; y 3,5% NaCl) estos tres cultivos muy similares al tratamiento más drástico 3,5% NaCl y a 28 ºC, serían un índice que apoya esto.A salinidad (0,5% NaCl) el comportamiento se basa en la síntesis de novo de ácidos grasos 17:0 anteiso con disminución de 15:0 anteiso, que es la que tiene mayor importancia por la magnitud del cambio. Las otras modificaciones son cuantitativamente mucho menos importantes. En el caso de los índices que tienen modificación, ninguno de ellos cambia en forma proporcional con el aumento de temperatura. Estrategia diferente a una cepa de Pseudomonas que coloniza el mismo hábitat. Las variaciones que se producen por las concentraciones salinas ensayadas son en general erráticas para los ácidos grasos mayoritarios. Los ácidos grasos ciclo propano tienen una respuesta que puede expresarse con ecuaciones matemáticas que permiten predecir el porcentaje de éstos ácidos en relación a la concentración de cloruro de sodio (Pucci y Pucci, 2004; Pucci et al., 2004).
El análisis de agrupamiento (Fig. 3) permite analizar el comportamiento de M. esteraromaticum con los 12 tratamientos de osmolaridad y temperatura en donde hay dos grandes agrupamientos: uno que involucra a las temperaturas de 14 y 28 °C (temperaturas usuales en la Patagonia) en todos los tratamientos osmolares y el otro agrupa a todos los tratamientos a 35 °C cualquiera sea su salinidad. La primera característica que presenta este agrupamiento es que los tratamientos actúan sobre los ácidos grasos de membrana dando composición similar para cada temperatura y dentro de cada temperatura la concentración de sal produce modificaciones de importancia. La osmolaridad producida por una concentración de 0,5% NaCl es la que produce cambios más profundos y en las tres temperaturas ensayadas es la que tiene una distancia euclidiana mayor.
CONCLUSIONES
M. esteraromaticum utiliza la estrategia de aumentar la longitud de sus ácidos grasos de cadenas impar (17 átomos de carbono) en detrimento de sus homólogos 15:0 anteiso. La otra estrategia es modificar el porcentaje de ácidos grasos 15:0 iso (de mayor punto de fusión) a partir de los respectivos anteiso. El aumento de la osmolaridad modifica la composición de ácidos grasos de M. esteraromaticum siguiendo estrategias diferentes según la temperatura de desarrollo. A 14 y 28 °C incrementa los 15:0 iso y
17:0 iso en detrimento de sus homólogos anteiso. A 37 °C este grupo de ácidos grasos no sigue los mismos patrones anteriores. La longitud de cadena, expresada como el índice C15/C17, no sigue un patrón definido con el aumento de la salinidad. Los dos tratamientos aplicados a la cepa en estudio ejercen una acción diferente, agrupándolas por temperatura y dentro de cada una de ellas la osmolaridad produce cambios en la composición de ácidos grasos que dependen de la temperatura. Los datos obtenidos siguen un patrón que podría resumirse en que el aumento de temperatura actúa aumentando 17:0 anteiso, 17:0 iso y 15:0 iso y disminuyendo 14:0, 15:0, 14:0 iso, 15:0 anteiso, 15:1 anteiso. Mientras que el aumento del porcentaje de NaCl implica aumento de 15:0 iso y 17:0 anteiso en menor proporción con disminución de 17:0 anteiso, 17:0, 16:0 iso, 16:0.
AGRADECIMIENTOS
Se agradece a todo el personal del CEIMA por su valiosa colaboración.
BIBLIOGRAFÍA
ABEL K, DE SCHMERTZING H, PETERSON JI. Classification of Microorganisms by Analysis of Chemical Composition. J Bacteriol. 1963;85:10391044.
[ Links ]AGUILAR PS, CRONAN JE Jr, DE MENDOZA D. A Bacillus subtilis Gene Induced by Cold Shock Encodes a Membrane Phospholipid Desaturase. J Bacteriol. 1998;180:21942200.
[ Links ]ANNOUS BA, BECKER LA, BAYLES DO, LABEDA DP, WILKINSON BJ. Critical Role of AnteisoC15:0 Fatty Acid in the Growth of Listeria monocytogenes at Low Temperatures. Appl Environ Microbiol. 1997; 63:38873894.
[ Links ]BOUSFIELD IJ, SMITH GL, DANDO TR, HOBBS G. Numerical Analysis of Total Fatty Acid Profiles in the Identification of Coryneform, Nocardioform and Some Other Bacteria. J Gen Microbiol. 1983;129:375394.
[ Links ]CHIHIB NE, RIBEIRO DA SILVA M, DELATTRE G, LAROCHE M, FEDERIGHI M. Different Cellular Fatty Acid Pattern Behaviours of Two Strains of Listeria monocytogenes Scott A. and CNL 895807 Under Different Temperature and Salinity Conditions. FEMS Microbiol Lett. 2003;218:155160.
[ Links ]COLLINS MD, JONES D, KROPPENSTEDT RM. Reclassification of Brevibacterium imperiale (Steinhaus) and Corynebacterium laevaniformans (Dias and Bhat) in a redefined genus Microbacterium (OrlaJensen), as Microbacterium imperiale comb. Nov. And Microbacterium laevaniformans comb. Rev comb Nov Syst Appl Microbiol. 1983;4:6578.
[ Links ]DENNIS WH, YATVIN KB. Correlation of Hyperthermic Sensitivity and Membrane Microviscosity in E. coli K1060. Int J Radiat Biol. 1981;39:265271.
[ Links ]GUCKERT JB, RINGELBERG DB, WHITE DC, HANSONN RS, BRATINA BJ. Membrane Fatty Acids as Phenotypic Markers in the Polyphasic Taxonomy of Methylotrophs Within the Proteobacteria. J Gen Microbiol. 1991;137:26312641.
[ Links ]HENNINGSON PJ, GUDMESTAD NC. Fatty Acid Analysis of Phytopathogenic Coryneform Bacteria. J. Gen. Microbiol. 1991;137:427440.
[ Links ]HUYS G, VANCANNEYT M, COOPMAN R, JANSSEN J, FALSEN E, M. ALTWEGG, KERSTERS K. Cellular Fatty Acid Composition as a Chemotaxonomic Marker for the Differentiation of Phenospecies and Hybridization Groups in the Genus Aeromonas. Int J Syst Bacteriol. 1994;44:651658.
[ Links ]JULÁK JM, RYSKA M, KORUM I, MENCIKOVA E. Cellular Fatty Acids and Fatty Aldehydes of Listeria and Erysipelothrix. Zentralbl Bakteriol. 1989;272:171180.
[ Links ]JUNEJA VK, DAVIDSON PM. Influence of Temperature on the Fatty Acid Profile of Listeria monocytogenes. J Rapid Methods Automa Microbiol. 1993;2:7381.
[ Links ]KADNER RJ.,1996. Cytoplasmic Membrane. In F. C. Neidhardt, R. Curtiss III,
[ Links ]J. L. Ingraham, Lin ECC, Low KB Jr, Magasanik B, Reznikoff WS, Riley M, Schaechter M, Umbarger HE (ed.), Escherichia coli and Salmonella: Cellular and Molecular Biology. Washington, D.C: ASM Pres.; 1996. p. 5887.
[ Links ]KOMARATAT P, KATES P. The Composition of a Halotolerant Species of Staphylococcus epidermidis. Biochim Biophys Acta. 1975;1464:1826.
[ Links ]KANAMESA Y, YOSHIOKA T, HAYASHI H. Alteration of the Phospholipid Composition of Staphylococccus aureus Cultured in Medium Containing NaCl. Biochim Biophys Acta. 1972;280:44444450.
[ Links ]LECHEVALIER MP, MOSS CW. Lipids in Bacterial Taxonomy a Taxonomist’s View. CRC Crit Rev Microbiol. 1977;6:109210.
LÓPEZ CS, HERAS H, GARDA H, RUZAL S, SÁNCHEZRIVAS C, RIVAS E. Biochemical and Biophysical Studies of Bacillus subtilis Envelopesunder Hyperosmotic Stress. Int J Food Microbiol. 2000;55:137142.
[ Links ]MILLER KJ. Effect of Temperature and Sodium Chloride Concentration on the Phospholipid and Fatty Acids Composition of a Halotolerant Planococcus sp. J Bacteriol. 1985;162:263270.
[ Links ]MCGARRITY JT, ARMSTRONG JB. The Effect of Temperature and Other Growth Conditions on the Fatty Acid Composition of Escherichia coli. Can J Microbiol. 1981;27:835840.
[ Links ]OMELIANSKI VL. AromaProducing Microorganisms. J Bacteriol. 1923;8:393419.
[ Links ]ORLAJENSEN S. The Lactic Acid Bacteria. Copenhagen, Host and Son; 1919.
[ Links ]OSTERHOUT GJ, SHULL VH, DICK JD. Identification of Clinical Isolates of GramNegative Nonfermentative Bacteria by an Automated Cellular Fatty Acid Identification System. J Clin Microbiol. 1991;29:18221830.
[ Links ]PUCCI GN, PUCCI OH. Microbiología Agrícola: un aporte de la investigación argentina. Capítulo ácidos grasos de membranas bacterianas su rol en identificación y como expresión de estrés bacteriano en suelos. Revista de Ciencia y Tecnología UNSE. 2003;8:175:184.
[ Links ]PUCCI GN, PUCCI OH. Cambios del patrón de ácidos grasos de membrana celular de Bacillus sp. cepa gnpohp8b a la temperatura y osmolaridad. Revista de Ciencia y Tecnología UNSE. 2003;8:175184.
[ Links ]PUCCI GN, HÄRTIG C, PUCCI OH. Influencia de la concentración salina y la temperatura en la composición de ácidos grasos de membrana de Pseudomonas fluorescens gnpohp3. Rev Argent Microbiol. 2004;36:615.
[ Links ]PUCCI GN, PUCCI OH. Variación de la composición de ácidos grasos de membrana celular de Rhodococcus rodochrous gnp38r en respuesta a la temperatura y salinidad. Rev Argent Microbiol. 2004;36:5762.
[ Links ]PÜTTMAN M, ADE N, HOF H. Dependence of Fatty Acid Composition of Listeria spp. on Growth Temperature. Res Microbiol. 1993;144:747754.
[ Links ]RAINES LJ, MOSS CW, FARSHTCHI D, PITTMAN B. Fatty Acids of Listeria monocytogenes. J Bacteriol. 1968;96:21752177.
[ Links ]RAINEY PB, THOMPSON IP, PALLERONI NJ. Genome and Fatty Acid Analysis of Pseudomonas stutzeri. Int J Syst Bacteriol. 1994;44:5461.
[ Links ]REES CED, DODD CER, GIBSON PT, BOOTH IR, STEWART GSSB. The Significance of Bacteria in Stationary Phase to Food Microbiology. Int J Food Microbiol. 1995;28:263275.
[ Links ]RUSSELL NJ. Mechanisms of Thermal Adaptation in Bacteria: Blueprints for Survival. Trends Biochem Sci. 1984;9:108112.
[ Links ]RUSSELL NJ, SANDEROCK SP. In Membrane Fluidity Biophysical Techniques an Cellular Regulation; 1980. p. 181190.
[ Links ]RUSSELL NJ, EVANS RI, TER STEEG PF, HELLEMONS J, VERHEUL A, ABEE T. Membranes as a Target Stress Adaptation. Int J Food Microbiol. 1995;28:255261.
[ Links ]SCHWEIZER S. Biosynthesis of Fatty Acids and Related Compounds. In Ratledge C, Wilkinson SG (ed.), Microbial Lipids. London, England: Academic Press; 1989(2). p. 350.
[ Links ]SINENSKY M. Homeoviscous AdaptationA Homeostatic Process That Regulates the Viscosity of Membrane Lipids in Escherichia coli. Proc Natl Acad Sci U S
A. 1974;71:523525.STEAD DE. Grouping of PlantPathogenic and Some Other Pseudomonas spp. by Using Cellular Fatty Acid Profiles. Int J Syst Bacteriol. 1992;42:281295.
[ Links ]STEAD DE, SELLWOOD JE, WILSON J, VIENY I. Evaluation of a Commercial Microbial Identification System Based on Fatty Acid Profiles for Rapid, Accurate Identification of Plant Pathogenic Bacteria. J Appl Microbiol. 1992;72:315321.
[ Links ]SUUTARI M, LAAKSO S. Microbial Fatty Acids and Thermal Adaptation. Crit Rev Microbiol. 1994;20:285328.
[ Links ]TAKEUCHI M, HATANO K. Union of the Genera Microbacterium OrlaJensen and Aureobacterium Collins et al. in a Redefined Genus Microbacterium. Int J Syst Bacteriol. 1998;48:739747.
[ Links ]YANG P, VAUTERIN L, VANCANNEYT M, SWINGS J, KERSTERS K. Application of Fatty acid Methyl Esters for the Taxonomic Analysis of the Genus Xanthomonas. Syst Appl Microbiol. 1993;16:4771.
[ Links ]YATVIN MB, GIPP JJ, KLESSIG DK, DENNIS WH. Hyperthermic Sensitivity and Growth Stage in Escherichia coli. Radiat Res. 1986;106:7888.
[ Links ]