Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.11 no.2 Bogotá June 2006
ESTUDIO DE LA DIVERSIDAD CITOGENÉTICA DE Physalis peruviana L.(Solanaceae)
Study of the cytogenetic diversity of Physalis peruviana L. (Solanaceae)
NOHRA C. RODRÍGUEZ C., MARTA LUCÍA BUENO A. Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia, Sede Bogotá.
Presentado septiembre 29 de 2005, aceptado febrero 10 de 2006, correccciones marzo 23 de 2006.
RESUMEN
Se caracterizó el cariotipo de cinco ecotipos de Physalis peruviana L., tres silvestres distribuidas en los municipios de Villa de Leyva (Boyacá, Colombia), La Calera y Choachí (Cundinamarca, Colombia) y dos cultivados, uno de ellos nativo, el ecotipo Colombia distribuido en el municipio de Subachoque (Cundinamarca) y uno foráneo, procedente de Kenia, cultivado en el municipio de Paipa (Cundinamarca). Ápices radicales obtenidos a partir de semillas y de hojas en medios de cultivo in vitro enriquecidos con auxinas se emplearon para estandarizar el protocolo de obtención de cromosomas, con las diferentes técnicas de pretratamiento, fijación, hidrólisis y montaje de las muestras. Adicionalmente se evaluó la duración del ciclo celular para establecer la hora mitótica. Se encontró variabilidad genética entre los ecotipos evaluados. Los ecotipos silvestres presentaron una dotación cromosómica 2n=24, el ecotipo Colombia 2n=32 y el ecotipo Kenia 2n=48. Los ecotipos exhibieron también variación en las características morfológicas y anatómicas, que de acuerdo a la literatura, son un reflejo del nivel de ploidía, como altura, área foliar, número de estomas/mm2, número de cloroplastos en las células guarda de los estomas, diámetro de frutos, semillas y contenido de masa seca.
Palabras clave: uchuva, Physalis peruviana L., cariotipo, variabilidad genética, ecotipo Colombia, ecotipo Kenia.
ABSTRACT
We report here the karyotype characterization of five Physalis peruviana L. ecotypes. Three wild types were collected from the areas around Villa de Leyva (Boyacá, Colombia), La Calera and Choachí municipalities (Cundinamarca, Colombia) and two were from cultivated cape gooseberry crops. One of the latter was the native Colombia ecotype found near the Subachoque municipality (Cundinamarca) and the other was a foreign ecotype from Kenya, which had been cultivated near Paipa municipality (Cundinamarca). Karyotypes were obtained after standardizing a protocol involving obtation of radical apexes from seeds and leaves, using in vitro auxinenriched culture medium. The chromosomes protocol was standardized using different pretreatment, fixation, hydrolysis and samplemounting techniques. Duration of the cellular cycle was also evaluated for determining the mitotic hour. A wide genetic variability among the ecotypes was observed. Wild ecotypes presented 2n=24 chromosomes while Colombia and Kenya ecotypes 2n=32 and 2n=48, respectively. Morphological and anatomical characterization also showed variation among the ecotypes reflecting ploidy level, according to the literature, in terms of plant height, foliate area, number of stoma/mm2, chloroplast number in stoma guard cells, fruit and seed diameter and dry mass content.
Key words: cape gooseberry, Physalis peruviana L., karyotype, genetic variability, Colombia ecotype, Kenya ecotype.
INTRODUCCIÓN
El centro de origen y diversificación de la uchuva (Physalis peruviana L.) está en los Andes, principalmente de Colombia, Perú y Ecuador (Medina, 1991). La especie se distribuye en las zonas tropicales y subtropicales en un rango altitudinal comprendido entre los 1.500 y 3.000 msnm (Villamizar et al., 1993). Posteriormente se introdujo en África e India y hoy existen más de 80 ecotipos a nivel mundial, diferenciables por el porte de la planta, la forma del cáliz, el tamaño, el color y el sabor del fruto. En Colombia se cultivan tres ecotipos: Kenia y Sudáfrica reintroducidos del África, sus nombres derivados del país de procedencia, y Colombia (Villamizar et al., 1993). El ecotipo colombiano se caracteriza por tener una mejor coloración y mayor contenido de azúcares, por lo cual ha tenido mucha demanda en los mercados internacionales y el país ha llegado a ser el principal productor mundial de uchuva (Almanza y Fischer, 1993). La uchuva es hoy una de las frutas más importantes para Colombia, con exportaciones anuales promedio de cinco millones de dólares, representados en 1.850 toneladas de fruto fresco, de las cuales más del 95% se destina a la Unión Europea: Holanda (46%), Alemania (26,8%), Gran Bretaña (11,7%) y Francia (7,2%). Así mismo la producción nacional se ha incrementado en los últimos cinco años, pasando de 936 toneladas en 1.994 a 6.335 toneladas en el año 2000, con una tasa de crecimiento promedio anual del 36,9% (Corporación Colombia Internacional, 2004). Esta importancia comercial que ha adquirido la uchuva en los últimos años ha incentivado en nuestro país, el desarrollo de diversos estudios con el propósito de mejorar la producción de los cultivos, fomentando investigaciones en varias disciplinas como, genética molecular, fitoquímica y cultivo de tejidos con el propósito de evaluar la diversidad genética (Bonilla y Espinosa, 2003) e identificar, producir y extraer metabolitos secundarios de uso farmacológico como son los witanólidos y alcaloides (Torres et al., 1991) muy abundantes en estas plantas y potencialmente útiles en el biocomercio.
Sin embargo, para el país no existe documentación detallada de las variaciones en los ecotipos locales (genéticas, fisiológicas y agronómicas) que permitan determinar los mejores materiales y hasta ahora se empieza a trabajar en programas de mejoramiento. Los cultivadores por su parte, han reconocido las características de interés agronómico y las han aprovechado para seleccionar de manera masal las mejores variedades de uchuva, y se podría pensar que el ecotipo Colombia es realmente una mezcla de los diferentes ecotipos que se cultivan en el país. La variación fenotípica en esta especie, es soportada a nivel citogenético por varios estudios destacándose los realizados por Menzel (1951), Wenzel (1973), Moriconi et al. (1990) y Bracamonte et al. (1997). Los resultados de estos trabajos difieren significativamente poniendo en evidencia la amplia diversidad adquirida con sus respectivas adaptaciones, durante la radiación de esta especie que se ve reflejada en las diferentes poblaciones biogeográficas. Lagos et al. (2005) analizaron el comportamiento meiótico de seis genotipos diferentes P. peruviana, cuatro formas silvestres del departamento de Nariño y del Valle de Cauca, dos importados de Kenia y cultivadas en Silvania (Cundinamarca), y además un genotipo de P. philadelphica (2n=24), proveniente de Norteamérica. Reportan un comportamiento meiótico normal, reflejado por la alta viabilidad polínica, a pesar de la ocurrencia de mixoploidía, lo que corresponde a variaciones en el número cromosómico entre células en un mismo tejido, siendo muy frecuentes dotaciones de 24, 36 y 48 cromosomas y poco frecuentes 32, 38 y 40, concluyendo que la especie está en proceso de evolución y por ello se presentan alteraciones numéricas. Desde el punto de vista citogenético se desconoce si otros ecotipos silvestres diferentes y cultivados en el país presentan o no variaciones cromosómicas numéricas o estructurales, por lo tanto es importante evaluar la riqueza intraespecífica y los procesos de introgresión genética, para diseñar futuros programas de mejoramiento y diversificación de cultivos, entre otras investigaciones.
MATERIALES Y MÉTODOS
| Tipo de material | Ecotipo | Localidad | Altitud msnm | Tº promedioanual |
|---|---|---|---|---|
| Comercial | Colombia | Cundinamarca/Subachoque /Vereda Sabaneta | 2650 | 12 °C |
| Comercial | Kenia | Boyacá /Paipa/ Vereda Soconsuca | 2510 | 14 ºC |
| Silvestre | Choachí | Cundinamarca/Choachí/ Vereda El Verjón | 2870 | 11 °C |
| Silvestre | Calera | Cundinamarca/La Calera, Serranía Santa Helena | 2718 | 13 °C |
| Silvestre | Villa de Leyva | Boyacá/Villa de Leyva/ San Pedro de Iguaque | 2450 | 12°C |
Tabla 1. Localidades en las cuales se colectó material de uchuva.
ADQUISICIÓN Y CARACTERIZACIÓN DEL MATERIAL VEGETAL
Las plantas y frutos de uchuva silvestres y cultivadas se colectaron y se mantuvieron bajo condiciones de invernadero (Tabla 1).
ESTANDARIZACIÓN DE TÉCNICAS PARA EL ESTUDIO CARIOTÍPICO
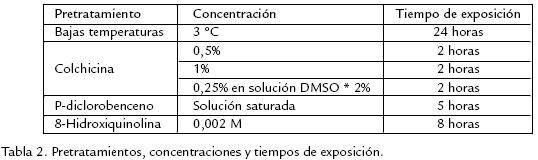
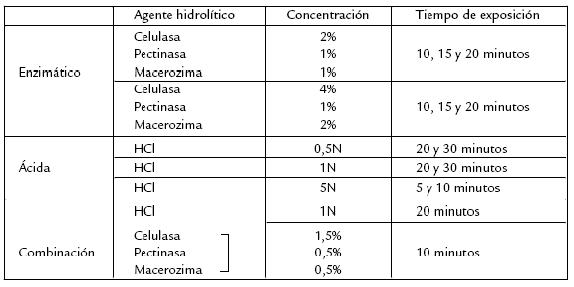
Se determinó la hora mitótica, siguiendo la metodología descrita por Talledo et al. (1993). Posteriormente se estandarizó la obtención de cromosomas empleando ápices radiculares jóvenes a partir de semillas de acuerdo a Moscone (1990) y Bueno (2001) y rizogénesis foliar in vitro, empleando medio MS enriquecido con auxinas AIA 1 mg/L y AIB 1 mg/L. Se efectuaron observaciones cada 48 horas para determinar el índice de germinación de cada uno de los ecotipos y establecer el tiempo más adecuado para la cosecha de ápices radicales. Dado que era necesario obtener buen número de ápices radiculares, se emplearon ápices de raíces secundarias de los cultivos in vitro. Es importante tener en cuenta que tiempos muy prolongados de desarrollo in vitro, ocasionan una gran proliferación de las raíces secundarias, pero estas muestran una tendencia a adelgazarse, lo cual dificulta su manipulación. La estandarización del protocolo para la obtención de cromosomas en uchuva fue realizada a partir de las técnicas descritas en citogenética vegetal, considerando cinco fases: pretratamiento, fijación, hidrólisis, coloración y montaje. En el pretratamiento se emplearon cuatro agentes inhibidores mitóticos: 8hidroxiquinolina, paradiclorobenceno, colchicina y bajas temperaturas según Moscone (1990), Fukui y Nakayama (1996), Jahier (1996), Tanguy (1996) y Bueno (2001; Tabla 2). La fijación se realizó con Carnoy (etanol 96% y ácido acético glacial en proporción 3:1, de acuerdo con lo recomendado por Sharma y Sharma (1980), empleando diferentes tiempos de fijación (4, 8, 12 y 24 horas a 3 °C). Se evaluaron tres tipos de hidrólisis: enzimática, ácida y una combinación de las dos. En la primera, de acuerdo con Moscone (1990), se utilizaron cocteles enzimáticos solubilizados con buffer sorbitol 0,5 M pH 5,8. Las mezclas empleadas están compuestas de celulasa, pectinasa y macerozima en diferentes concentraciones (Tabla 3). Se emplearon dos protocolos para la coloración: acetocarmín de acuerdo a Fukui y Nakayama (1996) y coloración de Feulgen descrita por Caetano et al. (2000) modificada con una contratinción con acetocarmín por diez minutos, antes de realizar el squash del modo convencional entre porta y cubreobjetos.
DETERMINACIÓN DEL NÚMERO CROMOSÓMICO Y CARIOTIPOS
En cada uno de los ensayos se seleccionaron metafases de buena calidad y dispersión para identificar la morfología de los cromosomas siguiendo las normas propuestas por Levan et al. (1964) y Ackerman (1971). Se registraron las mejores metafases con una cámara Olympus PMC35 DX, adaptada a un microscopio óptico Olympus BX
50. Posteriormente se elaboraron los cariotipos e ideogramas para cada ecotipo. Se evaluaron la altura de las plantas, área foliar promedio, masa y diámetros longitudinal y transversal de los frutos y se determinó el nivel de ploidía para cada ecotipo utilizando el método de Taleb (1996) y Dumas (1996), mediante el número de estomas/mm2 y de cloroplastos/célula guarda.
RESULTADOS Y DISCUSIÓN
Los programas actuales con uchuva están orientados al mejoramiento de las características del fruto (tamaño, color, grados brix, y nutrientes), por tanto es importante determinar la relación entre los niveles de ploidía con el grado de exhibición de tales características. Se determinó en todos los materiales del estudio un índice mitótico (IM) del 85% entre las 9 y las 9:30 a.m., por lo cual se estableció este rango como la hora mitótica para la colecta de ápices radiculares. Este rango es presentado por diversos grupos de plantas (Ackerman, 1971), y es explicado por el umbral de absorción de nutrientes y agua para suplir las necesidades en las diversas rutas metabólicas, por lo cual se incrementa la división celular en los ápices radiculares. Los ápices de raíces primarias y secundarias se colectaron ocho días (promedio) después de emerger, observándose un mayor incremento (80%) del índice metafásico en las secundarias. Estas se emplearon en las estandarizaciones posteriores. No se hubo diferencia en la actividad mitótica de las raíces procedentes de hoja con respecto a las procedentes de semilla.
Tabla 3. Agentes hidrolíticos empleados en la degradación de la pared celular.
Se presentó un alto índice de germinación igual o superior al 94% tanto in vivo como in vitro; esta particularidad responde a una amplia adaptabilidad y eficiencia biológica de las formas nativas o cultivadas, reflejando también una buena polinización, sin evidenciar problemas de fertilidad por hibridización o introgresión genética. Para algunos ecotipos no se contaba con una buena cantidad de semilla, lo que obligó a emplear medios de cultivo in vitro, con medio MS enriquecido con auxinas (AIA 1 mg/L + AIB 1 mg/L) permitiendo de manera eficiente y rápida una proliferación elevada de ápices radiculares, a partir de los cuales se obtuvo un excelente material, con una menor consistencia de la pared celular, adecuado para estudios citogenéticos. Estas técnicas pueden ser una alternativa para estudios en especies en las cuales sea difícil la obtención de semillas o que presenten problemas de germinación. Con estos ápices se estandarizó el protocolo de obtención de cromosomas en metafase, después de ajustar cada una de las etapas: Pretratamiento. El empleo de colchicina 0,25% en solución con dimetilsulfóxido (DMSO) al 2% alcanzó una acumulación importante de metafases (85%). Esta solución presentó un sinergismo que favoreció la penetración de la colchicina dentro de la célula, posiblemente por la acción del DMSO, que modifica los fosfolípidos de la membrana incrementando la difusión intracelular de la colchicina (Tanguy, 1996). El pdiclorobenceno es empleado en estudios con solanáceas (Moscone, 1990; Moscone et al., 1993), sin embargo, la solución saturada y el tiempo de exposición evaluados no fueron los adecuados, presentando bajos índices metafásicos en los ápices radiculares. Resultados semejantes se observaron en las células de los ápices radiculares que fueron expuestos a 8hidroxiquinolina y bajas temperaturas. Fijación. El empleo de Carnoy (3:1) como agente fijador resultó muy adecuado; se recomienda un periodo mínimo de 12 horas de fijación para evitar la persistencia de residuos citoplasmáticos y un periodo máximo de 24 horas para evitar la deshidratación celular, resultados que influyen en la resolución final de los cromosomas. Una exposición superior a 24 horas altera la morfología cromosómica, afectando sensiblemente su visualización. Hidrólisis. Para la digestión de la pared celular se emplearon cocteles enzimáticos de celulasa, pectinasa y macerozima los cuales fueron más efectivos que las enzimas utilizadas individualmente, ya que la pared celular es el resultado de un proceso evolutivo producto de las interacciones con fitopatógenos, con otros organismos y con las condiciones ambientales que se presentan como elementos seleccionadores, por lo cual, ha generado resistencia a agentes químicoenzimáticos como los empleados en la hidrólisis. La hidrólisis con cocteles enzimáticos por si sola, no fue lo suficientemente efectiva para degradar adecuadamente la pared. Los resultados se mejoraron sustancialmente con la hidrólisis combinada.
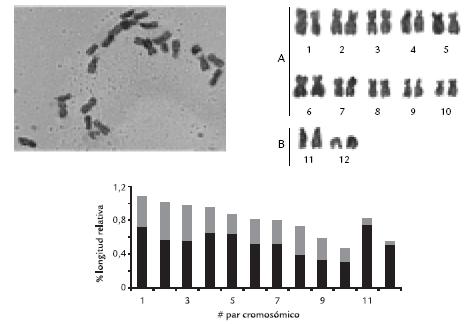
Figura 1. Metafase, cariotipo con coloración homogénea e ideograma del ecotipo silvestre de P. peruviana L., con 2n = 24.
Tinción. La tinción con el reactivo de Feulgen y contratinción con acetocarmín previo al squash fue efectivo para la visualización y diferenciación de los cromosomas.
Composición cromosómica. Se determinó como car acterística gener al de todos los ecotipos de uchuva, una composición de dos grupos cr omosómicos, el grupo A conformado por cromosomas metacéntricos y submetacéntricos y el grupo B compuesto de unos pocos elementos acrocéntricos, según la nomenclatura de Levan et al. (1964). Los ecotipos silvestr es e xhibieron una dot ación cr omosómica de 24 par es, clasificándose en el grupo A los par es metacéntricos 2, 3, 8, 9 y los submet acéntricos 1, 4, 5, 6, 7 y 10. El grupo B está conf ormado por dos par es de acr océntricos, cromosomas 11 y 12 ( Fig. 1).
El ecotipo Colombia, cultivado en Subachoque, pr esentó 32 cromosomas. En el grupo A están los pares metacéntricos 1,
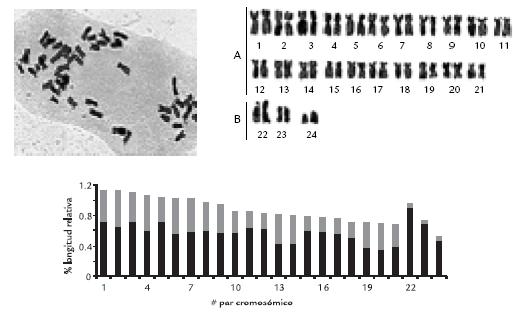
2, 4, 5 y 7 y los pares submetacéntricos 3, 6, 8, 9, 10, 11, 12 y 13, y en el grupo B tres pares acrocéntricos 14, 15 y 16. Son tres pares más en el grupo A y uno más en el grupo B, con relación a los ecotipos silvestres (Fig. 2). El ecotipo Kenia pr esentó 48 cromosomas. Los pares metacéntricos 1, 2, 4, 6, 7, 8, 9, 13, 14, 19, 20 y 21 y los par es submetacéntricos 3, 5, 10, 11 , 12, 15, 16, 17 y 18 conforman el grupo A , mientras tres pares acrocéntricos 22, 23 y 24, el grupo B (Fig. 3). A pesar de que se pr esentaron dot aciones numéricas que en principio sugieren un númer o básico de 8 cr omosomas, fue difícil de sust entar la poliploidía como la única dif erencia entre los ecotipos, por lo cual se sugirier on otros posibles rearreglos cr omosómicos, sean estructur ales o numéricos (inver siones peripar acéntricas, aneuploidías, nuliploidías, diploidías) que se han present ado independientemente en cada ecotipo. Eso es particularmente evidenciable en las variaciones observadas en los cromosomas monobranquios ( acrocéntricos) que son solo dos pares en las f ormas silvestr es de la sabana y tr es tanto en la variedad Colombia como en el ecotipo Kenia, exhibiendo un nivel más alto de ploidía.
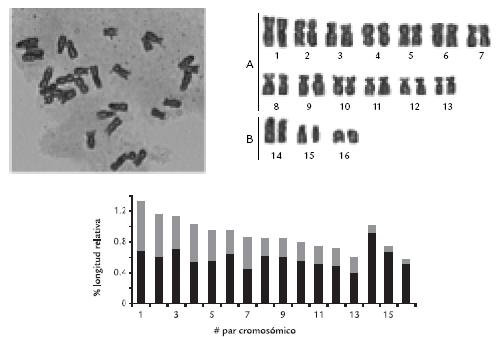
Figura 2. Met afase, cariotipo con color ación homogéneo e ideograma de ecotipo de Colombia de P peruviana L 2n = 32.
Asumiendo como número básico del género Physalis n=12 (Menzel, 1951), el ecotipo silvestre corr esponde a un diploide y el ecotipo Kenia a un t etraploide, per o por el 12345678910 11 12 1314 15 16AB número y tamaño de los pares acrocéntricos no es posible realizar una organización del cariotipo por tétradas de cromosomas, por lo cual no se excluye que durante la diversificación de grupo se hayan presentado también pérdidas de cromosomas soportadas por la presencia de monovalentes en el trabajo de Lagos et al., 2005.
Por otra parte, si se piensa en un número básico n=8, los ecotipos silvestres serían triploides (3x), el ecotipo Colombia tetraploide (4x) y el ecotipo Kenia hexaploide (6x), por lo tanto presentarían 3, 4 y 6 copias de cada cromosoma respectivamente. Sin embargo, el número de pares cromosómicos presentados en cada grupo (A y B) no soportan esta hipótesis: los ecotipos Kenia y Colombia poseen un número de acrocéntricos muy bajo (tres pares) que difieren entre sí en tamaño y no corresponden a su posible forma poliploide. De forma equivalente los ecotipos silvestres (triploides) solo presentaron dos pares acrocéntricos que difieren significativamente en tamaño. Para clarificar los datos obtenidos por el presente trabajo, es necesario adelantar estudios al nivel de tinción diferencial (bandeo C), para establecer posibles rearreglos cromosómicos ocurridos en la diversificación de estas variedades entre los que se pueden predecir, inversiones peri y paracéntricas responsables de las diferencias encontradas entre los complementos cromosómicos descritos para cada una de las variedades y formas silvestres.
Figura 3. Metafase, cariotipo con coloración homogénea e ideograma ecotipo Kenia de P. peruviana L., 2n = 48.
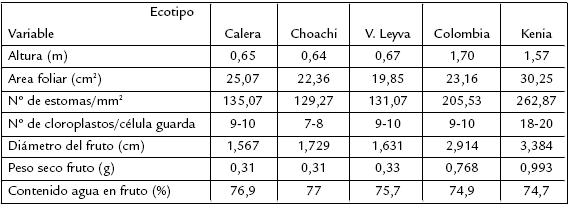
Algunos rasgos evaluados en los frutos y plantas de uchuva parecen estar altamente correlacionados con el nivel de ploidía. Esto se evidencia en la altura de las plantas, y en el diámetro y peso seco de los frutos, con valores mayores en los ecotipos Colombia y Kenia en comparación con los ecotipos silvestres (Tabla 4), los caracteres fenotípicos son una respuesta de la interacción genotipo y ambiente, por lo cual también hay efecto de las condiciones ambientales de cultivo tecnificado (sistema de riego, tutorado, iluminación, podas y fertilización) vs. silvestre. Estos resultados se complementan con los obtenidos para área foliar, número de estomas por mm2 y de cloroplastos, variables que fueron significativamente superiores para los ecotipos Kenia y Colombia en relación a los encontrados en las formas silvestres (Tabla 4). Dumas (1996) y Taleb (1996) proponen que estas características se encuentran relacionadas con el nivel de ploidía, “…a mayor número de cromosomas mayor la morfometría en las plantas...”, justificando que a mayor número de cromosomas, mayor será la expresión de cada uno de los genes, por lo que se duplica o cuadriplica la producción de metabolitos por cada célula.
Tabla 4. Promedios de variables medidas en plantas, hojas y frutos de los ecotipos de uchuva estudiados.
CONCLUSIONES Y RECOMENDACIONES
La uchuva es uno de los frutales más promisorios de nuestro país, razón que ha motivado el estudio de su variabilidad para ayudar eficientemente los programas de mejoramiento y producción. En el presente estudio se evidenciaron las diferencias cromosómicas en los ecotipos cultivados y silvestres (ancestrales) presentes en Colombia y se hace tangible la necesidad de ampliar la investigación a fin de evitar posibles procesos de introgresión con ecotipos adaptados a otras latitudes (africanos), con la subsecuente pérdida de su variabilidad natural y/o reducción de las características de interés agronómico presentes en los ecotipos locales. Esta diversidad se evidencia tanto en las variaciones en el número como en la morfología de los cromosomas en los ecotipos estudiados. Los ecotipos silvestres Calera, Choachí y Villa de Leyva presentan una dotación de 24 cromosomas, mientras el ecotipo Colombia de 32 y Kenia de 48 cromosomas. Estas variaciones a nivel genético repercuten en las características fenotípicas, justificando una relación directamente proporcional entre el nivel de ploidía y el tamaño o número de diversos caracteres del fruto y de la planta. En los cariotipos se observaron diferencias claras en la composición de los grupos cromosómicos (A y B), que apoyan la idea de la diversificación, junto con los diferentes mecanismos de poliploidización que generaron un incremento heterogéneo en el número de cromosomas. Adicionalmente es factible que se hayan presentado varios rearreglos cromosómicos a nivel estructural y numérico (inversiones, fusiónfisión, aneuploidías, nuliploidías, diploidías), responsables de los cambios en la composición de los grupos cromosómicos. Para esclarecer el origen de las variaciones citológicas observadas y detectar posibles procesos de hibridación entre los ecotipos nativos y los reintroducidos por los cultivadores, se recomienda desarrollar estudios citogenéticos más detallados con diferenciación de homólogos con bandeo C y localización de cromosomas con regiones organizadoras de nucleolo (bandeo NOR).
Desde el punto de vista técnico, para la obtención de cromosomas metafásicos en uchuva se recomienda: Pretratamiento: colchicina 0,25% en solución con dimetilsulfoxido al 2% durante 2 horas a temperatura ambiente; lavar con agua corriente. Fijación: Carnoy durante 12 horas a 3 °C. Hidrólisis: Doble digestión, primero ácida con HCl 1N durante 20 minutos a 60 °C, seguida de una hidrólisis enzimática a 37 °C con un coctel compuesto de celulasa 1,5%, peptidasa 0,5% y macerozima 0,5%, solubilizadas en un buffer citratofosfato pH 5,8. Lavar en repetidas ocasiones. Tinción: Reactivo de Schiff por diez minutos, luego una solución hipotónica (agua destilada) durante una hora. Finalmente hacer el montaje en acetocarmín y sellar con esmalte transparente.
Para la obtención de ápices radiculares de especies con baja producción de semilla viable o de difícil consecución, se recomienda el empleo de medios de cultivo in vitro, por el cual se asegura obtener un material óptimo para el desarrollo de las técnicas citogenéticas.
AGRADECIMIENTOS
Los autores agradecen al Laboratorio de Citogenética del Departamento de Biología, por facilitarnos las instalaciones y equipos para desarrollar el trabajo. A la profesora Margarita Perea y al laboratorio de cultivo de tejidos vegetales por su valiosa colaboración en el desarrollo de los cultivos in vitro. Al profesor Gerhard Fisher por las semillas del ecotipo Kenia y su valiosa asesoría. A los investigadores Creucí Maria Caetano y Cristian Olaya (CIAT) por guiar los protocolos de citogenética.
BIBLIOGRAFÍA
ACKERMAN WL. Genetic and Cytological Studies with Camellia and Related Genera. Agricultural Research Service U.S.D.A. Technical. 1971;1427:7983.
[ Links ]ALMANZA P, FISCHER G. La uchuva (Physalis peruviana L.) Una alternativa promisoria para las zonas frías de Colombia. Agricultura Tropical. 1993;30(1):7987.
[ Links ]BRACAMONTE O, GUEVARA M, GONZÁLEZ R, COX E, SILES M, MAGUIÑA E. Estudio citogenético de Physalis peruviana “capuli de la costa”. Revista Universidad Nacional de San Marcos. 1997. Disponible en URL: . http://www.unmsm.edu.pe/biologia/
BONILLA M, ESPINOSA K. Colección, caracterización fenotípica y molecular de poblaciones de uchuva Physalis peruviana [tesis]. Palmira, Valle: Facultad de Agronomía, Universidad Nacional de Colombia, Sede Palmira; 2003.
[ Links ]BUENO ML. Mitosis y meiosis en células vegetales. Guías de laboratorio de genética II. Departamento de Biología. Universidad Nacional de Colombia. Bogotá; 2001.
[ Links ]CAETANO CM, DA SILVA N, DA SILVA P. Técnicas convencionais da Citogenética Vegetal (Summary) II Encontro Maringaense da Biologia, XV Semana da Biología Emabi. Maringá, Paraná, Brasil; 2000.
[ Links ]CORPORACIÓN COLOMBIA INTERNACIONAL Sistema de inteligencia de mercados SIM, Ministerio de Agricultura y Desarrollo Rural. 2004. Disponible en URL: http://www.cci.org.co/publicaciones
[ Links ]DUMAS DV. Techniques of Estimation Number of Stomata. En Jahier, J. (ed.). Techniques of Plant Cytogenetics. New York: Science Publishers Inc.; 1996.
[ Links ]FUKUI F, NAKAYAMA SS. Plant Chromosomes. Laboratory methods. New York: CRC Press Inc.; 1996.
[ Links ]JAHIER J. Techniques of Plant Cytogenetics. New York: Science Publishers Inc.; 1996.
[ Links ]LAGOS TC, VALLEJO FA, CAETANO CM, MUÑOZ JE, CRIOLLO EH. Comportamiento meiótico de algunos genotipos de Physalis peruviana L. Fitotecnia Colombiana. 2005;5:112.
[ Links ]LEVAN A, FREDA K, SANDBERG A. Nomenclature for Centromeric Position of Chromosomes. Hereditas. 1964;52:201220.
[ Links ]MEDINA M. El cultivo de la uchuva tipo exportación. Revista Agricultura Tropical. 1991;28(2):5558.
[ Links ]MENZEL MY. The Cytotaxonomy and Genetics of Physalis. Proc Am Phylos Soc. 1951;95:132183.
[ Links ]MORICONI D, RUSH M, FLÓREZ H. Tomatillo: una cosecha vegetal potencial para Luisiana. Avances en cosechas nuevas. Prensa de la Madera, Portland; 1990. p. 407413.
[ Links ]MOSCONE E. Chromosome Studies on Capsicum (Solanaceae) I. Karyotype Analysis in C. chacoense. Brittonia. 1990;42(2):147154.
[ Links ]MOSCONE E, LAMBROU M, HUNZIKER A, EHRENDORFER F. Giemsa C Banded Karyotypes in Capsicum (Solanaceae). Plant Syst Evol. 1993;186:213229.
[ Links ]SHARMA K, SHARMA A. Chromosome Techniques: Theory and Practice. 3th Edition. London: Butterworths & Co; 1980.
[ Links ]TALEB G. Techniques of Estimation Number of Chloroplasts. En Jahier, J. (ed.). Techniques of Plant Cytogenetics. New York: Science Publishers Inc.; 1996.
[ Links ]TALLEDO C, ESCOBAR C, ALLEMAN V. Introducción al análisis cromosómico en vegetales. Universidad Ricardo Palma, Lima, Perú; 1993.
[ Links ]TANGUY AM. Techniques of Inducing Polyploidy. En Jahier, J. (ed.). Techniques of Plant Cytogenetics. New York: Science Publishers Inc.; 1996.
[ Links ]TORRES F, PEREA M, LÓPEZ A, SALAMANCA A, MIKAN J. The use of Physalis peruviana Tissue Culture for Breeding and Selection. En Hawkes, Lester, Nee y Estrada (eds.), Solanaceae III: Taxonomy, Chemistry, Evolution. Royal Botanical Gardens Kew and the Linean Society of London; 1991.
[ Links ]WENZEL WG. A Cytological Study of Colchiploid Cape Gooseberry (Physalis peruviana L.). Agroplantae. 1973;5:7984
[ Links ]VILLAMIZAR F, RAMÍREZ A, MENES M. Estudio de la caracterización física, morfológica y fisiológica poscosecha de la uchuva (Physalis peruviana L.). Agrodesarrollo. 1993;4(12):305320.
[ Links ]