Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.11 suppl.1 Bogotá Dec. 2006
ESTUDIO DE LA ACTIVIDAD ENZIMÁTICA DE POLIGALACTURONASA EN LA CORTEZA DE PITAYA AMARILLA (Acanthocereus pitajaya)
Polygalacturonase Activity in Yellow Pitaya Peel (Acanthocereus pitajaya)
JOHANNA PAOLA RODRÍGUEZ CASTRO1, Química, CARLOS EDUARDO NARVÁEZ CUENCA2, Químico, M.Sc., LUZ PATRICIA RESTREPO SÁNCHEZ3, Química, M.Sc.
1Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, Sede Bogotá, Calle 45 Carrera 30, Ciudad Universitaria, Bogotá, Colombia.jprodriguezc@unal.edu.co2Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, Sede Bogotá, Calle 45 Carrera 30, Ciudad Universitaria, Bogotá, Colombia cenarvaezc@unal.edu.co,
3Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, Sede Bogotá, Calle 45 Carrera 30, Ciudad Universitaria, Bogotá, Colombia lprestrepos@unal.edu.co
Presentado 2 de diciembre de 2005, aceptado 4 de agosto de 2006, correcciones 18 de septiembre de 2006.
RESUMEN
Se determinó la actividad poligalacturonasa en corteza de pitaya amarilla (Acanthocereus pitajaya). El buffer fosfato de sodio 20 mM pH 7,0 con NaCl 0,5 M se constituyó en el sistema más efectivo para la extracción. Se obtuvieron valores óptimos de actividad a pH 5,0 en buffer citratos, a una temperatura de 40 °C. Los valores de KM y VMÁX hallados para esta enzima fueron 2,9 mg ácido poligalacturónico/ml y 0,076 nmol de azúcares reductores/s, respectivamente. Los resultados muestran que la poligalacturonasa está vinculada con el ablandamiento de este fruto.
Palabras clave: ablandamiento, pitaya amarilla, frutas tropicales, enzimas del ablandamiento.
ABSTRACT
Polygalacturonase activity was determinated in yellow pitaya fruit (Acanthocereus pitajaya). Protein concentrations and activities of the enzyme in the extracts were determined. Buffer sodium phosphate 20 mM pH 7,0 with NaCl 0,5 M was the most effective extraction system. The enzyme exhibited optimum activity at pH 5,0 in buffer citrate at 40 °C. The KM of the enzyme was 2.9 mg/mL for polygalacturonic acid and VMÁX of 0.076 nmol of reducing groups/s. Results show that polygalacturonase is related with softening on yellow pitaya fruit.
Key words: Polygalacturonase, yellow pitaya, Acanthocereus pitajaya, enzyme of softening.
INTRODUCCIÓN
La pitaya amarilla (Acanthocereus pitajaya) es considerada como uno de los frutos exóticos más importantes de Colombia, ya que representa el 5% del mercado en las exportaciones del país (www.cci.org). Esta fruta es apetecida en muchos países, especialmente en los europeos, por sus propiedades organolépticas y su alto contenido nutricional (ICBF, 1992). Por esta razón, se han adelantado trabajos para establecer las mejores condiciones de almacenamiento. Entre los métodos empleados para su almacenamiento se encuentran la refrigeración, sola o con tratamientos de choque térmico o atmósfera modificada. Es así como se han efectuado estudios de refrigeración a 2, 4, 6 y 8 °C, (Camargo y Moya, 1995; Rudas, 1995; Rodríguez y Patiño, 2003) encontrando en todos los casos la generación de daños por frío. Estos síntomas son más evidentes en la corteza que en la pulpa y se caracterizan por la aparición de zonas necróticas, pardeamiento y ablandamiento excesivos. Para evitar las lesiones por frío se ha recurrido, de un lado, al choque térmico (Camargo y Moya, 1995), almacenando los frutos a 25 °C/24 horas antes de realizar la refrigeración a 2 °C y de otro lado, al almacenamiento con atmósfera modificada: 15% de CO2, 2% de O2 y balance con N2 (Arenas y Camero, 1995). Tras el uso de estos tratamientos se prolonga la vida útil de los frutos en cinco y diez días, respectivamente. En investigaciones más recientes se ha evaluado el papel de algunas enzimas relacionadas con los principales factores de deterioro de esta fruta. Estos estudios muestran que la polifenoloxidasa y la peroxidasa están vinculadas directamente con el pardeamiento de la corteza de la pitaya y que la catalasa afecta de manera positiva la vida útil de este fruto (Baquero et al., 2005). Otro de los síntomas de deterioro presentados durante el almacenamiento de estos frutos, además del pardeamiento, es el excesivo ablandamiento de la corteza. Este proceso se relaciona con enzimas del grupo de las hidrolasas, al cual pertenece la poligalacturonasa (PG), que genera ruptura del enlace ∴1,4glicosídico del ácido péctico. La actividad de ésta puede ser endo (degradación al azar de la cadena pectídica, EC 3.2.1.15) o exo (degradación de los extremos libres no reductores de la cadena pectídica, EC 3.2.1.67). El resultado final de esta actividad es la pérdida de la integridad celular y el incremento de la concentración de polisacáridos solubles (Bartley y Knee, 1982). Existen publicaciones sobre el comportamiento que presenta la PG en la maduración y su relación con el ablandamiento de diferentes frutos como pera (Pressey y Avants, 1976), tomate (Tucker et al., 1980; Goodenough et al., 1982; Grierson y Tucker, 1983; Warrilow y Jones, 1994), fresa (Nogata et al., 1993), kiwi (Bonghi et al., 1996), pimentón (Priya, et al., 1996), banano (Pathak y Sanwal, 1998; Pathak et al., 2000; Srivastava y Dwivedi, 2000; Payasi y Sanwal, 2003), durian (Imsabai, 2002), guayaba (AbuBark et al., 2003), arracacha, cuatro frutos silvestres de Zimbabwe (Muchuweti et al., 2005) y mango (Prasanna et al., 2006). En estos estudios se ha determinado la participación de PG en los procesos de maduración, observando que el máximo de actividad enzimática coincide con el máximo climatérico. El presente trabajo tiene como objetivo evaluar algunas condiciones para la medida de actividad de PG, con el ánimo de contribuir al estudio de la relación que puede existir entre la actividad de esta enzima y el ablandamiento de la corteza de pitaya amarilla.
MATERIALES Y MÉTODOS
MATERIAL VEGETAL
Se emplearon las cortezas de frutos de pitaya amarilla adquiridos en la ciudad de Bogotá, en condiciones óptimas de maduración (100% amarillo en corteza) y completamente sanas.
EXTRACCIÓN DE POLIGALACTURONASA
El procedimiento empleado para la extracción de PG se basó en técnicas previamente descritas (Tucker et al., 1980; Nogata et al., 1993; Priya et al., 1996; Srivastava y Dwivedi, 2000). Para retirar sustancias reductoras que interfieren en la técnica de cuantificación de azúcares reductores y para eliminar fenoles que pueden inactivar la PG, se homogeneizaron 5 g de corteza con 25 mL de acetona a 8 °C, se filtró sobre tela y el retenido se lavó dos veces con 25 mL de acetona a 8 °C. El residuo blanco fue resuspendido en 25 mL de buffer fosfatos 20 mM, pH 7,0 y colocado en agitación continua por 24 horas a 2 °C. Posteriormente, se centrifugó a 8.000 rpm durante 30 min a 4 °C, y el sobrenadante fue empleado para la cuantificación de proteína y las medidas de actividad de PG. Parámetros evaluados en la extracción. Se evaluó la incidencia de diferentes compuestos adicionados al buffer fosfato de sodio sobre la cantidad de proteína extraída y la actividad de PG. Teniendo en cuenta que la PG es una enzima asociada a la pared celular, se recurrió al uso de NaCl 1M y Tritón 1% para solubilizar la enzima por efecto de la fuerza iónica ó por acción detergente, respectivamente. Puesto que en diversas investigaciones se establece el uso de agentes reductores como la cisteína, el 2mercaptoetanol y el metabisulfito de sodio, para evitar la oxidación de los grupos sulfihidrilos de la PG (Pressey y Avants, 1976; Grierson y Tucker, 1983; Bonghi et al., 1996; Srivastava y Dwivedi, 2000; Payasi y Sanwal, 2003; Prasanna et al., 2006), se quiso evaluar el efecto de alguno de ellos, en éste caso de la cisteína. Los extractos que contenían Tritón o cisteína fueron dializados para evitar la interferencia que genera el Tritón en la cuantificación de proteína y para determinar si la cisteína realmente ejercía algún efecto sobre el comportamiento de la enzima. También se evaluó el efecto del NaCl en la solución extractora con concentraciones entre 0,0 y 2,0 M.
CUANTIFICACIÓN DE PROTEÍNA
Se cuantificó proteína en los extractos enzimáticos por el método de Bradford modificado (Zor y Selinger, 1996), con lectura de absorbancia a 450 nm y 590 nm. Como patrón de cuantificación se empleó BSA.
ACTIVIDAD DE LA PG
La actividad enzimática de PG fue determinada por medida espectrofotométrica de los azúcares reductores generados tras la acción de la enzima sobre el ácido poligalacturónico por el método de Nelson (1944) modificado por Somogyi (1952). Como punto de partida para la medida de actividad se tomaron unas condiciones generales de acuerdo a lo encontrado en la literatura (Tucker et al., 1980; Goodenough et al., 1982; Pathak y Sanwal, 1998; Srivastava y Dwivedi, 2000). La técnica es la siguiente: la mezcla de reacción contenía 125 µL de ácido poligalacturónico al 1,25% (v/v), preparado en buffer acetatos 200 mM pH 4,5, 95 µL de agua destilada y 30 µL de extracto enzimático, para un volumen final de 250 µL. Los componentes de la mezcla fueron previamente incubados y la mezcla de reacción se incubó a 37 °C por 10 min. Al cabo de este tiempo se detuvo la reacción por calentamiento en un baño de agua a ebullición. Se realizaron blancos de enzima, sustrato y buffer sometiéndolos a las mismas condiciones de la mezcla de reacción. La formación de azúcares reductores fue calculada usando Dglucosa como patrón de cuantificación, una unidad (U) de la enzima cataliza la liberación de una nmol de ácido galacturónico en 1 s en las condiciones de ensayo. La actividad específica fue expresada como U por mg de proteína. Además, se expresó la actividad como U por g de corteza. Parámetros evaluados en la medida de actividad. Con el objeto de obtener una máxima actividad se evaluó el efecto del tiempo de incubación, del volumen del extracto enzimático, de la concentración salina, del pH, la temperatura y la concentración de ácido poligalacturónico. Para esto se partió de las condiciones generales anteriormente descritas y cada vez que se evaluaba un parámetro éste se modificaba para lograr la máxima respuesta. Para determinar el efecto del tiempo de incubación y del volumen de extracto enzimático, la mezcla fue incubada durante 10, 20, 30 45 y 60 min., con dos volúmenes de extracto enzimático (30 y 60 µL). Posteriormente, se evaluó el efecto de la concentración salina en la cual se adicionó NaCl, a la mezcla de reacción, para generar concentraciones finales que variaron entre 0,15 y 0,40 M; se incluyó la medida con un extracto dializado para tomar el 0 M de NaCl. Para valorar el efecto del pH se emplearon dos sistemas buffer en un rango similar, en los cuales se preparó el sustrato, estos sistemas fueron: ácido acéticoacetato 200 mM con pH 3,7; 4,0; 4,5; 5,0 y 5,5; y ácido cítricocitrato de sodio 200 mM con pH 3,5; 4,0; 4,5; 5,0; 5,5 y 6,0. Posteriormente, se evaluó el efecto de la temperatura en un intervalo desde 0 hasta 80 °C, en este caso el sustrato fue preparado en buffer ácido cítricocitrato de sodio 200 mM pH 5,0. Por último, se estudió el efecto de la concentración de ácido poligalacturónico, en un intervalo de 0,04 a 0,75% en la mezcla de reacción, a 40 °C. Con estos resultados se determinó el valor de la constante de MichaelisMenten, KM y la velocidad máxima de reacción, VMÁX.
ANÁLISIS DE DATOS
Las medidas de proteína y de actividad enzimática se realizaron en tres extractos diferentes, cada una por duplicado para tener un total de seis réplicas. Para establecer las mejores condiciones de medida de actividad de PG se llevaron a cabo los ANDEVA de un factor para el diseño planteado de un paso a la vez para cada variable (n=6): efecto de la concentración salina, pH, temperatura, concentración de sustrato. Se empleó un diseño de dos factores para el efecto del tiempo de incubación con respecto al volumen de extracto. Además, se compararon las diferencias entre tratamientos por la prueba de Tukey.
RESULTADOS Y DISCUSIÓN
PARÁMETROS EVALUADOS EN LA EXTRACCIÓN DE PG
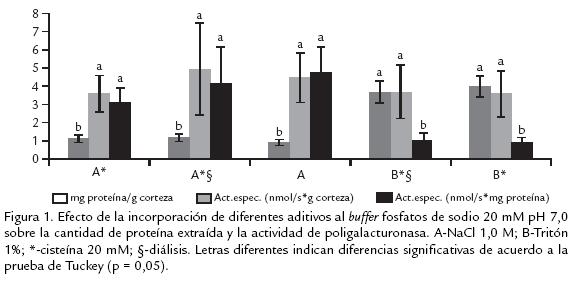
En la figura 1 se muestra el efecto de los diferentes compuestos adicionados sobre el buffer fosfato de sodio 20 mM pH 7,0. El ANDEVA mostró que el tipo de extractante tiene un efecto altamente significativo sobre la cantidad de proteína extraída y sobre la actividad expresada como nmol/ s*mg proteína. Sin embargo, no hubo efecto significativo sobre la actividad expresada como nmol/s*g corteza.
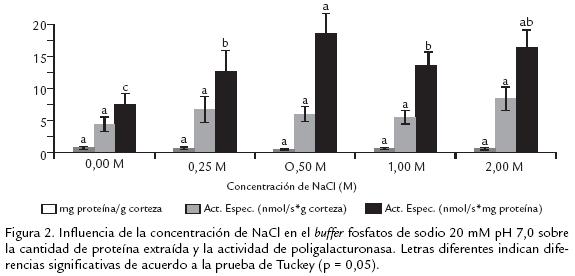
Al comparar la capacidad extractora se observa que, el Tritón es mejor extractante que el NaCl. Por ser el Tritón un detergente, que genera un efecto surfactante es capaz de romper todo tipo de tejidos y como consecuencia extrae mayor cantidad de proteína asociada a la pared celular (Pathak y Sanwal, 1998). La actividad específica expresada en nmol/s*g corteza no se vió afectada por el tipo de extractante, por lo que se podría decir que el uso de cualquiera de éstos es indiferente. Sin embargo, al expresar la actividad no referida a g de corteza sino a mg de proteína se observa que el NaCl es un extractante más selectivo hacia la extracción de PG. La posible interferencia que podría ejercer el Tritón sobre la actividad de PG queda descartada al observar que la actividad del extracto con Tritón dializado es significativamente igual a la de su homólogo sin dializar. Este comportamiento es similar al observado en banano, en donde la adición de un detergente no iónico como el Tritón X100 no altera significativamente la actividad de las tres isoformas de PG, contrario a lo que ocurre con la adición de detergentes sulfónicos (como el Teepol) y catiónicos (como el CTAB) los cuales inhiben la actividad de alguna de las tres isoformas hasta en un 40% (Pathak y Sanwal, 1998). Hasta el momento se ha analizado que el NaCl es mejor extractante que el Tritón. Ahora, para determinar la necesidad del empleo de la cisteína se puede realizar una comparación entre los extractos de NaCl con y sin cisteína; se observa que no hay un efecto significativo ni en la cantidad de proteína extraída, ni en la actividad específica, por lo que se consideró innecesario el uso de cisteína en la extracción. Por otro lado, al analizar la incidencia de la diálisis, se observa que tampoco hay un efecto significativo ya que la actividad específica no disminuye, por lo que el proceso de diálisis no es necesario. En este punto, al haber determinado que es mejor el empleo de NaCl sin cisteína y sin diálisis, en la extracción, se procedió a evaluar cuál era la concentración de NaCl más apropiada. En la figura 2 se observa que, para las diferentes concentraciones de NaCl, la cantidad de proteína extraída y la actividad expresada como nmol de azúcares reductores/s*g corteza es significativamente igual. Sin embargo, la actividad específica expresada como nmol/s*mg proteína mostró un aumento significativo desde 0,0 M hasta un máximo de 0,5 M y una tendencia hacia la estabilidad desde 0,5 hasta 2,0 M. Aunque la cantidad de proteína fue significativamente igual para todas las concentraciones de NaCl al parecer, la fuerza iónica del buffer hace más selectiva la extracción de proteína con actividad PG.
PARÁMETROS EVALUADOS EN LA MEDIDA DE ACTIVIDAD
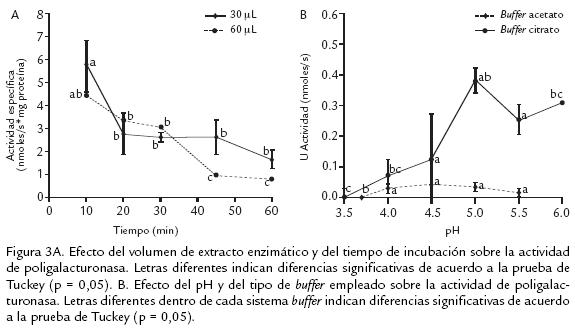
La figura 3A muestra el efecto del volumen de extracto y del tiempo de reacción. Según el ANDEVA hay un efecto altamente significativo tanto del volumen de extracto como del tiempo de incubación. Al realizar las medidas con un volumen de extracto enzimático de 60 µL la actividad específica fue significativamente menor que con 30 µL, como posible resultado de la presencia de inhibidores naturales en el extracto crudo. Es importante resaltar que el tiempo de incubación también afectó la actividad enzimática, por lo que al aumentar el tiempo se debió favorecer la inactivación de la enzima ya sea por la poca estabilidad térmica o por la generación de oligogalacturonatos tras la acción enzimática (Muchuweti et al., 2005). Para las siguientes medidas de actividad se decidió emplear un volumen de extracto enzimático de 30 µL y una incubación por 10 min.
Al evaluar el efecto de la concentración salina en la mezcla de reacción se encontró que ésta no afecta, de manera significativa, la medida de actividad enzimática (datos no mostrados). Este hecho confirma que, el efecto observado tras la variación de la concentración de NaCl, en la extracción, no se debe al cambio en la concentración de este componente en la medida. En dicho ensayo la concentración de NaCl en la mezcla de reacción varió entre 0 y 0,24 M. El comportamiento observado en este trabajo es diferente al encontrado en estudios sobre la actividad PG evaluada en cuatro frutos silvestres de Zimbabwe (Uuupaca kirkina, Zizphus mauritiana, Tamarindus indica y Berchemia discolor; Muchuweti et al., 2005) y las isoformas de banano (Pathak y Sanwal, 1998), en los cuales se observa el efecto positivo de sales monovalentes sobre la actividad de PG.
En la figura 3B se muestra el efecto del pH sobre la medida de actividad. Se observa que el comportamiento de la enzima frente al pH es diferente dependiendo del sistema buffer empleado. El ANDEVA efectuado para ambos sistemas buffer muestra un efecto significativo sobre la actividad para el buffer acetatos y altamente significativo para el sistema con citratos. Al emplear buffer acetatos la actividad permanece significativamente invariable a valores de pH entre 4,0 a 5,5, mientras que con citratos se obtienen mayores diferencias. Además, con este último sistema la actividad a pH 5,0 es 10 veces superior a la obtenida con acetatos. En otros estudios (Pressey y Avants, 1976; Nogata et al., 1993; Warrilow y Jones, 1994; Pathak y Sanwal, 1998; Muchuweti et al., 2005; Prasanna et al., 2006) los valores de pH óptimo se encuentran en un intervalo de 4,0 a 5,5, todos evaluados en buffer acetatos. Cabe pensar que la diferencia observada entre el pH con buffer acetatos y citratos, depende de qué especies se pueden ionizar en función del pH, ya que van a variar la conformación de las proteínas y sus cargas eléctricas. Estos cambios pueden alterar la conformación adecuada para la actividad catalítica. Las especies que se pueden ver afectadas son principalmente, el sistema buffer, el sustrato, el (los) cofactor (es), y los grupos esenciales ionizables del centro activo de la enzima (carboxilos COOH; amino NH2; tiol SH; imidazol, entre otros).
Con base en los hechos experimentales se podría creer que lo que ocurrió al preparar el sustrato en el buffer fue precisamente una ionización diferente para cada caso, favoreciendo la reacción enzimática con el buffer citratos. Finalmente, se decidió continuar las medidas de actividad enzimática con buffer citratos 200 mM, pH 5,0.
La evaluación del efecto de la temperatura sobre la actividad de PG se observa en la figura 4A. El ANDEVA mostró un efecto altamente significativo. La temperatura óptima de 40 °C obtenida en este trabajo es similar a las encontradas para tres isoformas extraídas de mango: 37, 42 y 37 °C (Prasanna et al., 2006) y a la PG III de banano: 40 °C (Pathak et al., 2000).
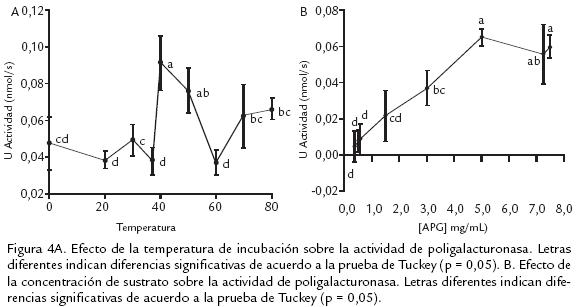
Concentración de sustrato. En la figura 4B se muestra el efecto de la variación en la concentración del ácido poligaractúronico sobre la actividad de PG. El ANDEVA mostró un efecto altamente significativo. Desde las concentraciones más bajas se observa un incremento en la actividad enzimática hasta llegar a la concentración de 5,0 mg/mL, en la cual aparentemente se alcanzó la velocidad de reacción máxima, por encima de esta concentración se observa una disminución, aunque no significativa, en la actividad. Para determinar el valor de KM se utilizó la linealización de LinerweaverBurk, en donde se graficó el inverso de la concentración de sustrato en función del inverso de las unidades de actividad. Una vez realizada la linealización, se obtuvo la siguiente ecuación: y = 13,11x + 37,702 y un r = 0,9272; valor que es altamente significativo para 48 datos experimentales (8 concentraciones x 6 réplicas). El valor obtenido para KMa partir de la ecuación fue de 2,88 mg/mL, el cual es cercano al reportado en banano, 1,5 mg/mL, para ácido poligalactúronico (Pathak et al., 2000). La VMÁX calculada a través de la ecuación fue de 0,076 nmol de azúcares reductores/s, similar a la encontrada para Uapaca kirkiana (Muchuweti et al., 2005). Dada la similitud en la afinidad de esta PG con la de otros reportes es de proponer que efectivamente esta enzima debe participar en los procesos de ablandamiento de la corteza de pitaya amarilla.
Con lo hallado en este trabajo se puede plantear la siguiente pregunta: ¿Cómo será la afinidad de esta enzima ya no por el ácido poligalacturónico sino por pectinas de diferente grado de metoxilación? Teniendo en cuenta que existen evidencias del papel complementario entre la PG y la pectinmetilestearasa (PME) (Warrilow y Jones, 1994; Priya et al., 1996; Imsabai et al., 2002; Verlent et al., 2005), surgen dos posibilidades: 1. Si se cuenta con PG purificada se podría esperar que la afinidad por las pectinas sea menor que por el ácido poligalacturónico y esta afinidad se haría mucho menor al incrementarse el grado de esterificación de la pectina. 2. Si ahora se trata de un extracto crudo en el que se tenga la presencia tanto de PG como de PME, que es lo que ocurre realmente en el fruto: la PME actuaría sobre los enlaces metílicos disminuyendo el grado de metoxilación, lo que mejoraría la actividad y la afinidad de la PG por el sustrato endógeno (Imsabai et al., 2002). También sería importante determinar la naturaleza de la acción catalítica de la PG presente en pitaya, ya que si la acción enzimática es endo tiene como resultado principal la pérdida de la viscosidad, en tanto que si la actividad es exo la respuesta más importante es el incremento en la cantidad de azúcares reductores (Pathak y Sanwal, 1998). Analizando todas estas posibilidades y pretendiendo lograr el entendimiento de la relación existente entre las actividades de PG, PME, el contenido, el grado de metoxilación de la pectina y la maduración de la pitaya amarilla se logrará contribuir a la búsqueda de alternativas para controlar el excesivo ablandamiento asociado al deterioro de este fruto.
AGRADECIMIENTOSLos autores agradecen a la Universidad Nacional de Colombia por su apoyo económico a través de la DIB.
BIBLIOGRAFÍA
ABUBARK A, ABUGOUKH AA, BASHIRHIND A. Changes in Pectic Enzymes and Cellulose Activity During Guava Fruit Ripening. Food Chem. 2003;83:213218. [ Links ]
ARENAS C, CAMERO LF. Influencia del dióxido de carbono en la inhibición de los daños por frío de la pitaya amarilla (Acanthocereus pitajaya) [trabajo de grado]. Bogotá: Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia; 1995. [ Links ]
BAQUERO DEL, CASTRO RJA, NARVÁEZ CCE. Catalasa, peroxidasa y polifenoloxidasa en pitaya amarilla (Acanthocereus pitajaya): maduración y senescencia. Acta Biol Colom. 2005;10:4959. [ Links ]
BARTLEY I, KNEE M. The Chemistry of Textural Changes in Fruit During Storage. Food Chem. 1982;9:4758. [ Links ] BONGHI C, PAGNI S, VIDRIH R, RAMINA A, TONUTTI P. Cell Wall Hydrolases and Amylase in Kiwifruit Softening. Postharvest Biol and Tech. 1996;9:1929. [ Links ]
CAMARGO A, MOYA OL. Estudio preliminar de la influencia del choque térmico en la inhibición de daños por frío en pitaya amarilla (Acanthocereus pitajaya) [trabajo de grado]. Bogotá: Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia; 1995. [ Links ]
GOODENOUGH PW, TUCKER GA, GRIERSON D, TUDOR T. Changes in Colour, Polygalacturonase Monosaccharides and Organic Acids During Storage of Tomatoes. Phytochem. 1982;21:281284. [ Links ]
GRIERSON D, TUCKER GA. Timing of Ethylene and Polygalacturonase sinthesis in Relation to the Control of Tomato Fruit Ripening. Planta. 1983;157:174179 [ Links ]
ICBF. Tabla de composición de alimentos. Sexta edición. Bogotá; 1992. [ Links ]
IMSABAI W, KETSA S, VAN DOORN WG. Effect of Temperature on Softening and the Activities of Polygalacturonase and Pectinesterase in Durian Fruit. Postharvest Biol Technol. 2002;26:347351. [ Links ]
MUCHUWETI M, MOYO E, MUSHIPE S. Some Properties of the Polygalactunase from Four Zimbabwean Wild Fruits (Uapaca kirkiana, Zizphus mauritiana, Tamarindus Indica and Berchemia Discolor Fruits). Food Chem. 2005;90:655661. [ Links ]
NELSON N. A Photometric Adaptation of the Somogyi Method for Determination of Glucose. J Biol Chem. 1944;153:378380. [ Links ]
NOGATA Y, OHTA H, VORAGEN AGJ. Polygalacturonase in Strawberry Fruit. Phytochem. 1993;34:617620. [ Links ]
PATHAK N, SANWAL GG. Multiple Forms of Polygalacturonase from Banana Fruits. Phytochem. 1998;48:249255. [ Links ]
PATHAK N, MISHRA S, SANWAL GG. Purification and Characterization of Polygalacturonase from Banana Fruit. Phytochem. 2000;54:147152. [ Links ]
PAYASI A, SANWAL GG. Pectate Lyase Activity During Ripening of Banana Fruit. Phytochem. 2003;63:243248. [ Links ]
PRASANNA V, PRABHA TN, THARANATHAN RN. Multiple Forms of Polygalacturonase from Mango (Mangifera indica L. cv Alphonso) Fruit. Food Chem. 2006;95:3036. [ Links ]
PRESSEY R, AVANTS JK. Pear Polygalacturonase. Phytochem. 1976;15:13491351. [ Links ]
PRIYA SKM, PRABHA TN, THARANATHAN RN. PostHarvest Biochemical Changes Associated with the Softening Phenomenon in Capsicum Annuum Fruits. Phytochem. 1996;42:961966. [ Links ]
RODRÍGUEZ RDA, PATIÑO GMP. Efecto de dos índices de madurez y dos temperaturas de almacenamiento sobre el comportamiento poscosecha de la pitaya amarilla (Acanthocereus pitajaya) [trabajo de grado]. Bogotá: Facultad de Agronomía, Universidad Nacional de Colombia; 2003. [ Links ]
RUDAS OL. Contribución al estudio de las condiciones de almacenamiento en frío de pitaya amarilla (Acanthocereus pitajaya) [trabajo de grado]. Bogotá: Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia; 1995. [ Links ]
SOMOGYI M. Notes on Sugar Determination. J Biol Chem. 1952;195:1923. [ Links ]
SRIVASTAVA MK, DWIVEDI UN. Delayed Ripening of Banana Fruit Salicylic Acid. Plant Science. 2000;158:8796. [ Links ]
TUCKER G, ROBERTSON N, GRIERSON D. Changes in Polygalacturonase Isoenzymes During the “Ripening” of Normal and Mutant Tomato Fruit. Eur J Biochem. 1980;112:119124.
VERLENT I, SMOUNT C, DUVETTER T, HENDRICKX ME, VAN LOEY A. Effect of Temperature and Pressure on the Activity of Purified Tomato Polygalacturonase in the Presence with Different Patterns of Methyl Esterification. Innov Food Scienc Emerg Technolog. 2005;6:293303. [ Links ]
WARRILOW AGS, JONES MG. Different Forms of Tomato Pectinesterase Have Different Kinetic Properties. Phytochem. 1994;39:277282. [ Links ]
www.cci.org.co. Fecha de consulta: 21 de noviembre de 2005. Tomado del Boletín CCI (Corporación Colombia Internacional). Perfil de Producto. No. 5. JulioSeptiembre 1999. [ Links ]
ZOR T, SELINGER Z. Linearization of the Bradford Protein Assay Increases its Sensitivity: Theoretical and Experimental Studies. Anal Biochem. 1996;36:302308. [ Links ]