Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.11 suppl.1 Bogotá Dec. 2006
NUEVAS PERSPECTIVAS PARA EL ESTUDIO DE LA ASIGNACIÓN DE BIOMASA Y SU RELACIÓN CON EL FUNCIONAMIENTO DE PLANTAS EN ECOSISTEMAS NEOTROPICALES
New Perspectives to Study the Biomass Allocation and its Relationship with the Functioning of Plants in Neotropical Ecosystems
IVÁN DARÍO CAMARGO RODRÍGUEZ1, Biólogo, NELSON RODRÍGUEZLÓPEZ2, M.Sc.
1Grupo Nacional de Investigación en Ecofisiología y Metabolismo Vegetal Tropical. Laboratorio de Ecofisiología Vegetal, Escuela de Biología, Facultad de Ciencias, Universidad Industrial de Santander, Calle 9 Carrera 27, Ciudad Universitaria, Bucaramanga, Colombia. icaro@tux.uis.eu.co
2 Grupo Nacional de Investigación en Ecofisiología y Metabolismo Vegetal Tropical. Laboratorio de Ecofisiología Vegetal, Escuela de Biología, Facultad de Ciencias, Universidad Industrial de Santander, Calle 9 Carrera 27, Ciudad Universitaria, Bucaramanga, Colombia fisionel@uis.edu.co
Presentado 22 de noviembre de 2005, aceptado 9 de mayo de 2006, correcciones 7 de septiembre de 2006.
RESUMEN
Cómo responden las plantas a la variabilidad en la disponibilidad de los recursos abióticos, es un tema central en estudios de fisiología ecológica. Varios modelos de partición óptima han sugerido un balance funcional en la biomasa asignada al vástago y la raíz con la siguiente predicción: “las plantas cambiarían su asignación de biomasa hacia el vástago si la ganancia de carbono de la parte aérea de la planta es afectada por un nivel bajo de recursos sobre el suelo, tal como luz o CO2. Igualmente, las plantas cambiarían su asignación hacia la raíz si el nivel de los recursos del suelo es bajo, tal como nutrientes y agua”. Estos cambios en la asignación pueden ser considerados como adaptativos, ya que permiten a la planta capturar más de aquel recurso que limita fuertemente su crecimiento. En este trabajo, discutimos algunos esquemas metodológicos que a través de la descripción y análisis de la asignación de biomasa pretenden probar dicha predicción. Enfatizamos que la conclusión extraída en contra o a favor de la predicción se fundamenta en la interpretación del término plasticidad, conllevando recientemente al uso de metodologías que sugieren que la predicción no se cumple en respuesta a la disponibilidad de algunos recursos. Proponemos la utilización de un protocolo de investigación para estudiar los patrones de asignación de biomasa y sugerimos una metodología para cuantificar la plasticidad de diferentes genotipos desde un punto de vista discreto.
Palabras clave: partición de biomasa, plasticidad, ontogenia, alometría.
ABSTRACT
How plants respond to variation in the availability of abiotic resources is a central research topic in physiological ecology. Several optimal partitioning models have suggested a functional balance in the biomass allocated to the shoot and root with the following prediction: “plants shift their allocation towards shoots if the carbon gain of the shoot is impaired by a low level of aboveground resources, such as light and CO2. Similarly, plants shift allocation towards roots at a low level of belowground resources, such as nutrients and water”. These shifts could be seen as adaptive, as they enable the plant to capture more of those resources that most strongly limit plant growth. Some methodological frameworks pretend to prove this prediction trough the description and analysis of biomass allocation, these are discussing here. We emphasize that the conclusion in favor or against of this prediction is due to interpret in different ways the plasticity term. The last have induced to use methodologies which are suggesting that the prediction not be fulfilled in response to the availability of some resources. We propose the utilization of a research protocol to study biomass allocation patterns and suggest a methodology to quantify the plasticity of different genotypes from a discrete viewpoint.
Key words: Biomass Partitioning, Plasticity, Ontogeny, Allometry.
INTRODUCCIÓN
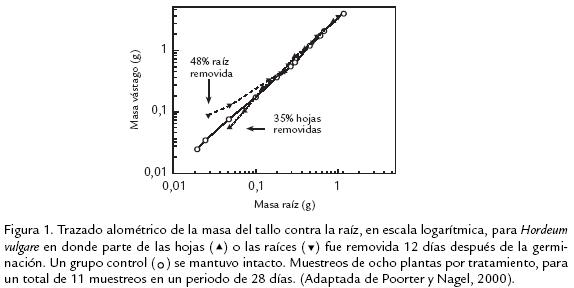
En general, los patrones de asignación1 de biomasa han sido utilizados para responder una pregunta central en estudios de fisiología ecológica de plantas: ¿Es la captura de un recurso dependiente de la asignación diferencial de biomasa? Existe la interpretación generalizada que las plantas coordinan el crecimiento de sus órganos a través de un balance entre la biomasa asignada al vástago2y la biomasa asignada a la raíz (Bloom et al., 1985). Lo anterior, fue postulado gracias a los experimentos clásicos de Brouwer (1962a), quien siguió los cambios en la asignación de biomasa del vástago y en la raíz de plantas de fríjol, crecidas en medios hidropónicos. Su experimento consistió, en la remoción de la mitad de las hojas y la mitad de las raíces después de un periodo de tiempo, desde el inicio del crecimiento. Al cabo de una semana de la poda, la proporción inicial entre la biomasa de la raíz y el vástago fue restaurada, es decir, las plantas podadas regresaron a la misma trayectoria alométrica de las plantas no podadas (testigos). La única diferencia encontrada consistió en que las plantas podadas tuvieron una menor biomasa total. Este último hecho ha sido interpretado como una reducción del crecimiento producido por la menor biomasa generada por la poda (Poorter y Nagel, 2000). Experimentos posteriores han mostrado el mismo tipo de respuesta del experimento de Brouwer en Citrus sinensis (Alexander y Maggs, 1971), otras herbáceas monocotiledóneas (Farrar y Gunn, 1998) y Hordeum vulgare (Fig. 1; Poorter y Nagel, 2000).
En tres trabajos sucesivos Brouwer (1962a; 1962b; 1983), postuló la teoría del equilibrio funcional derivada de sus observaciones sobre plantas podadas. Sin embargo, varios autores (e.g., Lambers, 1983; van der Werf y Nagel, 1996), han cuestionado el mecanismo propuesto por Brouwer aunque la predicción general de su modelo ha sido aceptada (Poorter y Nagel, 2000; Reich, 2002). La teoría del equilibrio funcional se fundamenta en la predicción que sugiere que las plantas cambian su asignación hacia el vástago, si la ganancia de carbono del vástago es perjudicada por un nivel bajo de recursos sobre el suelo, tal como luz o CO2. Similarmente, las plantas cambiarían su asignación hacia la raíz en respuesta a un nivel bajo de los recursos del suelo, tal como nutrientes y agua. Estos cambios en la asignación pueden ser interpretados como adaptativos, siempre que permitan a la planta capturar más de aquel recurso que limita fuertemente su crecimiento. La teoría del equilibrio funcional ha sido considerada como cercana a un paradigma por varias generaciones de fisiólogos y ecólogos (Reich, 2002). En este trabajo exploramos y analizamos la solidez de la evidencia que soporta esta teoría, con énfasis en los parámetros y el método para describir la asignación de biomasa como una de las principales causas que pueden afectar las conclusiones extraídas en los estudios de asignación de biomasa.
¿ES LA CAPTURA DE UN RECURSO DEPENDIENTE DE LA ASIGNACIÓN DE BIOMASA?
La predicción de Brouwer coincide con la mayoría de los modelos de partición óptima, esto es, que el ajuste en la asignación de biomasa es quien determina la tasa de crecimiento al cambiar las tasa de captura de recursos (e.g., Bloom et al., 1985; Robinson, 1986; Ägren y Ingestad, 1987; Johnson y Thornley, 1987; Szaniawski, 1987; Hilbert, 1990; Mooney y Winer, 1991; Gleeson y Tilman, 1992). Sin embargo, las observaciones de Brouwer con respecto a que plantas podadas recuperan los valores de la trayectoria alométrica de los controles sin poda, durante el crecimiento; y de la relación unidireccional entre asignación de biomasa y tasa de crecimiento, tiene al menos una hipótesis alternativa y es la siguiente: caracteres como la asignación de biomasa son determinados por cambios en el tamaño de las plantas, inducidos por los diferentes ambientes en que se desarrollan, en pocas palabras, la señal ambiental es la responsable del ajuste en las tasas de crecimiento y no de la asignación de biomasa como tal (e.g., Pearsall, 1927; Troughton, 1956; Terry, 1968; Ledig et al., 1970; Evans, 1972; Coleman et al., 1994; Coleman y McConnaughay, 1995, Jongejans et al., 2006).
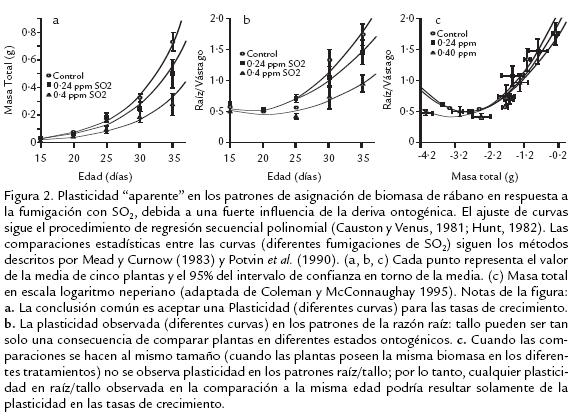
Evans (1972), definió el fenómeno de un carácter cambiando en una forma predecible en función del crecimiento de la planta como deriva ontogénica. Farrar y Gun (1998) corroboraron en sus experimentos con herbáceas monocotiledóneas lo sugerido por Evans, ya que las fuertes respuestas de crecimiento en plantas podadas, tenían una notable flexibilidad al redireccionar la partición de fotosintatos para alcanzar la constante en el patrón de asignación de biomasa. Así, para plantas herbáceas se ha predicho que la razón raíz/vástago disminuye con el tiempo, mientras que en especies leñosas tiende a incrementar (Hunt, 1990). Actualmente, la discusión se centra en la interpretación que se le ha dado al término “plasticidad” para la asignación de biomasa en plantas. McConnaughay y Coleman (1999) presentaron un esquema teórico para distinguir entre lo que ellos llaman plasticidad “aparente” y plasticidad “verdadera” para los patrones de asignación de biomasa de un carácter específico, la razón raíz/vástago. El fundamento principal de ese esquema es basado en que la razón raíz: vástago es diferente para plantas creciendo a distinta tasa de crecimiento cuando las comparaciones son hechas a la misma edad (i.e., días después de la germinación), pero podría no ser diferente cuando las comparaciones son hechas al mismo tamaño o estado de desarrollo, esto es, la misma etapa fenológica (Coleman et al., 1994; Coleman y McConnaughay, 1995). Cualquier plasticidad observada en la razón raíz: vástago en respuesta a la variación en la disponibilidad de un recurso, podría ser el resultado de la modificación de las tasas de crecimiento (McConnaughay y Coleman, 1999) y no de los patrones de asignación de biomasa. Por lo tanto, sin un estudio cuidadoso de la alometría de la raíz y del vástago, los datos podrían ser mal interpretados.
Cuando las comparaciones se hacen a la misma edad en plantas creciendo en diferentes disponibilidades de un recurso (Fig. 2a; Fig. 2b) se están comparando plantas que crecen a diferentes tasas y consecuentemente serían de diferente tamaño y estado ontogénico (Evans, 1972). Si las plantas de una edad particular fueran ontogenéticamente distintas, particularmente, con relación a la distribución relativa de la biomasa en diferentes órganos de la planta, entonces la comparación de plantas a la misma edad generaría problemas en la interpretación de los datos (Coleman et al., 1994; Coleman y McConnaughay, 1995; Gedroc et al., 1996). Lo anterior fue propuesto por Schlichting y Smith (2002) para definir la plasticidad fenotípica. Ellos proponen que todas las respuestas son estimuladas por una señal del ambiente, independientemente que el resultado sea un cambio en la producción de proteína, actividad fisiológica, crecimiento o comportamiento. Además, estos autores, consideran que todas las señales ambientales internas o externas, deben ser recibidas y procesadas al nivel de células individuales. Por lo tanto, en una célula específica a un tiempo específico, no todos los genes son necesariamente transcritos, ni todos los transcritos necesariamente traducidos, ni tampoco están necesariamente todos los polipéptidos funcionalmente activos. Así que, células y organismos pueden ejercer sobre estos procesos un notable grado de control. Finalmente, el control diferencial sobre los procesos, de transcripción, traducción y activación ocurre dinámicamente en una manera coordinada como una respuesta a las influencias internas y externas ambientales. Si los anteriores mecanismos, que ocurren para cada uno de los ambientes, convergen en generar la misma trayectoria para el desarrollo (Fig. 2c), no habría diferencias en la partición de biomasa cuando las plantas son comparadas a igual tamaño, y la plasticidad resultante sería “aparente” (Pearsall, 1927; Troughton, 1956; Terry, 1968; Ledig et al., 1970; Evans, 1972; Coleman et al., 1994; Coleman y McConnaughay, 1995). De ese modo, las plantas no escogerían la estrategia plástica “verdadera”, es decir, aquella que utiliza la asignación diferencial de biomasa para optimizar las tasas de crecimiento en respuesta a la variabilidad en la disponibilidad de un recurso. Por lo tanto, la señal ambiental sería la responsable de inducir los cambios en el tamaño y desarrollo de las plantas. Para este caso, la anterior estrategia ha sido mal interpretada porque se asume que las plantas alteran sus patrones de asignación de biomasa cuando las comparaciones se hacen a la misma edad (e.g., Mooney et al., 1988; cf., Coleman y McConnaughay, 1995).
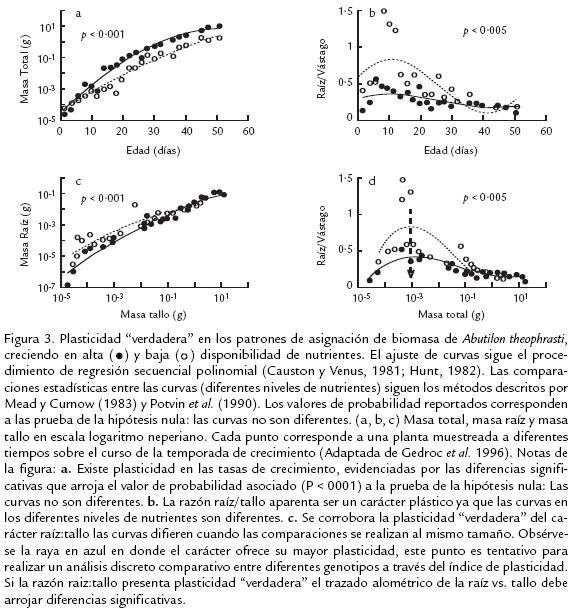
De otro lado, si los mecanismos mencionados anteriormente, divergen en generar distintas trayectorias para el desarrollo en los diferentes ambientes, habría diferencias en la partición de biomasa cuando las plantas son comparadas a igual tamaño. Así las plantas estarían optando por la estrategia plástica “verdadera” optimizando sus tasas de crecimiento a través de la asignación diferencial de biomasa a sus diferentes órganos (Fig. 3). Por lo tanto, la captura de un recurso puede o no puede ser dependiente de la biomasa asignada a diferentes órganos (Coleman y McConnaughay, 1995).
De ese modo, la influencia de la deriva ontogénica en el estudio de la asignación de biomasa ha sido omitida por muchos autores, a pesar, del llamado de atención realizado por Evans (1972). Este autor hizo énfasis en que cualquier cambio inducido por el ambiente sobre caracteres que involucran la asignación de biomasa necesita ser examinado en función del tamaño de la planta para poder llegar a conclusiones acerca del significado funcional de la variación fenotípica. Considerando lo planteado por Evans (1972), es de particular relevancia mencionar que, algunos estudios ecofisiológicos que tratan caracteres de asignación de biomasa no utilizan modelos polinomiales (Fig. 2 y Fig. 3) sino modelos discretos (e.g., Valladares et al., 2000; Guan et al., 2004) para cuantificar la plasticidad fenotípica. Los modelos discretos enfatizan sus conclusiones en el tradicional índice de plasticidad (Valladares et al., 2000). Este índice es calculado por medio del valor máximo menos el valor mínimo que ofrece el carácter a través de la variable ambiental dividido por el valor máximo. Sin embargo, este índice corresponde a un punto específico del tiempo (generalmente cerca del final de la etapa vegetativa) a través de los diferentes ambientes y no tiene en cuenta el efecto que las diferencias en tamaño y desarrollo (de plantas en diferentes tratamientos) puedan ejercer sobre los patrones del carácter observado. Aunque se ha demostrado que los métodos discretos y polinomiales son equivalentes (de Jong, 1995), a la hora de elegir hay que tener en cuenta siempre el eje de comparación (tiempo o biomasa total) para que los resultados puedan ser bien analizados e interpretados.
Proponemos que si se desea utilizar un modelo discreto para cuantificar la plasticidad debería realizarse sobre el trazado alométrico del caracter de asignación de biomasa de interés y la biomasa total. Así, el índice de plasticidad fenotípica puede ser calculado en el punto donde el investigador desee conocer las diferencias en plasticidad “verdadera” del carácter de interés, generalmente, en el punto de las trayectorias donde ofrezca mayor variabilidad (Fig. 3d). Esta metodología cobra una particular relevancia en los estudios agroecológicos que desean comparar genotipos a través de la plasticidad “verdadera” que ofrezcan a determinados ambientes. Los índices de plasticidad así calculados para cada genotipo pueden entonces compararse a través de pruebas no paramétricas.
BALANCE FUNCIONAL DE LA ASIGNACIÓN DE BIOMASA
Hasta aquí hemos tratado de dejar en claro el significado del término plasticidad en el marco de los estudios de asignación de biomasa, queda por discutir el balance funcional o ajustes en la asignación de biomasa, dado el caso que dichos ajustes fueran “verdaderos”; para ello, tomaremos como ejemplo el experimento realizado por Gedroc et al. (1996). Si los patrones de asignación de biomasa responden a las predicciones funcionales de Brouwer y a la mayoría de los modelos de partición óptima, entonces, una planta creciendo en un suelo bajo en nutrientes debería tener una mayor acumulación de masa seca en la raíz que una planta creciendo en un suelo rico en nutrientes, cuando ambas plantas son comparadas al tener la misma biomasa total (i.e., el mismo tamaño). En la figura 3, se muestra que la razón raíz:vástago vs. biomasa total de plantas de Abutilon theophrasti creciendo en un sustrato con menor disponibilidad de nutrientes, tiene un mayor valor en la razón raíz:vástago que plantas creciendo en alta disponibilidad de nutrientes (Gedroc et al., 1996). Resultados similares que evidencian partición óptima en un gradiente de nutrientes han sido encontrados en Chenopodium album y Polygonum pensylvanicum (McConnaughay y Coleman, 1999).
Varios estudios reportan ajustes en la asignación de biomasa consistentes con las predicciones del equilibrio funcional y la mayoría de teorías de partición óptima (Chapín, 1991; Jones y Coleman, 1991; Reynolds y D’Antonio, 1996). Sin embargo, se ha reportado que esta predicción se cumple en respuesta a la limitación de nutrientes (Cromer y Jarvis, 1989; van de Vijver et al., 1993) y no en respuesta a CO2 (Farnsworth et al., 1996), agua (Ledig et al., 1970; McConnaughay y Coleman, 1999) y luz (Hughes y Evans, 1962; Ledig et al., 1970; Evans, 1972; Rice y Bazzaz, 1989). Estudios recientes con varias especies herbáceas (Müller et al., 2000) han sugerido una estrecha relación alométrica entre diferentes compartimentos de las plantas como raíz vs. hojas y raíz vs. tallo, que no varió al incrementarse la disponibilidad de nutrientes. No obstante, los coeficientes alométricos de estas relaciones pueden incrementarse por la aplicación de nutrientes, sugiriendo que el crecimiento alométrico debería ser considerado la hipótesis nula en los estudios de asignación de biomasa (Weiner, 2004).
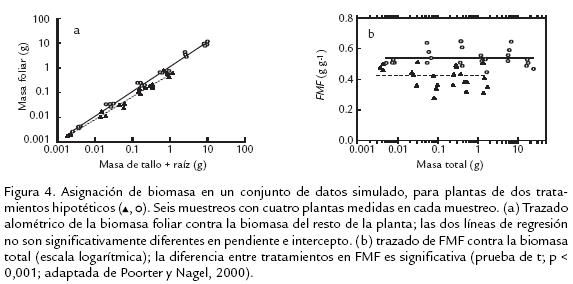
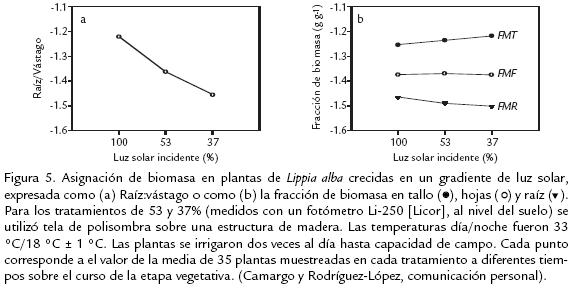
Por otro lado, Poorter y Nagel (2000), sugieren que siempre que se desee probar las diferencias estadísticas entre relaciones alométricas es más adecuado considerar solo los datos de los trazados alométricos donde plantas de diferentes tratamientos sean de igual tamaño, es decir, en el sector en donde las trayectorias se solapen; evitando así, juicios basados en una extrapolación parcial de los datos, fuera del rango actual de tamaño medido en alguno de los tratamientos. Además, esos autores destacan que el uso de la razón raíz/vástago tiene una desventaja conceptual importante desde el punto de vista funcional, argumentando que la combinación del tallo y las hojas en un solo compartimiento (vástago) no reconoce las diferentes funciones que estos órganos cumplen en las plantas. Proponen entonces, un modelo de tres compartimentos, que caracteriza la asignación por fracciones, en donde se expresa la biomasa de cada órgano relativa a la biomasa total de la planta (fracción de masa foliar, FMF; fracción de masa del tallo, FMT; fracción de masa de la raíz, FMR). Así, en un set de datos simulados (Fig. 4) Poorter y Nagel (2000), demuestran que el uso del análisis alométrico puede no arrojar diferencias significativas entre plantas de diferentes tratamientos (Fig. 4a), mientras, el uso de fracciones como FMF trazadas contra la biomasa total y utilizando solo los datos donde las trayectorias se solapan, muestran una diferencia altamente significativa entre tratamientos (Fig. 4b).
El uso del modelo de Poorter y Nagel (2000), aplicado en plantas de Lippia alba, sometidas a tres tratamientos de luz, nos permitió encontrar una disminución de la razón raíz: vástago, a medida que disminuye la disponibilidad de luz (Fig. 5a) por lo tanto, la presunción de partición óptima en esta planta, no fue ocasionada por un incremento de la asignación de biomasa hacia las hojas, ya que la FMF en las plantas permaneció constante a través de los tratamientos de luz (Fig. 5b). En contraste, los cambios en raíz:vástago, fueron una causa del incremento de la FMT y de la disminución de la FMR a medida que disminuyó la disponibilidad de luz. Así, mientras el reconocimiento de que el tallo pueda cumplir un papel específico en incrementar la tasa fotosintética, estas observaciones no cumplen con las predicciones del equilibrio funcional. Es decir, plantas de Lippia alba, no invierte más en las hojas, el órgano que causaría una fuerte limitación del crecimiento a intensidades de luz bajas. Observaciones de una FMF constante al variar la disponibilidad de luz, han sido reportadas para otras especies (Corré, 1983; Lehto y Grace, 1994; van der Werf y Nagel, 1996).
La anterior evidencia se suma a otras como la de Müller et al. (2000) rechazando las predicciones del equilibrio funcional. No obstante, Shipley y Meziane (2002), aplicando un protocolo que involucra la respuesta de plantas creciendo en un modelo bifactorial con luz y nutrientes, corroboran las predicciones del equilibrio funcional de Brouwer y de la mayoría de modelos de partición óptima. Sin embargo, en ese trabajo no fueron utilizadas las consideraciones del análisis alométrico propuestas por Poorter y Nagel (2000).
CONCLUSIONES
Proponemos que para el estudio de la plasticidad fenotípica con énfasis en la asignación de biomasa de las plantas en ambientes del Neotrópico, por ejemplo, en Colombia, donde existe una gran variación de las condiciones edafoclimáticas, se debería utilizar un protocolo de investigación que aplique metodologías enfocadas a: 1) Discernir entre plasticidad “aparente” y plasticidad “verdadera”, que no es más que la respuesta a la pregunta, ¿la captura de un recurso depende de la asignación diferencial de biomasa? 2) Determinar si existe un balance funcional entre los componentes de biomasa estudiados. Sugerimos que estos dos requerimientos deben ser corroborados con la fuerza interpretativa de la caracterización de la asignación de biomasa en fracciones, como lo propuesto por Poorter y Nagel (2000) y no a través de caracteres como raíz/vástago, cuyo uso podría llegar a validar equívocamente el balance funcional de los modelos de partición óptima. No obstante, si se desean usar razones de biomasa se puede privilegiar entonces, el uso de otras razones diferentes a raíz/vástago, que involucren la separación del vástago en hojas y tallo; por ejemplo, raiz/hojas, raiz/tallo, tallo/hojas, de tal manera que sean comparadas estadísticamente a un mismo tamaño, utilizando los datos donde las trayectorias de los diferentes tratamientos utilizados se solapen. Las anteriores consideraciones pueden ayudar a distinguir mejor la plasticidad en los patrones de asignación de biomasa, asociándolos a un modelo metodológico que reconozca las diferentes funciones que las hojas, el tallo y la raíz cumplen en las plantas. Reiteramos que si se pretende cuantificar la plasticidad bajo un modelo discreto, debería calcularse el índice de plasticidad en la parte del trazado (carácter de interés vs. biomasa total) donde plantas de diferentes tratamientos ofrezcan mayor variabilidad para el carácter de interés. De esta forma se podría comparar la plasticidad fenotípica de diferentes genotipos a través de estadística no paramétrica.
1Definición usada por Poorter y Nagel (2000) en la cual la asignación se refiere a la cantidad de biomasa que esta presente en los diferentes órganos de la planta con respecto a la cantidad de biomasa total, no se debe entender el término asignación como sinónimo de la transferencia y ubicación de nuevos incrementos de biomasa (Reich, 2002). Los términos asignación y partición son tratados como sinónimos.
2El término vástago es utilizado como el conjunto del tallo más las hojas y el término tallo es utilizado exclusivamente como el órgano portador de las hojas y órganos reproductores (Font Quer, 1953).
AGRADECIMIENTOS
Este proyecto fue financiado parcialmente por COLCIENCIAS (Contrato Co 432CENIVAM) y la Dirección General de Investigaciones de la Universidad Industrial de Santander. Los autores extienden sus agradecimientos a los profesores Fabio M. da Matta (UFV, Brasil), Miquel A. GonzálezMéler (UIC, USA) y Wilmer Tezara (UCV, Venezuela) por su asesoría científica. A Mabrouk ElSharkawy por su legado y aporte a la ecofisiología vegetal.
BIBLIOGRAFÍA
ÄGREN GI, INGESTAD T. Root:Shoot Ratio as a Balance between Nitrogen Productivity and Photosynthesis. Plant Cell Environ. 1987;10:579586. [ Links ]
ALEXANDER DM, MAGGS DH. Growth Responses of Sweet Orange Seedlings to Shoot and Root Pruning. Ann Bot. 1971;35:109–115.
BlOOM AJ, CHAPIN FS, MOONEY HA. Resource Limitation in Plantsan Economic Analogy. Annu Rev Ecol Syst. 1985;16:363392. [ Links ]
BROUWER R. Nutritive Influences on the Distribution of Dry Matter in the Plant. Neth J Agric Sci. 1962a;10:361376. [ Links ]
BROUWER R. Nutririve Influences on the Distribution of Dry Matter in the Plant. Neth J Agric Sci. 1962b;10:399408. [ Links ]
BROUWER R. Functional Equilibrium: Sense or Nonsense? Neth J Agri Sci. 1983;31:335348. [ Links ]
CAUSTON DR, VENUS JC. The Biometry of Plant Growth. London: Edward Arnold; 1981. [ Links ]
CHAPIN FS. Effects of Multiple Environmental Stresses on Nutrient Availability and Use. En: Mooney HA, Winner WE, Pell EJ, editors. Responses of Plants to Multiple Stresses. San Diego, California, USA: Academic Press; 1991. p. 6778. [ Links ]
COLEMAN JS, McCONNAUGHAY KDM. A NonFunctional Interpretation of a Classical OptimalPartitioning Example. Funct Ecol. 1995;9:951954. [ Links ]
COLEMAN JS, McCONNAUGHAY KDM, ACKERLY DD. Interpreting Phenotypic Variation in Plants. Trends Ecol Evol. 1994;9:187191. [ Links ]
CORRÉ WJ. Growth and Morphogenesis of Sun and Shade Plants. I. The Influence of Light Intensity. Act Bot Neerl. 1983;32:4962. [ Links ]
CROMER RN, JARVIS PG. Allocation of Dry Matter in Eucalyptus grandis Seedlings in Response to Nitrogen Supply. Ann Sci Forest. 1989;46:680683. [ Links ]
de JONG G. Phenotypic Plasticity as a Product of Selection in a Variable Environment. Am Nat. 1995;145:493512. [ Links ]
EVANS GC. The Quantitative Analysis of Plant Growth. California, USA: University of California Press; 1972. [ Links ]
FARRAR JF, GUNN S. Allocation: Allometry, Acclimationand Alchemy? En: Lambers H, Poorter H, Van Vuuren MMI, editors. ‘Inherent Variation in Plant Growth. Physiological Mechanisms and Ecological Consequences’. Leiden, The Netherlands: Backhuys Publishers; 1998. p. 183198.
FARNSWORTH EJ, ELLISON AM, GONG WK. Elevated CO2 Alters Anatomy, Physiology, Growth and Reproduction of Red Mangrove (Rhizophora mangle L.). Oecologia. 1996;108:599609. [ Links ]
FONT QUER P. Diccionario de Botánica. Barcelona: Labor; 1953. [ Links ]
GEDROC JJ, MCCONNAUGHAY KDM, COLEMAN JS. Plasticity in Root/Shoot Partitioning: Optimal, Ontogenetic, or Both? Funct Ecol. 1996;10:4450. [ Links ]
GLESSON E, TILMAN D. Plant Allocation and the Multiple Limitation Hypothesis. Am Nat. 1992;139: 13221343. [ Links ]
GUAN BH, YING GE, CHANG J. Phenotypic Plasticity of Mosla chinensis and M. scabra (Labiatae) Response to Soil Water Status. Bot Bull Acad Sinica. 2004;45:229236. [ Links ]
HILBERT DW. Optimization of Plant Root:Shoot Ratios and Internal Nitrogen Concentrations. Ann Bot. 1990;66:9199. [ Links ]
HUGHES AC, EVANS GC. Plant Growth and the Aerial Environment. II. Effects of Light Intensity on Impatiens parviflora. New Phytol. 1962;61:154174. [ Links ]
HUNT R. Plant Growth Curves: the Functional Approach to Plant Growth Analysis. London: Edward Arnold, 1982. [ Links ]
HUNT R. Basic Growth Analysis. London: Unwin Hyman; 1990. [ Links ]
JOHNSON IR, THORNLEY JHM. A Model for Root:Shoot Partitioning and Optimal Growth. Ann Bot. 1987;60:133142. [ Links ]
JONES CG, COLEMAN JS. Plant Stress and Insect Herbivory: Toward an Integrated Perspective. En: Mooney HA, Winner WE, Pell EJ, editors. Responses of Plants to Multiple Stresses. San Diego, California, USA: Academic Press; 1991. p. 249282. [ Links ]
JONGEJANS E, de KROON H, BERENDSE F. The Interplay between Shift in Biomass Allocation and Cost of Reproduction in Four Grassland Perennials under Simulated Successional Change. Oecologia. 2006;147:369378. [ Links ]
LAMBERS H. ‘The Functional Equilibrium’, Nibbling on the Edges of a Paradigm. Neth J Agri Sci. 1983;31,305311.
LEDIG FT, BORMANN FH, WENGER KF. The Distribution of Dry Matter Growth between Shoot and Roots in loblolly pines. Bot Gaz. 1970;13:349359. [ Links ]
LEHTO T, GRACE J. Carbon Balance of Tropical Tree Seedlings: a Comparisons of Two Species. New Phytol. 1994;127:455463. [ Links ]
McCONNAUGHAY KDM, COLEMAN JS. Biomass Allocation in Plants: Ontogeny or Optimalyty? a Test Along Tree Resource Gradients. Ecology. 1999;80:25812593. [ Links ]
MEAD R, CURNOW RN. Statistical Methods in Agriculture and Experimental Biology. London: Chapman and Hall; 1983. [ Links ]
MOONEY HA, WINNER WE. Partitioning Responses of Plants to Stress Responses of Plants to Multiple Stresses. En: Mooney HA, Winner WE, Pell EJ, editors. San Diego, California, USA: Academic Press; 1991. p. 129142. [ Links ]
MOONEY HA, KUPPERS M, KOCH GW, GORMAN J, CHU CC, WINNER WE. Compensating Effects to Growth of Carbon Partitioning Changes in Response to SO2Induced Photosynthetic Reduction in Radish. Oecología. 1988;72:502506. [ Links ]
MÜLLER I, SCHMID B, WEINER J. The Effect of Nutrient Availability on Biomass Allocation Patterns in 27 Species of Herbaceous Plants. Perspect Plant Ecol Evol Syst. 2000;3:115127. [ Links ]
PEARSALL WH. Growth Studies. VI. On the Relative Sizes of Growing Plant Organs. Am J Bot. 1927;41:549556. [ Links ]
POORTER H, NAGEL O. The Role of Biomass Allocation in the Growth Response of Plants to Different Levels of Light, CO2, Nutrients and Water: a Quantitative Review. Aust J Plant Physiol. 2000;27:595607. [ Links ]
POTVIN C, LECHOWICZ MJ, TARDIF S. The Statistical Analysis of Ecological Response Curves Obtained from Experiments Involving Repeated Measures. Ecology. 1990;71:13891400. [ Links ]
REICH PB. RootShoot Relations: Optimality in Acclimation and Adaptation or the “Emperor’s New Clothes”? En: Weisel Y, Eshel A, Kafkafi U, editors. Plant Roots, The Hidden Half. New York: Marcel Dekker, Inc.; 2002. p. 205220.
REYNOLDS HL, D’ANTONIO C. The Ecological Significance of Plasticity in Root Weight Ratio in Response to Nitrogen: Opinion. Plant Soil. 1996;185:7597.
RICE SA, BAZZAZ FA. Quantification of Plasticity of Plant Traits in Response to Light Intensity: Comparing Phenotypes at a Common Weight. Oecologia. 1989;78:502507. [ Links ]
ROBINSON D. Compensatory Changes in the Partitioning of Dry Matter in Relation to Nitrogen Uptake and Optimal Variations in Growth. Ann Bot. 1986;58:841848. [ Links ]
SCHLICHTING CD, SMITH H. ‘Phenotypic Plasticity: Linking Molecular Mechanisms with Evolutionary Outcomes’. Evol Ecol. 2002;16:189211.
SHIPLEY B, MEZIANE D. The BalancedGrowth Hypothesis and the Allometry of Leaf and Root Biomass Allocation. Funct Ecol. 2002;16:326331. [ Links ]
SZANIAWSKI RK. Plant Stress and Homeostasis: a Hypothesis. Plant Physiol Biochem. 1987;25:6372. [ Links ]
TERRY N. Developmental Physiology of Sugar Beet. I. The influence of light and temperature on growth. J Exp Bot. 1968;61:795811. [ Links ]
THORNLEY JHM. A Balanced Quantitative Model for Root:Shoot Ratios in Vegetative Plants. Ann Bot. 1972;36:431441. [ Links ]
TROUGHTON A. Studies on the Growth of Young Grass Plants with Special Reference to the Relationship between the Shoot and Root Systems. J Brit Grassland Soc. 1956;11:5665. [ Links ]
VALLADARES, F, SJ WRIGHT, E LASSO, K KITAJIMA. Plastic Phenotypic Response to Light of 16 Congeneric Shrubs from a Panamanian Rainforest. Ecology. 2000;81:19251936. [ Links ]
VAN DE VIJVER CADM, BOOT RGA, POORTER H, LAMBERS H. Phenotypic Plasticity in Response to Nitrate Supply of an Inherently FastGrowing Species from a Fertile Habitat and an Inherently SlowGrowing Species from an Infertile Habitat. Oecologia. 1993;96:548554. [ Links ]
VAN DER WERF A, NAGEL OW. Carbon Allocation to Shoots and Roots in Relation to Nitrogen Supply is Mediated by Cytokinins and Sucrose: Opinion. Plant Soil. 1996;185:2132. [ Links ]
WEINER J. Allocation, Plasticity and Allometry in Plants. Perspect Plant Ecol Evol Syst. 2004;6:207215. [ Links ]