Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Biológica Colombiana
versão impressa ISSN 0120-548X
Acta biol.Colomb. v.12 n.1 Bogotá jan./jun. 2007
INÓCULO DE HONGOS DE MICORRIZA ARBUSCULAR EN PASTURAS DE Brachiaria decumbens (POACEAE) EN ZONAS DE LOMA Y VEGA
Inoculum of Arbuscular Mycorrhizal Fungi on Brachiaria decumbens (Poaceae) Pastures in Valley and Hilly Terrain
RAÚL HERNANDO POSADA ALMANZA1, M. Sc., Mic.; LUÍS ANTONIO FRANCO CASTRO1, Esp. Biomatemáticas; ADRIANA PATRICIA CUÉLLAR CALDERÓN2, Ing. Agroecóloga; WILSON SÁNCHEZ CHACÓN2, Ing. Agroecólogo; ADRIANA PATRICIA SÁNCHEZ FIGUEROA2 Ing. Agroecóloga. 1Programa de Biología, Facultad de Ciencias Básicas, Universidad de la Amazonía, Av. Circunvalar, El Porvenir, Florencia, Caquetá, Colombia. raulposada@hotmail.com 2Programa de Ingeniería Agroecológica, Facultad de Ingeniería. Universidad de la Amazonía, Av. Circunvalar, El Porvenir, Florencia, Caquetá, Colombia.
Presentado 12 de mayo de 2006, aceptado 29 de enero de 2007, correcciones 26 de febrero de 2007.
RESUMEN
Los factores que influyen en la distribución del inóculo de hongos micorrícicos arbusculares (micelio externo y esporas) son diversos. Entre ellos pueden mencionarse la especie vegetal predominante, el pH, la humedad del suelo, la conductividad, el contenido de fósforo, nutrientes y de metales pesados. Muchos de los reportes de la literatura son contradictorios y basados en estudios realizados en zonas templadas; en condiciones tropicales es difícil determinar los factores edáficos y ambientales que estimulan la producción de inóculo y la forma en que lo hacen. Brachiaria decumbens, como especie de pasto predominante en paisajes de loma y vega en el piedemonte amazónico colombiano, ha sido poco estudiada en su relación micorrícica. En este estudio se realizó la determinación de la densidad de esporas y micelio externo en 26 zonas cubiertas con B. decumbens, correspondientes a paisajes de loma y vega. Simultáneamente se valoraron el contenido de fósforo disponible (ppm), pH y humedad relativa del suelo (%). Mediante correlaciones de Spearman (rangos) y análisis de varianza (ANDEVA) de una vía por KruscallWallis, se encontró que el inóculo se distribuye de forma diferente en loma y vega, siendo mayor la densidad de esporas en loma que en vega y más homogéneo en contenido de micelio externo en vega que en loma. No se encontró efecto del fósforo disponible, el pH y la humedad del suelo sobre la densidad de inóculo de HMA.
Palabras clave: Brachiaria decumbens, micorriza arbuscular, inóculo, Amazonas
ABSTRACT
The diversity of factors influencing the distribution of arbuscular mycorrhizal fungi inoculum (spores and hyphae), plant species, pH, soil humidity, conductivity, P availability, nutrients and heavy metals have been reported. Reports are contradictory and mostly supported on data from temperate zones; under tropical conditions it is difficult to determine the edaphycal and environmental factors that stimulate inoculum production, and how it happens. Brachiaria decumbens is the dominant grass species in plain and hilly landscapes on the Amazonian piedmont of Colombia. There are few studies on its mycorrhizal relationships. In this study the spore density and external hyphae were determined in 26 B. decumbens pastures, on plain and hilly landscapes; simultaneously phosphorus availability (ppm), pH, and soil relative humidity (%) were measured. Spearman (ranks) correlations coefficients and nonparametric KruscallWallis one way ANOVA were performed and found that: the inoculum has a different distribution in plain and hilly, the spore densities were higher in hilly terrain than in plain soils, and the external hyphae were more homogeneous in plain than in hilly terrain. Phosphorus availability, pH and soil humidity have no effect on the density of inoculum of HMA.
Key words: Brachiaria decumbens, arbuscular mycorrhiza, inoculum, Amazon.
INTRODUCCIÓN
Las actividades agrícolas mal empleadas y el sobre pastoreo en el CaquetáColombia, han contribuido al cambio de un ecosistema de bosque natural a uno de pasturas. Sumado a esto, las características físicoquímicas propias de los suelos han contribuido a que se produzcan procesos de erosión y destrucción de la integridad microbiológica del suelo, ocasionando la pérdida de gran parte de sus nutrientes (IGACINPA, 1993). Brachiaria decumbens es usada frecuentemente como pastura por su gran capacidad de adaptación a las condiciones ambientales y a la poca fertilidad de los suelos; en estos las asociaciones simbióticas con hongos micorrízicos arbusculares (HMA) generan ventajas para su desarrollo, que se traducen en un mayor vigor y una mejor absorción de los nutrientes disponibles en el suelo, permitiendo la formación de micro y macroagregados que actúan como reservas de nutrientes (Barea et al., 1991). Las principales fuentes de inóculo de HMA están amplia y uniformemente distribuidas en los 10 cm superficiales del suelo (Pattinsib et al., 1990); corresponden a las esporas, el micelio externo de los HMA y a las raíces previamente colonizadas de plantas coexistentes o fragmentos de las preexistentes. Se acepta que los fragmentos de raíz micorrizados son el inóculo más infectivo, pero las esporas aisladas, por su capacidad de supervivencia y mayor tolerancia a las situaciones adversas, son las principales responsables de perpetuar los HMA (Barea et al., 1991).
Mecinas et al. (1991) han sugerido que una alta esporulación es una respuesta de los hongos a condiciones climáticas adversas. Las densidades de esporas proveen un indicativo de la densidad de inóculo (Orozco et al., 1986; Friese y Allen, 1991) y probablemente son la principal forma de migración de éste (Friese y Allen, 1991). No existe un estímulo único para la producción de esporas en los sistemas tropicales con fotosíntesis continua durante el año y crecimiento asiduo de las raíces (Sieverding, 1991). Sin embargo, en algunos estudios se ha determinado la existencia de una relación inversa entre el número de propágalos de HMA en el suelo y el estado nutricional de los hospederos (Mosse, 1973). En cuanto a la humedad, los datos en la literatura son contradictorios, sugiriendo que la densidad de esporas puede incrementarse, disminuirse o no mostrar cambios con los contenidos de humedad del suelo o inundación (Rickerl et al., 1994; Carvalho et al., 2001; Entry et al., 2002). El pH influye en la distribución y abundancia de diferentes especies de hongos, entre ellos los HMA (Read et al., 1976; Porter et al., 1987a; Porter et al., 1987b; Wang et al., 1993). Según Abbott y Robson (1991), los incrementos en el pH y contenido nutricional del suelo están relacionados con un descenso en la densidad de esporas de HMA, pero los resultados son opuestos a los encontrados en estudios posteriores (Mendoza et al., 2002; Escudero y Mendoza, 2005). Dada la alta discrepancia en los resultados mencionados y a que estos en su mayoría han sido obtenidos en estudios realizados en zonas templadas, el presente trabajo tiene como objeto evaluar la influencia del pH, la humedad y el contenido de fósforo en la densidad de inóculo de HMA en dos unidades paisajísticas como son loma y vega, en las condiciones naturales predominantes del piedemonte amazónico colombiano, como una de las primeras dentro de un conjunto de investigaciones en esta área por parte de la Universidad de la Amazonía.
MATERIALES Y MÉTODOS
El trabajo se realizó en el municipio de FlorenciaCaquetá (Colombia), ubicado en el piedemonte amazónico, con temperatura promedio anual de 28 ºC, pluviosidad de 3.500 mm al año, evotranspiración entre 1.200 a 1.500 mm anuales y humedad relativa del 87%, a una altura aproximada de 303 msnm; la zona de muestreo limita al norte a los 1º28’50,3’N, al sur a los 1º26’41”N, al oriente a los 75º28’26’’W y al occidente a los 75º40’14’’W, el paisaje corresponde a relieves predominantes de loma y vega, con suelo usado como pastura y vegetación predominante de B. decumbens.
Se seleccionaron 26 zonas de muestreo (APY, ARY, FBY, JMY, UAY, AAY, ABYA, FMY, GSY, DCY, ESYA, ESYB, FGY, NAY, ABYB) en loma, y (CNX, ESX, JAX1, JAX2, ACX, GSX, VPX, FGX, NAXA, NAXB, VAX) en vega, cada una con un área de 1.000 m2, con pastura predominante de B. decumbens. Un tubo de PVC de 3,8 cm de diámetro y 25 cm de longitud, fue usado para tomar las muestras a una profundidad entre 020 cm y distancias al tronco de la planta de 010 cm, introduciendo, rotando y extrayendo el cilindro con la muestra. En cada zona se tomaron diez muestras (260 muestras), estas se homogenizaron por zona; dos submuestras (200 g cada una) fueron empleadas para evaluar el inóculo (esporas y micelio), y una submuestra de 100 g de suelo, para las determinaciones físicoquímicas. Las muestras etiquetadas en bolsas plásticas se llevaron al laboratorio y se conservaron a 4 ºC durante la evaluación de las variables físicoquímicas y biológicas, tal como fue realizado por Posada (2001) y Posada et al. (2006). La determinación de la humedad (%) y el pH (1:1) se realizósegún la metodología del IGAC (1999). El fósforo disponible (P) por el método de Bray II (ppm) fue realizado por el laboratorio de suelos de CORPOICA, Tibaitatá.
Las esporas de HMA se obtuvieron empleando la metodología de Gerdermann y Nicholson (1963), modificada por Sieverding (1983), realizando el tamizado con 45, 120 y 500 µm, gradiente de densidad con sacarosa al 50%, centrifugación a 3.200 rpm por tres minutos; los resultados son expresados en número de esporas/100 g de suelo. El micelio externo se obtuvo empleando la técnica de Herrera et al. (1986) en la cual la muestra se seca, se agita con H2O2, se licua, se filtra en húmedo y lava; se mide el número de hífas de HMA en cuatro transectos sobre un cuadrante de 22x22 mm por cada 0,02 g de suelo seco y dos gotas de glicerina. Los resultados se expresan en metros de micelio por gramo de suelo. El contenido de micelio externo fue transformado por Log10(x). No se obtuvo normalidad de la densidad de esporas, se realizó análisis de varianza (ANDEVA) por el método de KruscallWallis y separación de medias por rangos por el procedimientos de Tukey, entre tipos de paisajes, se determinaron los coeficientes de correlación de Spearman (rangos), empleando el programa SAS.
RESULTADOS Y DISCUSIÓN
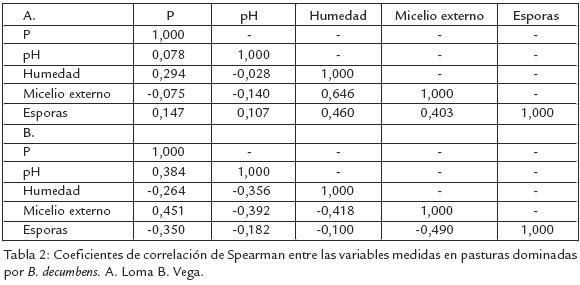
A pesar del predominio en estos suelos de muy bajos contenidos de fósforo, una alta acidez y un alto contenido de alumino, se encontraron diferencias entre paisajes en la misma zona. Los contenidos registrados de fósforo y el pH del suelo fueron inferiores en el paisaje de loma, pero el de esporas fue superior (Tabla 1). Una alta variabilidad en las características microbiológicas evaluadas, así como de las características físicoquímicas del suelo induce a pensar en ausencia de relaciones entre estos dos tipos de variables. Sin embargo, se encontró una alta correlación entre la humedad y el micelio externo en el paisaje de loma, mientras en el paisaje de vega no se encontraron correlaciones significativas (Tabla 2).
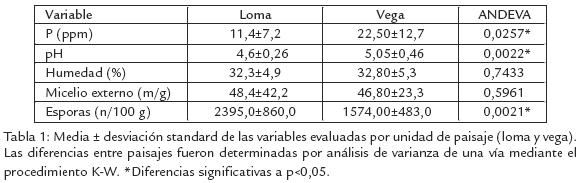
Los bajos contenidos de P disponible y los bajos pH del suelo son características predominantes en los suelos amazónicos, sin embargo en los suelos de loma se observaron valores promedio más bajos que en los de vega (Tabla 1). Esto puede deberse al lavado, escorrentía y acumulación en las vegas; a pesar de estas diferencias, no se encontró una correlación significativa entre estas variables y la densidad de inóculo, si bien las densidades de esporas fueron mayores en los suelos de loma (Tabla 1). El micelio externo de HMA y la humedad del suelo no presentaron diferencias entre paisajes (Tabla 1). Sin embargo, se observó una alta correlación entre estas dos características en loma (Tabla 2). Creemos que en las partes altas (humedad inferior) el micelio externo tiende a desarrollarse menos en busca de nutrientes, y en la parte más baja (mayor humedad), se desarrolla y extiende de forma más eficiente; diferencia que no ocurre en la vega donde el paisaje es homogéneo. Tomando en cuenta la distribución de inóculo (micelio y esporas de HMA) en los dos paisajes, los contenidos de micelio son más heterogéneos y el contenido de esporas es más alto en la loma que en la vega (Fig. 1). La mayor variabilidad del micelio externo observado en loma (Tabla 1), indicaría condiciones más diversas para su desarrollo que en vega; además las redes hifales son menos tolerantes a los disturbios en los suelos donde las esporas de HMA son frecuentes (Jasper et al., 1991). Se ha indicado que el incremento de la densidad de esporas puede ser el resultado de la exposición a situaciones de mayor estrés (Mecinas et al., 1991), aunque no necesariamente causado por las variables evaluadas (bajas correlaciones).
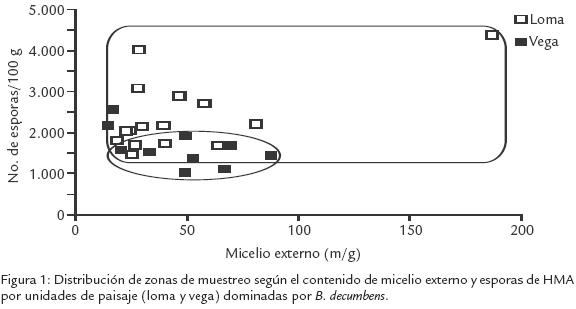
A manera de conclusión, en las condiciones predominantes en los sitios estudiados, el inóculo se distribuye de forma diferente en loma y vega, siendo mayor la densidad de esporas en loma que en vega y más homogéneo (menos variable) el contenido de micelio externo en vega que en loma. No se encontró efecto del fósforo disponible, el pH y la humedad del suelo sobre la densidad de inóculo de HMA.
AGRADECIMIENTOS
Deseamos expresar nuestros agradecimientos por la financiación del proyecto e infraestructura a la Universidad de la Amazonía, por medio de la Vicerrectoría de Investigaciones; a los miembros del grupo de Investigaciones de Microorganismos Simbiontes: Edith Medina Girón, Giovanni Lara, Faver Álvarez Carrillo, Juan Carlos Suárez, Carlos Rodríguez por su valiosa colaboración en todo sentido.
BIBLIOGRAFÍA
ABBOTT LK, ROBSON AD. Factors Influencing the Occurrence of VesicularArbuscular Mycorrhizas. Agric Ecosyst Environ. 1991;35:121150.
[ Links ]BAREA JM, AZCÓNAGUILAR C, OCAMPO JA, AZCÓN R. Morfología, anatomía y citología de las micorrizas vesículoarbusculares. En: Olivares J, Barea JM, editors. Fijación y movilización biológica de nutrientes Vol II. Capítulo 17. Fijación de N. y micorrizas. Madrid. Consejo superior de Investigaciones científicas; 1991. [ Links ]
CARVALHO LM, CAÇADOR I, MARTINSLOUÇÃO MA. Temporal and Spatial Variation of Arbuscular Mycorrhizas in Salt Marsh Plant of the Tagus Estuary (Portugal). Mycorrhiza. 2001;11:303309.
[ Links ]ENTRY JA, RYGIEWICZ PT, WATRUD LS, DONNELLY PK. Influence of Adverse Soil Conditions on the Formation and Function of Arbuscular Mycorrhizas. Adv Environ Res. 2002;7:123138.
[ Links ]ESCUDERO V, MENDOZA R. Seasonal Variation of Arbuscular Mycorrhizal Fungi in Temperate Grasslands Along a Wide Hydrologic Gradient. Mycorrhiza. 2005;15:291299.
[ Links ]FRIESE CF, ALLEN MF. The Spread of VA Mycorrhizal Fungal Hyphae in the Soil; Inoculum Types and External Hyphal Architecture. Mycologia. 1991;83:409418.
[ Links ]GERDEMANN J, NICHOLSON T. Spores of Mycorrhizal Endogone Species Extracted from Soil by Wet Sieving and Decanting. Trans Brit Mycol Soc. 1963;46:236244.
[ Links ]HERRERA R, RODRÍGUEZ A, FURRAZOLA E. Método para determinar la biomasa de micelio extramátrico vesículoarbuscular. En: Ciclo lectivo sobre el tema: Técnicas de investigación en micorriza. Turrialba; 1986. p.1828.
[ Links ]IGACINPA. Aspectos ambientales para el ordenamiento territorial del occidente del Departamento de Caquetá., V 2. IGACINPA. Bogotá: Editorial Tropembos Colombia; 1993.
[ Links ]IGAC. Métodos analíticos de CALS, recomendaciones establecidas para la reunión de representantes de laboratorios efectuada en el IBAC. Bogotá, Colombia. 1999.
[ Links ]JASPER DA, ABBOTT LK, ROBSON AD. The Effect of Soil Disturbance on VesicularArbuscular Mycorrhizal Fungi in Soils from Different Vegetation Types. New Phytol. 1991;118:471476.
[ Links ]MECINAS LJ, DOOR RC, CHUNG MA, MORENO DP. Micorrizas en tres especies forestales de la amazonía peruana. Rev For Perú. 1991;18:2943
[ Links ]MENDOZA R, GOLDMANN V, RIVAS J, ESCUDERO V, PAGANI E, COLLANTES M, MARBÁN L. Poblaciones de hongos micorrízicos arbusculares en relación con propiedades del suelo y planta hospedante en pastizales de Tierra del Fuego. Ecol Aust. 2002;12:105116.
[ Links ]MOSSE B. Advances in the Study of VesicularArbuscular Mycorrhiza. Annu Rev Phytopathol. 1973;11:171196.
[ Links ]OROZCO MO, RODRÍGUEZ ME, HERRERA RA, FERRER RL. Micorrizas VA, Micelio extramátrico y otras poblaciones microbianas asociadas a troncos en descomposición en un bosque tropical. En: Ciclo lectivo sobre el tema Técnicas de Investigación en Micorriza. CATIE, IFS, editors. Turrialba: Informe Provisional 1986;18. p. 251271.
[ Links ]PATTINSIB GS, HAMMILL KA, SUTTON BG, McGEE PA. Simulated Fire Reduces the Density of Arbuscular Mycorrhizal Fungi at the Soil Surface. Mycol Res. 1990;103:491496.
[ Links ]PORTER WM, ROBSON AD, ABBOTT LK. Factors Controlling the Distribution of Vesicular Arbuscular Mycorrhizal Fungi in Relation to Soil pH. J Appl Ecol. 1987a;24:663672.
[ Links ]PORTER WM, ROBSON AD, ABBOTT LK. Field Survey of the Distribution of Vesicular Arbuscular Mycorrhizal Fungi in Relation to Soil pH. J Appl Ecol. 1987b;24:659662.
[ Links ]POSADA R. Presencia de propágalos de hongos de micorriza arbuscular en muestras de hojarasca de alrededor de dos especies arbóreas en un bosque húmedo tropical. Acta biol Colomb. 2001;6(1):4755.
[ Links ]POSADA RH, FRANCO LA, MEDINA E. El tiempo de establecimiento de pasturas y su relación con la micorriza arbuscular en paisajes de loma y vega. Acta biol Colomb. 2006;11S:5565.
[ Links ]READ J, KOUCHEKI HK, HODGSON J. VesicularArbuscular Mycorrhiza in Natural Vegetation Systems. New Phytol. 1976;77:641653.
[ Links ]RICKERL DH, SANCHO FO, ANANTH S. VesicularArbuscular Endomycorrhizal Colonization of Wetland Plants. J Environ Qual. 1994;23:913916.
[ Links ]SIEVERDING E. Manual de métodos para la investigación de la micorriza vesículoarbuscular en el laboratorio. Centro Internacional de Agricultura Tropical (CIAT). Cali. Proyecto Micorriza; 1983.
[ Links ]SIEVERDING E. Vesicular Arbuscular Mycorrhizae Management in Tropical Agroecosystems. Technical Cooperation, Federal Republic of Germany. Eschborn; 1991. p. 271.
[ Links ]WANG GM, STRIBLEY DP, TINKER PB, WALTER C. Effects of pH on Arbuscular Mycorrhizal. I. Field Observations on the LongTerm Liming Experiments at Rothamstead and Woburn. New Phytol. 1993;124(3):465472.
[ Links ]