Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.12 no.2 Bogotá Jul./Dec. 2007
APROXIMACIÓN AL ESTUDIO DE LA INTERACCIÓN ENTRE Aristolochia maxima Y LARVAS DE LAS MARIPOSAS Battus polydamas polydamas Y Parides panares erythrus MEDIADA POR ÁCIDOS ARISTOLÓQUICOS
Approach to the Interaction Studies of Aristolochia maxima and the Caterpillars of Butterflies Battus polydamas polydamas and Parides panares erythrus
RICARDO A. CLARO1, M.Sc.; HEBELIN CORREA2, M.Sc.; CARMENZA DUQUE2, Ph. D.; NATALIA RUIZ1*, Ph. D. 1 Departamento de Biología, Universidad Nacional de Colombia. Sede Bogotá, ciudad universitaria, Carrera 30 No. 4503. AA. 14490. Bogotá, Colombia. raclaroc@unal.edu.co nruizr@unal.edu.co 2 Departamento de Química, Universidad Nacional de Colombia. Sede Bogotá, ciudad universitaria, Carrera 30 No. 4503. AA. 14490. Bogotá, Colombia. hcorreav@unal.edu.co cduqueb@unal.edu.co *Autor para correspondencia: nruizr@unal.edu.co
Presentado 26 de febrero de 2007, aceptado 28 de marzo 2007, correcciones 7 de junio de 2007.
RESUMEN
Las mariposas de la tribu Troidini (Lepidoptera: Papilionidae) capturan los ácidos aristolóquicos (AAs) provenientes de su alimentación larval en plantas de Aristolochiaceae para su protección. En este estudio se detectó la presencia de los ácidos aristóloquicos I y II (AAI y AAII) en hojas jóvenes de Aristolochia maxima (Aristolochiaceae) y en larvas de las mariposas Battus polydamas polydamas y Parides panares erythrus (Papilionidae, Papilioninae) por Cromatografía Líquida de Alta Eficiencia (CLAE). De acuerdo con los resultados de los perfiles cromatógraficos por CLAE, el AAI fue el ácido aristolóquico mayoritario encontrado tanto en las larvas como en las hojas jóvenes de la planta, seguido por cantidades menores del AAII. Estos resultados permiten afirmar que la interacción plantaanimal entre las mariposas de las especies B. polydamas y P. panares y las plantas de A. maxima, está mediada, por los ácidos aristóloquicos I y II.
Palabras clave: aristolóquicos, Lepidópteros, cromatografía, Parides, Papilionidae, Aristolochia, mariposas, Troidini, CLAE.
ABSTRACT
Most butterflies of the tribe Troidini (Lepidoptera: Papilionidae) sequester aristolochic acids (AA) for their protection. These acids are derived from their host plants family Aristolochiaceae upon which they feed on during their larval stages. Using analytical High Performance Liquid Chromatography (HPLC) methods we were able to detect the presence of aristolochic acids I and II both in the young leaves of Aristolochia maxima (Aristolochiaceae) and in the caterpillars of the butterflies Battus polydamas polydamas and Parides panares erythrus (Papilionidae, Papilioninae). Aristolochic acid I was the major constituent found, followed by lesser amounts of Aristoloquic acid II. These results confirm that the hostanimal interaction among butterflies of the studied species and A. maxima plants is mediated, by aristolochic acids.
Key words: Aristolochic, chromatography, butterflies, Lepidoptera, Aristolochia, Larval, HPLC.
INTRODUCCIÓN
Existen numerosos estudios con evidencia significativa que permiten asignar a los metabolitos de las plantas un papel importante como mediadores de herbivoría y de acuerdo a su efecto en el comportamiento de los insectos, éstos pueden clasificarse como atrayentes, repelentes, estimulantes y disuasivos (Mitchell, 1981; Jaenike, 1990; Bernays y Chapman, 1994). Específicamente a los ácidos aristolóquicos, en la relación AristolochiaTroidini, se les ha asignado un papel de defensa química contra depredadores (Brower, 1984), en vista de su toxicidad contra insectos, pocos insectos, con excepción de los Troidini, pueden alimentarse de Aristolochia, lo cual estaría indicando una toxicidad inusual en estas plantas (Chen y Zhu, 1987; Sun, 1995). Por el contrario, otros compuestos tóxicos producidos por las aristoloquias y otras familias de plantas (i.e., alcaloides pirrolizidínicos, glicósidos iridoides, glicósidos cianogénicos) son tolerados e incorporados por diferentes insectos aposemáticos (Feeny, 1991). En contraste, los ácidos aristolóquicos (AA) disuaden la alimentación y son tóxicos para varias larvas de lepidópteros no adaptados (Sime et al., 2000). Esta situación condujo a la hipótesis de que la relación entre el género Aristolochia y los Troidini neotropicales ha evolucionado mutuamente (Brown et al., 1991), debido a que los Troidini se alimentan de géneros de Aristolochiaceae que contienen ácidos aristolóquicos. Por lo tanto, se asume que la dependencia de los Troidini por esos compuestos, para defensa y reconocimiento de la planta hospedera, explica la restricción de Troidini a las aristoloquias (Feeny, 1991; Feeny, 1995; Morais y Brown, 1991; Fagua y Ruiz, 1996; Da Silva, 2004).
La función de defensa de los ácidos aristolóquicos contra enemigos naturales se evidencia en el gran número de especies aposemáticas tóxicas en la tribu Troidini que hacen parte de complejos miméticos (Brower y Brower, 1964). Por ejemplo, Nishida y Fukami (1989) mostraron el efecto del AAI como repelente alimenticio para aves de la especie Passer montanus. Por otra parte, Haase (1893) notó que las larvas y pupas son menos susceptibles al parasitismo que los inmaduros de otros papilionidos de sabor agradable (Sime et al., 2000). No obstante, el conocimiento del papel defensivo de los ácidos aristolóquicos recae sobre las investigaciones químicas; el sabor desagradable de las mariposas es frecuentemente más asumido que documentado (Sime et al., 2000). En el caso de Battus polydamas hay evidencia experimental del sabor desagradable para los pájaros (Chai, 1986; Pinheiro, 1996) que complementa los datos químicos preliminares (Rothschild et al., 1970; Urzua y Priestap, 1985).
Sin embargo, se han determinado concentraciones muy variables de ácidos aristolóquicos en Troidini que van desde cero o en cantidades traza a más de 150 µg por insecto, predominantemente AAI y AAIII (Mebs y Schneider, 2002). Urzua et al. (1987) aislaron AAI y AAIVa de Battus archidamas, y AAI, II, IIIa, y IVa de larvas de B. polydamas capturadas en el campo, pero larvas criadas en A. elegans mostraron solo trazas de AA (Urzua y Priestap, 1985). Igualmente, Klitzke y Brown (2000) midieron la concentración de ácidos aristolóquicos en 17 especies de Troidini, encontrando la más baja concentración en hembras de B. polydamas criadas en A. elegans en condiciones de laboratorio. En contraste, Mebs y Schneider (2002) no encontraron ácidos aristolóquicos, o solo presentaban valores marginales, ni en las especies de Troidini ni en la mayoría de especies de Aristolochia que estudiaron (i.e., A. elegans), sugiriendo que la presencia o ausencia de ácidos aristolóquicos en las larvas puede deberse a la especie de Aristolochia disponible en el área donde la mariposa ha sido recolectada.
La hipótesis de que los ácidos aristolóquicos presentes en las especies del género Aristolochia sirven a las mariposas de la tribu Troidini como mecanismo de defensa química, fagoestimulantes, inductores de oviposición y disuasores de depredación (Chai, 1986; Codella y Lederhouse, 1989; Morais y Brown, 1991; Fordyce, 2000; Sime et al., 2000), al igual que la gran variación en la presencia de ácidos aristolóquicos tanto en las aristoloquias como en los Troidini, nos condujo al estudio de métodos de detección analíticos de AAs, en hojas jóvenes de Aristolochia maxima y en larvas de las especies de papilionidae Battus polydamas polydamas y Parides panares erythrus, para evidenciar la relación química entre estos organismos. Por lo tanto, en este trabajo se utilizaron los métodos analíticos de cromatografía en capa delgada (CCD), cromatografía líquida de alta eficiencia (CLAE) y espectrometría de masas (EM) por impacto electrónico, con el fin de detectar la presencia de los ácidos aristolóquicosI y II, en hojas de Aristolochia maxima y en larvas de B. polydamas y P. panares en condiciones de laboratorio.
MATERIALES Y MÉTODOS
GENERAL
Una mezcla de ácidos aristolóquicos, grado comercial, y de composición incierta, fue comprada a Chromadex Inc. (USA; Lote 011000767) y purificada en el laboratorio por cromatografía líquida de alta eficiencia preparativa, para obtener estándares puros de AAI y AAII. Los demás reactivos usados fueron grado analítico. Para la cromatografía en capa delgada (CCD) se utilizaron cromatoplacas de sílica gel 60 F254, Poligram SILG /UV254 MACHEREYNAGEL, (20x20) de 0,20 mm de espesor, usando como eluente una mezcla de AcOEt/Hexano (8:2) y como estándar de referencia la mezcla de ácidos aristolóquicos mencionada anteriormente. La visualización fue hecha en primera instancia con una cámara de luz ultravioleta a una longitud de onda de 254 nm y después se revelaron las placas con una solución de ácido sulfúrico en etanol al 50% con calentamiento a 100 ºC. La cromatografía en columna (CC) se realizó sobre sílica gel 60 (0,0400,063 mm Merck; 1 g), en un tubo de vidrio de longitud de 15 cm y un diámetro interno de 1 cm, empleando como eluente acetato de etilo R.A. Para la cromatografía líquida de alta eficiencia (CLAE) preparativa, se usó un equipo MerckHitachi equipado con un detector UV/VIS L4250, y una columna LiChrosphere C18 (125x4 mm d.i., 5µm), detectando a 254 nm. Los análisis por espectrometría de masas en modo de impacto electrónico fueron realizados en un equipo Shimadzu QP5050, con un voltaje de ionización de 70 eV. Se detectaron los iones positivos con masas entre 50 y 500 u.
MATERIAL VEGETAL Y ANIMAL
Hojas jóvenes de Aristolochia maxima y huevos de mariposas Battus polydamas y Parides panares fueron recolectados, en el municipio de Nilo en el departamento de Cundinamarca, Colombia, en el mes de marzo de 2006, a una altitud media de 336 m con una temperatura entre 2430 ºC y humedad relativa promedio de 75%. El espécimen de la planta fue identificado y depositado bajo el número RAC014 en el Herbario Nacional Colombiano, en el Instituto de Ciencias Naturales. Las larvas de las mariposas se obtuvieron a partir de huevos eclosionados en un cuarto de cría con condiciones controladas de temperatura 27,7 ºC ± 1,6, humedad 59,6% ± 4,7 y fotoperíodo de 12 horas luz, durante los meses de marzo y mayo de 2006. Las larvas se alimentaron con hojas jóvenes de Aristolochia maxima, suministrada at libitum hasta su madurez, determinada cuando su cuerpo presenta características de color café claro con amarillo, moteado con finas estrías negras y tubérculos carnosos de color café con un par de tubérculos largos móviles en el protórax.
EXTRACCIÓN DE ÁCIDOS ARISTOLÓQUICOS
Un gramo de material seco y molido tanto de hojas como de larvas de cada una de las dos mariposas aquí estudiadas, fue sometido por separado a extracción Soxhlet usando metanol R.A. durante cinco horas, hasta que el material extraído se tornó incoloro. Cada extracto crudo fue concentrado a presión reducida en rotavapor (40 ºC).
CCD DE LOS EXTRACTOS CRUDOS DE ÁCIDOS ARISTOLÓQUICOS
Cada uno de los extractos crudos fue disuelto en una mezcla de AcOEt/Hexano (8:2) y una pequeñísima parte fue aplicada sobre las cromatoplacas de sílica gel y sometida a elución con el mismo solvente mencionado. Luego de un corrimiento, las placas fueron secadas a temperatura ambiente y observadas a luz UV y luego reveladas como se menciona anteriormente en la primera parte de la sección de materiales y métodos.
CC DE LOS EXTRACTOS CRUDOS DE ÁCIDOS ARISTOLÓQUICOS
Una parte (150 mg) de de cada uno de los extractos fue fraccionada por separado por cromatografía en columna (CC) sobre sílica gel usando como fase móvil acetato de etilo, recogiendo fracciones de 5 mL. Las fracciones fueron controladas por CCD frente al estándar de AAI y AAII para seleccionar aquellas donde estuvieran presentes los ácidos aristolóquicos. De esta manera se obtuvieron tres fracciones, una enriquecida con ácidos aristolóquicos proveniente de las hojas de de A. maxima y otras dos provenientes de las larvas de mariposas. Estas fracciones fueron luego analizadas por CLAE.
CLAE DE LAS FRACCIONES ENRIQUECIDAS CON ÁCIDOS ARISTOLÓQUICOS
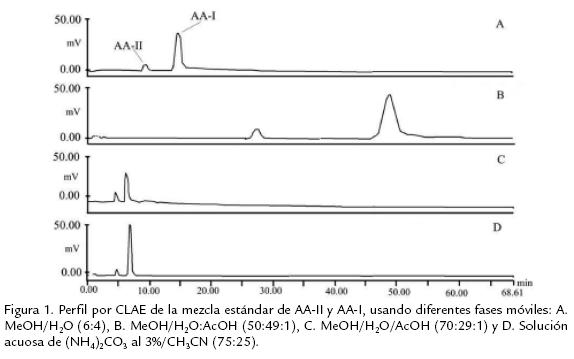
Para realizar la CLAE de los ácidos aristolóquicos que pudieran estar presentes en las fracciones obtenidas del material vegetal y animal usado, fue necesario primero seleccionar una fase móvil que permitiera una buena separación de ellos. Para este propósito y tomando la mezcla estándar de AAI y AAII, se ensayaron varias fases móviles, por ejemplo: MeOH/H2O (6:4), MeOH/H2O/AcOH (50:49:1), (70:29:1) y (80:19:1), una solución acuosa de (NH4)2CO3 al 3%/CH3CN (75:25), todas a un flujo de 1 mL/min. Finalmente, y tomando en cuenta el criterio de obtener una buena separación en un tiempo razonable de análisis, se seleccionó como mejor fase móvil la solución acuosa de (NH4)2 CO3 al 3%/CH3CN (75:25) al flujo mencionado. Así, utilizando estas condiciones, se inyectaron 20 µl de cada una de las fracciones de AA de las hojas de A. maxima y de las larvas de las mariposas B. polydamas y P. panares, a una concentración de 0,1 mg/mL y 20 µl de una solución de 0,85 mg/mL de la mezcla patrón de ácidos aristolóquicos.
ESPECTROMETRÍA DE MASAS
Para confirmar la identidad de los ácidos aristolóquicos presentes en la mezcla estándar utilizada en este trabajo, se sometieron a espectrometría de masas cada uno de los ácidos aristolóquicos aislados por CLAE preparativa a partir de dicha mezcla. Se utilizó el modo de impacto electrónico, por entrada directa del analito a la fuente de ionización.
RESULTADOS Y DISCUSIÓN
Tanto los extractos como las fracciones enriquecidas en ácidos aristolóquicos de las hojas jóvenes de A. maxima y de las larvas de las mariposas B. polydamas y P. panares, fueron primero analizados por CCD usando una mezcla estándar de AAI y AAII como referencia. Bajo las condiciones usadas todos los extractos y fracciones mostraron la presencia de AA.
Para seleccionar las mejores condiciones de análisis por CLAE en cuanto a separación y tiempo de análisis de las fracciones enriquecidas en ácidos aristolóquicos fue necesario seleccionar diferentes composiciones de fase móvil, usando como analito de prueba la mezcla estándar de AAI y AAII. La figura 1 muestra el perfil de separación obtenido para los dos ácidos sometidos a separación vs. tiempo de análisis, con las diferentes fases móviles ensayadas. De ellas las que mejor resultado ofrecieron fueron la fase móvil MeOH/H2O/AcOH (70:29:1) y la solución acuosa de (NH4)2CO3 al 3%/CH3CN (75:25) a un flujo de 1mL/min. Sin embargo, con la primera fase la simetría de las señales obtenidas no fue buena, por esta razón se prefirió trabajar con la segunda que ofreció una buena resolución y un tiempo razonable de análisis (menos de 10 minutos para cada muestra).
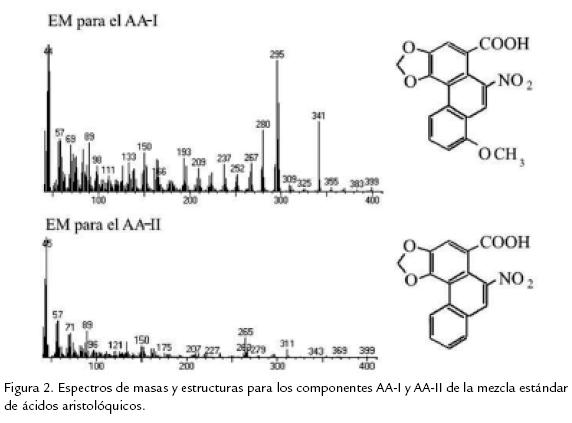
Para la identificación de cada uno de los ácidos aristolóquicos presentes en la mezcla estándar, fue necesario aislar cada uno de los dos compuestos visibles en los cromatogramas obtenidos anteriormente, por CLAE preparativa, con el fin de obtener cantidad suficiente de cada uno de ellos para investigar y/o confirmar su identidad por espectrometría de masas. La figura 2 muestra los espectros de masas obtenidos por inyección directa de cada compuesto (tanto para AAI como para el AAII), en una fuente de ionización de impacto electrónico y las estructuras químicas deducidas acordes con el espectro de fragmentación obtenido. El espectro de masas del AAI mostró un ión molecular en m/z 341 consistente con una formula C17H11O7N y un ión base en m/z 295 correspondiente a la pérdida de NO2 desde el ión molecular, además de otros iones que están de acuerdo con la estructura de ácido 8metoxi3,4dioximetilen10nitrofenantreno, para este compuesto. De igual forma, el espectro de masas por impacto electrónico del AAII mostró un ión molecular en m/z 311 consistente con una fórmula 16H9O6N, además se observa un ión en m/z 265 correspondiente a la pérdida de NO2 desde el ión molecular y otros iones que de manera similar al caso anterior permiten asignar la estructura de ácido 3,4dioximetilen10nitrofenantreno para este segundo ácido aristolóquico (AAII).
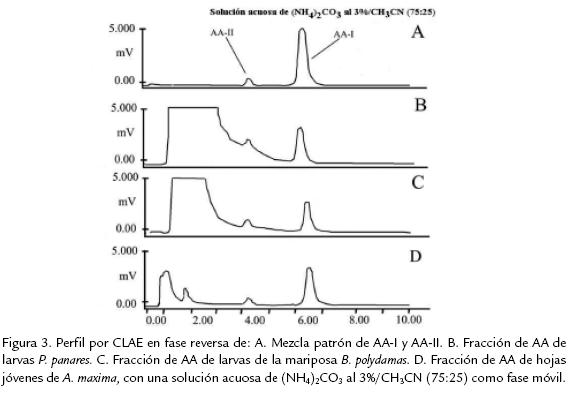
Una vez establecidas las mejores condiciones en CLAE para la separación e identificación de ácidos aristolóquicos patrones, se sometieron las fracciones enriquecidas en ácidos aristolóquicos de hojas jóvenes de A. maxima y de las larvas de las mariposas B. polydamas y P. panares a CLAE utilizando como fase móvil una solución acuosa de (NH4)2CO3 al 3%/CH3CN (75:25). Los resultados obtenidos se muestran en la figura 3. En los perfiles cromatográficos obtenidos tanto de la planta como de las larvas de mariposa, se observan siempre dos señales con tiempos de retención idénticos a los mostrados por los compuestos AAI y AAII de la mezcla estándar usada, lo cual permite concluir con certeza que la planta y las larvas contienen los mismos ácidos aristolóquicos identificados en la mezcla estándar. Adicionalmente, se realizó la coinyección de AAI y AAII, aislados de la mezcla patrón, con cada una de las fracciones enriquecidas en ácidos aristolóquicos de la planta y las larvas, obteniendo en cada caso total homogeneidad de las dos señales cromatográficas, confirmando así, la presencia de AAI y AAII tanto en la planta y como en las larvas de las dos especies de mariposas.
También es importante anotar que de acuerdo con los resultados de los perfiles cromatógraficos por CLAE, el ácido aristolóquicoI fue el ácido aristolóquico mayoritario detectado tanto en las larvas de B. polydamas y P. panares, así como en las hojas jóvenes de la planta de A. maxima, seguido de cantidades menores del ácido aristolóquico II. Lo anterior coincide con trabajos previos realizados en aristoloquias (Li et al., 2004); sin embargo puede existir variabilidad en las concentraciones de AA, dependiendo de diferentes factores (i.e., lugar, estación, parte de la planta) o de la técnica y condiciones de análisis de la muestra (Sime et al., 2000; Li et al., 2004; Koh et al., 2006). Finalmente, es importante anotar que los ácidos aristolóquicos I y II, constituyentes químicos específicos y de distribución restringida a las especies de plantas de la familia Aristolochiaceae (Feeny, 1995), encontrados en los últimos instares larvales de Battus polydamas polydamas y Parides panares erythrus, son posiblemente almacenados y utilizados como mecanismo de defensa de estas larvas contra depredadores (Berenbaum, 1995; Klitzke y Brown, 2000).
AGRADECIMIENTOS
Los autores expresan sus agradecimientos a la Asociación Parque Natural Mana Dulce, a los profesores Juan Carulla del Laboratorio de Nutrición y Jairo Cerón del Laboratorio de Entomología del IBUN de la Universidad Nacional de Colombia. La investigación y experimentación, fuente de este artículo, se logró gracias al apoyo financiero de la Vicerrectoría de Investigaciones de la Universidad Nacional de Colombia.
BIBLIOGRAFÍA
BROWER LP. Chemical Defense in Butterflies. En: VaneWright RI, Ackery PR, editors. The Biology of Butterflies. London: Academic Press; 1984.p.109-134.
[ Links ]BROWER LP, BROWER JVZ. Birds, Butterflies, and Plant Poisons: A Study in Ecological Chemistry. Zoologica. 1964;49:137-159.
[ Links ]BROWN KS, TRIGO JR, FRANCINI RB, DE MORAIS AB, MOTTA PC. Aposematic Insects on Toxic Host Plants: Coevolution, Colonization, and Chemical Emancipation. En Price PW, Lewinsohn TM, Fernandez GW, Benson WW, editors. PlantAnimal Interactions: Evolutionary Ecology in Tropical and Temperate Regions. New York: WileyInterscience; 1991. p. 1375-1402.
[ Links ]CHAI P. Field Observations and Feeding Experiments on the Responses of RofousTailed Jacamars (Galbula ruficauda) to FreeFlying Butterflies in a Tropical Rainforest. Biol J Linn Soc. 1986;29:161-189.
[ Links ]CODELLA GS, LEDERHOUSE RC. Intersexual Comparison of Mimetic Protection in the Black Swallowtail Butterfly, Papilio polyxenes: Experiments with Captive Blue Jays Predators. Evolution. 1989;43:410-420.
[ Links ]DA SILVA LK. Preferência de hospedeiros e relaçôes filogenéticos na tribo Troidini (Lepidoptera: Papilionidae) e suas plantas hospedeiras, Aristolochia (Aristolochiaceae). 2004. Resem, XXVI Reuniâo Anual sobre Evolçâo, sistemática e Ecologia Macromoleculares. Instituto de Química, Universidade Federal Fluminense, 1 a 3 de dezembro. Disponible en URL: http://www.uff.br/lapromar/RESEMFiles/Resumos/KarinaLucasdaSilva.pdf
[ Links ]FAGUA GG, RUIZ N. Relaciones de herbivoría entre papiliónidas (Lepidoptera) y especies de Aristolochia (Aristolochiaceae). En: Andrade CG, García AG, Fernández F, editores. Insectos de Colombia, estudios escogidos. Bogotá: Academia Colombiana de Ciencias Exactas, Físicas y Naturales: 1996. XIII: p. 473-541.
[ Links ]FEENY P. Chemical Constraints on the Evolution of Swallowtail Butterflies. En: Price PW, Lewinsohn TM, Fernandez GW, Benson WW, editors. PlantAnimal Interactions: Evolutionary Ecology in Tropical and Temperate Regions. New York: J. Wiley and Sons; 1991. p. 315-339.
[ Links ]FEENY P. Ecological Opportunism and Chemical Constraints on the Host Associations of Swallowtail Butterflies. En Scriber J. M., Tsubaki Y. Lederhouse R. C. Swallowtail Butterflies: Their Ecology and Evolutionary Biology. Gainesville: Scientific Publishers; 1995. 2: p. 9-16.
[ Links ]FORDYCE JA. A Model Without a Mimic: Aristolochic Acids from the California Pipevine Swallowtail, Battus philenor hirsuta, and its host plant, Aristolochia californica. J Chem Ecol. 2000;26(11):2567-2578.
[ Links ]KLITZKE FC, BROWN KS. The Occurrence of Aristolochic Acids in Neotropical Troidine Swallowtails (Lepidoptera: Papilionidae). Chemoecology. 2000;10:19-102.
[ Links ]KOH HL, WANG H, ZKOU S, CHAN E, WOO SO. Detection of Aristolochic Acid I, Tetrandrine and Fangchinoline in Medicinal Plants by High Liquid Chromatography and Liquid Chromatography/Mass Spectrometry. J Pharm Biomed Anal. 2006;40:653-661.
[ Links ]LI W, GONG S, WEN D, CHE B, LIAO Y, LIU H, et al. Rapid Determination of Aristolochic Acid I and II in Aristolochia Plants from Different Regions by CyclodextrinModified Capillary Zone Electrophoresis. J Chromatogr A. 2004;1049:211-217.
[ Links ]LI W, LI R, BO T, LU H, FENG X, SHILIN H. Rapid Determination of Aristolochic Acids I and II in Some Medicinal Plants by HighPerformance Liquid Chromatography. Chromatographia. 2004;59:233-236.
[ Links ]MEBS D, SCHNEIDER M. Aristolochic Acid Content of Southeast Asian Triodine Swallowtail (Lepidoptera: Papilionidae) and of Aristolochia Plant Species (Aristolochiaceae). Chemoecology. 2002;12:11-13.
[ Links ]MORAIS BBA, BROWN K. Larval Foodplant and Other Effects on Troidine Guild Composition (Papilionidae) in Southeastern Brazil. J Res Lipid. 1991;30(1-2):19-37.
[ Links ]NISHIDA R, FUKAMI H. Ecological Adaptation of an AristolochiaceaeFeeding Swallowetail Butterfly, Atrophaneura alcinous, to Aristolochic Acids. J Chem Ecol. 1989;15:2549-2575.
[ Links ]PINHEIRO CEG. Palatability and Escaping Ability in Neotropical Butterflies: Test with Wild Kingbirds (Tyrannus melancholicus, Tyrannidae). Biol J Linn Soc. 1996;59:351-365.
[ Links ]ROTHSCHILD M, REICHSTEIN T, VON EUW J, APLIN R, HARMAN RM. Toxic Lepidoptera. Toxicon. 1970;8:293-299.
[ Links ]SIME RK, FEENY PP, HARIBAL MM. Sequestration of Aristolochic Acids by the Pipevine Swallowtail, Battus philenor (L.): Evidence and Ecological Implications. Chemoecology. 2000;10:169-178.
[ Links ]URZUA A, PRIESTAP H. Aristolochic Acids from Battus polydamas. Biochem Syst Ecol. 1985;13(2):169-170.
[ Links ]URZUA A, RODRIGUEZ R, CASSELS B. Fate of Ingested Aristolochic Acids in Battus archidamas. Biochem Syst Ecol. 1987;15(6):687-689.
[ Links ]