Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.12 no.2 Bogotá Jul./Dec. 2007
AISLAMIENTO Y CARACTERIZACIÓN DE UNA POLIFENOLOXIDASA RELACIONADA CON LA TOLERANCIA DEL CLAVEL (Dianthus caryophyllus) A Fusarium oxysporum f. sp. dianthi raza 2
Isolation and Characterization of a Polyphenoloxidase Related with Carnation (Dianthus caryophyllus) Resistence to Fusarium oxysporum f. sp. dianthi raza 2
VIANA ROQUESA MAYORGA1, M.Sc. CienciasBioquímica; BLANCA LIGIA HIGUERA M1, Dr.Sc. CienciasQuímica 1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, Sede Bogotá, ciudad universitaria, Carrera 30 No. 4503. AA. 14490. Bogotá, Colombia. blhiguerad@unal.edu.co
Presentado 4 de diciembre de 2006, aceptado 8 de marzo 2007, correcciones 28 de mayo de 2007.
RESUMEN
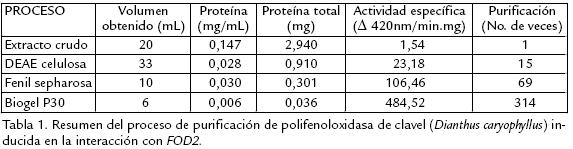
Se purificó y caracterizó bioquímicamente la enzima polifenoloxidasa (PFO) inducida en tallos de clavel (Dianthus caryophyllus L) de variedad tolerante por inoculación con el patógeno Fusarium oxysporum f. sp. dianthi raza 2 (FOD2), causante del marchitamiento vascular. La purificación se logró a través de procesos sucesivos de cromatografía en columna de intercambio iónico, de interacción hidrofóbica y de exclusión molecular. A través de éstos se logró un factor de purificación de 314 veces con respecto al extracto inicial. La proteína purificada mostró actividad PFO y una única banda en SDSPAGE correspondiente a 40 kDa. Usando catecol como sustrato, se determinó su temperatura óptima en 45 ºC y su pH óptimo en 7,5. La enzima presentó una cinética tipo MichaelisMenten con un valor Km de 249 mM y Vmáx 322 U/min. El punto isoeléctrico (PI= 5,0) permitió establecer que se trata de una proteína de tipo ácido. Con la enzima purificada se realizaron ensayos in vitro de actividad fungitóxica, usando sus productos de reacción enfrentados al hongo FOD2, encontrándose una actividad inhibitoria importante de cerca del 57% a las 24 horas, lo que permite postular su papel en los mecanismos de defensa del clavel contra este patógeno vascular.
Palabras clave: polifenoloxidasa, PPO, clavel, Fusarium oxysporum, proteínas purificación.
ABSTRACT
Polyphenoloxidase (PPO) was isolated and purified from stems of carnation (Dianthus caryophyllus L) after the inoculation with Fusarium oxysporum f. sp. dianthi race 2 (FOD2) of a tolerant variety. Purification was performed using column chromatography of ionic exchange, hydrophobic interaction and molecular exclusion. With these successive steps, a factor of 314 fold purification was achieved. The SDSPAGE analysis showed one band of 40 kDa. The purified enzyme was partially characterized using cathecol as substrate and determined the optimal temperature as 45ºC and 7.5 as optimal pH. The enzyme showed a MichaelisMenten kinetic with Km of 249 mM and Vmax 322 U/min. The IP was 5.0 indicating the acidic character of this protein. Using the purified enzyme and its reaction products, in vitro fungitoxic assays were realized indicating an important inhibitory activity against FOD2 of 57% at 24 hours. Then, it is possible to postulate that this enzyme is activated as a part of the defense mechanisms in this interaction model.
Key words: Polyphenol oxidase, carnation, Fusarium oxysporum, proteins purification.
INTRODUCCIÓN
El clavel (Dianthus caryophyllus L.) hace parte del gran mercado de las flores en el mundo. Colombia tiene un papel importante en la producción de flores, siendo el segundo exportador mundial después de Holanda y el primero en claveles1. Es por ello que el estudio de las enfermedades que llegan a afectar la producción de esta flor reviste particular importancia, especialmente el marchitamiento vascular ocasionado por el hongo FOD2, que ataca de manera agresiva este cultivo dejando pérdidas anuales significativas a los cultivadores en todo el mundo. Estudios anteriores del grupo en este modelo ( Higuera, 2001; Ardila e Higuera, 2005) han permitido determinar que en la interacción del clavel de variedad tolerante con el hongo FOD2, ocurren una serie de eventos que están siendo investigados en detalle, entre los cuales se destaca la producción de compuestos fenólicos (fitoalexinas) que contribuyen a la defensa de la planta (Higuera, 2001). Se ha encontrado también que se produce una importante inducción de la enzima polifenoloxidasa, inducción que fue observada a un tiempo temprano después de la infección de una variedad tolerante con el patógeno FOD2, indicando su posible papel en la defensa vegetal en este modelo de interacción (Ardila e Higuera, 2005).
Polifenoloxidasa (E.C. 1.10.3.1) es una óxidoreductasa dependiente de cobre, que cataliza la reacción entre catecol y oxígeno para dar benzoquinona y otras quinonas, productos que interactúan con otras moléculas formando, entre otros, compuestos coloreados responsables del pardeamiento vegetal, muy estudiado en frutas y productos agrícolas y a los que se ha atribuido efecto tóxico hacia ciertos microorganismos. Además, dichas oxidasas pueden estar involucradas con la producción de compuestos fenólicos, precursores de la síntesis de lignina para el reforzamiento de paredes vegetales, proceso éste que tiene un papel importante en las respuestas de defensa de las plantas. La caracterización molecular de diversas PFO se ha llevado a cabo desde los años 70 (Mayer y Harel, 1979), encontrándose rasgos interesantes como la activación de una protoenzima que está sujeta a las membranas de los tilacoides (PM: 6765 kDa) y que por acción de proteasas toma su forma activa (PM: 4530 kDa) (Gelder et al., 1997). La diversidad entre las PFO puede ser explicada en parte por este fenómeno. Se reporta también variación en cuanto a sus parámetros cinéticos, especificidad de sustratos (catecol, Ldopa, ácido clorogénico, entre otros), temperatura óptima (2050 ºC), pH óptimo (5,09,0) y PI (5,010,0). El estudio de esta enzima ha tomado importancia en modelos de interacción plantainsecto (Constabel et al., 2000), en los cuales la protección de la planta contra herbívoros parece darse debido al mal sabor que presentan las hojas por su alto contenido de quinonas, las cuales son producidas por dichas enzimas. Sin embargo, son muy escasos los reportes de PFO involucradas en interacciones plantahongo y no se conocen, hasta ahora, enzimas de este tipo relacionadas con la defensa del clavel. Dada su posible participación en las respuestas del clavel frente a FOD2, en este trabajo se aisló y se caracterizó una PFO inducida en plantas de variedad tolerante por inoculación con el patógeno, con miras a contribuir a la elucidación de los mecanismos de defensa en este modelo, conocimiento que es básico para poder plantear estrategias futuras de control de la enfermedad marchitamiento vascular.
MATERIALES Y MÉTODOS
MATERIAL VEGETAL
Se realizó un ensayo in vivo con 150 esquejes de clavel de la variedad Carolina, tolerante a FOD2, de nueve semanas, provenientes de propagación in vitro y certificados para ausencia de patógenos. Se usaron además esquejes de la variedad Uconn, susceptible a FOD2, como control positivo de la infección.
INOCULACIÓN
Un aislamiento del patógeno FOD2 fue suministrado por la empresa América Flor S.A. Este fue mantenido en medio sólido Czapeck Broth® a 25 ºC y posteriormente recultivado en medio líquido Czapeck Broth®, a 25 ºC, con agitación constante (80 rpm), hasta que la concentración de conidias fue la adecuada para obtener, después de filtrar a través de gasa estéril, una suspensión de 1 x 106 conidias/mL. Los esquejes (tanto de la variedad tolerante como susceptible) fueron inoculados según procedimiento implementado en un trabajo anterior (Higuera, 2001), el cual consistió en realizarles una pequeña herida con una cuchilla estéril en el tallo y posteriormente sumergirlos por 30 s en la suspensión de conidias. Se sembraron luego en recipientes que contenían un sustrato arcilloso y agua estériles.
EXTRACCIÓN DE LA ENZIMA POLIFENOLOXIDASA (E.C. 1.10.3.1)
A las 12 horas postinoculación (Ardila e Higuera, 2005), los esquejes de la variedad tolerante fueron cosechados, lavados, marcados y congelados para realizar la extracción. Para ésta, los tallos fueron macerados con N2 líquido y el polvo resultante fue extraído por tres veces con acetona fría. El pellet obtenido fue tratado con buffer fosfatos 0,1M, pH 7,0 que contenía 3% de polivinilpolipirrolidona (PVPP). La extracción se realizó a 4 ºC por 1 h, con agitación constante. El sobrenadante fue recobrado por centrifugación (11.000 rpm) por 30 min a 4 ºC (Ardila e Higuera, 2005). De éste, se tomaron alícuotas de 1 mL para realizar la cuantificación tanto de proteína como de actividad PFO. El extracto sobrante fue congelado a 20 ºC y posteriormente liofilizado para realizar el aislamiento de la enzima, usando la metodología que se describe más adelante.
DETERMINACIÓN DE LA ACTIVIDAD ENZIMÁTICA
La actividad PFO fue determinada según el protocolo establecido en un trabajo previo (Ardila e Higuera, 2005). Se usó como sustrato catecol 0,1 M en buffer fosfatos 0,1 M pH 7,0 con piruvato de sodio (1,64 mg/mL) y 50 µL de proteína. La absorbancia fue leída a 420 nm desde el momento de la adición del catecol hasta 30 s, con un intervalo de lectura cada 5 s. Una unidad enzimática fue definida como la cantidad de enzima que causa un incremento en la absorbancia de 0,001/min a 37 ºC. Todas las medidas de actividad se hicieron mínimo por duplicado.
DETERMINACIÓN DE PROTEÍNA
El contenido de proteína fue determinado en todos los casos según el método de Bradford, modificado por Zor y Selinger (1996), usando albúmina de suero bovino (BSA) como patrón para las curvas de calibración con concentraciones entre 0 y 14 µg/mL. Todas las determinaciones se hicieron por duplicado.
PROCESO DE PURIFICACIÓN DE LA ENZIMA PFO
Para la purificación de la enzima PFO extraída de los tallos de clavel, se ensayaron inicialmente diversos procesos de cromatografía de filtración en gel sobre Sephadex G75 y Biogel P100. Estos ensayos no dieron buenos resultados, teniéndose tiempos de elución muy largos para el caso de Sephadex G75, debido a la compactación y disminución significativa del flujo, lo que ocasionaba frecuente inactivación de la enzima. En cuanto al Biogel P100, no se obtuvo separación efectiva de las proteínas de interés. Ensayos siguientes condujeron a obtener mejores resultados en el proceso de purificación, según se describe a continuación.
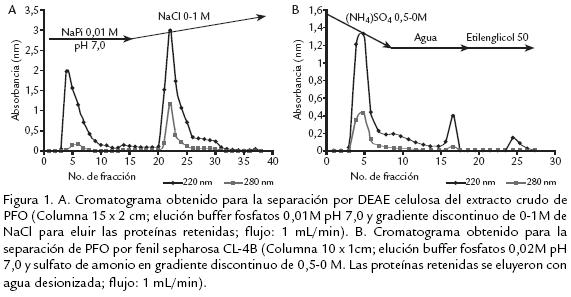
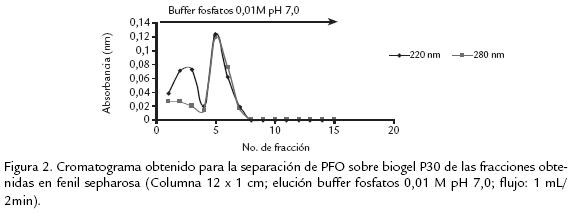
El extracto liofilizado fue resuspendido en buffer fosfatos 10 mM y cargado en una columna empacada con DEAE celulosa (15 x 2 cm) la cual fue previamente equilibrada con el mismo buffer. Las proteínas retenidas fueron eluídas con un gradiente de NaCl de 0 a 1 M en buffer fosfatos 0,01 M, con un flujo de 1 mL/min. Se recogieron fracciones de 1,5 mL, las cuales fueron leídas a 280 nm (Fig. 1A ). Las fracciones fueron reunidas en no retenidas (F1) y retenidas (F2). Se determinó luego la actividad PFO a éstas, así como también la cantidad de proteína. Una vez realizada la reunión de fracciones con actividad, se dializaron contra agua destilada durante toda la noche a 4 ºC, luego fueron congeladas a 20 ºC y liofilizadas. Las fracciones F2 que mostraron actividad PFO, fueron resuspendidas en sulfato de amonio 0,5 M en buffer fosfatos 10 mM pH 7,0 y colocadas en una columna empacada con fenil sepharosa CL4B (10 x 1 cm), la cual fue previamente equilibrada en el buffer inicial. Las proteínas fueron eluídas con un gradiente lineal de 0,5 a 0 mM de sulfato de amonio, seguido por agua desionizada y finalmente etilenglicol al 50%. El flujo fue 1 mL/min y todas las fracciones (1,5 mL) fueron leídas a 280 nm. Las que presentaron actividad PFO (F2,Fig. 1B ), fueron reunidas y se les determinó actividad enzimática y cantidad de proteína. Luego fueron dializadas durante toda la noche a 4 ºC contra agua, congeladas y liofilizadas. Continuando con el proceso de purificación, se resuspendió el liofilizado en buffer fosfatos 10 mM y se separó en una columna empacada con biogelP30 (12 x 1 cm), obteniendo una fracción no retenida (BF1) con actividad PFO, mientras que la fracción retenida no presentó actividad PFO. Todo el proceso de purificación fue realizado a 4 ºC y seguido a través de electroforesis SDSPAGE.
ELECTROFORESIS SDSPAGE
Las electroforesis fueron realizadas en geles de bisacrilamida y acrilamida tanto en condiciones denaturantes como nativas. Las muestras fueron denaturadas por calor y por adición de SDS al 10%. Las electroforesis se llevaron a cabo a 200 V en el gel de concentración (5%) y a 150 V en el gel de separación (12,5%). Los geles fueron teñidos con azul de Coomassie R. Los marcadores de peso molecular usados (SIGMAMARKER™) fueron: ∴lactoalbúmina de leche bovina (14,2 kDa), inhibidor de tripsina de soya (20 kDa), tripsinógeno de páncreas de bovino (24 kDa), anhidrasa carbónica (29 kDa), gliceraldehído3fosfatodeshidrogenasa (36 kDa), glutámico deshidrogenasa (55 kDa) y albúmina de suero bovino (66 kDa). Se usó también tinción con plata y tinción específica para PFO, implementada en este trabajo, usando 2,4dinitrofenilhidrazina en etanol para detectar las quinonas formadas.
CARACTERIZACIÓN BIOQUÍMICA
ESTIMACIÓN DEL PESO MOLECULAR
El peso molecular (PM) de la enzima purificada fue estimado interpolando en gráficas realizadas con las movilidades electroforéticas relativas de cada proteína patrón versus el log del PM.
EFECTO DEL PH Y DE LA TEMPERATURA
El efecto del pH en la actividad de la enzima PFO fue determinado bajo las condiciones del ensayo enzimático descritas, usando diversas soluciones buffer de concentración 0,1 M: acetato de sodio (pH 3,06,0), fosfatos de sodio (pH 6,08,0) y trisHCl (pH 8,510,0) a 37 ºC. El pH óptimo obtenido en este ensayo fue usado luego en el estudio de la temperatura óptima. Esta última fue determinada usando como sustrato catecol, en el intervalo entre 25 a 60 ºC, empleando las condiciones para la determinación de actividad ya descritas.
EVALUACIÓN DE LA ACTIVIDAD ENZIMÁTICA CON OTROS SUSTRATOS
Para evaluar la actividad de la enzima purificada se ensayaron como sustratos catecol (0,1 M) con lectura a 420 nm, ácido clorogénico (0,005 M) y Ldopa (0,005 M) con lecturas a 410 nm, manteniendo constantes las condiciones establecidas en cuanto al buffer fosfatos 0,1 M, pH 7,5 y 45 ºC. Se tomaron siempre medidas de actividad por duplicado.
CONCENTRACIÓN ÓPTIMA DE SUSTRATO
Se usaron diferentes concentraciones del sustrato (catecol), el cual había sido establecido previamente como el más adecuado. Las evaluadas fueron: 0,005, 0,01, 0,02, 0,025, 0,050, 0,075, 0,1, 0,15, 0,2 y 0,25 M. Se usó buffer fosfatos 0,1 M pH 7,5 a 45 ºC y la actividad fue medida usando las condiciones previamente establecidas. Cada ensayo enzimático se realizó por duplicado.
DETERMINACIÓN DEL PUNTO ISOELÉCTRICO
Para la determinación del punto isoeléctrico (PI), se realizaron experimentos de isoelectroenfoque en condiciones nativas, usando una corriente de 400 vatios por espacio de 4 h, luego de las cuales se realizó la neutralización de anfolitos con ácido tricloroacético al 10%. Los geles fueron teñidos con azul de Commassie R. El valor del PI se dedujo por interpolación usando los marcadores de anfolitos entre los intervalos de pH de 3 a 9.
ACTIVIDAD ANTIFÚNGICA in vitro
Una vez aislada y purificada la enzima PFO, se procedió a llevar a cabo la reacción con 50 µL de la enzima pura (0,21 ug) sobre 400 µL de sustrato que contenía 37,6 µg catecol, 5,6 µg de piruvato de sodio y 3 mL de buffer fosfatos 0,1 M pH 7,5. En un ensayo continuo espectrofotométrico, se siguió la formación de las respectivas quinonas, las cuales fueron después conservadas en oscuridad, para realizar el ensayo antifúngico in vitro (Broekaert et al., 1990), que consistió en enfrentar a estos productos un inóculo del hongo FOD2 (1 x 105 conidias/mL). Para ello, los productos obtenidos en la reacción se filtraron (0,22 µm, Pharmacia®), luego se tomó una placa de Elisa de 96 pozos, para sembrar 80 µL del inóculo y 20 µL de dichos productos. Como uno de los controles se usó los productos de reacción previamente expuestos por 10 min a 80 ºC así como pozos sin adición de éstos. La placa se incubó a 25 ºC. La lectura control se efectuó a los 30 min empleando un lector de microplacas BIORAD® modelo 680 a 595 nm. Este valor constituyó el factor de corrección para el análisis, tanto para los controles como para las muestras. A las 24 h se realizó una segunda lectura y a las 54 h una tercera y última lectura, en las mismas condiciones que las iniciales. A partir de los resultados obtenidos, se evaluó la actividad antifúngica de los productos de reacción de la enzima. El porcentaje de inhibición se definió así:
%Inhibición = 100 X (Abs595 nmControl —Abs595 nmEnsayo) / Abs595 nmControl
Los valores corregidos se tomaron como:
Abs595 nm = Abs24 horas — Abs30 min
Para el porcentaje de inhibición a las 54 h se realizó la misma operación que en la ecuación anterior, solamente cambiando por la lectura realizada a las 54 h.
TINCIÓN CON AZUL DE LACTOFENOL
Para evaluar algunos efectos de los productos de la enzima PFO sobre la morfología de las conidias, se realizó tinción de los microcultivos con una solución de azul de lactofenol 0,1%. Las muestras fueron colocadas en láminas portaobjetos, para ser observadas por un microscopio de luz transmitida a 1.250X.
RESULTADOS Y DISCUSIÓN
EXTRACCIÓN Y PURIFICACIÓN DE PFO
El resumen del proceso seguido para la purificación de la PFO extraída de clavel e inducida por inoculación, se muestra en la tabla 1. Como se observa, se logró una notable purificación de la enzima correspondiente a 314 veces con relación al extracto inicial.
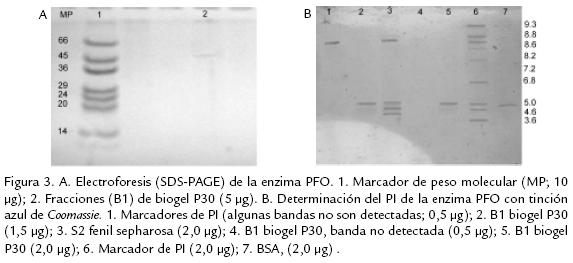
Varios métodos y soportes han sido empleados para la purificación de diversas PFO, como son filtración en gel sobre sephadex G75, para el caso de tabaco (Chuncua et al., 2001), níspero (Ding et al., 1998), piña (Das et al., 1997). Para el caso de la PFO extraída de tallos de clavel este soporte no fue exitoso, al igual que el uso de la precipitación con sulfato de amonio de 3070% de saturación, técnica muy común en los procesos de purificación reportados, pero que para el presente estudio resultó en una pérdida significativa de actividad debido a la notable labilidad de la enzima. Es así que, previendo la pérdida de actividad durante el proceso de purificación, se acondicionaron técnicas que permitieran una separación rápida y efectiva de la proteína, realizando además toda la experimentación a 4 ºC para mantener su actividad. Se usaron soportes como DEAE celulosa que permitió tiempos de elución cortos (Fig. 1A ) y un soporte de interacción hidrofóbica fenil sepharosa CL4B (Fig. 1B .) que, según se reporta para PFO de otras fuentes vegetales, permite la retención efectiva de esta enzima, como es el caso de piña (Das et al., 1997) y café (Mazzafera y Robinson, 2000). El seguimiento del proceso de purificación por electroforesis permitió determinar que era necesario realizar un paso adicional, por lo cual fue sometida la fracción de interés a cromatografía por biogel P30 ( Fig. 2). Después de éste, la proteína demostró estar pura dado que se obtuvo una única banda en diversas SDSPAGE (Fig. 3A).
PESO MOLECULAR
La fracción purificada migró en SDSPAGE como una banda con una masa molecular (PM) estimada en 40 kDa, (Fig. 3A). Este valor concuerda con lo reportado para café (Mazzafera y Robinson, 2000) y álamo (Wang y Constabel, 2003). Cabe destacar la diversidad en los PM de PFOs de fuentes vegetales; para citar algunos casos: álamo 45 kDa (Constabel et al., 2000), níspero 58 kDa (Ding et al., 1998), piña 104 kDa (Das et al., 1997), papa 69 kDa (Thygesen et al., 1994), Duranta plumieri 14 kDa (Roy et al., 2001), Hevea brasilensis 32 y 34 kDa (Wititsuwannakul et al., 2002), morera 65 kDa (Arslan et al., 2004). Según los reportes en la literatura, es muy probable que la enzima se localice en los tilacoides de los cloroplastos unida a la membrana y que su activación sea realizada por la acción de una proteasa sobre un zimógeno de 65 KDa que da como resultado una proteína activa de cerca de 40 kDa y otra de 14 kDa (Constabel et al., 2000). Este hecho se pudo evidenciar también en este estudio a través de diversas electroforesis realizadas, en las cuales mediante tinción con plata se evidenciaron estas 3 bandas (datos no mostrados).
PUNTO ISOELÉCTRICO
A través de diversos procesos de isoelectroenfoque se determinó que el punto isoeléctrico de la proteína purificada fue 5,0 (Fig. 3B). La naturaleza ácida de esta proteína se ha observado en PFOs aisladas de marula (PI 5,43; Mdluli, 2005) y de papa (PI 6,5; Marri et al., 2003), entre otras. La particularidad del PI fue evidenciada durante los procesos de purificación a través del soporte aniónico, en el que fue retenida permitiendo su purificación parcial.
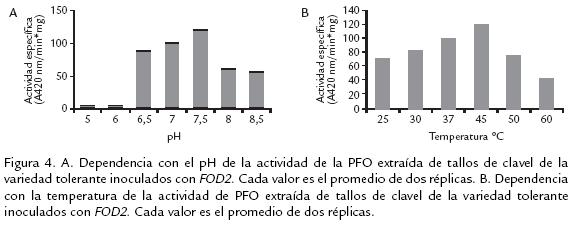
DETERMINACIÓN DEL PH ÓPTIMO
La enzima PFO proveniente de tallos de clavel de la variedad tolerante tuvo su máxima actividad a pH 7,5 (Fig. 4A) con un decremento significativo en pH 6 y 8,5. El valor de pH óptimo difiere ampliamente entre PFOs aisladas de diferentes fuentes vegetales. Proteínas con pHs ácidos han sido encontradas en níspero, pH 4,5 (Ding et al., 1998), piña y papa pH 6,0 (Das et al., 1997; Thygesen et al., 1994), marula pH 4,0 (Arslan et al., 2004), pH 7,0 y 7,5 para tabaco (Chuncua et al., 2001), café (Mazzafera y Robinson, 2000), álamo (Wang y Constabel, 2003), Hevea brasilensis (Wititsuwannakul et al., 2002), uva caimarona (Narváez y Restrepo, 2002) y pera (Smith y Montgomery, 1985). Las variaciones del pH óptimo entre PFO de diversas fuentes vegetales puede deberse, entre otras causas, a los diversos sustratos usados para la evaluación, así como a la localización de la enzima en la planta o en la misma célula. El intervalo de pH determinado permite evidenciar un desempeño similar de la enzima PFO en rutas metabólicas secundarias comunes en plantas como lo es el pardeamiento vegetal, proceso que es muy reportado con la participación de oxidasas (Narváez y Restrepo, 2002).
TEMPERATURA ÓPTIMA
La temperatura óptima determinada para la enzima PFO aislada de tallos de clavel de la variedad tolerante fue 45 ºC (Fig. 4B). La enzima tuvo su mayor actividad en un intervalo de temperatura entre 37 y 45 ºC declinando tal actividad a temperaturas superiores a 60ºC y menores de 37 ºC. Este intervalo de temperatura concuerda con reportes de PFO de níspero 35 ºC (Ding et al., 1998), Hevea brasilensis 45 ºC (Wititsuwannakul et al., 2002), morera 45 ºC (Arslan et al., 2004), ferula 30 ºC (Erat et al., 2005), menta 30 ºC (Kavrayan y Aydemir, 2001) y manzana 40 ºC, (Rocha y Morais, 2001), entre otros. La notoria disminución de actividad a temperaturas superiores a 50 °C confirman la labilidad de la enzima, al igual que por largos periodos de almacenamiento y manipulación, condiciones en las cuales la enzima pierde su actividad (Constabel et al., 2000; Mazzafera y Robinson, 2000).
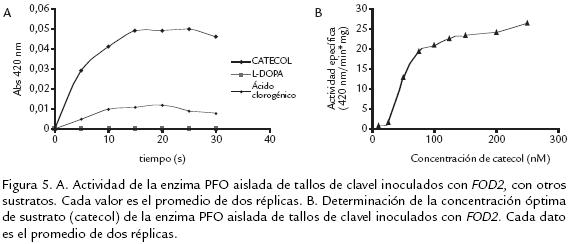
EVALUACIÓN DE LA ACTIVIDAD ENZIMÁTICA PFO CON OTROS SUSTRATOS
De acuerdo con la figura 5A, se obtuvieron los mayores valores de actividad cuando se usó catecol como sustrato, empleando las mejores condiciones de temperatura y pH previamente determinadas. El uso de estas mismas condiciones con los otros sustratos se fundamentó en consulta bibliográfica según la cual los valores de pH y temperatura para éstos son similares a los acá usados (Aydemir, 2004; Gómez, 2002). Con los sustratos Ldopa y ácido clorogénico no se presentó actividad PFO significativa. Esta aparente especificidad por sustratos dihidroxilados con la posición 1’ del anillo libre, da cuenta por una parte de la posible acción que puede estar realizando al ser inducida en ésta situación particular de interacción y, por otra, de su grado de aislamiento de otras oxidasas generalmente presentes en plantas. Es así, como en trabajos similares a éste (Chuncua et al., 2001; Mduli, 2005; Erat et al., 2005) el empleo de catecol dió también mejores resultados en cuanto a la actividad de la proteína. Esto comprueba que la enzima aislada de clavel corresponde a una PFO del tipo catecolasa, lo cual coincide con el origen vegetal de la misma y su afinidad por este tipo de sustrato (Mayer y Harel, 1979). Se obtuvo además la mayor actividad PFO a una concentración 0,1M, tal como se muestra en la figura 5B.
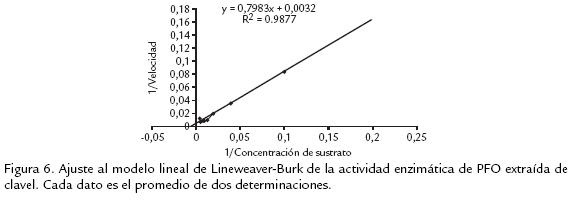
ESTUDIO DE LA CINÉTICA ENZIMÁTICA DE LA POLIFENOLOXIDASA AISLADA DE TALLOS DE CLAVEL INOCULADOS CON FOD2
A partir de la variación en la actividad de la PFO ya purificada, en función de la concentración de sustrato, se obtuvo un comportamiento similar al que plantea el modelo de MichaelisMenten. Al realizar el ajuste al modelo lineal, según el tratamiento de LineweaverBurk (figura 6, se estimó la Km con un valor de 249 mM y la Vmáx de 322 Umin1 mg1. Al compararla con PFOs reportadas para otras fuentes vegetales se tienen valores de Vmáx que varían desde baja transformación del sustrato, como en el caso de manzana Jonagored (1100 U/min) y Km de 230 mM (Rocha y Morais, 2001), hasta un alto recambio en Duranta plumieri (73,5 U/mL) y Km de 7,1 mM (Roy et al., 2001). La variación se puede deber a la diversidad de sustratos fenólicos naturales que estas enzimas encuentran en las plantas y a la afinidad que presenten con dicho sustrato. Es por esto que las medidas expresadas en cuanto a la cinética evaluada no indican necesariamente la actividad real que pueda estar presentando con su sustrato natural.
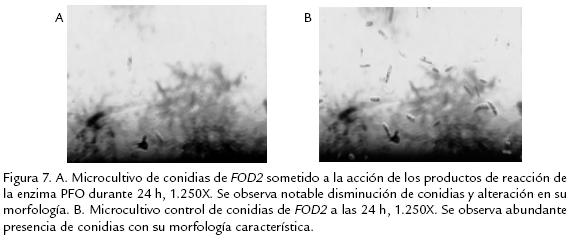
ENSAYO ANTIFÚNGICO
Los resultados obtenidos (Figs. 7A y 7B) permitieron establecer que se produce cerca del 57% de inhibición del patógeno al cabo de 24 h de estar sometido a la acción de los productos de reacción de la enzima (quinonas) y 22% cuando se realizaron las medidas al cabo de 54 h. Se destaca con este ensayo la posible capacidad de los productos de reacción de la enzima PFO sobre el sustrato catecol, de formar parte en la defensa vegetal, postulando así a las quinonas como fuertes inhibidores microbianos de crecimiento de patógenos, adicional a su papel en la formación de precursores fenólicos que conllevan a la formación de compuestos que terminan siendo parte de la ruta de lignificación de la planta o en síntesis de gomas, con el propósito de ocluir el patógeno, tal como se ha postulado en diversos trabajos (Valentones et al., 2005; Bolaños y Mercado, 2004).
CONCLUSIONES
El presente estudio describe la purificación y caracterización parcial, no reportada antes, de la enzima polifenoloxidasa obtenida de tallos de clavel (Dianthus caryophyllus L.) de una variedad tolerante, después de la infección con el hongo FOD2, agente causal del marchitamiento vascular, enfermedad que ocasiona pérdidas significativas para la economía de los productores de clavel en Colombia y en el mundo. El procedimiento llevado a cabo permitió la obtención de una proteína purificada de 40 KDa que presentó actividad PFO. El pH y la temperatura óptimos se determinaron en 7,5 y 45 ºC y presentó un PI de 5. Usando como sustrato catecol, los parámetros cinéticos de la enzima purificada fueron estimados como Km 249 mM y Vmáx 322 Αabs min1*mg1 a las condiciones de pH y temperatura de máxima actividad. La evaluación in vitro de la acción frente a FOD2 de los productos formados durante la reacción de la enzima aislada, sobre el sustrato catecol, permitió determinar que se produce 57% de inhibición del patógeno a las 24 h, inhibición que se mantiene en 22% a las 54 h. Ello permite apoyar lo postulado previamente respecto a la posible participación de esta enzima en los mecanismos de defensa del clavel. La inestabilidad de la enzima, con pérdida total de actividad en diversas ocasiones, fue observada durante todo el trabajo, lo cual hace complicado el proceso de purificación y permite deducir que la PFO proveniente de tallos de clavel parece ser más lábil que otras PFOs obtenidas de fuentes vegetales diferentes.
AGRADECIMIENTOS
Los autores agradecen el apoyo financiero así como de infraestructura otorgado por COLCIENCIAS (Proyecto código 11010511440), el Departamento de Química de la Universidad Nacional de Colombia y la empresa América Flor S.A. por el suministro de los esquejes.
BIBLIOGRAFÍA
ARSLAN O, ERZENGIN M, SINAN S, OZENSOY O. Purification of Mulberry (Morus alba L.) Polyphenol Oxidase by Affinity Chromatography and Investigation of its Kinetic and Electrophoretic Properties. Food Chem. 2004;88:479-484.
[ Links ]ARDILA H, HIGUERA B. Inducción diferencial de polifenoloxidasa y 1,3glucanasa en clavel (Dianthus caryophyllus L) durante la infección por Fusarium oxysporum f. sp. dianthi raza 2. Act biol Colomb. 2005;10:65-78.
[ Links ]AYDEMIR T. Partial Purification and Characterization of Polyphenol Oxidase from Artichoke (Cynara scolymus L.) Heads. Food Chem. 2004;87:59-67
[ Links ]BOLAÑOS E, MERCADO E. Effects of Polyphenol Oxidase and Peroxidase Activity, Phenolics and Lignin Content on the Browning of Cut Jicama. Postharvest Biol Technol. 2004;33:275-283.
[ Links ]BROEKAERT W, TERRAS F, CAMMUE B, VANDERLEYDEN J. An Automated Quantitative Assay for Fungal Growth Inhibition. FEMS Microbiol Lett. 1990;69:55-56.
[ Links ]CHUNCUA S, YA D, BINGLE X, XIAOLONG X, YONGSHU X, QINGLIANG L. The Purification and Spectral Properties of Polyphenol Oxidase from Nicotiana tabacum. Plant Mol Biol Rep. 2001;19:381-381.
[ Links ]CONSTABEL P, LYNN Y, PATTON J, CHRISTOPHER M. Polyphenol Oxidase from Hybrid Poplar Cloning Expression in Response to Wounding and Herbivory. Plant Physiol. 2000;124:285-295.
[ Links ]DAS J, BHAT S, GOWDA L. Purification and Characterization of Polyphenoloxidase from the New Cultivar of Indian Pineapple Fruit. J Agric Food Chem. 1997;45:2031-2035.
[ Links ]DING C, CHACHING K, UEDA Y. Purification and Properties of Polyphenoloxidase from Loquat Fruit. J Agric Food Chem. 1998;46:4144-4149.
[ Links ]ERAT M, SAKIROGLU H, KUFREVIOGLU I. Purification and Characterization of Polyphenol Oxidase from Ferula sp. Food Chem. 2005;95:503-508.
[ Links ]GELDER C, FLURKEY W, WICHERS H. Sequence and Structural Features of Plant and Fungal Tyrosinases. Phytochemistry. 1997;45:1309-1323.
[ Links ]GÓMEZ V. Some Biochemical Properties of Polyphenol Oxidase from Two Varieties of Avocado. Food Chem. 2002;77:163-169.
[ Links ]HIGUERA BL. Contribución al estudio de la participación de los compuestos fenólicos en los mecanismos de la interacción clavel Dianthus caryophyllus LFusarium oxysporum f, sp, dianthi, raza 2 [Tesis de Doctorado en Ciencias Químicas]. Bogotá: Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia; 2001.
[ Links ]KAVRAYAN D, AYDEMIR T. Partial Purification and Characterization of Polyphenoloxidase from Peppermint (Mentha piperita.) Food Chem. 2001;74:147-154.
[ Links ]MARRI C, FRAZZOLI A, HOCHKOEPPLER A, POGGI V. Purification of a Polyphenol Oxidase Isoform from Potato (Solanum tuberosum) tubers. Phytochemistry. 2003;63:745-752.
[ Links ]MAYER A, HAREL E. Polyphenol Oxidases in Plants. Phytochemistry. 1979;18:193-215.
[ Links ]MAZZAFERA P, ROBINSON S. Characterization of Polyphenol Oxidase in Coffee. Phytochemistry. 2000;55:285-296.
[ Links ]MDLULI K. Partial Purification and Characterization of Polyphenol Oxidase and Peroxidase from Marula Fruit (Sclerocarya birrea subsp. Cafrra). Food Chem. 2005;92:311-323.
[ Links ]NARVÁEZ C, RESTREPO P. Efecto del almacenamiento de uva caimarona (Pouroma cecropiifolia) a diferentes temperaturas sobre la actividad de la polifenoloxidasa y peroxidasa. Rev Col Química. 2002;31(2):131-144.
[ Links ]ROCHA A, MORAIS A. PPO Extracted from 'Jonagored' Apple. Food Control. 2001;12:85-90.
[ Links ]ROY I, SHARMA S, NATH M. Separation of an Isoenzyme of Polyphenol Oxidase from Duranta plumieri by Expanded bed Chromatography. Protein Expr Purif. 2001;24:181-187.
[ Links ]SMITH D, MONTGOMERY M. Improved Methods for the Extraction of Polyphenol Oxidase from D'anjou Pears. Phytochemistry. 1985;24(5):901-904.
[ Links ]THYGESEN P, DRY I, ROBINSON S. Polyphenol Oxidase in Potato. Plant Physiol. 1994;109:525-531.
[ Links ]VALENTONES M, VILAPLANA R, TORRES R, USALL J, LARRIGAUDIÉRE C. Specific Roles of Enzymatic Browning and Lignification in Apple Disease Resistance. Postharvest Biol Technol. 2005;36:227-234.
[ Links ]WANG J, CONSTABEL P. Biochemical Characterization of Two Differentially Expressed Polyphenol Oxidases from Hybrid Poplar. Phytochemistry. 2003;64:115-121.
[ Links ]WITITSUWANNAKUL D, CHAREONTHIPHAKORN N, PACE M, WITITSUWANNAKUL R. Polyphenol Oxidases from Latex of Hevea brasiliensis: Purification and Characterization. Phytochemistry. 2002;61:115-121.
[ Links ]ZOR T, SELINGER Z. Linearization of the Bradford Protein Assay Increases its Sensitivity: Theoretical and Experimental Studies. Anal Biochem. 1996;236:302.
[ Links ]