Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.12 suppl.1 Bogotá Dec. 2007
VARIACIÓN CARIOLÓGICA EN DIFERENTES FENOTIPOS DE Sciurus granatensis (RODENTIA, SCIURIDAE)
Karyologic Variation in Different Phenotypes of Sciurus granatensis (Rodentia, Sciuridae)
ARANGO CAROLINA1, Biólogo; BUENO MARTHA LUCÍA2, MS.c; CHACÓN MARCOS NICOLÁS3, Biólogo.
1. Instituto de Genética, Universidad Nacional de Colombia, Sede Bogotá, Calle 53 con Carrera 37, edificio 426.carangor@unal.edu.co
2Departamento de Biología, Universidad Nacional de Colombia, Sede Bogotá, Grupo de Citogenética. Instituto de Genética, Universidad Nacional de Colombia, Sede Bogotá. mlbuenoa@unal.edu.co
3Departamento de Biología, Universidad Nacional de Colombia, Sede Bogotá.
Presentado el 26 de abril de 2007, aceptado el 7 de junio de 2007, correcciones 4 de septiembre de 2007.
RESUMEN
Siete ejemplares de Sciurus granatensis (ardilla colombiana) de diferentes fenotipos según color, rescatadas del tráfico ilegal de fauna silvestre de Colombia fueron estudiadas. Mediante técnicas convencionales de bandeo cromosómico G, C, Q, R y NOR se estableció su cariotipo 2n=42. Se encontraron tres cariomorfos de acuerdo al Número Fundamental (NF) y características propias de cada uno de los complementos ocasionadas por distintos rearreglos cromosómicos, lo cual sugiere que S. granatensis es un complejo de especies. No se observó relación entre cariotipo y fenotipo. La variación en el color del pelaje se debe probablemente a las condiciones ambientales.
Palabras clave: S. granatensis, ardillas, cariología, Colombia, tráfico ilegal.
ABSTRACT
Seven specimens of Sciurus granatensis (redtailed squirrel) rescued from illegal fauna traffic in Colombia were studied; they had different phenotypes according to colour. G, C, Q, R and NOR chromosome banding was used, being found a 2n=42 diploid number for the Sciurus granatensis Colombian squirrels. There were 3 karyomorphs according to fundamental number (FN) and different chromosomal characteristics caused by rearregement, suggesting that S. granatensis represents a complex of species. Relationships between karyotype and phenotype were not observed. The variation in the colour of sqirrels' fur was probably due to environmental conditions.
Key word: Sciurus, karyotype, redtailed squirrel, Colombia, illegal traffic.
INTRODUCCIÓN
S. granatensis (Humboldt, 1811) es una especie común en Centro América y norte de Sur América. Se distribuye desde Costa Rica hasta Ecuador, pasando por Venezuela y Colombia (Wilson y Reeder, 2005). Presenta una gran variación fenotípica según la coloración de su pelaje, por lo cual Emmons (1990), ha propuesto tres fenotipos: el fenotipo 1, localizado en el norte de Colombia el cual se caracteriza por tener el dorso y cola naranjarojizo brillante y vientre blanco; el fenotipo 2, presente en el oriente de país que tiene el dorso y cola caféoliváceo y vientre rojizo oscuro a naranja; el fenotipo 3, de la costa occidental de Ecuador y Colombia, con ejemplares de dorso negro oliváceo, extremidades y pies rojos a naranja y cola con punta negra.
La mayoría de los estudios cariológicos en ardillas se han centrado en las especies de Europa, Asia, África y Norteamérica (Liapunova y Vorontsov, 1970; Nadler et al., 1970; Li et al., 2004; Li et al., 2006). Los estudios en ardillas suramericanas son escasos y se limitan a las ardillas brasileñas S. alphonsei de la mata Atlántica y la ardilla de bosque amazónico S. spadiceus (Lima y Langguth, 2002). Todas las especies del género Sciurus reportadas presentan un cariotipo de 2n=40 a excepción de S. granatensis, 2n=42 (Nadler y Hoffmann, 1970). El Número Fundamental (NF) según Matthey (1945), se establece por el conteo de los brazos cromosómicos en el cariotipo (cromosomas metacéntricos los cuales cuentan por dos y los acrocéntricos por uno). Fusiones céntricas e inversiones pericéntricas, pueden modificar el NF. En el primer caso existe reducción en el número de cromosomas, mientras que en el segundo se modifica el NF sin alterar el conteo cromosómico. La fusión céntrica es uno de los mecanismos comúnmente encontrado en la evolución cromosómica en roedores (Elder, 1980; King, 1987). Cuando dos especies relacionadas tienen el mismo número de brazos cromosómicos (NF) pero difieren en su número cromosómico (2n), las diferencias pueden ser originadas por la fusión de dos cromosomas acrocéntricos y/o la fisión de un cromosoma metacéntrico (Nadler, 1969).
Debido a la poca información ecológica, taxonómica y genética sobre las ardillas colombianas, existen problemas sistemáticos aun no resueltos (Emmons, 1990) desde la revisión de Allen (1914), lo cual dificulta la reubicación y/o liberación de ejemplares sin procedencia conocida, provenientes del tráfico ilegal de fauna silvestre. Para el correcto estudio y seguimiento de ejemplares decomisados a partir de tráfico ilegal, es necesario hacer uso de herramientas apropiadas, tales como la caracterización citogenética y estudios moleculares, lo cual permite la identificación y soporte citotaxonómico para poder establecer los lugares correctos de liberación, evitando así hibridizaciones por la introducción inadecuada de especies o subespecies que puedan tener efectos nocivos sobre el genotipo de la fauna residente, ocasionando rearreglos cromosómicos que pueden dar origen a individuos infértiles tal como ha sido documentado en la introducción de S carolinensis, especie de Norteamérica, a Europa mediante marcadores de microsatélites. (Hale y Lurz, 2003; Hale et al., 2004).
Los estudios cariológicos son útiles para detectar variaciones intra e inter específicas, por lo cual este trabajo tiene como objetivo principal enriquecer el conocimiento acerca de la ardilla colombiana S. granatensis, ejemplar que hasta la fecha ha sido objeto del tráfico ilegal de fauna silvestre.
METODOLOGÍA
Se estudiaron dos machos y cinco hembras de S. granatensis provenientes del tráfico ilegal, depositados en la Unidad de Rescate y Rehabilitación de Animales Salvajes, URRAS, de la Universidad Nacional de Colombia, Sede Bogotá. Para la obtención de cromosomas metafásicos, 0,7 ml de sangre total fueron sembrados en 4 ml de medio RPMI 1640, enriquecido con 1 ml suero fetal bovino, 100 µl de penicilinaestreptomicina y 150 µl de mitógeno. Los cultivos permanecieron a 37 °C por 72 horas. Para la cosecha, se utilizaron 100 µl de colchicina (25 g/l), solución hipotónica de KCl 0,075M y fijador de ácido acético glacial 96% y metanol (6:1).
Se realizaron técnicas modificadas para bandeamientos QFQ, (Caspersson et al., 1968); RBG, (Verma, 1984); GTG, (Seabrigth, 1971); CBG, (Arrighi y Hsu, 1971) y Ag NOR, (Goodpasture y Bloom, 1975). Adicionalmente, se realizaron Bandas G con colorante Wright, según protocolos expuestos por (Sole y Woessner, 1992). La modificación de las técnicas de bandeamiento dependieron de las características propias del material biológico analizado y de las condiciones ambientales y de suministros del laboratorio en donde se llevó a cabo la investigación, sin abandonar en ningún caso, las bases originalmente expuestas por los autores mencionados. Las metafases obtenidas fueron observadas al microscopio y organizadas según morfología, en el programa Lucia Karyotyping ®. Para la comparación y establecimiento de homeologías se empleó como base el cariotipo de S. carolinensis (Stanyon et al., 2003; Li et al., 2004).
RESULTADOS
Todos los individuos S. granatensis estudiados, que incluyeron los tres fenotipos reportados en Emmons (1990), presentaron un cariotipo de 2n=42. De cada individuo se analizaron al menos diez metafases con bandas G, R, C, Q y solo de un ejemplar se obtuvieron bandas NOR informativas. Los cromosomas se clasificaron en tres grupos según morfología: Grupo A (pares 16) de cromosomas grandes metacéntricos o submetacéntricos; Grupo B (pares 716) de cromosomas medianos, metacéntricos, submetacéntricos o acrocéntricos y Grupo C (pares 1720) de cromosomas pequeños, metacéntricos, submetacéntricos y acrocéntricos (fig 1). El cromosoma sexual X y el cromosoma Y, son submetacéntrico grande y acrocéntrico mediano, respectivamente. Se detectaron algunas diferencias entre los cariotipos que nos permitieron establecer que en la muestra estudiada existían 3 cariomorfos a partir de diferencias en el NF que fue de 76 en el cariomorfo A (Fig. 2A) y de 78 en los cariomorfos B y C (Fig. 2B y 2C).
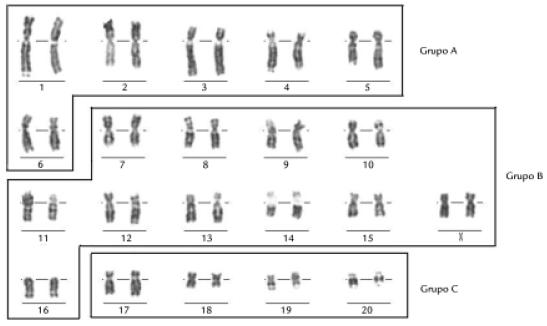
Figura 1. Presentación de los grupos cromosómicos definidos para el cariotipo del cariomorfo A de S granatensis con bandas G.
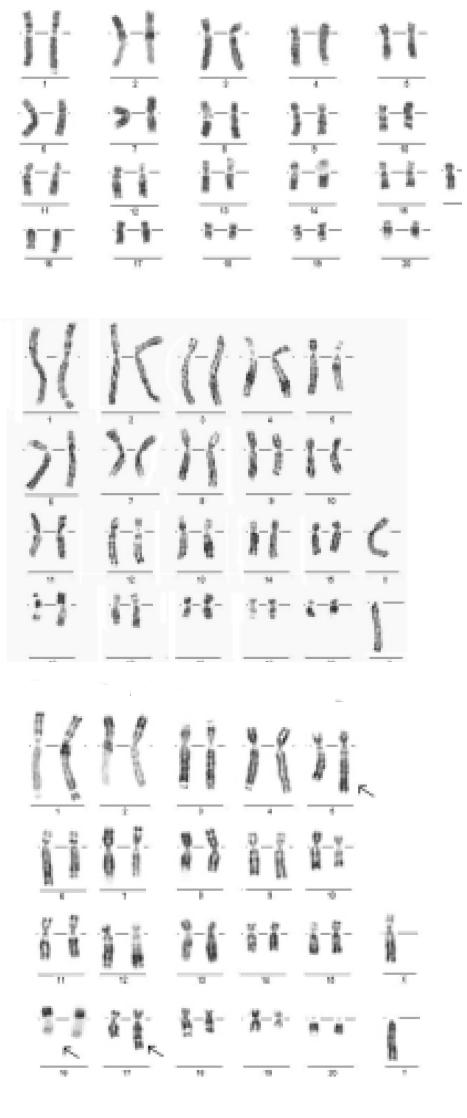
Figura 2. A. Cariotipo de hembra del carioformo A de S granatensis con bandas G. B. Cariotipo de macho de carioformo B de S granatensis con bandas G. C. Cariotipo de macho de carioformo B de S granatensis con bandas G; las flechas indican la translocación t (5; 17) y la presencia de un cromosoma 16 metacéntrico con igual patrón de bandeo al observado en el carioformo B, hechos presentes en el 100% de las metafases analizadas
Estas diferencias se relacionan con la morfología del par 16, siendo acrocéntrico en el cariomorfo A (tres de siete ejemplares) y metacéntrico en los cariomorfos B y C. Adicionalmente, en un ejemplar se encontró un rearreglo cromosómico en el 100% de las metafases analizadas. Este reordenamiento se caracterizó por presentar un par cromosómico heterocigoto, originado por una translocación reciproca t(5;17), lo cual caracterizó al cariomorfo C (Fig. 2C). Con la técnica de bandas R con adición de bromodeoxiuridina (BrdU) en la fase terminal del ciclo celular, se evidenciaron grandes bloques de replicación tardía en los autosomas del grupo A de los tres cariomorfos. En las hembras se esperaba encontrar un patrón de replicación tardía para uno de los cromosomas X, pero en la totalidad de las metafases analizadas de las hembras los X fueron isomórficos (Fig. 3A), con patrón muy similar al X humano de los cromosomas X de los machos (Fig. 3B). El patrón de bandas C fue estrictamente centromérico y no se detectaron polimorfismos heterocromáticos en este grupo de ejemplares de S. granatensis (Fig. 3C). Las regiones organizadoras nucleorales (NOR) se localizaron en tres pares de autosomas, dos del grupo A y uno del grupo C. En el grupo A los pares involucrados son el par 3, en el brazo largo región proximal al centrómero, y el par 4, en la región terminal del brazo largo. En el grupo C el par involucrado se caracteriza por ser acrocéntrico, siendo posiblemente el par 19. En este último caso, la ubicación de los NOR se observa en la parte distal de los brazos largos. (Fig. 3D). No se encontró una relación clara entre fenotipos y cariomorfos. Ejemplares que exhiben patrones de coloración distintos presentaron cariotipos similares. Dado que no se conoce la procedencia de estos ejemplares, por ser producto de decomiso, no es posible correlacionar biogeográficamente las variaciones cariológicas encontradas.

DISCUSIÓN
El cariotipo encontrado en este trabajo para los ejemplares de S. granatensis, 2n=42, corresponde, al descrito por Nadler y Hoffmann (1970), para otros ejemplares de la misma especie. El número diploide reportado para otros individuos del género Sciurus, en particular para S. carolinensis es de 2n=40 (Stanyon et al., 2003). Aunque en el presente estudio no se realizaron pruebas adicionales en individuos de S. carolinensis, investigaciones anteriores nos permiten suponer que la reducción en el 2n entre S. granatensis y S. carolinensis se deba a una posible fusión céntrica de dos de los pares cromosómicos de S. granatensis o una fisión de uno de los pares submetacéntricos o metacéntricos de S. carolinensis, condiciones que pueden originar el par acrocéntrico adicional en la especie colombiana. Sin embargo, ninguna de las dos hipótesis pudieron ser analizadas a fondo en este estudio, debido a que no se obtuvieron muestras de S. carolinensis, al reducido número de ejemplares de S. granatensis, a las variaciones cromosómicas encontradas en los individuos evaluados de la misma y a la baja resolución en el patrón de bandas, en especial en los cromosomas del grupo C. Dado que ya se han desarrollado sondas para todos los cromosomas de S. carolinensis, (Stanyon et al., 2003), las técnicas de hibridización in situ (FISH) serían las más indicadas para esclarecer estos rearreglos.
Los estudios realizados en S. carolinensis han sido extensos, comprendiendo desde citogenética clásica hasta estudios exhaustivos de genómica comparativa (ZooFISH) con hibridización in situ (Stanyon et al., 2003). Li et al. en el 2004 realizaron estudios de comparación genómica con sondas específicas de cromosomas humanos arrojando importantes conclusiones a tener en cuenta en posteriores estudios en ardillas, como por ejemplo la alta homología de los autosomas humanos (cromosomas 1 22) sobre los cromosomas de S. carolinensis (mostrando 38 regiones homólogas), y la alta homología del cromosoma X entre las especies. Otro hecho de importancia resaltado por los autores fue la fabricación de sondas específicas para el genoma de S. carolinensis, estableciendo homologías entre la especie y otras de diferente género, corroborando así que las homologías encontradas por genómica comparada eran congruentes con la conservación del patrón de bandas G entre especies. Los anteriores resultados permiten establecer la existencia de un alto nivel de conservación en la organización del genoma de las ardillas. Basados en lo anterior, se decidieron establecer homologías entre S. carolinensis y S. granatensis, mediante el patrón de bandas G reportado por Stanyon en el 2003 y Li en el 2004. Seis de los pares cromosómicos (5, 8, 13, 16, 17 y 18) de los cariomorfos A y B se diferenciaban en morfología y patrón de bandas entre las dos especies, mientras que con el cariomorfo C, no se encontró homología para seis de los pares cromosómicos (3, 4, 5, 13, 14, 16, X), lo cual sugiere un nivel alto de rearreglos entre estas dos especies de ardillas arbóreas, S. carolinensis y S. granatensis. Dentro de los mismos cariomorfos, especialmente hembras, se presentaron dificultades en la identificación de los cromosomas X, ya que el patrón de bandas G no resultó suficientemente informativo en muchos de los casos analizados. Para confirmar el patrón de bandas de los cromosomas X, se realizó la técnica de bandeo R con adición terminal de BrdU, esperando encontrar un cromosoma X de replicación tardía y su homólogo de replicación temprana. Sin embargo, ninguno de los ejemplares arrojó lo esperado ya que en todas las metafases analizadas con la técnica de bandas R se encontraron amplios patrones de replicación tardía en todos los brazos largos de los cromosomas del Grupo A y B, impidiendo una inequívoca identificación del cromosoma X. Solo uno de los ejemplares macho analizado mostró un patrón similar al presente en los cromosomas X humanos (Fig. 3B). Partiendo de la existencia de homología entre los cromosomas X de los mamíferos (Ohno, 1969), confirmada mediante hibridización in situ con sondas humanas y de S. carolinensis es importante la realización de estudios de FISH sobre el genoma de las ardillas colombianas, que permitirán esclarecer las dudas acerca de la morfología y patrón de bandeo de los cromosomas sexuales y confirmar la homología o no homología con S. carolinensis en los autosomas, propuestas con base en los patrones de bandas. En S. granatensis, la tinción para Bandas C no evidenció regiones de heterocromatina constitutiva diferentes a las presentes en la zona pericentromérica (Fig. 3C). Únicamente el cromosoma 6 del cariomorfo A posee una banda más conspicua, que puede ser vista como una banda intersticial en brazos largos muy proximal al centrómero. No se encontraron bandas Cpositivas en regiones intersticiales o teloméricas en ninguno de los cariomorfos, que han sido observadas en S. vulgaris y S. vulgaris coreae (Petit et al., 1984; revisado por Lima y Langguth, 2002). Es importante tener en cuenta que dentro de los genomas de algunas ardillas pueden presentarse regiones de heterocromatina Cnegativa, que no hibridizan con ninguna de las sondas para genoma humano, pero que pueden tener homeología para sondas de S. carolinensis específicas para el cromosoma Y y algunos autosomas, lo cual supondría la existencia de regiones con ADN repetitivo diferente al encontrado en la región centromérica (Li et al., 2004).
Uno de los métodos más usados en citogenética animal es la tinción de las regiones organizadoras de los nucleolos mediante nitrato de plata (AgNO3), la cual tiñe regiones con alto contenido de RNA ribosomal (Verma y Babu, 1995). Esta técnica se ha utilizado para detectar marcadores específicos y así realizar estudios comparativos de la actividad de los NOR entre especies (Cross et al., 2002). Los puntos de tinción encontrados en una célula analizada son el reflejo de los NOR activos que participaron en la formación del nucleolo en la interfase anterior dentro de la célula en cuestión (Verma y Babu, 1995), de modo que es posible encontrar diferencias en el número de pares activos (NOR positivos) entre células de un mismo individuo, conservando NOR positivos en los pares cromosómicos dominantes. Más aún tales diferencias pueden incrementarse al estudiar varias especies. En el presente estudio, solo se obtuvieron NOR para uno de los ejemplares del cariomorfo A. Lamentablemente, la baja cantidad de metafases analizables para esta técnica dentro de este individuo no permitió obtener el número concreto de pares dominantes que tiñen con NOR, de allí que únicamente se logre ubicar NOR en tres pares cromosómicos: dos del grupo A (par 3 y 4) con bandas intersticiales en brazos largos (uno subterminal y otro pericentromérico); y un acrocéntrico pequeño del grupo C (par 19) con banda NOR terminal en el brazo largo. Sin embargo, las regiones NOR fueron frecuentemente visualizadas como constricciones secundarias o discontinuidades en la coloración, en otras técnicas de bandeo y con coloración homogénea con Giemsa. El número y la ubicación de estas regiones difiere de la reportada para Sciurus altuensis ingrami (Fagundes et al., 2003), ya que en esta especie, se observan NOR en cuatro pares de cromosomas: intersticialmente en los brazos largos de tres autosomas grandes y en uno de los cromosomas pequeños en donde no es posible determinar la ubicación de los NOR. La falta de un cariotipo en banda G para Sciurus altuensis ingrami dificulta la comparación de cromosomas con S. granatensis. Sin embargo, se puede observar que los cromosomas portadores de los NOR en ambas especies parecen ser los mismos, aunque la existencia de diferencias en la ubicación en cada cromosoma puede sugerir la ocurrencia de rearreglos como inversiones, lo que modificaría la ubicación de los NOR. No se lograron obtener bandas NOR en los cariomorfos B y C.
Dentro de los ejemplares estudiados, se encontraron individuos con diferentes características fenotípicas, especialmente en el color del pelaje. Ridgway y Allen (1875) observó que en las ardillas arbóreas el color de la piel parece estar determinado más por los factores ambientales a los que están sometidas las poblaciones, como temperatura, altitud y abundancia de vegetación que por variaciones genéticas asociadas al cariotipo. Wauters et al. (2004) confirmaron que en zonas húmedas, de baja altitud y con altas temperaturas aumenta la intensidad del color y las tonalidades rojas de las ardillas, mientras que en los ambientes opuestos la tendencia es encontrar tonalidades pálidas o grises. Dentro de los ejemplares analizados en el presente trabajo se observaron diferencias fenotípicas en cuanto al color de piel. Sin embargo, y aunque se esperaba encontrar variaciones genotípicas que pudieran ser correlacionadas con el fenotipo, tal hipótesis no fue válida ya que ejemplares de diferente morfotipo (disímiles en cuanto al color de piel) constituyeron un mismo cariomorfo lo cual permite sugerir que no existe una relación entre fenotipocariotipo, y que así como anteriores estudios lo han afirmado (Ridgway y Allen, 1875; Wauters et al., 2004), las variaciones fenotípicas de color de piel son consecuencia de las condiciones ambientales del lugar de procedencia del ejemplar en cuestión.
En estudios taxonómicos, es necesario tener en cuenta el mayor número de caracteres diagnósticos indispensables para la identificación de las especies entre los cuales tienen especial valor los patrones morfométricos del cráneo y dentadura, la distribución geográfica de los morfotipos y de las variantes citológicas, que constituyen una variable de peso para la diagnosis. Los resultados obtenidos en este trabajo, sugieren que en S. granatensis puede presentarse una diferenciación genética más que fenotípica, debido a los rearreglos cromosómicos encontrados dentro de los individuos analizados y a la presencia de más de un cariomorfo en la muestra estudiada. Se propone también la existencia de por lo menos dos poblaciones diferenciadas cariológicamente y una tercera explicada por la presencia del cariomorfo C como posible hibrido homocigoto para la translocación t(5;17). La presencia del cariomorfo C, puede ser el resultado de la hibridización en cautividad de individuos del cariomorfo B con ejemplares de otro cariotipo no detectado en este estudio que fueran homocigotos para la translocación t(5;17). Es posible que esté ocurriendo un proceso de deriva genética que lleve a la separación de las poblaciones portadoras de cada cariomorfo. De allí que se proponga a S. granatensis como un complejo de especies, que requiere un mayor número de estudios tanto de taxonomía clásica morfológica, y de distribución, como de citotaxonomía en poblaciones naturales con localidades conocidas, para lograr esclarecer la verdadera identidad específica en este grupo.
AGRADECIMIENTOS
Este trabajo fue realizado en las instalaciones del Instituto de Genética en la Universidad Nacional de Colombia, en los laboratorios del Grupo de Investigación de Citogenética, dirigido por la profesora Marta Lucía Bueno. Agradecemos a los médicos veterinarios Claudia Brieva, Néstor Varela y Carlos del Valle de la Unidad de Rescate y Rehabilitación de Animales Salvajes, URRAS por la toma de muestras de sangre de los especimenes de estudio.
BIBLIOGRAFÍA
ALLEN JA. Review of the South American Sciuridae. Bull Am Mus Nat Hist 1914;XXXIV:147-309. [ Links ]
ARRIGHI FE, HSU TC. Localization of Heterochromatin in Human Chromosomes. Cytogenetics. 1971;10:81-86. [ Links ]
CASPERSSON T, ZECH L, JOHANSSON C. Chemical Differentiation Along Metaphase Chromosomes. Exp Cell. Res 1968; 49: 219-222. [ Links ]
CROSS I, VEGA YL, REBORDINOS L. Análisis caritípico y variabilidad de los AgNOR en Crassostrea angulata (Lamarck, 1819). Bol Inst Esp Oceanogr. 2002;18(14):221-227. [ Links ]
ELDER FFB. Tandem Fusion, Centric Fusion, and Chromosomal Evolution in the Cotton Rats, Genus Sigmodon. Cytogenet Cell Genet. 1980;26:199-210. [ Links ]
EMMONS LH. Neotropical Rainforest Mammals: A Field Guide. Univ. Chicago Press. 1990. [ Links ]
FAGUNDES V, CHRISTOFF A, AMARO RC, SCHEIBLER D, YONENAGA Y. Multiple Intersticial Ribosomal Sites (NOR) in the Brazilian Squirrel Sciurus aestuans ingrami (Rodentia: Sciuridae) with 2n=40. An Overview of Sciurus cytogenetics. Genet Mol Biol. 2003;26(3):253-257. [ Links ]
GOODPASTURE C, BLOOM SE. Visualization of Nucleolar Organizer Regions. III. Mammalian Chromosomes Using Silver Staining. Chromosomes. 1975;53:37-50. [ Links ]
HALE ML, LURZ PWW, WOLFF K. Patterns of Genetic Diversity in the Red Squirrel (Sciurus vulgaris L.): Footprints of Biogeographic History and Artificial Introductions. Conserv Genet. 2004;5:167-179. [ Links ]
HALE ML, LURZ PWW. Morphological Changes in a British Mammal as a Result of Introductions and Changes in Landscape Managemen in the Red Squirrel (Sciurus vulgaris), J of Zool (London). 2003;260:159-163. [ Links ]
KING M. Chromosomal Arrangements Speciation and Theoretical Approch. Heredity. 1987;59:1-6. [ Links ]
LI T, O'BRIEN PCM, BILTUEVA L, FU B, WANG J, NIE W, FERGUSONSMITH MA, GRAPHODATSKY AS, YANG F. Evolution of Genome Organizations of Squirrels (Sciuridae) Revealed by CrossSpecies Chromosome Painting. Chromosome Res. 2004;12:317-335. [ Links ]
LI T, WANG J, SU W, NIE W, YANG F. Karyotypes Evolution of the Family Sciuridae. Inferences from the Genome Organizations of Ground Squirrels. Cytogent Genome Res. 2006;112:270-276. [ Links ]
LIAPUNOVA EA, VORONTSOV NN. Chromosomes and Some Issues of the Evolution of the Ground Squirrel Genus Citellus (Rodentia:Sciuridae), Experientia. 1970;29:1033-1038. [ Links ]
LIMA JF, LANGGUTH A. Karyotypes of Brazilian Squirrels: Sciurus spadiceus and Sciurus alphonsei. Folia Zool. 2002;5(3):201-204. [ Links ]
MATTHEY RL. L' évolution de la formule chromosomiale chez les vertébrés. Experientia. 1945;1:50-56. [ Links ]
NADLER CF. Chromosomal Evolution in Rodents. En: Benirschke K, editor. Comparative Mammalian Cytogenetics. New York: SpringerVerlag Press; 1969. p. 277-309. [ Links ]
NADLER CF, HOFFMANN RS, HIGHT ME. Chromosomes of the Three Species of Asian Squirrels Callosciurus (Rodentia:Sciuridae). Experientia. 1970;30:1082-1083. [ Links ]
NADLER CF, HOFFMANN RS. Chromosomes of Some Asian and South American Squirrels (Rodentia, Sciuridae). Experientia. 1970;26:1383-1386. [ Links ]
OHNO S. Evolution of Sex Chromosomes in Mammals. Annu Rev Genet. 1969;3:495-524 [ Links ]
PETIT D, COUTURIER J, VIEGASPÉQUIGNOT E, LOMBARD M, DUTRILLAUX, B. Très grande similitude entre le caryotype ancestral des écureuils rongeurs et celui des Primates et des carnivores. Ann Genet 1984; 27: 201212. Citado en Lima y Langguth; 2002. [ Links ]
RIDGWAY R, ALLEN JA. Geographical Variation in Color among Squirrels. The Am Nat. 1875;9(9):504-509 [ Links ]
SEABRIGTH M. A Rapid Banding Technique for Human Chromosomes. Lancet. 1971;2:971-972. [ Links ]
SOLE F, WOESSNER S. Microwaves Improve Chromosome GBanding in Fresh Blood and Bone Marrow . J Clin Pathol. 1992;45:11-18. [ Links ]
STANYON R, STONE G, GARCIA M, FROENICKEA L. Reciprocal Chromosome Painting Shows that Squirrels, Unlike Murid Rodents, Have a Highly Conserved Genome Organization. Genomics. 2003;82:245-249. [ Links ]
VERMA R.S The varieties of Rbanding: Their Methodology and Application. Karyogram. 1984;8:72-73 [ Links ]
VERMA RS, BABU, A. Human Chromosomes. Principles and Techniques. Second Edition. McGrawHill Inc. Estados Unidos; 1995. [ Links ]
WAUTERS LA, ZANINETTI M, TOSI G. Is coat colour polymorphism in Eurasian red squirrels (Sciurus vulgaris L.) adaptative? Mammalia. 2004;68(1):37-48. [ Links ]
WILSON D, REEDER DM. Mammal Species of the World, a Taxonomic and Geographic Reference. 3 ed. Baltimore: The Johns Hopkins University Press.; 2005. [ Links ]














