Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Biológica Colombiana
versão impressa ISSN 0120-548X
Acta biol.Colomb. v.12 supl.1 Bogotá dez. 2007
PLASTICIDAD FENOTÍPICA DE Lippia alba Y Lippia origanoides (VERBENACEAE) EN RESPUESTA A LA DISPONIBILIDAD DE LUZ
Phenotypic Plasticity of Lippia alba and Lippia origanoides (Vervenaceae) in Response to Availability of Light
EDWIN PARRA TORRES1, Biólogo; NELSON RODRÍGUEZ LÓPEZ1, M.Sc.
1Grupo Nacional de Investigación en Ecofisiología y Metabolismo Vegetal Tropical. Laboratorio de Ecofisiología Vegetal, Escuela de Biología, Facultad de Ciencias, Universidad Industrial de Santander, Calle 9, Carrera 27, Ciudad Universitaria, Bucaramanga, Colombia. Email: edwinparra1@gmail.com, efisionel@uis.edu.co
Presentado el 31 de julio de 2007, aceptado el 4 de septiembre de 2007, correcciones 23 de octubre de 2007.
RESUMEN
La distribución de la especies es usualmente relacionada con la magnitud de la plasticidad fenotípica (PF). Con el fin de examinar la posible relación entre la magnitud de la PF y la amplitud ecológica en respuesta a la disponibilidad de luz, este trabajo evaluó la PF a través de la ontogenia en clones de Lippia alba y Lippia origanoides, especies congenéricas que presentan diferencias en su distribución. Clones de cada especie fueron distribuidos aleatoriamente en tres tratamientos, baja (33%), media (53%), y alta (100%) disponibilidad lumínica. Se evaluó la PF de caracteres morfológicos y de asignación de biomasa a través de la ontogenia por medio de un análisis de varianza (ANAVA) y la comparación interespecífica se realizó a través del índice de plasticidad fenotípica (RDPI). L. alba y L. origanoides presentaron variación de la plasticidad a través de la ontogenia en varios de los caracteres estudiados. La comparación interespecífica a través del RDPI mostró que la mayor PF de L. alba sobre L. origanoides en algún estado de la ontogenia no fue consistente ni uniforme a través de esta. Estos resultados sugieren una débil asociación entre la magnitud de la PF en respuesta a la disponibilidad lumínica. Además, indican que la mayor distribución de L. alba, se debe a un mayor desempeño en la tasa de crecimiento relativa y consecuentemente a una mayor acumulación de biomasa total, que posiblemente, le permiten alcanzar rápidamente su madurez sexual y así la colonización de nuevas áreas.
Palabras clave: Plasticidad fenotípica, Lippia sp., luz, morfología y crecimiento, distribución ecológica.
ABSTRACT
The distribution of the plant species is usually related to the magnitude of the phenotypic plasticity (PF). With the purpose of to stablish the possible relationship between the magnitude of the PF and the ecological breadth in response to light availability, the PF during the ontogeny in clones of Lippia alba and Lippia origanoides was evaluated. Both species are congeneris and show differences in their distribution. Three random treatments of light availability were set up, low (33%), medium (53%), and high (100%). The PF of morphologic and biomass allocation traits was evaluated during the ontogeny in clones of L. alba and L. origanoides through the ANOVA and the interspecific comparison were carried out through relative distance plasticity index (RDPI). L. alba and L. origanoides displayed variation of the plasticity through the ontogeny in several of the studied traits. The interspecific comparison through RDPI showed that the PF greather of L. alba in comparison to L. origanoides in some state of the ontogeny was not consistent nor uniform. These results suggest a lack association between the magnitudes of the PF in response to the availability of light. Additionally this indicate that the greater distribution of L. alba could be cause by a greater performance in the relative rate of growth and the greater accumulation of total biomass, therefore, it would likely contribute L. alba to reach its sexual maturity faster and the colonization of new areas.
Key words: Phenotypic plasticity, Lippia sp., ecological breadth, light, morphology and growth.
INTRODUCCIÓN
Las plantas como organismos sésiles no pueden eludir fácilmente las condiciones ambientales desfavorables; por esa razón, a lo largo de su evolución han desarrollado mecanismos que les permiten tolerar condiciones ambientales adversas (Brock et al., 2005). Por lo tanto, muchas especies vegetales presentan modificaciones en su morfología y fisiología originados por los cambios en su ambiente natural (Smekens y Van Tienderen, 2001). A lo anterior se le denomina plasticidad fenotípica (PF), definida como la capacidad que tiene un mismo genotipo para producir diferentes fenotipos en respuesta a la variación ambiental (Sultan, 2001; Pigliucci, 2005).
Adicionalmente, la distribución ecológica de las especies ha sido asociada con la PF, por lo que se asume que especies con una amplia distribución ecológica tendrían una mayor PF que especies con una limitada distribución (Sultan, 1995; Alpert y Simms, 2002, Paschke et al., 2003; Niinemets y Valladares 2004). Sin embargo, la hipótesis de asociación entre el rango de distribución ecológica y PF es materia de controversia. Esa hipótesis ha sido probada en numerosos estudios evaluando la plasticidad en un punto particular del desarrollo (i.e., en el estado adulto o la madurez sexual) de las plantas (González y Gianoli, 2004; Guan et al., 2004, Griffith y Sultan, 2006). Sin embargo, algunos reportes indican que no hay una asociación entre la amplitud ecológica y la magnitud de la plasticidad fenotípica (Baskauf y Eichmeier, 1994; González y Gianoli, 2004).
Una causa probable por la cual no se cumple la hipótesis planteada anteriormente, se debe al hecho que la PF puede no expresarse uniformemente a través del ciclo de vida de las plantas (Schlichting y Pigliucci, 1998; McConnaughay y Coleman, 1999; Wright y McConnaughay, 2002). Por lo tanto, una prueba robusta de la hipótesis de asociación entre plasticidad y la amplitud del rango ecológico de las plantas debería involucrar la estimación de la plasticidad a través de la ontogenia (Wright y McConnaughay, 2002).
De otro lado, un factor ambiental de gran importancia que define la distribución y adaptación de las plantas a diferentes ambientes es la luz. Este factor abiótico no solo es un recurso importante de energía, sino que también causa un estímulo que gobierna el desarrollo de las plantas y ocasionalmente, también es un factor que produce estrés en muchas especies vegetales (Larcher, 1995). Además, la luz es un elemento del ambiente que varía tanto temporal como espacialmente. En ese sentido, esa variación ambiental es el escenario propicio para que se evidencie plasticidad entre y dentro de las especies vegetales (Bazzaz y Morse, 1991).
Lippia alba y Lippia origanoides, especies pertenecientes a la familia Verbenáceae, son productoras de aceites esenciales con gran potencial para la industria (Stashenko et al., 2003). Estas especies se diferencian especialmente por su rango de distribución ya que L. alba, posee una amplia distribución, encontrándose desde México hasta Argentina, en lugares con alta o baja disponibilidad de luz (Woodson et al., 1973). En tanto que, L. origanoides, es una especie dominante en ambientes desfavorables, especialmente zonas semiáridas caracterizadas por suelos secos, pobres en nutrientes y de alta incidencia lumínica (Albesiano et al., 2003). Estas especies congenéricas, L. alba y L. origanoides, no han sido estudiadas desde un punto de vista ecológico o ecofisiológico y son un buen modelo para probar la hipótesis de PF asociada a distribución de especies. En este trabajo, nosotros evaluamos la plasticidad fenotípica durante la ontogenia vegetativa de clones de L. alba y L. origanoides en respuesta a la disponibilidad de luz, con el fin de establecer si existe relación entre la amplitud ecológica y la PF en estas especies. De ese modo, en este trabajo se plantearon las siguientes preguntas: i) ¿Es uniforme la expresión de plasticidad a través de la ontogenia vegetativa de estas dos especies? y ii) ¿Es la plasticidad de L. alba (con mayor distribución ecológica) mayor que la expresada por L. origanoides a través puntos de su ontogenia vegetativa.
MATERIALES Y MÉTODOS
El experimento fue realizado en el área experimental del Laboratorio de Ecofisiología Vegetal de la Universidad Industrial de Santander, Bucaramanga, Colombia. Se propagaron por medio de estacas, 150 clones de L. alba y de L. origanoides, respectivamente. Los clones de L. alba y L. origanoides, se obtuvieron a partir de plantas madre que se encontraban establecidas en la granja experimental Guatiguará de la Universidad Industrial de Santander, ubicada en el municipio de Piedecuesta (Santander), en 6º 59’ 16, 20’’ latitud norte y 73º 2’ 51, 66’’ longitud oeste a una altura de 900 msnm y en la localidad de Pescadero (región semiárida del cañón del río Chicamocha) ubicada a 6º 48’ 42, 6’’ latitud norte y 73º 00’ 29, 6’’ longitud oeste a una altura de 500 msnm, respectivamente. Se homogenizó la longitud (i.e., 20 cm) y el peso (i.e., 4,5±1,5 g) de las estacas utilizadas para la propagación (Albuquerque, 2001; Ehlert et al., 2002). Con la aparición de las dos primeras hojas totalmente expandidas, 20 días después de la siembra, se procedió a trasplantar los clones en bolsas de 3 kg (un clon por bolsa), las cuales contenían una mezcla 1:3:1 de tierra, arena de río y materia orgánica, esta mezcla se mantuvo constante para las dos especies en todos los tratamientos. Los tratamientos de luz a los que se sometieron los clones de ambas especies fueron: (i) baja disponibilidad de luz (33%), (ii) media disponibilidad de luz (53%) y (iii) alta disponibilidad de luz, plena exposición solar (100%). El segundo y el tercer tratamiento lumínico se obtuvo mediante la utilización de malla polisombra adecuada a una estructura de madera (McConnaughay y Coleman, 1999). Las mediciones de la disponibilidad de luz se realizaron con un sensor de radiación fotosintéticamente activa Li250 (LiCor, USA). Las temperaturas promedio día/noche registradas en el área experimental durante la ejecución del experimento fueron de 30 ºC/20 ºC ± 1 ºC. Reiteramos que los tres tratamientos lumínicos representan tres condiciones de crecimiento diferentes, en donde la luz es el factor principal considerado en este trabajo. Aunque pudieran existir diferencias microambientales, los componentes de variación se asociaron al efecto dominante de la luz. Para evitar este problema potencial, en el cual otras variables microclimáticas pudieran interferir con los resultados obtenidos, se siguieron los siguientes criterios: i) los clones crecieron en bolsas plásticas usando el mismo tipo de suelo; ii) los clones se mantuvieron bajo temperatura, humedad relativa natural y a capacidad de campo en todos los tratamientos; iii) a los tratamientos se les permitía el acceso a polinizadores y al viento, asegurando un régimen térmico más uniforme; y iv) los tratamientos fueron colocados en un lugar geográfico uniforme sin estructuras aledañas o árboles que interfirieran los tratamientos a determinadas horas del día.
DISEÑO EXPERIMENTAL, VARIABLES DE CRECIMIENTO Y DE ASIGNACIÓN DE BIOMASA
Se distribuyeron aleatoriamente 50 clones de cada especie (100 clones por tratamiento) en los tres tratamientos (300 clones en total). Se realizaron cinco muestreos destructivos en cinco individuos por tratamiento de cada especie a través de la ontogenia, i.e., día 10, 19, 31, 40 y 63, después del trasplante definitivo. Los clones fueron separados en hojas, tallo y raíz. Cada uno de los órganos de cada uno de los clones se sometió a secado en una estufa de ventilación forzada a 70 ºC, aproximadamente por 72 horas hasta peso constante. Se evaluaron diez variables dependientes: número de hojas (NH), número de ramas (NR), longitud promedio de ramas (LPR), área foliar (AF), área foliar específica (SLA), razón de área foliar (LAR), fracción de masa seca de la raíz (FMR), la fracción de masa seca foliar (FMH) y biomasa total (BMT). La medición del área foliar se realizó a través del programa Eye, Leaf & Symptom Area Software (Bakr, 2005), previo al secado del material foliar. La tasa de crecimiento relativo (RGR), se estimó a través de la aproximación funcional (Hunt y Parsons, 1974). Los datos registrados de los caracteres evaluados, excepto la RGR, se sometieron a una transformación del logaritmo natural (Ln), para cumplir con las asunciones de normalidad y homogeneidad de varianzas. Posteriormente, se realizó un análisis de varianza (ANAVA), para probar si existían diferencias significativas de los caracteres para los factores luz, muestreo y la interacción luz por muestreo. Las diferencias significativas de un carácter causado por el efecto del factor luz, nos indica que se presenta PF; mientras que, un efecto significativo en la interacción luz por muestreo, nos indica si la PF varía a través de la ontogenia. Como algunas variables morfológicas varían con el tamaño de la planta la biomasa total se utilizó como una covariante (Coleman et al., 1994).
CUANTIFICACIÓN DE LA PLASTICIDAD Y COMPARACIÓN INTERESPECÍFICA
El índice de plasticidad basado en distancias fenotípicas relativas (RDPI; Valladares et al., 2006) fue calculado para los caracteres que presentaron plasticidad o cuya plasticidad varió a través de la ontogenia según los resultados obtenidos mediante el ANAVA. Para la comparación del RDPI entre ambas especies, se utilizaron aquellos caracteres que simultáneamente presentaron diferencias significativas, según el ANAVA, por efecto del factor luz y la interacción luz por muestreo. Posteriormente, se utilizó el test de UMannWhitney (Camargo y Rodríguez, 2006), para la comparación interespecífica de los caracteres a los cuales se les estimó el RDPI.
RESULTADOS
La disponibilidad de luz tuvo un efecto significativo sobre la expresión de la PF en varios caracteres evaluados en ambas especies (fig 1). El ANAVA mostró la luz que afectó todos los caracteres evaluados en L. alba, excepto en NH, NR y FMR (Tabla 1A). Los muestreos realizados durante la ontogenia vegetativa presentaron un efecto significativo en todos los caracteres (Tabla 1A). Mientras que, para la interacción luz por muestreo solo se encontraron diferencias significativas en SLA, BMT y FMH (Tabla 1A). En el caso de L. origanoides, se registraron diferencias significativas en respuesta a la disponibilidad de luz solo en los caracteres AF, SLA y LAR (Tabla 1B). El efecto de los muestreos fue significativo en todos los caracteres, excepto en NH y NR (Tabla 1B).
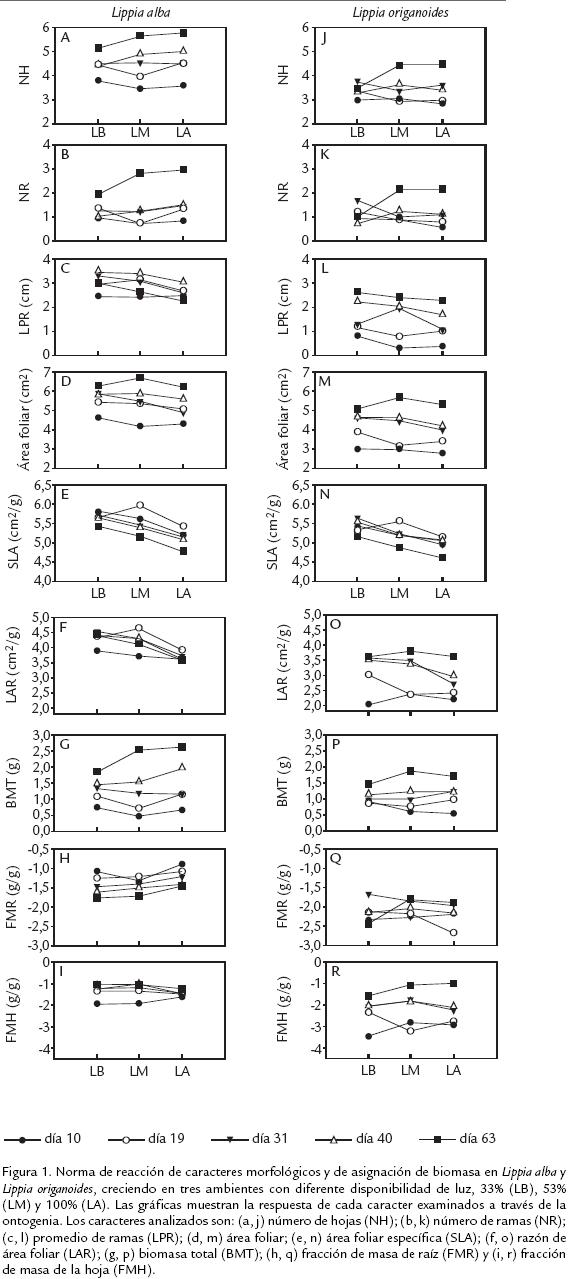
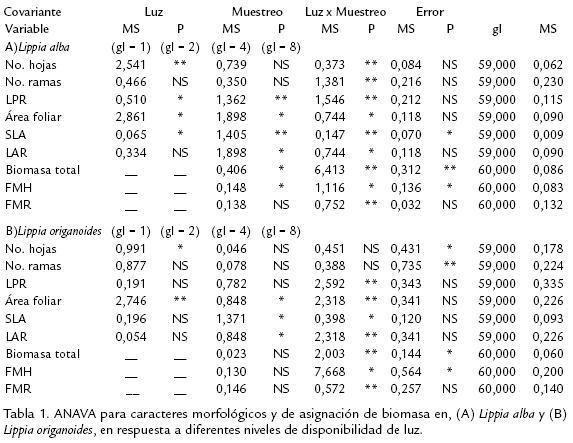
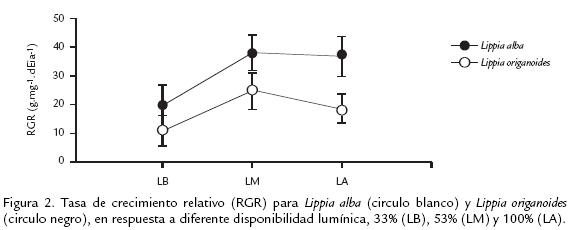
Estos dos últimos caracteres, mostraron diferencias significativas para la interacción luz por muestreo, al igual que BMT y FMH (Tabla 1B). La RGR en L. alba fue mayor en todos los tratamientos de luz, comparada con la observada en L. origanoides. Sin embargo, solo en los tratamientos de LM y LA se presentaron diferencias estadísticas significativas entre las especies (fig 2).
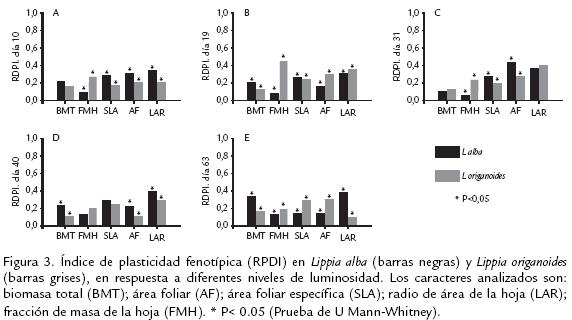
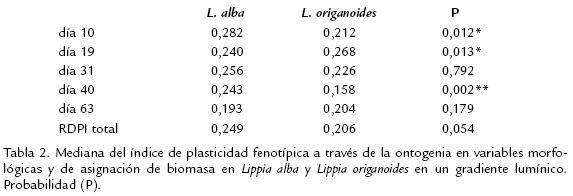
La PF total entre L. alba y L. origanoides no mostró diferencias significativas (p=0,054) (Tabla 2 ). Además, la PF no fue uniformemente expresada en ambas especies a través de la ontogenia, encontrándose diferencias significativas en los días 10, 19 y 40 ( Tabla 2; fig 3a, b, d. ). L. alba mostró mayor plasticidad en los días 10 y 40 ( Tabla 2; fig 3a, d. ) mientras que, L. origanoides solo presentó una mayor plasticidad en el día 19 (fig 3b. ; Tabla 2). Así mismo, la variación interespecífica en el índice de plasticidad fenotípica, arrojó diferencias significativas en varios caracteres a través del desarrollo ontogénico de ambas especies (fig 3). L. origanoides, mostró mayor plasticidad en FMH a través de la ontogenia (fig 3). Además, expresó mayor plasticidad en AF en los días 19 y 63 (fig 3b, e ) y SLA en el día 63 (fig 3e. ). Por otro lado, L. alba acumuló mayor BMT al compararse con L. origanoides, lo cual favoreció la mayor expresión de la PF para ese carácter a través de la ontogenia (fig 1g. , p; fig 3e).
DISCUSION
La importancia ecológica de la capacidad de organismos sésiles como las plantas de responder a la variación ambiental se apreció a lo largo de este trabajo. Los resultados sugieren que, tanto L. alba como L. origanoides, presentaron cambios morfológicos típicos de plantas que buscan maximizar la captación de luz (Sultan y Bazzaz, 1993; Poorter y Nagel, 2000; Ryser y Eek, 2000; Valladares et al., 2003). Lo anterior se corroboró en este trabajo mediante la disminución en el NR, NH y el aumento de LAR y SLA, este último carácter implica que la hoja invierta menos biomasa por unidad de área (Poorter, 2002). Adicionalmente, no se observó plasticidad en la asignación de biomasa del sistema radicular a través de la ontogenia. Resultados similares fueron encontrados por McConnaughay y Coleman (1999), quienes examinaron la asignación de biomasa vegetativa en tres especies anuales, en respuesta a la disponibilidad de luz.
Esos autores reportaron que la respuesta de asignación de biomasa en Chenopodium album fue concordante con la teoría de partición óptima, ya que la asignación de biomasa hacia la raíz no presentó diferencias significativas entre los tratamientos de luz. No obstante, sí fue evidente el aumento de LAR en ambientes de baja disponibilidad lumínica.
En este trabajo, a pesar que la PF fue evaluada a través de la ontogenia, la ausencia de diferencia ínterespecífica en la PF total estimada mediante el RDPI, demuestra que no hay una clara asociación entre la amplitud ecológica y la PF de las especies aquí estudiadas. Lo anterior también fue observado en estudios realizados en el estado adulto de plantas pertenecientes a los géneros Echinacea sp y Convolvulus sp, de distribución ecológica contrastante, en donde se analizaron caracteres fisiológicos y morfológicos, respectivamente (Baskauf y Eichmeier, 1994; González y Gianoli, 2004). En algunas especies anuales, se ha encontrado una mayor expresión de la PF en fases tempranas o tardías de la ontogenia. Gedroc et al. (1996), reportó que el incremento en la asignación de biomasa a la raíz en respuesta a disponibilidad de nutrientes, se presentó en una fase temprana de la ontogenia en plantas de Chenopodium album y Abutilon theophrasti. Mientras que, en Polygonum pensylvanicum, sometida a un gradiente de disponibilidad lumínica, la respuesta de LAR fue confinada a un estado avanzado de su ontogenia (McConnaughay y Coleman, 1999). En este trabajo, los resultados indican que, la expresión de la PF de L. alba, la especie con mayor distribución ecológica, no presentó un marcado patrón en su PF comparada con la PF de L.origanoides, ya que no se expresa homogéneamente en estas especies a través de la ontogenia. Además, la PF no estuvo limitada a la fase temprana ni final de la misma. Contrario a lo planteado en nuestra hipótesis, L. origanoides presentó mayor PF a través de la ontogenia en caracteres como, FMH, AF (i.e., día 19 y 63) y SLA (i.e., día 63). Lo anterior puede ser explicado en parte, debido a que esta especie se encuentra en sitios de alta incidencia lumínica, razón por la cual estos caracteres poseen una mayor plasticidad, ya que estos están implicados en la captura de luz (Poorter y Nagel, 2000; Ryser y Eek, 2000).
Además, estos caracteres podrían favorecer la tolerancia a condiciones de alta luminosidad que no solo se alcanzan mediante adaptaciones fisiológicas de las hojas, sino también mediante determinadas características arquitecturales que sirven para evitar parte de la radiación incidente (Valladares, 2001). De este modo, teóricamente, L. origanoides, se podría clasificar como un ecotipo localmente adaptado, que además presenta plasticidad, como lo plantea Pigliucci (2001). Sin embargo, es necesario realizar otros estudios para probar esa hipótesis. No obstante, se conoce que L. origanoides tiene una alta producción de metabolitos secundarios, especialmente terpenoides en su hábitat natural (BlancoMoreno, 2005). Lo anterior sugiere que la expresión de esa características por parte L. origanoides, sumada a la expresión de PF en los caracteres anteriormente mencionados, serían fundamentales para su supervivencia en hábitats con una alta oferta de radiación en ambientes semiáridos o áridos. No obstante, la capacidad que tienen algunas plantas para colonizar diversos ambientes, es posible gracias a una alta expresión de la PF en algunos caracteres de importancia ecológica (Pigliucci, 2001). En este contexto, la especie con mayor amplitud ecológica (L. alba) presentó el mejor desempeño evidenciado mediante la mayor expresión de la RGR, determinada por la SLA, FMH y la TAN (tasa asimilatoria neta), en ambientes de media y alta disponibilidad lumínica, sumado a la mayor acumulación de biomasa, que podría explicar en parte, su mayor distribución ecológica. La mayor expresión de esos caracteres permiten que las plantas reduzcan su ciclo de vegetativo y así aseguran colonizar nuevas áreas (Poorter, 2002).
Bajo las condiciones experimentales utilizadas en este trabajo, no fue posible corroborar la expectativa teórica que la magnitud de la PF en respuesta a la disponibilidad lumínica se encuentre asociada directamente con la amplitud ecológica de L. alba y L. origanoides. Sin embargo, sí se corroboró que la PF no es uniforme a través de la ontogenia en ambas especies, especialmente, el predominio de la PF de L. alba no fue consistente a través de la ontogenia comparada con la PF expresada por L. origanoides en respuesta a la disponibilidad de luz. Posiblemente, la amplitud ecológica de estas especies depende de otros factores ambientales, tales como la disponibilidad hídrica del suelo, la disponibilidad de nutrientes, la temperatura, entre otros. Este estudio deja claro la importancia de realizar la evaluación a través de la ontogenia de la PF, ya que ésta generalmente, es analizada en el estado adulto de las plantas, perdiéndose así información valiosa, ya que estos cambios se pueden presentar en primeras etapas del desarrollo.
AGRADECIMIENTOS
Los autores agradecen a COLCIENCIASCO 432CENIVAM el financiamiento de este trabajo. A los miembros del GIEFIVET por su apoyo y colaboración en la realización de este proyecto. A Iván Darío Camargo Rodríguez por su apoyo, asesoría y valiosos aportes.
BIBLIOGRAFÍA
ALBESIANO S, RANGELCH JO, CADENA A. La vegetación del cañón del río Chicamocha (Santander, Colombia). Caldasia. 2003;25:73-99 [ Links ]
ALBUQUERQUE HÁ. Enraizamiento de estacas de ervacidreira quimiotipo III (citrallimoneno). Hort. Brasileira. 2001;19(2):245 [ Links ]
ALPERT P, SIMMS EL. The Relative Advantages of Plasticity and Fixity in Different Environments: When is it Good for a Plant to Adjust? Evol Ecol. 2002;16:285-297. [ Links ]
BAKR EM. A New Software for Measuring Leaf Area, and Area Damaged by Tetranychus urticae Koch, J Appl Entomol. 2005;129:173-175. [ Links ]
BASKAUF C, EICKMEIER W. Comparative Ecophysiology of A Rare and Widespread Species of Echinaceae (Asteraceae). Am J Bot. 1994;81:958-964. [ Links ]
BAZZAZ FA, MORSE SR. The Response of Annual Plants to Multiple Stresses. En Winnert W, Pell E, Mooney HA, editores. The Response of Plants to Multiple Stresses. San Diego (California); 1991. p. 283-299. [ Links ]
BLANCOMORENO DC. Composición y rendimiento del aceite esencial de Lippia origanoides en el ambiente semiárido del cañón del río Chicamocha, Santander, Colombia [tesis de pregrado]. Bucaramanga: Escuela de Biología, Facultad de Ciencias, Universidad Industrial de Santander; 2006. [ Links ]
BROCK MT, WEINING C, GALEN C. A Comparison of Phenotypic Plasticity in the Native Dandelion Taraxacum ceratophorum and Its Invasive Congener T. officinale. New Phytol. 2005; 166,173-183. [ Links ]
CAMARGO RODRÍGUEZ ID, RODRÍGUEZ LÓPEZ N. Nuevas perspertivas para el estudio de la asignación de biomasa y su relación con el funcionamiento de plantas en ecosistemas neotropopicales. Acta biol. Colom. 2006;11:75-87. [ Links ]
COLEMAN JS, McCONNAUGHAY KDM, ACKERLEY D. Interpreting Phenotypic Variation in Plants. Trends Ecol Evol. 1994;9:187-191. [ Links ]
EHLERT PAD, CHAVES FCM, MING LC, da SILVA MAS. Effect of Substrata on the Development of Stem Cuttings of Lippia alba (mill.) n. e. br. LimoneneCarvone Chemotype. Acta Hort. 2002;(ISHS)576:259-262. [ Links ]
GEDROC JJ, MCCONNAUGHAY KDM, COLEMAN JS. Plasticity in root/shoot partitioning: Optimal, ontogenetic, or both?. Funct Ecol. 1996;10:44-50. [ Links ]
GONZÁLEZ AV., GIANOLI E. Morphological Plasticity in Response to Shading in Three Convolvulus Species of Different Ecological Breadth. Acta Oecologica. 2004;26:185-190. [ Links ]
GRIFFITH TM, SULTAN SE. Plastic and Constant Developmental Traits Contribute to Adaptive Differences in Cooccurring Polygonum Species. Oikos. 2006;114:5-14. [ Links ]
HUNT R, PARSONS IT. A Computer Program for Deriving GrowthFuntions in Plant GrowthAnalysis. J Appl Ecol. 1974;11:297-304. [ Links ]
LARCHER W. Physiological Plant Ecology: Ecophysiology and Stress Physiology of Function Groups (3rd edition). Springer Verlag. BerlinHeidelberg; 1995. [ Links ]
McCONNAUGHAY KD, COLEMAN JS. Biomass Allocation in Plants: Ontogeny or Optimality? A Test Along Three Resources Gradients. Ecology. 1999;80:2581-2593. [ Links ]
NIINEMETS U, VALLADARES F. Photosynthetic Acclimation to Simultaneous and Interacting Environmental Stresses Along Natural Light Gradients: Optimality and Constraints. Plant Biol. 2004;6:254-268. [ Links ]
PASCHKE M, BERNASCONI G, SCHMID B. Population Size and Identity Influence the Reaction Norm of the Rare, Endemic Plant Cochlearia bavarica Across A Gradient of Environmental Stress. Evolution. 2003;57:496-508. [ Links ]
PIGLIUCCI M. Phenotypic Plasticity: Beyond Nature and Nurture. John Hopkins University Press, Baltimore; 2001. [ Links ]
PIGLIUCCI M. Evolution of Phenotypic Plasticity: Where Are We Going Now? Trends Ecol Evol. 2005;20:481-486. [ Links ]
POORTER H. Plant Growth and Carbon Economy. En: John Wiley & Sons, Ltd. Encyclopedia of Life Sciences. Chichester; 2002. http://www.els.net/(doi:10.1038/npg.els.0003200). [ Links ]
POORTER H, NAGEL O. The Role of Biomass Allocation in the Growth Response of Plants to Different Levels of Light, CO2, Nutrients and Water: A Quantitative Review. Aust J Plant Physiol. 2000;27,595-607. [ Links ]
RYSER P, EEK L. Consequences of Phenotypic Plasticity vs. Interspecific Differences in Leaf and Root Traits for Acquisition of Aboveground and Belowground Resources. Am J Bot. 2000;87:402-411. [ Links ]
SCHLICHTING CD, PIGLIUCCI M. Phenotypic Evolution: A Reaction Norm Perspective. Sunderland, MA: Sinauer Associates; 1998. [ Links ]
SMEKENS MJ, VAN TIENDEREN MH. Genetic Variation and Plasticity of Plantago coronopus Under Saline Condition. Acta Oecologica. 2001;22:187-200. [ Links ]
STASHENKO EE, JARAMILLO BE, MARTÍNEZ JR. Comparación de la composición química y de la actividad antioxidante in vitro de los metabolitos secundarios de plantas de la familia Verbenaceae. Rev Acad Colomb Cienc. 2003;27:579-597. [ Links ]
SULTAN SE. Phenotypic Plasticity and Plant Adaptation. Act Bot Neerl. 1995;44:363-383. [ Links ]
SULTAN SE. Phenotypic Plasticity for Fitness Components in Polygonum Species of Contrasting Ecological Breadth. Ecology. 2001;82:328-343. [ Links ]
SULTAN SE, BAZZAZ FA. Phenotypic Plasticity in Polygonum persicaria. I. Diversity and Uniformity in Genotypic Norms of Reaction to Light. Evolution. 1993;47:1009-1031. [ Links ]
VALLADARES F. Luz y evolución vegetal. Invest. y Ciencia. 2001;73-79. [ Links ]
VALLADARES F, WRIGHT SJ, LASSO E, KITAJIMA K, PEARCY RW. Plastic Phenotypic Response to Light of 16 Congeneric Shrubs from Panamanian rainforest. Ecology. 2000;87(7):1928-1936. [ Links ]
VALLADARES F, HERNANDEZ LG, DOBARRO I, GARCIAPEREZ C, SANZ R, PUGNAIRE FI. The Ratio of Leaf to Total Photosynthetic Area Influences Shade Survival and Plastic Response to Light of GreenStem Leguminous Shrub Seedlings. Ann Bot. 2003;91:1-8. [ Links ]
VALLADARES F, SÁNCHEZGÓMEZ D, ZAVALA MA. Quantitative Estimation of Phenotypic Plasticity: Bridging the Gap Between the Evolutionary Concept and its Ecological Applications. J Ecol. 2006;94 (6):1103-1116. [ Links ]
WRIGHT SD, McCONNAUGHAY KD. Interpreting Phenotypic Plasticity: The Importance of Ontogeny. Plant Species Biology. 2002;17:119-131. [ Links ]
WOODSON RE, SCHERY RW, MOLDENKE HN. Flora of Panama. Part IX. Family 168. Verbenaceae. Annals of the Missouri Botanical Garden. 1973;60(1):41-148. [ Links ]














