Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.13 no.1 Bogotá Jan./Apr. 2008
PLASTICIDAD FENOTÍPICA EN Lippia alba Y Lippia origanoides (VERBENACEAE): RESPUESTA A LA DISPONIBILIDAD DE NITRÓGENO
Phenotypic Plasticity in Lippia alba and Lippia origanoides (Verbenaceae): Response to Nitrogen Availability
CARLOS ANDRÉS ANTOLINEZ-DELGADO1, Biólogo; NELSON RODRÍGUEZ-LÓPEZ1, M.Sc.
1 Grupo Nacional de Ecofisiología y Metabolismo Vegetal Tropical (GIEFIVET), Escuela de Biología, Universidad Industrial de Santander, Bucaramanga Colombia. caad2000048@tux.uis.edu.co - Fisionel@uis.edu.co
Presentado 12 de agosto de 2007, aceptado 4 de septiembre de 2007, correcciones 27 de diciembre de 2007.
RESUMEN
Este trabajo comparó la plasticidad fenotípica (PF) a través de la etapa vegetativa de dos especies del genero Lippia (Verbenaceae) que presentan amplitud ecológica contrastante con respecto a la disponibilidad de nitrógeno. Lippia alba, especie distribuida en suelos de alta a baja disponibilidad de nitrógeno y Lippia origanoides distribuida en suelos con baja disponibilidad de nitrógeno. Nuestra hipótesis de trabajo planteó que la magnitud de la plasticidad fenotípica en estas especies podría correlacionarse con su amplitud ecológica. Treinta y cinco clones de Lippia alba y Lippia origanoides fueron asignado aleatoriamente en tres tratamientos que variaron en la disponibilidad de nitrógeno en el suelo así: 0,5; 2,5 y 5 mM. A los 25, 35, 50 y 70 días cinco clones de cada especie por tratamiento fueron colectadas. Se evaluó el numero de hojas, área foliar, fracción masa de las hojas, fracción masa de la raíz, razón raíz/parte aérea, volumen de la raíz, longitud de la raíz, masa seca total y tasa de crecimiento relativo. Los resultados indican que ambas plantas presentan una alta PF a la disponibilidad de nitrógeno; sin embargo, las normas de reacción de los caracteres estimados variaron dependiendo de la especie y la edad de la planta. Contrario a nuestra hipótesis no encontramos una correlación entre la PF y la distribución ecológica de estas especies.
Palabras clave: Lippia sp., nitrógeno, distribución ecológica, ontogenia, expresión fenotípica.
ABSCTRACT
Here we present a comparative study of phenotypic plasticity in response to soil nitrogen availability in two perennial Lippia species that show different ecological breadth. Lippia alba occurs in soils whith low to high nitrogen concentrations, while Lippia origanoides is only found in soils whit low nitrogen concentrations. We hypothesized that the magnitude of phenotypic plasticity of these species could be correlated with their ecological breadth. Thirty five clones of L. alba and L. origanoides were putted randomly in three treatments with different nitrogen concentrations: 0.5, 2.5 and 5 mM. At 25, 35, 50 and 70 days five plants per treatment was harvested and the number of leaves, leaf area, leaf mass fraction, root mass fraction, root shoot, radical volume, root length, total mass and relative growth rate were evaluated. The results showed that both plants displayed high amounts of phenotypic plasticity in response to nitrogen availability. The reaction norms changed depending of the species and plant age. Contrary to our hypothesis we did not found a correlation between magnitude of phenotypic plasticity and ecological breath.
Key words: Lippia sp; nitrogen; ecological breath, ontogeny, phenotypic expression.
INTRODUCCIÓN
La plasticidad fenotípica (PF) es la capacidad de un organismo de producir diferentes fenotipos en respuesta a cambios en el ambiente (Schmalhausen, 1949; Gianoli, 2004b). Muchos estudios han considerado que la plasticidad tiene un gran significado para la adaptación de organismos en ambientes heterogéneos (Schlichting, 1986; Sultan y Bazzaz, 1993a; Bell y Sultan, 1999, Valladares et al., 2000). Lo anterior se fundamenta en que la PF puede generar ajustes funcionales a ciertos rasgos estructurales o fisiológicos en respuesta a una condición ambiental particular para permitir a un individuo tolerar condiciones adversas (Sultan y Bazzaz, 1993b). Así, la diferencia en la magnitud de la plasticidad fenotípica puede estar correlacionada con la diferencia en la distribución ecológica de especies vegetales con respecto a factores edáficos o climáticos (Bell y Sultan,1999; Guan et al., 2004).
Se ha postulado que las especies que se limitan a un hábitat determinado, i.e., especialistas, tienen menor plasticidad que especies generalistas o de amplia distribución ecológica (van Tienderen, 1997; Niinemets y Valladares, 2004). En diversos estudios se ha probado la hipótesis anterior, comparando fenotipos de plantas creciendo bajo un rango de condiciones ambientales en el estado adulto o la madurez sexual (González y Gianoli, 2004; Guan et al., 2004; Sultan, 2001; Griffith y Sultan, 2006). Sin embargo esta forma de calcular la PF no toma en cuenta que esta puede variar dramáticamente en función del crecimiento y desarrollo (Wright y McConaughay, 2002), de esta forma en el curso del desarrollo de las plantas los cambios en las condiciones ambientales pueden o no producir respuestas plásticas que difieren de las expresadas en otros puntos del desarrollo. Por lo tanto, los estudios que no siguen los fenotipos a través del desarrollo ontogénico, al menos durante el crecimiento vegetativo, podrían sobre o subestimar el grado de plasticidad fenotípica (Wright y McConaughay, 2002).
Uno de los factores ambientales más importantes que influye en la distribución de las plantas es la disponibilidad de nutrientes en el suelo. Entre los nutrientes el nitrógeno es el elemento más importante para el desarrollo y crecimiento de las plantas en términos de acumulación de biomasa (Larcher, 1995). La plasticidad fenotípica en respuesta a la disponibilidad de nitrógeno en el suelo conlleva profundos cambios en la fisiología, tasas de crecimiento, patrones de asignación de biomasa a los distintos órganos y expresión fenotípica de la arquitectura del sistema radicular (Larcher 1995; Zhang et al., 1999; Agren y Franklin, 2003).
Lippia alba (Mill N.E. Brown ex Britton & Wills) es una planta aromática que contiene aceites esenciales ampliamente utilizados en la industria cosmética y farmacéutica (Staschenko et al., 2003), se encuentra ampliamente distribuida en América Central y del Sur habitando zonas que varían en la disponibilidad de nutrientes en el suelo (Gupta, 1995). Lippia origanoides (Kunth), también produce aceites esenciales que poseen un alto potencial para el control de patógenos de plantas (Rodríguez y Sanabria, 2005) y posee gran actividad biológica (Dos Santos et al., 2004), presenta distribución restringida a zonas de vida semiáridas con suelos secos y pobres en nutrientes (Albesiano y Rangel, 2003; Carmona et al., 2004). Este trabajo examinó la plasticidad fenotípica a través de la ontogenia en clones de L. alba y L. origanoides en respuesta a la disponibilidad de nitrógeno en el sustrato. Nuestra hipótesis de trabajo fue: la especie distribuida en mayor variedad de ambientes con distintas disponibilidades de nitrógeno, L. alba, es más plástica que L. origanoides la especie distribuida en ambientes pobres en este recurso. Para probar esa hipótesis en este trabajo se formularon las siguientes preguntas: i. ¿Existen diferencias en la magnitud de la plasticidad fenotípica entre L. alba y L. origanoides? y ii ¿En qué etapa de la ontogenia se presenta plasticidad fenotípica y cuál es la magnitud de la misma para cada carácter tanto en L. alba como en L. origanoides?
MATERIALES Y MÉTODOS
Se colectaron seis plantas de una población natural de L. origanoides en la zona baja del Cañón del río Chicamocha (Santander, Colombia). La zona de muestreo se ubicó en 6º 48' 42.6" latitud Norte y 73º 00' 29.6" longitud Oeste a una altura de 500 msnm. Esta zona se caracteriza por un suelo arenoso, con un pH ligeramente alcalino (pH=7,4), contenido de materia orgánica (%MO) bajo (1,50), baja concentración de nitrógeno en el suelo (%N=0,086) y altas concentraciones de fósforo (50 ppm). Además, se colectaron seis plantas de L. alba en el municipio de Piedecuesta, Santander, Colombia. La zona de muestreo se ubicó en 6º 59' 16.20" latitud Norte y 73º 2' 51.66" longitud Oeste a una altura de 900 msnm, zona caracterizada por un suelo franco-arenoso, con (pH=6,5), porcentaje de materia orgánica (%MO) medio (3,1), concentración de nitrógeno media (%N 0,16) y concentraciones de fósforo de (64 ppm). El experimento se realizó en los meses de abril a julio de 2006 en el área experimental del laboratorio de ecofisiología vegetal de la Universidad Industrial de Santander, Bucaramanga, Santander, Colombia. Durante el experimento se registró una temperatura promedio día/noche máxima de 30 ºC y mínima de 20 ºC. De las seis plantas madre colectadas se obtuvieron en total 105 clones de L. alba y 105 clones de L. origanoides por medio de propagación vegetativa en tubetes plásticos. Se homogenizó la longitud (i.e., 20 cm) y el peso (i.e., 3 g) de las estacas utilizadas para la propagación (Ehlert et al., 2002, Albuquerque, 2001). Las estacas se trataron con 250 mg/L de ácido indolbutirico (AIB) durante 10 minutos (Albuquerque, 2001). Una vez que aparecieron las primeras hojas verdaderas (dos semanas de edad) las plántulas se transplantaron a bolsas plásticas de 6 kg (Hernández et al., 2004), utilizando como sustrato un suelo pobre en nutrientes proveniente del municipio de San Juan de Girón (Santander, Colombia) con las siguientes características: textura arcilloso-arenoso (i.e. arena 50% limo 14% y arcilla 36%), pH de 4,9, materia orgánica 0,08%, nitrógeno total 0,003 %, carbono orgánico 0,05 % y fósforo 3 ppm. Se prepa-raron 3 tratamientos con distintas concentraciones de nitrógeno (i.e. 0,5 2,5 y 5mM) adicionando al sustrato solución nutritiva, la composición de los nutrientes en la solución basal distintos al nitrógeno fue: 3 mM K2HPO4, 1 mM MgSO4.7H2O, 3 mM CaCl2, 25 mM H3BO3, 2 mM MnSO4.5H2O, 2 mM ZnSO4.7H2O, 0,5 mM CuSO4.5H2O, 0,5 mM Na2MoO2.2H2O (Hirose y Kitajima, 1986; Osone y Tateno, 2005). Se adicionó NH4NO3 a la solución basal para obtener 3 soluciones con concentraciones finales de nitrógeno de 0,5; 2,5 y 5mM. El pH de la solución fue ajustado a seis con ácido acético (CH3COOH).
Cada tratamiento fue conformado por 35 plantas para cada especie, a las cuales se les aplicaron 300 mL de solución nutritiva cada cuatro días. Se realizaron colectas destructivas de cinco individuos por especie en cada tratamiento durante la ontogenia vegetativa a los 25, 35, 50 y 70, días de edad de las plantas. Las plantas fueron retiradas de la bolsa plástica, lavadas y seccionadas en hojas, tallo y raíz. Todos los órganos de la planta fueron secados a 70°C por 72 horas hasta peso constante. Se midieron nueve variables: volumen de raíz (VR; estimada midiendo el desplazamiento de agua en una probeta graduada), longitud del sistema radicular (LR), masa seca total (MST), fracción masa seca de raíces (FMR), fracción masa seca de las hojas (FMH) y relación raíz/parte aérea (R/PA). A partir del día 35 se contó el número de hojas (NH) y se estimó el área foliar (AF) a través del programa Eye, Leaf y Symptom Area Software (Bakr, 2005). Se estimó la tasa de crecimiento relativo (RGR, g•kg-1•dia-1) tomando los valores de masa seca total de cinco plantas de cada uno de los tratamientos en cada muestreo, a través de la aproximación funcional (Hunt y Parsons, 1974).
ANÁLISIS ESTADÍSTICOLos clones de las dos especies se distribuyeron aleatoriamente en cada tratamiento y se realizó un análisis de varianza (ANDEVA) para observar diferencias en la respuesta fenotípica de las especies a los tratamientos de nitrógeno (N) y su interacción (tratamientos x especie). Un efecto significativo para el factor tratamiento de nitrógeno indica que hay plasticidad de un carácter. Un efecto significativo para el factor especie indica diferencias en el fenotipo promedio expresado por cada especie. Un efecto significativo para el factor interacción tratamiento x especie indica que la plasticidad varia entre las especies (i e. diferentes pendientes en la norma de reacción; Schlichting, 1986; Cheplick, 1995; Pigliucci, 2001; Giannoli, 2004b; Giannoli, 2004b). Los análisis fueron realizados por separado para cada época de muestreo. Para cumplir con las asunciones de normalidad y homogeneidad de varianzas de los caracteres estimados se utilizaron las siguientes transformaciones: Día 25 LN para VR y raíz cúbica para FMR y R/PA, día 35 raíz cúbica para VR, R/PA, FMR y FMH, día 50 raíz cúbica para VR, R/PA, AF y NH, 1/x para FMR, día 70 raíz cúbica VR y R/PA y Ln + 1 para NH y MST. El grado de plasticidad expresado se cuantificó para cada carácter que mostró plasticidad o variación de la plasticidad entre las especies mediante el índice de plasticidad basado en distancias fenotípicas relativas RDPI (Valladares et al.,2006). El RPDI fue calculado entre los tratamientos donde se observó la menor y mayor expresión para cada carácter. Se realizó una prueba no paramétrica de U Mann-Whitney para llevar a cabo las comparaciones entre especies en los diferentes puntos de la ontogenia donde se estimó PF.
RESULTADOS
TRATAMIENTOS
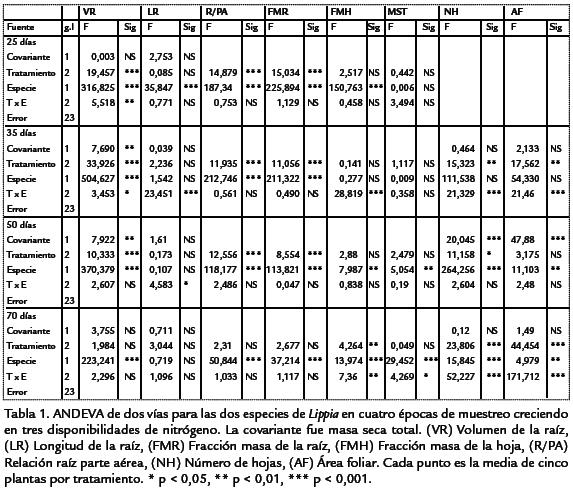
La adición de nitrógeno al sustrato ejerció efectos significativos sobre la expresión fenotípica de L. alba y L. origanoides (Tabla 1), presentándose plasticidad en los siguientes caracteres: VR, R/PA y FMR (día 25); VR, FMR, NH y AF (día 35); VR, R/PA, FMR y NH (día 50); FMH, NH y AF (día 70; Fig. 1a, d, c, f, e, i, k, l, m, n).
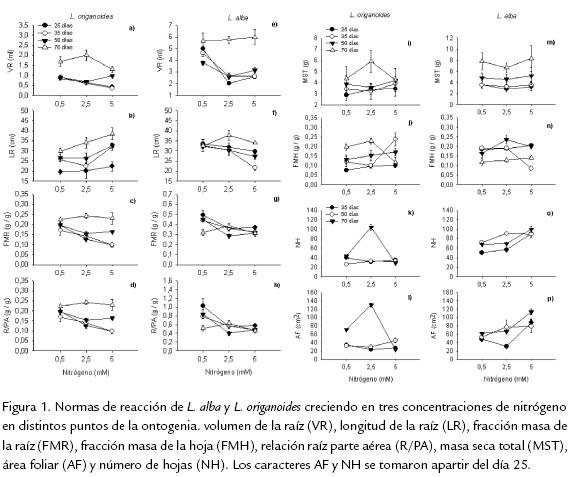
ESPECIES
Se presentaron diferencias significativas para los fenotipos promedio expresados por las especies a través de la ontogenia. En el día 25 todos los caracteres presentaron diferencias significativas excepto MST (Tabla 1). En las demás épocas de colecta de la planta se presentaron diferencias significativas en los caracteres: VR, R/PA y FMR (día 35); VR, R/PA, FMR, FMH, MST, NH y AF (día 50 y 70).
TRATAMIENTO X ESPECIE (T X E)L. alba y L. origanoides exhibieron variación de la plasticidad a través de la ontogenia. Los caracteres que presentaron una interacción significativa de T x E fueron: VR (día 25); VR, LR, FMH, NH y AF (día 35); LR (día 50); FMH, NH, AF y MST (día 70).
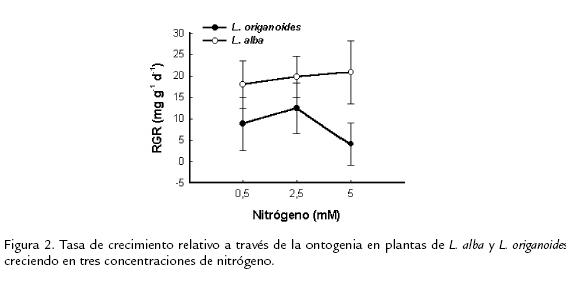
TASA DE CRECIMIENTO RELATIVO (RGR)La RGR calculada a través de la ontogenia presentó diferencias significativas entre L. alba y L. origanoides a disponibilidades de nitrógeno altas (Figura 2).
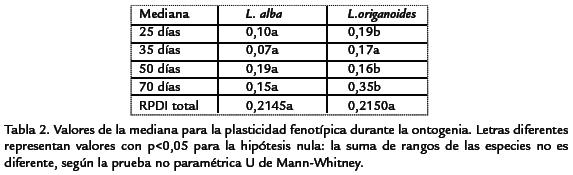
No se presentaron diferencias significativas para la PF total estimada mediante el RPDI entre L. alba y L. origanoides p = 0,2530 (Tabla 2). A pesar que la magnitud total de la plasticidad no fue diferente entre especies, se presentó una variación de esta a través de la ontogenia (Tabla 2). L. origanoides presentó mayor plasticidad a los 25 y 70 días; mientras que, L. alba fue más plástica a los 50 días. Durante la ontogenia también se presentó variación interespecifica para los índices de plasticidad fenotípica (Figura 3). L. origanoides presentó mayor plasticidad para FMR (día 25), VR FMR (día 35), NH AF y FMH (día 70). L. alba mostró una mayor plasticidad para NH y AF (día 35), FMR y R/PA (día 50; Tabla 2).

DISCUSIÓN
RESPUESTA PLÁSTICA DE LAS ESPECIES
L. alba y L. origanoides expresaron una considerable PF para caracteres morfológicos y de asignación de biomasa en respuesta a las diferentes concentraciones de nitrógeno en el suelo. La respuesta de los caracteres del sistema radicular fue rápida en ambas especies, presentando valores con diferencias significativas entre los tratamientos y entre las especies. La FMR, VR y R/PA incrementaron a medida que la concentración de nitrógeno disminuyó. Estos resultados son concordantes con la hipótesis que indica que la disponibilidad de nitrógeno en el suelo, especialmente iones como el nitrato, en bajas concentraciones son activadores del desarrollo radicular y tienen un efecto inhibitorio cuando las concentraciones son altas (Zhang et al., 1999; Crawford y Forde, 2002). Así, se incrementaría la asignación de recursos al sistema radicular generando una mayor superficie de captación cuando un recurso es limitante (Bloom et al., 1985; Agreen y Franklin, 2003).
El comportamiento de la LR es dependiente de la especie. En L. alba a los 25 y 35 días se presentó una tendencia a incrementar la longitud de la raíz en concentraciones bajas de nitrógeno; mientras que, en L. origanoides el comportamiento fue inverso. La mayor expresión de la LR en L. alba concuerda con estudios realizados en plantas de Spinacea oleracea, a una concentración de 0,01 mM de NO-3, donde la raíz fue más larga comparada con plantas creciendo en una concentración de 1 mM (Foehse y Jungk, 1987; Forde y Lorenzo, 2001). Bell y Sultan, (1999) evaluando la plasticidad en distintas condiciones hídricas del suelo obtuvieron resultados similares para el carácter LR en dos especies del género Polygonum, Polygonum persicaria (distribuida en suelos de muy secos a inundados) y Polygonum cespitosum (distribuida en suelos con disponibilidad hídrica intermedia). Estos autores encontraron que solo Polygonum persicaria cuando se sometió a condiciones de sequía incrementó la proporción de raíces a capas bajas del suelo donde el agua todavía se encontraba disponible traduciéndose en un mejor desempeño en ambientes se-cos comparado con P. cespitosum. Esto se fundamenta en que la estrategia de exploración del suelo podría favorecer la habilidad competitiva de la planta al dirigir su crecimiento a parches favorables donde la disponibilidad un recurso no es limitante (Pigliucci, 2001). Por tanto, bajo condiciones de baja disponibilidad de nitrógeno, la exploración de la raíz por parte de L. alba a capas más bajas del suelo, podría incrementar la captación de nutrientes al llegar a zonas con mayor disponibilidad de recursos, dotándola de una característica funcionalmente ventajosa para tolerar ese tipo de condiciones.
DIFERENCIAS EN LAS TASAS DE CRECIMIENTO Y SUS CONSECUENCIAS ECOLÓGICASComparando las tasas de crecimiento relativo (RGR) de L .alba y L. origanoides se observó que L. alba se desempeña mejor en la concentración más alta de nitrógeno. El incremento en parámetros de crecimiento de L. alba en concentraciones altas de nitrógeno ha sido reportado en estudios realizados en campo (Hernández, 2004; Montanari et al., 2004). Lo anterior sugiere que, el nicho óptimo de L. alba se encuentra en zonas con buena disponibilidad de nitrógeno en el suelo contrario a lo que se presentó en L. origanoides que presentó menor desempeño en términos de RGR, en concentraciones altas de nitrógeno; esto podría sugerir que el nicho óptimo de esta planta se encuentra en zonas con baja disponibilidad de este recurso, lo cual es concordante con su distribución actual. Ciertos grupos de características fisiológicas son importantes en la explotación exitosa de recursos en ambientes particulares (Chapin; 1980). La tasa de crecimiento relativo RGR es un carácter fundamental para definir la estrategia adaptativa de una planta ya que se ha postulado que las especies vegetales que dominan zonas de vida con suelos deficientes en nutrientes presentan bajas tasas de crecimiento relativo y las zonas con suelos ricos en nutrientes están dominadas por especies de crecimiento rápido o con altas tasas de crecimiento relativo (Chapin, 1980; Chapín, 1991; Chapin et. al., 1993). En un hábitat fértil una tasa de crecimiento relativo alta es claramente ventajosa porque permite una rápida producción de biomasa foliar y radical lo cual permite obtener una mayor cantidad de agua y nutrientes (Chapin, 1980). Es posible que L. alba debido a su mayor RGR alcance su óptimo fisiológico en zonas con buena disponibilidad de nitrógeno en el suelo pero debido a su plasticidad se presente como tolerante a concentraciones bajas de nutrientes lo que explicaría su distribución en campo. A su vez el comportamiento observado en L. origanoides, al crecer en hábitats con baja disponibilidad de recursos, poseer una alta relación R/PA, patrones de RGR conservativos y altas concentraciones de metabolitos secundarios (Dos Santos et al., 2004), es concordante con caracteres de plantas resistentes a condiciones ambientales estresantes (Chapin, 1991; Chapin et al., 1993). Los suelos infértiles son mejor explotados por especies resistentes al estrés debido a que sus bajas tasas de crecimiento pueden ser mantenidas por una baja capacidad fotosintética y de absorción de nutrientes (Chapin, 1980); así aunque la disponibilidad de recursos sea limitada la planta funciona cerca de su óptimo fisiológico y tiene un mayor fitness comparada con una especie de crecimiento rápido la cual tendría una reducción en su fitness en las mismas condiciones (Bradshaw, 1969). Aunque L. origanoides posee muchas de las características de una planta adaptada a suelos con baja fertilidad la información ecofisiológica disponible es limitada para establecer una hipótesis robusta del comportamiento de esta especie y su respuesta frente a condiciones adversas.
MAGNITUD DE LA PLASTICIDAD Y SU VARIACIÓN EN LA ONTOGENIAL. alba y L. origanoides presentaron una magnitud considerable de PF en respuesta a la disponibilidad de nitrógeno en el sustrato. Estos resultados indican una ausencia de asociación entre la distribución ecológica y la magnitud total de la plasticidad. Contrario a nuestra hipótesis L. alba no presentó una mayor magnitud en la PF comparada con L. origanoides. Resultados similares fueron obtenidos en tres especies del género Convolvulus (González y Gianoli, 2004). Esos autores reportaron que no se pudo correlacionar la magnitud de la plasticidad con la distribución de la planta respecto a un gradiente de luz. A pesar que las plantas no se diferencian en la magnitud total de PF, sí presentaron diferencias en un aspecto de gran importancia ecológica como lo es la etapa de desarrollo en que ocurre la respuesta, ya que la PF no fue uniforme a través de la ontogenia. En L. alba y L. origanoides, los caracteres radículares fueron más plásticos en las etapas tempranas del desarrollo. Estos resultados concuerdan con trabajos realizados en plantas anuales donde el incremento de asignación de biomasa a la raíz se da en fases tempranas de la ontogenia ya que un rápido desarrollo del sistema radical es fundamental para el establecimiento de la planta en el suelo (Gedroc et al., 1996; Wright y McConnaughay, 2002). Adicionalmente, los caracteres de la parte aérea NH, AF y FMH en L. origanoides son más plásticos en etapas tardías del desarrollo contrastando con L. alba donde no se presentó un incremento en la plasticidad.
Sin embargo, en etapas tempranas de la ontogenia (35 días), L. alba presentó valores de PF mayores que L. origanoides para NH y AF. Así L. alba, respondió más rápido al recurso disponible en el suelo e incrementó la superficie foliar. Esta estrategia puede favorecer a esta especie en la captación de un recurso limitante como la luz en diver-sos ambientes.
CONCLUSIONES
Los resultados de este trabajo indican que L. alba y L. origanoides no presentan diferencias en la magnitud de su PF, lo cual sugiere que no existe una correlación entre la distribución ecológica y la magnitud de la plasticidad fenotípica en respuesta a la disponibilidad de nitrógeno. Sin embargo, los caracteres de la parte aérea, la tasa de crecimiento relativo y la longitud de la raíz evidenciaron diferencias propias de cada especie en el patrón de la PF. La magnitud de la PF no es uniforme a través de la ontogenia, siendo los caracteres radiculares más plásticos en etapas tempranas del desarrollo en ambas plantas.
AGRADECIMIENTOS
Los autores agradecen a COLCIENCIAS-CO 432-CENIVAM por el financiamiento de esta investigación.
BIBLIOGRAFÍA
AGREEN GI, FRANKLIN O. Root: Shoot Ratios, Optimization and Nitrogen Productivity. Ann Bot. 2003;92:795-800. [ Links ]
ALBESIANO S, RANGEL-CH JO. La vegetación del río Chicamocha (Santander, Colombia). Caldasia. 2003;25(1)73-99. [ Links ]
ALBUQUERQUE HA. Enraizamiento de estacas erva-cidreira quimiotipo III (carvona-limoneno). Hortic Bras. 2001;19(2):245. [ Links ]
BAKR EM. A New Software for Measuring Leaf Area, and Area Damaged by Tetranychus urticae Koch. J Appl Ent. 2005;129:173-175. [ Links ]
BELL DL, SULTAN SE. Dynamic Phenotypic Plasticity for Root Growth in Polygonum: a comparative study. Am J Bot. 1999;86(6):807-819. [ Links ]
BLOOM AJ, CHAPIN FS, MOONEY HA. Resource Limitation in Plants-An Economic Analogy. Ann Rev Ecol Syst. 1985;16:363-392. [ Links ]
BRADSHAW AD. In Ecological Aspects of the Mineral Nutrition of Plants. I. H Rorison. Oxford Blackwell; 1969;415-427. [ Links ]
CARMONA J, MORALES A, RODRÍGUEZ M, RONDON M, ROJAS J, CEGARRA J. Listado preliminar de plantas del municipio Sucre del estado Mérida. Rev Fac Farm Univ Cent Venez. 2004;46(2):38-40. [ Links ]
CRAWFORD N, FORDE B. Molecular and Developmental Biology of Inorganic Nitrogen Nutrition. The Arabidopsis book. 2002;1-24. [ Links ]
CHAPIN FS. The Mineral Nutrition of Wild Plants. Annu Rev Ecol Syst. 1980;11:233-260. [ Links ]
CHAPIN FS. Integrated Responses of Plants to Stress. Bioscience. 1991;41:29-36. [ Links ]
CHAPIN FS, AUTUMN K, PUGNAIRE F. Evolution of Suites of Traits in Response to Environmental Stress. Am Nat. 1993;42:78-S92. [ Links ]
CHEPLICK GP. Genotypic Variation and Plasticity of Clonal Growth in Relation to Nutrient Availability in Amphibromus scabrivalvis. J Ecol. 1995;83(3):459-468. [ Links ]
DOS SANTOS FJB, ARIMATÉIA J, GRAÇAS AM, DE OLIVEIRA EH, DE LIMA SD, DE A.M. REIS F. Composition and biological activity of essential oils from Lippia origanoides H.B.K. J. Essent. Oil Res. 2004;16:504-506. [ Links ]
EHLERT PAD, CHAVES FCM, MING LC, da SILVA MAS. Effect of Substrata on the Development of Stem Cuttings of Lippia alba (mill.) n. e. br. -limonene-carvone chemotype. Acta Hort. 2002;(ISHS)576:259-262. [ Links ]
FOEHSE D, JUNGK A. Influence of nitrate and phosphate supply on root hair formation of rape, spinach and tomato plants. Plant Soil. 1987;74:359-368. [ Links ]
FORDE B, LORENZO H. The nutritional control of root development. Plant Soil. 2001;232:51-68. [ Links ]
GEDROC JJ, MCCONNAUGHAY KDM, COLEMAN JS. Plasticity in Root/Shoot Partitioning: Optimal, Ontogenetic, or Both? Funct Ecol. 1996;10:44-50. [ Links ]
GIANOLI E. Plasticity of traits and correlations in two populations of convovulus arvensis (Convolvulaceae) differing in environmental heterogeneity. Int J Plant Sci. 2004a;165(5):825-832. [ Links ]
GIANOLI E. Plasticidad fenotípica adaptativa en plantas. En: Fisiología Ecológica de Plantas. H.M. Cabrera. 2004b; p.12-25. [ Links ]
GONZÁLEZ AV, GIANOLI E. Morphological plasticity in response to shading in tree Convolvulus species of different ecological breadth. Act Oecol. 2004;26:185-190. [ Links ]
GRIFFITH TM, SULTAN SE. Plastic and constant developmental traits contribute to adaptive differences in co-occurring Polygonum species. Oikos. 2006; 114:5-14. [ Links ]
GUAN B, GE Y, CHANG J. Phenotypic plasticity of Mosla chiniensis and M. scabra (Labiatae) response to soil water status. Bot Bull Acad Sin. 2004;45:229-236. [ Links ]
GUPTA MP. 270 Plantas medicinales Iberoamericanas (Primera Edición). CYTED-SECAB, Bogotá; 1995. [ Links ]
HIROSE T, KITAJIMA K. Nitrogen uptake and plant growth I. Effect on nitrogen removal on growth of Polygonum cuspidatum. Ann Bot. 1986;58:479-476. [ Links ]
HERNÁDEZ H, BONILLA C, SANCHEZ M. Efecto de la fertilización nitrogenada en la producción de biomasa y calidad de aceite esencial en Lippia alba (Miller), Pronto alivio. Acta Agron. 2004;53(1):40-47. [ Links ]
HUNT R, PARSONS IT. A computer program for deriving growth-functions in plant growth-analysis. J Appl Ent. 1974;11:297-304. [ Links ]
LARCHER W. Physiological plant ecology: ecophysiology and stress physiology of function groups (Third edition). Springer Verlag. Berlin-Heidelberg; 1995. [ Links ]
MONTANARI RM, SOUSA LA, LEITE MN, COELHO AD, VICINI LF, STEFANINI MB. Plasticidade Fenotípica da Morfologia Externa de Lippia alba (Mill.) N. E. Br. ex Britt. & Wilson (Verbenaceae) em Resposta a Níveis de Luminosidade e Adubação. Rev Bras Plantas Med. 2004;6(3):96-101. [ Links ]
NIINEMETS U, VALLADARES F. Photosynthetic acclimation to simultaneous and interacting environmental stresses along natural light gradients: optimality and constraints. Plant Biol. 2004;6:254-268. [ Links ]
OSONE Y, TATENO M. Applicability and Limitations of Optimal Biomass Allocation Models: A Test of Two Species from Fertile and Infertile Habitats. Ann Bot. 2005;96:1211-1220. [ Links ]
PIGLIUCCI M. Phenotypic Plasticity: Beyond Nature and Nurture. John Hopkins University Press, Baltimore; 2001. [ Links ]
RODRÍGUEZ DA, SANABRIA ME. Efecto del extracto de tres plantas silvestres sobre la rizoctoniosis, la mancha sureña del maíz y los patógenos que las causan. Interciencia. 2005;30(12):739-744. [ Links ]
SCHLICHTING C. The evolution of phenotypic plasticity in plants. Ann Rev Ecol Syst 1986;(17):667-693. [ Links ]
SCHMALHAUSEN II. Factors of evolution. Blakiston Press, New York; 1949. [ Links ]
STASCHENKO EE, JARAMILLO BE, MARTINEZ JR. Comparación de la composición química y de la actividad antioxidante in vitro de los metabolitos secundarios volátiles de plantas de la familia (Verbenaceae). Rev Acad Colomb Cienc Exactas Fis Nat. 2003;27(105):579-597. [ Links ]
SULTAN SE, BAZZAZ FA. Phenotypic plasticity in Polygonum persicaria. I. Diversity and uniformity in genotypic norms of reaction to light. Evolution. 1993a; 47(4):1009-1031. [ Links ]
SULTAN SE, BAZZAZ FA. Phenotypic plasticity in Polygonum persicaria. Norms of reaction to soil moisture and the maintenance of genetic diversity. Evolution. 1993b; 47(4):1032-1049. [ Links ]
SULTAN SE. Phenotypic plasticity for fitness components in Polygonum species of contrasting ecological breadth. Ecology. 2001;82:328-343 [ Links ]
VALLADARES F, WRIGHT SJ, LASSO E, KITAJIMA K, PEARCY RW. Plastic phenotypic response to light of 16 congeneric shrubs from a panamanian rainforest. Ecology. 2000;7:1925-1936. [ Links ]
VALLADARES F, SANCHEZ-GOMEZ D, ZAVALA MA. Quantitative estimation of phenotypic plasticity: bridging the gap between the evolutionary concept and its ecological applications. J Ecol. 2006;94(6):1103-1116. [ Links ]
VAN TIENDEREN PH. Generalists, specialists and the evolution of the phenotypic plasticity in sympatric populations of distinct species. Evolution 1997; 51(5):1372-1380. [ Links ]
WRIGHT SD, McCONNAUGHAY. Interpreting phenotypic plasticity: the importance of ontogeny. Plant Species Biol. 2002;17:119-131. [ Links ]
ZHANG H. JENNINGS A, BARLOW P, FORDE B. Dual pathways for regulation of root branching by nitrate. Proc Nat Acad Sci USA. 1999;96:6529-6534. [ Links ]














