Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.13 no.1 Bogotá Jan./Apr. 2008
IVÁN DARÍO BARRERO-FARFÁN1, Biólogo; ALEJANDRO CHAPARRO GIRALDO2, Ingeniero Agrónomo, M.Sc., Ph. D.
1Escuela de Biología, Facultad de Ciencias. Universidad Industrial de Santander. Bucaramanga. IDBarrero@tux.uis.edu.co
2Profesor Asociado. Director Grupo de Ingeniería Genética de Plantas, Departamento de Biología, Facultad de Ciencias. Universidad Nacional de Colombia Bogotá. Cra 30 No.45-03, Bogotá. achaparrog@unal.edu.co
Presentado 24 de mayo de 2007, aceptado 11 de diciembre de 2007, correcciones 11 de febrero de 2008.
RESUMEN
La expresión transitoria y estable del gen gusA-intron en explantes internodales de papa criolla variedad Criolla Colombia cocultivados con Agrobacterium tumefaciens es reportada. Con el fin de determinar la susceptibilidad de esta variedad a la transformación mediada por A. tumefaciens, explantes internodales de Solanum phureja fueron infectados con la cepa LBA4404 de A. tumefaciens que contiene el plásmido pCAMBIA2301. Este plásmido contiene el gen ntpII que confiere resistencia a kanamicina y el gen reportero gusA-intron. La selección de los explantes potencialmente transgénicos fue realizada en medios con kanamicina. La eficiencia de transformación estable y transitoria fue calculada con base en la actividad GUS (ß-glucuronidasa), detectada por el ensayo histoquímico X-gluc. La expresión transitoria y estable del gen gusA-intron fue observada en células del explante más bien que en tejidos completos. Estos resultados demuestran que la papa criolla (S. phureja Juz. et. Buk) variedad Criolla Colombia es susceptible a la infección por A. tumefaciens.
Palabras clave: Solanum phureja, actividad Gus, expresión estable y transitoria, Agrobacterium tumefaciens, variedad Criolla Colombia.
ABSTRACT
The stable and transient expression of the gusA-intron reporter gene in internodal explants of "Papa Criolla" cultivar Criolla Colombia co-cultivated with Agrobacterium tumefaciens is reported. In order to determine the susceptibility of this cultivar to the A. tumefaciens-mediated transformation, internodal explants of Solanum phureja were infected by A. tumefaciens containing the vector pCAMBIA2301. This vector contains the kanamycin resistance gene ntpII and the reporter gene gusA-intron. The selection of potential transgenic explants was performed on kanamycin-containing media. The stable and transient transformation efficiency was calculated on the basis of the GUS (ß-glucuronidase) activity, detected by the histochemical X-Gluc essay. Transient and stable expression of the gusA-intron gene is observed in explants cells rather than in whole tissues. Nonetheless, these results demonstrated that "Papa Criolla" (Solanum phureja Juz. et. Buk) Cultivar Criolla Colombia is susceptible to the Agrobacterium tumefaciens infection.
Key words: Solanum, Agrobacterium tumefaciens, potato, GUS, transient expression, stable expression, transgenic cultivar.
INTRODUCCIÓN
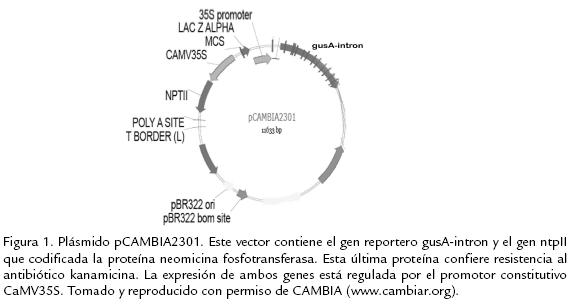
La papa criolla (Solanum phureja) es una especie diploide originaria de América tropical, derivada de Solanum stenotomum (Franco-Lara y Barker, 1999), se distribuye desde el norte de Bolivia hasta el suroccidente venezolano con un centro de diversidad genética al sur de Colombia en el departamento de Nariño (Carrasco y Pineda, 1993; Carrasco, 1994). Este cultivo presenta importantes características agronómicas y nutritivas, un significativo mercado interno en Colombia y un alto potencial como producto de exportación (Carrasco y Pineda, 1993; Franco-Lara y Barker, 1999; Ducreux et al., 2005a). Razones por las cuales Colombia solicitó y obtuvo, la exclusión de S. phureja del Tratado Internacional sobre Recursos Fitogenéticos para la Alimentación y la Agricultura de la FAO (TIRF) (http://www.fao.org/). La variedad Criolla Colombia es una nueva variedad de papa criolla, liberada comercialmente durante el primer semestre del año 2005, que presenta un mayor período de reposo respecto a otras variedades cultivadas, alto rendimiento por cosecha, frescura duradera, consistencia sólida del producto y resistencia a enfermedades que atacan el cultivo como la gota. Esta variedad fue seleccionada a partir de la multivariedad yema de huevo. Este trabajo de mejoramiento genético fue realizado por el grupo de Investigación en Papa de la Facultad de Agronomía de la Universidad Nacional de Colombia, sede Bogotá. La Ingeniería Genética ofrece la posibilidad de introducir genes específicos a las plantas sin alterar las características agronómicas propias de las variedades empleadas, permitiendo modificar y aumentar el pool de las variedades disponibles en poco tiempo (Johnson y Veilleux, 2003). La modificación genética de las variedades cultivadas a través de la ingeniería genética tiene un alto potencial para solucionar los problemas causados por el ataque de plagas; reflejo de ellos son las cerca de 56 millones de hectáreas mundiales sembradas con cultivos modificados genéticamente para resistencia a insectos (James, 2006). Diferentes autores han producido variedades transgénicas de Solanum tuberosum resistentes a insectos (Kondrák et al., 2005; Meiyalaghan et al., 2005; Reed et al., 2001; Valderrama et al., 2007), hongos (Conrath et al., 2003; Johnson y Veilleux, 2003; Osusky et al., 2004) y virus (Franco-Lara y Barker, 1999; Mlotshwa et al., 2002). Similarmente, variedades transgénicas de Solanum phureja con mayor producción de carotenos han sido reportadas (Ducreux et al., 2005a; Ducreux et al., 2005b). La producción de una planta transgénica implica el desarrollo de un sistema de regeneración y de transformación. Diferentes autores han encontrado que el porcentaje de regeneración y la eficiencia de transformación dependen del genotipo (Heeres et al., 2002; Nam et al., 1997; Trujillo et al., 2001), del explante o tejido y de la variedad empleada (Dale y Hampson, 1995; Mysore et al., 2000). Por lo cual es necesario evaluar el potencial regenerativo de cada una de las variedades que pretenden ser involucradas en un programa de transformación genética y determinar si son susceptibles a la transformación mediada por Agrobacterium tumefaciens. Las características agronómicas de papa criolla (Solanum phureja) variedad Criolla Colombia la hace una excelente candidata para realizar ensayos de transformación genética. No obstante es necesario primero evaluar y determinar la susceptibilidad de esta variedad a la transformación mediada por A. tumefaciens. Con el fin de determinar la eficiencia de transformación transitoria y estable, explantes internodales fueron infectados con la cepa de A. tumefaciens LBA4404 que contiene el plásmido pCAMBIA2301 (Figura 1). La selección mediante kanamicina y la expresión gus determinaron una frecuencia de transformación del 6%. Se reporta así por primera vez, los procesos iniciales de transformación genética para esta nueva variedad de papa criolla.
MÉTODOS
PROPAGACIÓN in vitro DE PLÁNTULAS DE PAPA CRIOLLA (Solanum phureja) VARIEDAD CRIOLLA COLOMBIA.
Los individuos in vitro de papa criolla (S. phureja) variedad Criolla Colombia fueron propagados cada cuatro semanas mediante el cultivo de segmentos terminales y los dos primeros entrenudos en medio sólido MS (Murashige y Skoog, 1962) suplementado con 25 g/L de azúcar comercial y 0,1 mg/L de ácido giberélico (AG3) y ajustado a pH 5,6. Las poblaciones fueron mantenidas a una temperatura de 20 °C ± 3 °C, un fotoperíodo de 12 horas luz y 12 horas oscuridad y una humedad relativa de 55 ± 5%. (Díazgranados, 2006; Díazgranados y Chaparro-Giraldo, 2007).
CALLOGÉNESIS Y REGENERACIÓN
Las condiciones de regeneración para este ensayo fueron establecidas con base en el trabajo desarrollado por Díazgranados y Chaparro-Giraldo (2007) para la variedad yema de huevo. Los explantes fueron mantenidos en medios sólidos MS (Murashige y Skoog, 1962) suplementados con 2 mg/L de Zeatina ribósido, 0,04 mg/l de ANA, 0,02 mg/L de AG3, 20 g/L de sacarosa y 50 mg/L de ácido ascórbico a pH 5,6. Como agente gelificante se adicionó phytagel (2,8 g/L; Díazgranados y Chaparro-Giraldo, 2007). Los explantes se mantuvieron en frascos de vidrio con el sistema tapa-tapón para permitir el intercambio gaseoso (Chaparro-Giraldo, 1999) y en cajas de petri. Los explantes fueron mantenidos en un cuarto de cultivo a una temperatura de 18 °C ± 3 °C, con un fotoperiodo de 16 horas luz y 8 horas oscuridad. Los explantes se cambiaron de medio cada 3 semanas para evitar el agotamiento de los nutrientes y los reguladores de crecimiento.
CURVA DE SENSIBILIDAD A KANAMICINA
Con base en las recomendaciones de López y Chaparro (2007) se determinó evaluar la sensibilidad de los explantes a la kanamicina mediante una curva de sensibilidad. Segmentos internodales de 0,5 a 1 cm derivados de plántulas in vitro de cuatro semanas fueron colocados en medios de regeneración con cuatro diferentes concentraciones de kanamicina (25, 50, 75 y 100 mg/L). Como control se emplearon medios de regeneración sin kanamicina. Semanalmente se evaluó el porcentaje de clorosis, oxidación y callogénesis. Los explantes se cambiaron de medio cada tres semanas. Después de la séptima semana se tomó el peso fresco y seco de los explantes por réplica para los diferentes tratamientos con kanamicina y el tratamiento control.
TRANSFORMACIÓN CON Agrobacterium tumefaciens
Para los ensayos de transformación genética se emplearon los protocolos descritos previamente por Díazgranados (2006) y por Ducreux et al. (2005a). El primer ensayo de transformación se realizó con base en el protocolo descrito por Díazgranados (2006). Explantes internodales de 0,5 a 1 cm provenientes de plántulas de seis semanas de edad fueron cocultivados con la cepa de A. tumefaciens LBA4404 previamente transformada con el plásmido pCAMBIA2301 (López y Chaparro, 2007). La bacteria se cultivó previamente en medio Luria-Bertani con 50 mg/L de kanamicina y estreptomicina durante 17 horas a 28 ºC y 250 rpm, hasta obtener un OD600nm de 0,6. La suspensión bacteriana se diluyó en medio MS suplementado con 20 mg/L de asetosiringona, utilizando una concentración de bacteria precrecida de 1/50 para el cocultivo. Los explantes se agitaron manualmente en esta suspensión durante 30 minutos, posteriormente los explantes se secaron en papel absorbente y se transfirieron a medios de regeneración suplementados con cefatoxina (250 mg/L) y kanamicina (50 mg/L). Para el segundo ensayo de transformación, el cocultivo se realizó de acuerdo al protocolo descrito por Ducreux et al. (2005a). En este ensayo se emplearon explantes internodales provenientes de plántulas de cinco semanas de edad. La bacteria se cultivó previamente como se describió anteriormente hasta alcanzar un OD600nm de 1,2. Esta suspensión bacteriana fue concentrada mediante centrifugación y luego resuspendida en medio MS. Luego esta suspensión bacteriana fue adicionada al medio de cocultivo (MS), suplementado con 20 mg/L de asetosiringona. Se empleó una concentración bacteriana de 1:50 para el cocultivo. Los explantes fueron mantenidos en esta solución de 5 a 10 minutos sin agitación y como paso adicional se incluyó un cocultivo sólido de 48 horas en luz. Posteriormente los explantes fueron transferidos a medios de regeneración. Para ambos protocolos, los explantes co-cultivados fueron mantenidos en una cámara de crecimiento para plantas (Phytotron Sanyo) con las siguientes condiciones: temperatura de 18 °C ± 0,5, fotoperíodo de 16 horas luz y 8 horas oscuridad, humedad del 60 ± 2% y una iluminación de 3000 Lux.
ENSAYO DE EXPRESIÓN GUS
Este ensayo se realizó con base en el protocolo descrito por Lacorte (1998). 50 mg de X-Gluc fueron disueltos en 1 mL de Dimetil sulfóxido (DMSO). Esta solución se adicionó a 100 mL de tampón de reacción (NapPO4.pO 100mM, Na2EDTA.2pO 10 mM, K4Fe(CN)6 · 3pO 0,5 mM, Triton X-100 0,1%, X.Gluc 50 mg/mL 1mM). Se tomaron 10 explantes sin co-cultivo como control. Después de 72 horas del co-cultivo, se tomaron 100 explantes para el ensayo de expresión transitoria y 15 callos de 11 semanas para el ensayo de expresión estable. Los explantes y callos se retiraron del medio de regeneración y se lavaron con agua destilada estéril. Después fueron secados en papel absorbente y se colocaron en tubos eppendorf estériles de 0,6 ml, cubiertos por el tampón de reacción. Posteriormente, fueron incubados en oscuridad a una temperatura de 37 ºC por 36 horas. Después se adicionó etanol al 70% para interrumpir la reacción y retirar la clorofila. Luego de 24 horas se lavaron las muestras en agua destilada y se transfirieron a glicerol 50% en una caja de petri. Finalmente las muestras se visualizaron en un estereoscopio.
ANÁLISIS ESTADÍSTICO
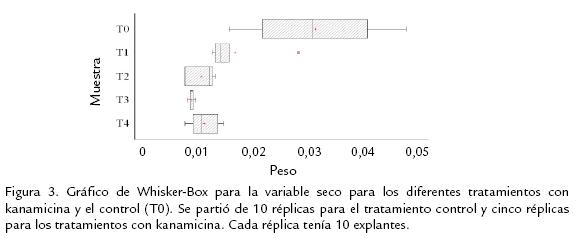
Con los datos obtenidos en la curva de sensibilidad a kanamicina para las variables peso seco y peso fresco, se realizó una prueba de normalidad de Shapiro-Wilks. Basados en estos resultados, se realizó una prueba no paramétrica de Kruskall-Wallis para establecer si había diferencias estadísticas significativas entre el peso fresco y seco de los explantes para los diferentes tratamientos con kanamicina. Finalmente, se determinó mediante un gráfico de Whisker-Box la diferencia entre las medianas de los tratamientos con kanamicina y el control (STATIGRAPHS v4.0). Las pruebas se realizaron asumiendo un nivel de confiabilidad del 95%.
RESULTADOS
CURVA DE SENSIBILIDAD A KANAMICINA
El tratamiento control presentó un menor porcentaje de oxidación y clorosis respecto a los tratamientos con kanamicina (resultados no mostrados). El porcentaje de callogénesis para el tratamiento control fue mayor que para el resto de los tratamientos. El menor porcentaje de callogénesis lo presentó el tratamiento 3 (Figura 2). Las variables peso seco y peso fresco para los tratamientos con kanamicina, no presentaron una distribución normal de acuerdo a la prueba de Shapiro Wilks (p≤0,05), por lo tanto se realizó una prueba no-paramétrica de Kruskall Wallis. Para la variable peso fresco, no se encontraron diferencias significativas (p=0,088≥0,05). En contraste, para la variable peso seco se encontraron diferencias altamente significativas entre los tratamientos (p< 0,01).
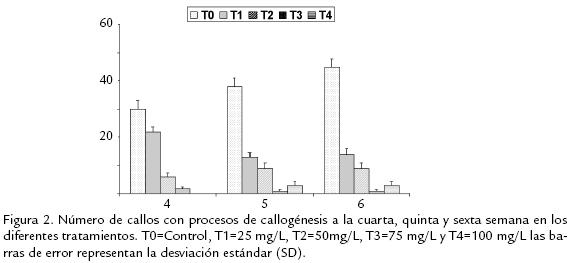
La ganancia de peso seco fue mayor para el tratamiento control, mientras los tratamientos con kanamicina tuvieron una ganancia menor de peso seco (Figura 3). El tratamiento tres presentó la menor ganancia de peso seco, mientras el resto de los tratamientos con kanamicina tuvieron una distribución de valores de peso seco similar. Estos resultados corroboran el efecto tóxico que ejerce la kanamicina sobre la síntesis de proteínas en el cloroplasto y la mitocondria en plantas (Brasileiro y Aragão, 2000; Miki y McHugh, 2004). Dado que el tratamiento uno presentó un mayor porcentaje de callogénesis, se decidió emplear una concentración de kanamicina de 50 mg/L para los ensayos de transformación genética con el fin de disminuir el porcentaje de escapes.
EXPRESIÓN GUS TRANSITORIA Y ESTABLE
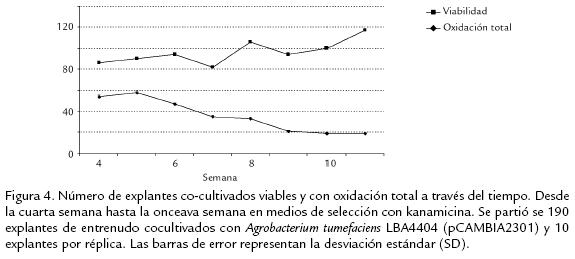
En el tratamiento control para el primer ensayo de transformación, los explantes no co-cultivados en la tercera semana ya eran inviables en medios de selección con kanamicina. En los explantes co-cultivados del primer ensayo de transformación, se observaron signos de callogénesis a partir de la semana cuatro, mientras en el segundo ensayo de transformación se observaron callos a la tercera semana. En el primer ensayo de transformación solo el 32% de los explantes co-cultivados eran viables y los signos de clorosis y oxidación eran evidentes en la mayoría de los explates durante la semana cuatro. En la sexta semana se observaron los primeros regenerantes. Los explantes que presentaron regenerantes tenían aproximadamente cuatro regenerantes por callo. Después de 11 semanas de selección en kanamicina (50 mg/L), solo 19 explantes de 190 eran viables y solo dos de estos explantes presentaban regenerantes. El porcentaje de oxidación del ensayo fue del 52% y fue el proceso que más afectó la viabilidad de los explantes (Figura 4). Dado el bajo porcentaje de regeneración presentado por los explantes cocultivados a las 11 semanas en el primer ensayo de transformación, se decidió realizar el ensayo GUS sobre 15 explantes viables que presentaban procesos de callogénesis hasta ese momento.
Los explantes con regenerantes no fueron empleados para el ensayo GUS porque este ensayo es destructivo. De los 15 callos cocultivados sometidos al ensayo GUS, 11 de ellos presentaron evidencias del metabolismo del sustrato x-gluc por la presencia del precipitado insoluble azul (Fig. 5A). Los focos de coloración azul obtenidos fueron muy pequeños y comprendían células de la corteza del explante (Fig. 5A). De acuerdo con los resultados de la expresión del gen gusA-intron, se determinó que la eficiencia de transformación fue del 6,8%. En el ensayo de transformación transitoria, después de 72 horas del co-cultivo sólido, solo seis explantes de 100 presentaron la coloración azul que evidencia el metabolismo del sustrato x-gluc. La coloración fue observada en células corticales de los explantes (Fig. 5B). Para este ensayo se determinó una eficiencia de transformación del 6%. Para los explantes control no se detectó la coloración azul que evidencia la degradación del sustrato x-gluc y la expresión del gen gusA-intron.

DISCUSION
El porcentaje de callogénesis observado después de siete semanas fue significativamente menor al reportado por Díazgranados y Chaparro-Giraldo (2007) bajo las condiciones citadas en ese trabajo. Una de las posibles causas que pudieron afectar este porcentaje fueron las variaciones en la temperatura que se presentaron en el cuarto de cultivo durante la regeneración de los explantes. Carvajal (2004) reportó la obtención de callos y regenerantes de Solanum phureja (variedad yema de huevo) después de lograr controlar las condiciones de temperatura y humedad en el cuarto de crecimiento. De la misma manera Gómez et al. (1997) citan que además de un adecuado balance de citoquininas y auxinas, la temperatura, la iluminación y el estado fisiológico de los explantes también influyen en la respuesta morfogenética. Otra posible causa de este bajo porcentaje de regeneración fue que Díazgranados y Chaparro-Giraldo (2007) trabajaron con la multivariedad yema de huevo clon 1, mientras en este trabajo se empleo la variedad Criolla Colombia. Dado que son variedades diferentes, se espera que la respuesta morfogenética no sea uniforme. Dale y Hampson (1995) y Heeres et al. (2002) evaluaron la susceptibilidad a la transformación mediada por A. tumefaciens y la capacidad morfogenética en 34 diferentes variedades de S. tuberosum para tres tipos de explantes provenientes de: discos de tubérculo, entrenudos y hojas, estos autores reportan variaciones en los procesos de regeneración y de transformación asociados con el tipo de explante y variedad empleada para los ensayos de transformación genética. El bajo porcentaje de regeneración obtenido en el ensayo de transformación estable a las 11 semanas, puede ser explicado por dos posibles hipótesis. Primero, el proceso de selección con kanamicina pudo afectar la respuesta morfogenética de los explantes, debido a su efecto tóxico sobre la fidelidad en la traducción de proteínas en el cloroplasto y la mitocondria (Brasileiro y Aragão, 2001; Miki y Mchugh, 2004). Segundo, basados en los resultados de la expresión del gen gusA-intron en grupos de células de los explantes más bien que en tejidos completos y dado que los genes de resistencia a kanamicina ntpII (neomicina fosfotransferasa) y el gen reportero gusA-intron están presentes en el mismo vector (Figura 1), se puede sugerir que la expresión de la proteína neomicina fosfotransferasa fue también baja y por lo tanto insuficiente para metabolizar la kanamicina y contrarrestar los efectos tóxicos mencionados previamente. La expresión del gen gusA-intron en células de explantes más bien que en tejidos completos se espera, puesto que no se realizó el ensayo GUS sobre plantas completas con tejidos diferenciados, sino sobre explantes y callos, donde es normal encontrar células transformadas y no transformadas. Por otro lado, la inclusión de una fase de co-cultivo sólido puede aumentar la eficiencia de transformación y por la tanto la actividad GUS. Esta fase de co-cultivo sólido tiene como objetivo que A. tumefaciens permanezca más tiempo con las células y aumente el porcentaje de infección. A pesar de que, Ducreux et al. (2005a) y Franco-Lara y Barker (1999) incluyeron en sus ensayos de transformación una fase de co-cultivo sólido, en este trabajo se decidió excluir la fase de co-cultivo sólido basados en los resultados obtenidos por Carvajal (2004) quien observó que el co-cultivo sólido disminuía la viabilidad de los explantes. Otros autores (Deng et al., 1995; Hansen, 2000) también reportan procesos de necrosis y de oxidación en células de maíz y Vitis vinifera después del cocultivo con A. tumefaciens. Respecto a la eficiencia de transformación obtenida de acuerdo con el ensayo histoquímico se puede afirmar que es más alta que la eficiencia de transformación reportada por Ducreux et al. (2005a). Estos autores reportan 30 líneas transgénicas a partir de 1.000 explantes distribuidos en seis ensayos de transformación, lo cual implica una eficiencia de transformación aproximada del 3%. Franco-Lara y Barker (1999) no reportaron la eficiencia de transformación ni el número de líneas transgénicas obtenidas en sus ensayos de transformación. Actualmente, solo dos artículos reportan la obtención de líneas transgénicas de S. phureja y ninguno ha reportado la expresión del gen reportero gusA-intron en esta especie de papa. Los porcentajes de regeneración y de transformación en papa criolla (Solanum phureja) son bastantes bajos en comparación con los obtenidos en la subespecies de Papa de año (Solanum tuberosum; Banerjee et al., 2006; Valderrama, 2004). Trujillo et al. (2001) reportaron eficiencias de transformación del 15 al 50% basado en el ensayo de expresión del gen GUS. Final-mente, con base en los resultados de la expresión del gen gusA-intron y la obtención de explantes viables en kanamicina, se puede concluir que A. tumefaciens infectó células de explantes internodales derivados de plántulas de S. phureja variedad Criolla Colombia y que esta variedad es apropiada para realizar ensayos de transformación empleando genes de interés agronómico. De la misma manera, se puede sugerir, con base en las experiencias previas del Grupo de Ingeniería Genética de Plantas y en este trabajo que la eficiencia de transformación se puede incrementar, empleando explantes en buen estado fisiológico y controlando las condiciones ambientales de temperatura, humedad y luz durante las etapas de regeneración. En los diferentes trabajos desarrollados en el grupo de Ingeniería Genética de Plantas y en observaciones realizadas en el laboratorio, se ha detectado que la papa criolla (S. phureja) es bastante sensible a los cambios de temperatura, y humedad. Variaciones mínimas en el ambiente induce procesos de estrés en la planta, afectando la respuesta morfogenética y la viabilidad de los explantes. En contraste, papa de año (Solanum tuberosum) siempre ha presentado una mayor resistencia a los cambios en las condiciones in vitro de cultivo. Dado esta susceptibilidad de S. phureja en las condiciones iniciales de regeneració ;n, también se sugiere que aplicar el proceso de selección con antibióticos 10 ó 12 días después puede aumentar la viabilidad de los explantes. Con base en los altos porcentajes de oxidación observados durante el proceso de regeneración también es aconsejable mantener los explantes en oscuridad los primeros días después del co-cultivo con el fin de disminuir los procesos de oxidación. Por último, la inclusión de una fase de co-cultivo sólido durante 36 ó 48 horas podría aumentar la infección de A. tumefaciens. No obstante, para evitar que los explantes pierdan viabilidad por el co-cultivo se debe realizar el co-cultivo líquido por 5 ó 10 minutos y secar bien los explantes para evitar sobreinfección durante el cocultivo sólido.
AGRADECIMIENTOS
A los miembros del grupo de Ingeniería Genética de Plantas de la Universidad Nacional de Colombia por su apoyo y asesoría en la realización de este proyecto. En especial a65 Cristina Díazgranados por su apoyo en el laboratorio y a Mary Luz Yaya por sus valiosas discusiones y contribuciones a este trabajo.
BIBLIOGRAFÍA
BANERJEE AK, PRAT S, HANNAPEL DJ. Efficient Production of Transgenic Potato (Solanum tuberosum L. ssp. andigena). Plant Sci. 2006;170:732-738. [ Links ]
BRASILEIRO ACM, ARAGÃO FJL. Marker Genes for in vitro Selection of Transgenic Plants. Plant Biotechnol J. 2001; 3(3):113-121. [ Links ]
CARRASCO CA. Descripción de clones de papa criolla 'yema de huevo' Solanum phureja colectados en diferentes campos de cultivo. Revista Papa.1994;10:6-13. [ Links ]
CARRASCO CA, PINEDA R. Papa criolla 'yema de huevo': una multivariedad nativa. Revista Papa. 1993;7:14-19. [ Links ]
CARVAJAL D. Estudios orientados a la transformación de papa criolla (Solanum phureja) mediada por Agrobacterium tumefaciens [trabajo de grado]. Bogotá: Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia; 2004. [ Links ]
CONRATH U, LINKE C, JEBLICK W, GEIGENBERGER P, QUICK WP, NEUHAUS HE. Enhanced Resistance to Phytophthora Infestans and Alternaria solani In Leaves and Tubers, Respectively, of Potato Plants with Decreased Activity of the Plastidic ATP/ADP Transporter. Planta. 2003;217(1):75-83. [ Links ]
CHAPARRO-GIRALDO A. Efeitos Pleiotrópicos em Plantas Transgénicas de Batata (Solanum tuberosum L.) Cv. Bintje Associados à Expressão da Leghemoglobina de Soja no Interior dos Cloroplastos [tesis de doctorado]. São Paulo: Escola Superior de Agricultura "Luiz de Queiroz", Universidade de São Paulo; 1999. [ Links ]
DALE PJ, HAMPSON KK. An Assessment of Morphogenetic and Transformation Efficiency in a Range of Varieties of Potato (Solanum tuberosum L.). Euphytica. 1995; 85:101-108. [ Links ]
DENG W, PU XA, GOODMAN RN, GORDON MP, NESTER EW. T-DNA Genes Responsible for Inducing a Necrotic Response on Grape Vines. Mol. Plant Microbe Interact. 1995;8:538-548. [ Links ]
DÍAZGRANADOS C, CHAPARRO-GIRALDO A. Desarrollo de un sistema de regeneración en papa criolla Solanum phureja Juz. et. Buk. Var. yema de huevo clon 1. Agronomía Colombiana. 2007;25(1):7-15. [ Links ]
DÍAZGRANADOS C. Producción de plantas transgénicas de Solanum phureja variedad Yema de Huevo mediada por Agrobacterium tumefaciens [tesis de Maestría]. Bogotá: Departamento de Biología. Facultad de Ciencias, Universidad Nacional de Colombia; 2006. [ Links ]
DUCREUX LJ, MORRIS WL, HEDLEY PE, SHEPHERD T, DAVIES HV, MILLAM S, TAYLOR MA. Metabolic Engineering of High Carotenoid Potato Tubers Containing Enhanced Levels of Beta-Carotene and Lutein. J Exp Bot. 2005a;56 (409):81-9. [ Links ]
DUCREUX L, MORRIS W, TAYLOR M, MILLAM S. Agrobacterium-Mediated Transformation of Solanum phureja. Plant Cell Rep. 2005b;24:10-14 [ Links ] FRANCO-LARA L, BARKER H. Characterisation of Resistance to Potato Leafroll Virus Accumulation in Solanum phureja. Euphytica. 1999;108:137-144. [ Links ]
GÓMEZ LM, JARAMILLO E, JARAMILLO S, HOYOS R. Regeneración de plantas de papa (Solanum tuberosum L.) a partir de tejido foliar en las variedades Diacol Capiro y Parda Pastusa. Revista Papa. 1997;17:20-27. [ Links ]
HANSEN G. Evidence for Agrobacterium-induced Apoptosis in Maize Cells. Mol. Plant-Microbe Interact. 2000;13:649-657. [ Links ]
HEERES P, SCHIPPERS-ROZENBOOM M, JACOBSEN E, VISSER R. Transformation of a Large Number of Potato Varieties: Genotype-Dependent Variation in Efficiency and Somaclonal Variability. Euphytic. 2002;124:13-22. [ Links ]
JAMES C. Global Status of Commercialized Biotech/GM Crops: 2006. ISAAA Brief No. 35.ISAAA: Ithaca, NY; 2006. [ Links ]
JOHNSON AT, VEILLEUX RE. Integration of Transgenes Into Sexual Polyploidization Schemes for Potato (Solanum tuberosum L.). Euphytica. 2003;133:125-138. [ Links ]
KONDRÁK M, KUTAS J, SZENTHE B, PATTHY A, BÁNFALVI Z, NÁDASY M, GRÁF L, ASBÓTH B. Inhibition of Colorado Potato Beetle Larvae by A Locust Proteinase Inhibitor Peptide Expressed in Potato. Biotechnol Lett. 2005;12:829-34. [ Links ]
LACORTE C. -Glucuronidase (GUS). En: BRASILEIRO A, V. CARNEIRO, editors. Manual de Transformação Genética de Plantas. Brasília. EMBRAPA-SPI/EMBRAPA-Cenagen; 1998. p. 128-129 [ Links ]
LÓPEZ, A, CHAPARRO, A. Propuesta de un sistema de transformación de plantas de papa (Solanum tuberosum sp andigena var. Pastusa suprema) mediado por Agrobacterium tumefaciens. Agronomía Colombiana. 2007;25(1):16-25. [ Links ]
MEIYALAGHAN S, TAKLA MF, JAIMESS O, YONGJIN S, DAVIDSON MM, COOPER PA, BARRELL PJ, JACOBS ME, WRATTEN SD, CONNER AJ. Evaluation of Transgenic Approaches for Controlling Tuber Moth in Potatoes. Commun Agric Appl Biol Sci. 2005;70(4):641-50. [ Links ]
MIKI B, MCHUGH S. Selectable Marker Genes In Transgenic Plants: Applications, Alternatives and Biosafety. J Biotechnol. 2004;107:193-232. [ Links ]
MLOTSHWA S, VERVER J, SITHOLE-NIANG I, PRINS M, VAN KAMMEN AB, WELLINK J. Transgenic Plants Expressing HC-Pro Show Enhanced Virus Sensitivity While Silencing of The Transgene Results in Resistance. Virus Genes. 2002;25(1):45-57. [ Links ]
MYSORE SK, KUMAR CT, GELVIN S. Arabidopsis Ecotypes and Mutants That Are Recalcitrant to Agrobacterium tumefaciens Root Transformation are Susceptible to Germ-Line Transformation. Plant J. 2000;21(1):9-16. [ Links ]
MURASHIGE T, SKOOG F. A Revised Medium For Rapid Growth And Bioassays With Tobacco Tissue Cultures. Physiol Plant. 1962;15:473-497 [ Links ]
NAM J, ANN G, MATTHYSSE B, STANTON BG. Differences in Susceptibility of Arabidopsis Ecotypes to Crown Gall Disease May Result from a Deficiency in T-DNA lntegration. The Plant Cell. 1997;9:317-333. [ Links ]
OSUSKY M, OSUSKA L, HANCOCK RE, KAY WW, MISRA S. Transgenic Potatoes Expressing a Novel Cationic Peptide are Resistant to Late Blight and Pink Rot. Transgenic Res. 2004;13(2):181-90. [ Links ]
REED GL, JENSEN AS, RIEBE J, HEAD G, DUAN JJ. Transgenic Bt Potato and Conventional Insecticides for Colorado Potato Beetle Management: Comparative Efficacy and Non-Target Impacts. Entomol Exp Appl. 2001;100:89-100. [ Links ]
TRUJILLO C, RODRÍGUEZ-ARANGO E, JARAMILLO S, HOYOS R, ORDUZ S & ARANGO R. One-Step Tranformation of Two Andean Potato Cultivars (Solanum tuberosum L. spp. andigena). Plant Cell Rep. 2001;20:637-641 [ Links ]
VALDERRAMA AM. Desarrollo de líneas de papa con posible resistencia a Tecia solanivora Utilizando el Gen cry1Ac de Bacillus thuringiensis [tesis de maestría]. Medellín: Facultad de ciencias. Universidad Nacional de Colombia. Sede Medellin; 2004. [ Links ]
VALDERRAMA AM, VELÁSQUEZ N, RODRÍGUEZ E, A ZAPATA, ZAIDI MA, ALTOSAAR I, ARANGO R. Resistance to Tecia solanivora (Lepidoptera: Gelechiidae) in Three Transgenic Andean Varieties of Potato Expressing Bacillus thuringiensis CrylAc protein. J Econ Entomol. 2007;(1):172-9. [ Links ]














