Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Biológica Colombiana
versão impressa ISSN 0120-548X
Acta biol.Colomb. v.13 n.1 Bogotá jan./abr. 2008
MARIA ANGÉLICA SANCLEMENTE1, Bióloga; ENRIQUE JAVIER PEÑA1, Ph. D.
1Departamento de Biología, Facultad de Ciencias, Universidad del Valle, Calle 13 No 100-00. A.A. 25360 Cali - Colombia. enripena@univalle.edu.co
Presentado 4 de mayo de 2007, aceptado 22 de octubre de 2007, correcciones 15 de febrero de 2008.
RESUMEN
En el presente estudio se evaluó el crecimiento y la eficiencia fotosintética de Ludwigia decurrens (Onagraceae), a partir de la estimación de la fluorescencia de la clorofila bajo diferentes concentraciones de nitrógeno (0 mg/L, 465 mg/L y 930 mg/L) en condiciones de laboratorio. Como parámetros de crecimiento se utilizaron la longitud total del tallo y el área foliar. Durante el periodo de estudio se observó un incremento en el crecimiento y la eficiencia quántica con el aumento en la concentración de nitrógeno. Sin embargo, no se presentaron diferencias significativas (p<0,05) en los valores de fluorescencia de la clorofila entre los tratamientos. Los resultados del comportamiento de la eficiencia fotosintética (Fv/Fm) y el crecimiento de las plantas tratadas con diferentes concentraciones de nitrógeno, demuestran que la macrófita Ludwigia decurrens crece en ambientes relativamente altos de nitrógeno.
Palabras clave: crecimiento, fotosíntesis, fluorescencia, Ludwigia, nitrógeno.
ABSTRACT
Growth parameters and quantum efficiency measurements of the photosynthesis were evaluated on the emergent macrophyte Ludwigia decurrens under different concentrations of nitrogen (0 mg/L, 465 mg/L y 930 mg/L). Growth was determined as measurements of total length and leaf area, and the emission of chlorophyll fluorescence was used as a measure of real quantum efficiency of the photosystem II. During the study period, a general tendency of increase of growth parameters and quantum efficiency with increase of nitrogen supply was noted. However, there was no significant difference (p<0.05) of emission of fluorescence among treatments. The results of the photosynthetic efficiency (Fv/Fm) behavior and the growth of the plant trated with different concentrations nitrogen, demonstrate that the macrophyte Ludwigia decurrens can grow on enriched nitrogen environments.
Key words: growth, photosynthesis, fluorescence, Ludwigia, nitrogen.
INTRODUCCIÓN
El papel del nitrógeno como nutriente esencial y componente estructural de moléculas como la Rubisco y la clorofila en plantas ha sido ampliamente documentado en varias especies debido a la importancia en los procesos de crecimiento y producción agrícola (Volenec et al., 1996; González et al., 2003; Reigosa et al., 2003; Makino y Osmond, 1991; Lattanzi et al., 2004). El nitrógeno es uno de los factores de mayor estrés en plantas tropicales ya sea por deficiencia o por exceso. Se reconoce que el nitrógeno puede ser un factor limitante del crecimiento y de la eficiencia fotosintética de las plantas, especialmente, bajo condiciones de déficit de nitrógeno, las cuales tienden a disminuir el peso seco, el número de hojas y el área foliar (Taiz y Zieger, 1998; Ciompi et al., 1996). En el caso de la eficiencia fotosintética, se puede ver limitada al disminuir el contenido de Rubisco y la clorofila en las hojas, así como la producción quántica de la fotosíntesis. La correlación entre el contenido de nitrógeno y la eficiencia fotosintética varía dependiendo del hábitat de la planta y de factores ambientales como la temperatura y la radiación (Evans, 1989; Toth et al., 2002; Lamsfus et al., 2003). Algunas plantas tienen la capacidad de acumular metales u otras sustancias como una respuesta de adaptación a la contaminación en la biosfera (Lamsfus et al., 2003). Dentro de este grupo, existen plantas hiperacumuladoras que pueden vivir en ambientes con altas concentraciones de nutrientes y agentes tóxicos y son ampliamente utilizadas en procesos de fitorremediación (Shiny et al., 2004). Esta estrategia requiere de especies con características especiales como la asimilación excedente de partículas y una alta producción de biomasa en estas condiciones (Baker y Brooks, 1989). Especies como Sarcobatus vermiculatus y Atriplex canescens han demostrado su capacidad para descontaminar suelos y aguas contaminadas con nitratos (Raskin et al., 1994; McKeon et al., 2001). Ludwigia decurrens Walter es una macrófita emergente nativa del trópico y subtrópico americano, que se considera una maleza del cultivo de arroz y su ambiente natural se relaciona con humedales, pantanos, bordes de río y sitios de gran humedad. A nivel local, esta especie se ha reportado en las áreas de inundación o planos inundables del río Cauca, así como en áreas de humedales relativamente ricos en nutrientes (Munz, 1974; Sanclemente, 2005). El estudio pretende demostrar cuál es el efecto del nitrógeno sobre el crecimiento y la actividad fotoquímica de la planta, evaluando el comportamiento de la eficiencia fotosintética de L. decurrens, a partir de la estimación de la fluorescencia de la clorofila a bajo diferentes concentraciones de nitrógeno.
MATERIALES Y MÉTODOS
ORGANISMO DE ESTUDIO
Ludwigia decurrens (Walter, 1788), conocida con el nombre común de "Clavitos", pertenece a la familia Onagraceae de 30-200 cm de largo libremente ramificada (Figura 1). El tallo posee cuatro alas desde la base decurrente de las hojas, las raíces están sumergidas. Las hojas son lanceoladas o elípticas; las flores poseen cuatro pétalos ama rillos o blancos, son solitarias y se encuentran en las yemas superiores, tienen ocho estambres y cuatro sépalos. El fruto es una capsula loculicida de color café (Munz, 1974).

TRANSPLANTE Y ACLIMATACIÓN DE INDIVIDUOS
Se obtuvieron 18 individuos de cinco a diez cm de longitud a partir de una población natural de L. decurrens, de la finca La Independencia, productora de arroz y ubicada en el municipio de Jamundí, Valle del Cauca, Colombia (3° 16 N y 76°33 O), en la vía río Claro-Timba. Las plántulas tuvieron un periodo de aclimatación previo al montaje de aproximadamente 15-20 días en casas de malla, ubicadas en la estación experimental de Biología, de la Universidad del Valle, Sede Meléndez. Para el montaje de los tratamientos, las plántulas fueron seleccionadas mediante el uso de una tabla de números al azar. A continuación se limpió la raíz de las plantas con agua corriente y se transplantaron seis individuos para cada tratamiento en materas plásticas con arena gruesa lavada, como medio inerte.
CONCENTRACIONES DE NITRÓGENO
Para los experimentos de nitrógeno, se utilizó la solución Hoagland completa (Hoagland y Arnon, 1950), modificando la concentración de nitrógeno (2,5 g/L Ca (NO3) para obtener concentraciones de nitrato cercanas a las del medio natural de las plantas, las cuales oscilaron entre 2,3 y 6,4 g/L (n = 9). Los concentraciones para cada tratamiento se establecieron de acuerdo a valores promedio de nitratos del suelo de las zonas de estudio como: sin nitrógeno (0 mg/L), solución control (465 mg/L) y doble nitrógeno (930 mg/L). Las soluciones fueron aplicadas directamente en las materas tres veces por semana, procurando de tal manera el mantenimiento de las concentraciones promedio de nitrógeno y la saturación del medio. Las plantas fueron regadas con agua común para evitar el estrés por déficit hídrico (Taiz y Zieger, 1998).
MEDICIÓN DE INDICADORES FISIOLÓGICOS
Crecimiento: para las medidas de longitud total y área foliar se utilizó una cinta métrica.
Las medidas de longitud se tomaron en las plantas de los tres tratamientos desde el talloa nivel de la arena, hasta el ápice. Para las medidas de área foliar, se escogieron cincohojas de cada una de las plantas en cada tratamiento. En cada hoja seleccionada, semidió el largo y ancho. Mediante una regresión linear entre estos valores, se hallaron losvalores de área foliar para las plantas de los tratamientos. La selección de las hojas sehizo mediante la utilización de una tabla de números al azar. Estas mediciones fuerontomadas dos veces por semana por un periodo de ocho semanas (Sanclemente, 2005).
Eficiencia fotosintética:se define como eficiencia quántica real del fotosistema II (PSII)a la eficiencia con la cual los electrones son procesados en la fotosíntesis por cantidadde luz absorbida y se expresa como la relación Fv/Fm, donde Fv es la fluorescencia varia-ble y Fm es la fluorescencia máxima cuando una planta está adaptada a condicionesde luz (Gemel et al., 1997; Maxwell y Johnson, 2000). La eficiencia fotosintética (Fv/Fm)se determinó utilizando un fluorómetro portátil Modelo Mini-PAM-2100 ChlorophyllFlourescence Systemmarca WALZ. Las mediciones se realizaron a primeras horas de la ma-ñana (5:30 a.m) y aclimatando las plantas por un periodo de 30 a 45 minutos a la oscu-ridad, para garantizar que todos los centros de reacción del PSII estuviesen abiertos,utilizando hojas plenamente desarrolladas de las plantas (Peña, 1998).Estas medicio-nes se tomaron en tres hojas de cinco plantas por cada tratamiento (n=45), con unperiodo de observación de ocho semanas. Las hojas fueron seleccionadas medianteel uso de una tabla de números al azar.
Contenido de nitrógeno foliar:se realizó un análisis del contenido de nitrógeno foliarde acuerdo a la técnica de Kjeldahl (Icontec, 1981). Esta medición se realizó utilizan-do tres hojas de cinco plantas por cada tratamiento (n=45), 30 días después de serexpuestas a las diferentes concentraciones de nitrógeno.
Observaciones de la sintomatología de las plantas en cada tratamiento:se observarondiferencias en las características fenotípicas de las plantas expuestas a las diferentesconcentraciones de nitrógeno ( Tabla 1). Las plantas que crecieron con doble concen-tración de nitrógeno tuvieron hojas de coloración intensa y abundancia de follaje.Mientras que las plantas que crecieron sin nitrógeno presentaron clorosis y necrosis enciertos puntos de las hojas adultas. Las hojas jóvenes permanecieron verdes hasta laetapa de senescencia.

DISEÑO EXPERIMENTAL
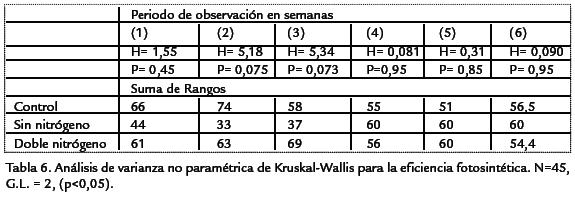
Para el diseño del experimento, se tomaron en cuenta los tres tratamientos por tri-plicado, con cinco repeticiones cada uno (n=45) durante ocho semanas de observación(360 combinaciones). Las mediciones de crecimiento (área foliar y longitud) y eficienciaquántica (Fv/Fm) del fotosistema II se hicieron igualmente por triplicado para un total1 de 360 muestras analizadas. El experimento fue manejado como un diseño experimentalcompletamente al azar (DCA) con medidas repetidas y un nivel de significancia de 95%(p< 0,05). Se tomaron como variables dependientes el área foliar, la longitud, la efi-ciencia fotosintética y el contenido de nitrógeno foliar. Como variable independiente lostratamientos expresados en las tres concentraciones de nitrógeno. Para los datos delongitud y área foliar se empleó un análisis de varianza y una prueba de Tuckey paradeterminar las diferencias entre los tratamientos. Para los datos de eficiencia fotosin-tética se utilizó un análisis no paramétrico de Kruskal-Wallis. Todos los datos fueronanalizados mediante el programa estadístico STATISTICA, versión 5.1 (1997).
RESULTADOS
EFECTO DEL NITRÓGENO SOBRE EL CRECIMIENTO
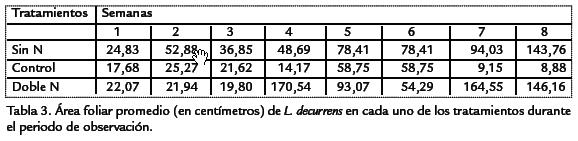
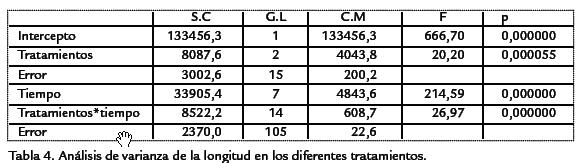
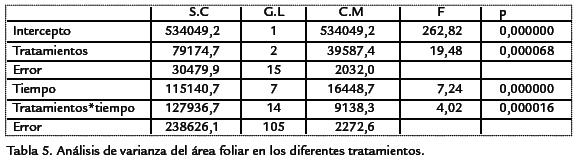
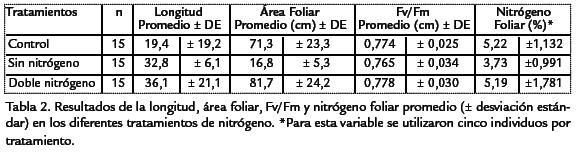
Durante el periodo de observación L. decurrenspresentó una curva de crecimiento sig-moidal típica de plantas anuales (Figura 2; Tabla 3). En las plantas del tratamiento condoble nitrógeno se distinguieron tres fases: una fase logarítmica en la cual el crecimientofue exponencial durante las primeras semanas. Una fase lineal en la cual el crecimien-to fue constante y máximo y una fase de senescencia, en la cual la velocidad de creci-miento disminuyó. Las plantas del tratamiento sin nitrógeno tuvieron un crecimientomás lento comparado con los otros tratamientos. Sobre el contenido de nitrógeno fo-liar, los resultados indicaron que las plantas de los ensayos control y doble nitrógeno,presentaron concentraciones de nitratos foliar más altas (p < 0,05, n=45) que las plantasdel tratamiento sin nitrógeno ( Tabla 2). Se encontraron diferencias significativas(p < 0,05, n=44) en el área foliar y longitud de las plantas entre los tratamientos estu-diados ( Tabla 4; Tabla 5). Las plantas con doble concentración de nitrógeno y controlpresentaron valores significativamente más altos en el área foliar mientras que las plan-tas del tratamiento sin nitrógeno tuvieron valores significativamente más bajos ( Tabla 2). Comparativamente con los otros tratamientos, se observó un menor número dehojas y menor tamaño en plantas expuestas a cero concentraciones nitrógeno.
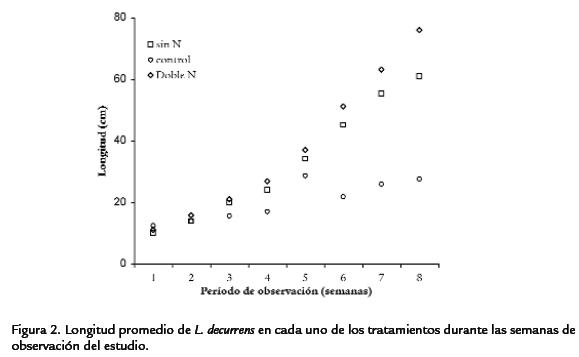
FLUORESCENCIA
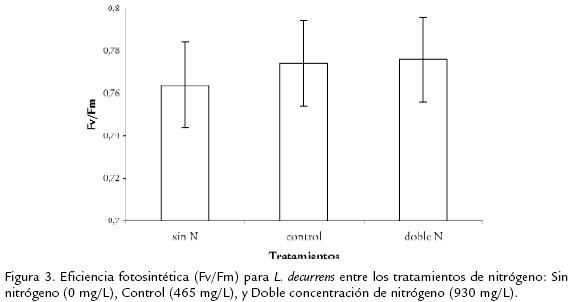
Los resultados mostraron que no existen diferencias significativas (p < 0,05, n = 45) en lafluorescencia de la clorofila para cada uno de los tratamientos ( Tabla 6). Sin embargo,se observó una tendencia general a aumentar la eficiencia fotosintética a medida queaumenta la concentración de nitrógeno (Figura 3). De acuerdo con los resultados se ob-servó una disminución en los valores de Fv/Fm en la semana tres. Estos valores osci-laron entre 0,70 (± 0,0007) y 0,74 (±0,0007) en comparación con el valor promediode Fv/Fm para plantas control de 0,80 (± 0,0008) y 0,83 (± 0,0008).
DISCUSIÓN
EFECTO DEL NITRÓGENO SOBRE EL CRECIMIENTO
Los resultados del estudio mostraron una tendencia general del incremento de los pará-metros de crecimiento de la planta (longitud del tallo y el área foliar) con el aumentode la concentración de nitrógeno. Estos datos sugieren que la limitación de nitrógenoinfluye en el área foliar total de las plantas por efecto del estrés nutricional (Walley,2001). En especies de cultivo, las hojas tienden a ser más grandes hasta cierto punto enel cual el tamaño comienza a disminuir progresivamente (Cechin y de Fátima-Fumis,2004; Vos et al., 1992). Sin embargo, este efecto fue menos aparente para las plantasque crecieron sin nitrógeno. Una alta sensibilidad del crecimiento de la hoja de acuerdocon la disponibilidad de nitrógeno ha sido demostrada en plantas como Triticum aestivumL. (Simpsonet al., 1983), Zea maysL. (Swank et al., 1982), Amaranthus powellii(Hunt et al.,1985), y Glycine max L (Tolley y Raper, 1986). Las plantas del tratamiento sin nitrógenono presentaron diferencias significativas de tamaño entre hojas jóvenes y maduras. Losdatos de crecimiento observados tanto en longitud y área foliar sugieren que L. decurrensresponde significativamente a la concentración de nitrógeno (p<0,05, n = 45).
El comportamiento del crecimiento de L. decurrensrefleja una curva de crecimientosigmoidal típica de plantas anuales en la cual se destacan tres fases principales: unaexponencial, logarítmica y de senescencia excepto en las plantas que crecieron sinnitrógeno. Igualmente, señalan que el nitrógeno tiene un efecto significativo sobre el180 Artículo - Crecimiento y eficiencia fotosintética de Ludwigia decurrensWalter (Onagraceae) bajo diferentesconcentraciones de nitrógeno área foliar de L. decurrens, presentando valores significativamente más altos en compa-ración con los de las plantas del tratamiento sin nitrógeno.
EFICIENCIA FOTOSINTÉTICA (FV/FM)
Los resultados mostraron una tendencia general de incremento en la Fv/Fm cuando elsuplemento de nitrógeno es alto (Figura 3; Tabla 2). Los valores de la relación Fv/Fmfueron más bajos para las plantas del tratamiento sin nitrógeno en comparación con lasplantas de los tratamientos control y doble nitrógeno. Este hecho pudo estar asociadocon la habilidad de la planta para optimizar su capacidad fotosintética por un incre-mento en el suplemento de nitrógeno. De acuerdo con Cechin y de Fátima-Fumis(2004), la actividad fotosintética en girasoles mejoró con el aumento en la concen-tración de nitrógeno relacionada a su vez con la acumulación de nitrógeno en la hoja.Aunque en este estudio solo se estimó la concentración de nitratos en hojas existenotros compuestos nitrogenados presentes, que pueden ser acumulados en otras partesde la planta (Lamsfus et al., 2003). En lechuga, Broadley et al.(2000) encontraron quela deficiencia de nitrógeno causa respuestas de estrés en las plantas, incluyendo ladisminución en el peso relativo de la hoja por incremento de la alocación de biomasa ynitrógeno en las raíces.
Por otro lado, se ha demostrado que existe una correlación positiva entre la concen-tración de nitrógeno y la fotosíntesis para plantas C3 y C4. Una disminución en latasa fotosintética bajo condiciones de limitación de nitrógeno es atribuida a unareducción en el contenido de la clorofila y en la actividad de la Rubisco (Correia et al.,2005). Según Evans (1989) esta correlación no siempre es generalizada y puede servariable por efectos del hábitat natural de la planta y factores ambientales como latemperatura y la radiación. En plantas de maíz, se han encontrado resultados similares, en donde el suministro de nitrógeno no tiene un efecto definido sobre los fotosistemas de las plantas (Trapáni et al., 1999). Igualmente, se ha evidenciado una disminución en la actividad fotosintética de las plantas que crecen a altos niveles de nitrógeno indicando que la tasa de asimilación por unidad de clorofila puede inhibirse con un aumento en el suplemento de nitrógeno (Toth et al., 2001). Los resultados registrados en L. decurrens indicaron que la relación entre los niveles de nitrógeno, en especial un suministro bajo de nitrógeno, redujeron la tasa máxima de fotosíntesis neta por unidad de área foliar. A pesar de que la deficiencia de nitrógeno indujo la disminución en la eficiencia quántica del PSII (Lu et al., 2001), los resultados encontrados en este estudio mostraron que la eficiencia fotosintética (Fv/Fm) mantuvo una alta eficiencia quántica en todos los tratamientos. El comportamiento de la Fv/Fm sugiere además que pudieron existir otros factores diferentes al suministro de nitrógeno que afectaron la actividad fotoquímica del PSII de la especie, especialmente en la tercera semana del periodo de observación. Se ha demostrado que el efecto de la temperatura, depende de la especie vegetal, de las condiciones naturales en las que ha crecido la planta, y las condiciones imperantes durante la medición (Martinez et al., 2004). Los incrementos de temperatura suelen incrementar las tasas fotosintéticas hasta el punto de la desnaturalización de enzimas y la destrucción del fotosistema (Evans, 1989). Comúnmente, las plantas vasculares y algas verdes saludables presentan valores de eficiencia quántica aproximados a 0,8-0,83 (Peña, 1998; Peña et al., 1999; Ospina et al., 2006). Este parámetro se usa como un indicador sensitivo de la eficiencia quántica real y potencial del PSII. Cuando los valores de Fv/Fm son menores de 0,80 significa que puede haber un daño en el aparato fotosintético por todos los factores que causan inhibición de los centros de reacción del PSII e incremento en la disipación calorífica (Gemel et al., 1997; Heinz Walz, 1999). Los resultados mostraron que a pesar de la tendencia general del incremento de Fv/Fm con el suplemento de nitrógeno, no se evidenció una limitación nutricional que haya influido directamente en la eficiencia quántica de la planta.
Los resultados obtenidos para evaluar el efecto del nitrógeno en el crecimiento y lasrespuestas fisiológicas de la planta sugieren que la actividad fotoquímica del Foto-sistema II no depende exclusivamente de la disponibilidad de nitrógeno, aunque unadeficiencia en este elemento afecta directamente el contenido de la clorofila y por endela tasa efectiva de crecimiento de la planta. El comportamiento general del incrementode los parámetros de crecimiento de la planta (longitud del tallo y el área foliar) y surelación con las concentraciones de nitrógeno evaluadas, permiten proponer a L.decurrensa como una especie indicadora de ambientes ricos en nitrógeno. Se reco-mienda para estudios futuros la realización de análisis simultáneos de contenido declorofila y nitrógeno foliar periódicos para tener una estimación directa de la res-puesta a nivel de los centros de reacción y su efecto como factor limitante de la activi-dad fotosintética de la especie.
AGRADECIMIENTOS
El estudio se realizó en el marco del proyecto "Modelación de los mecanismos involu-crados en la transformación y remoción de nutrientes y materia orgánica en humedalesartificiales superficiales para el tratamiento de aguas residuales domésticas" código1106-12-1385 de Colciencias. Los autores agradecen al Departamento de Biología dela Universidad del Valle, por su colaboración en el apoyo logístico del estudio. Un reco-nocimiento especial a las siguientes personas: Janine Herrera, Andrés Felipe Montaño yNéstor Paz por su colaboración en el desarrollo metodológico de los experimentos.Aleyda Acosta por su apoyo en la edición final del manuscrito.
BIBLIOGRAFÍA
BAKER AJM, BROOKS RR. Terrestrial higher plants which hyperaccumulatemetallic elements-a review of their distribution, ecology and phytochemistry.Biorecovery. 1989;1:81-126. [ Links ]
BROADLEY MR, ESCOBAR-GUTIERREZ AJ, BURNS A, BURNS G. What are theeffects of nitrogen deficiency on growth components of lettuce?. New Phytol.2000;147:519-526 [ Links ]
CECHIN C, DE FÁTIMA-FUMIS T. Effect of nitrogen supply on growth and photo-synthesis of sunflower plants grown in the greenhouse. Plant Sci. 2004;166:1379-1385. [ Links ]
CIOMPI S, GENTILI E, GUIDI L, SOLDATINI GF. The effect of nitrogen deficiency on leaf gas exchange and chloropyll fluorescence parameters in sunflower. Plant Sci. 1996;118:177-184. [ Links ]
CORREIRA CM, MOUTHINO-PEREIRA JM, COUTINHO FJ, BJÖRN LO, TORRES-PEREIRA JMG. Ultraviolet-B radiation and nitrogen affect the photosynthesis of maize: a Mediterranean field study. Eur J Agronomy. 2005;22:337-347. [ Links ]
EVANS JR. Photosynthesis and nitrogen relationship in leaves of C3 plants. Oecología. 1989;78: 9-19. [ Links ]
GEMEL J, WATERS-EARHART B, ELLERSIECK MR, ASFAW A, KRAUSE GF, PURI V, LOWER WR. Photosynthetic electron transport as a bioassay. En: Wang W, Gorsuch WJ, Hughes JS, editors. Plants for environmental studies. Nueva York. CRC Press LLC; 1997. p. 209-224. [ Links ]
HEINZ W. Phtosynthesis Yield Analizer Mini-PAM: Portable chlorophyll fluorometer, handbook of operation. Heinz Walz GmbH. Alemania; 1999. [ Links ]
HOAGLAND DR, ARNON DI. The culture method for growing plants without soil. Calif Agr Exp Circle. 1950;347:1-32. [ Links ]
HUNT R, WEBER J, GATES D. Effects of Nitrate Application on Amaranthus powellii Wats. III. Optimal Allocation of Leaf Nitrogen for Photosynthesis and Stomatal Conductance. Plant Physiol. 1985;79:619-624. [ Links ]
ICONTEC. Norma colombiana NTC 282, primera revisión; 1981. [ Links ]
LAMSFUS C, LASA B, APARICIO PM, IRIGOYEN I. Implicaciones ecofisilógicas y agronómicas de la nutrición nitrogenada. En: Reigosa MJ, Pedrol N, Sanches-Moreiras A, editores. La ecofisiología vegetal: Una ciencia de síntesis. España. Paraninfo S.A.; 2003. p. 361-386. [ Links ]
LATTANZI FA, SCHNYDER H, THORNTON B. The Sources of Carbon and Nitrogen Supplying Leaf Growth. Assessment of the Role of Stores with Compartmental Models. Plant Physiol. 2004;137: 383-395 [ Links ]
LU C, ZHANG J, ZHANG Q, LI L, KUANG T. Modification of photosystem II photochemistry in nitrogen deficient maize and wheat plants. J Plant Physiol. 2001;158:1423-1430. [ Links ]
MAKINO A, OSMOND B. Effects of Nitrogen Nutrition on Nitrogen Partitioning between Chloroplasts and Mitochondria in Pea and Wheat. Plant Physiol. 1991;96:355-362. [ Links ]
MARTINEZ R, PEREZ P, MORCUENDE R. Interactive effects of elevated CO2 temperature and nitrogen on photosynthesis of wheat grown under temperature gradient tunnels. Environ Exp Bot. 2004;54:49-59. [ Links ]
MAXWELL K, JONHSON GN. Chlorophyll fluorescence-a practical guide. J Exp Bot. 2000;51(345):659-668. [ Links ]
McKEON C, GLENN E, MOORE D, WAUGH W. Phytoremediation of Nitrate Contaminated Groundwater by Desert Phreatophytes. Department of Energy under DOE contract no. DE-AC13-96GJ87335. USA; 2001. [ Links ]
MUNZ PA. Onagraceae. En: Flora de Ecuador. Opera Botánica 141 ser. B No. 3; 1974. [ Links ]
OSPINA N, PEÑA E, BENITEZ R. Efecto de la salinidad en la capacidad de bioacumulación de plomo en el alga verde Rhizoclonium riparium (Roth) Harvey (Chlorophyceae, Cladophorales). Actual Biol. 2006;28(84):17-25. [ Links ]
PEÑA EJ. Physiological ecology of mangrove associated macroalgae in a tropical estuary [Tesis doctoral]. Estados Unidos. University of South Carolina; 1998. [ Links ]
PEÑA EJ, ZINGMARK R, NIETCH C. Comparative photosynthesis of two species of epithic macroalgae on mangrove roots during submersion and emersion. J Phycol. 1999;35:1206-1214. [ Links ]
RASKIN I, KUMAR N, DUSHENKOV V, SALT DE. Bioconcentration of heavy metals by plants. Curr Opin Biotechnol. 1994;5:285-290. [ Links ]
REIGOSA M, PEDROL N, SÁNCHEZ A. La ecofisiología Vegetal. Una ciencia de síntesis. Universidad del Vigo. Editorial Thomson; 2003. [ Links ]
SANCLEMENTE MA. Evaluación del crecimiento y la eficiencia fotosintética de la macrófita emergente Ludwigia decurrens bajo diferentes condiciones de nitrógeno a nivel de laboratorio [trabajo de grado]. Cali-Colombia: Departamento de Biología, Facultad de ciencias, Universidad del Valle; 2005. [ Links ]
SHINY KJ, REMANI KN, JALAJA TK, SASIDHARAN VK. Removal of Chromium by two aquatic pteridophytes. J Environ Sci Eng. 2004;46(3):249-251. [ Links ]
SIMPSON R, LAMBERS H, DALLING M. Nitrogen Redistribution during Grain Growth in Wheat (Triticum aestivum L.): IV. Development of a Quantitative Model of the Translocation of Nitrogen to the Grain. Plant Physiol. 1983;71:7-14. [ Links ]
STATSOFT INC. Statistica, versión 5.1. Estados Unidos; 1997. [ Links ]
SWANK J, BELOW F, LAMBERT R, HAGEMAN R. Interaction of Carbon and Nitrogen Metabolism in the Productivity of Maize. Plant Physiol. 1982;70:1185-1190. [ Links ]
TAIZ L, ZIEGER E. Plant Physiology. 3 ed. Estados Unidos: Sinauer Associaltes, Inc.; 1998. [ Links ]
TOLLEY L, RAPER D. Utilization of Ammonium as a Nitrogen Source : Effects of Ambient Acidity on Growth and Nitrogen Accumulation by Soybean. Plant Physiol. 1986;82:54-60. [ Links ]
TOTH VR, MESZAROS I, VERES S, NAGY J. Effects of the available nitrogen on the photosynthetic activity and xanthophyll cycle pool of maize in field. J Plant Physiol. 2002;159:627-634. [ Links ]
TRAPÁNI N, HALL AJ, WEBER M. Effects of constant and variable nitrogen supply on sunflower (Helianthus annuss L.) leaf cell number and size. Ann Bot. 1999;84:599-606. [ Links ]
VOLENEC JJ, OURRY A, JOERN BC. A role for nitrogen reserves in forage regrowth and stress tolerance. Physiol Plant. 1996;97:185-193. [ Links ]
VOS J, BIEMOND H. Effects of nitrogen on development and growth of the potato plant. 1. Leaf appareance, expansion growth, life spans of leaves and stem branching. Ann Bot. 1992;70:27-35. [ Links ]
WALLEY F, YATES T, GROENIGEN JV, KESSEL CHV. Relationships Between Soil Nitrogen Availability Indices, Yield, and Nitrogen Accumulation of Wheat. Soil Sci Soc Am J. 2002;66:1549. [ Links ]
WALTER T. Flora Caroliniana Walter, secundum; 1788. [ Links ]














