Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.13 no.2 Bogotá May./Aug. 2008
NUEVAS VÍAS DE PERMEABILIDAD Y REGULACIÓN DEL pH INTRACELULAR COMO POSIBLES BLANCOS TERAPÉUTICOS EN Plasmodium falciparum
The New Permeability Pathways And Cytosolic pH: Targets For Antimalarial Agents On Plasmodium falciparum
MARY LUZ LÓPEZ1*, M.Sc; CESAR SEGURA LATORRE1, Dr.Sc.
1Grupo Malaria, Universidad de Antioquia, Sede de Investigación Universitaria-SIU, Calle 62 # 52-59, laboratorio 610. Medellín Colombia. Teléfono/Fax (574) 219 64 87. *Autor responsable: Cesar Segura, cesar.segura@siu.udea.edu.co
Presentado 4 de diciembre de 2007, aceptado 2 de marzo de 2008, correcciones 11 de abril de 2008.
RESUMEN
Actualmente, existe una necesidad sentida para el desarrollo de nuevos fármacos antimaláricos o de compuestos conocidos dirigidos contra blancos terapéuticos diferentes a los afectados por los medicamentos usuales. Son diversos los blancos que pueden ser aprovechados en Plasmodium, y la alteración de parámetros fisiológicos como el pH y el transporte de solutos pueden explicar la muerte del parásito cuando se usan compuestos antiplasmodiales, lo que representa una opción para el desarrollo de nuevas alternativas antiparasitarias. El propósito de esta revisión es por tanto, proporcionar una visión general de los efectos causados por esteroides, discutiendo el caso específico de los esteroides antiplasmodiales aislados de Solanum nudum y revisar dos procesos fisiológicos importantes en el parásito como posibles blancos terapéuticos, la modificación de permeabilidad del eritrocito infectado y el mantenimiento del pH intracelular de Plasmodium.
Palabras clave: Plasmodium falciparum, antimaláricos, membranas biológicas, pH citoplasmático.
ABSTRACT
In malaria, attention has been posed to search or develop new antimalarial drugs or their modifications against different therapeutic targets in P. falciparum. Therapeutic targets such physiological parameters and solute transport have been proposed to kill the parasite and they represent an option for development of new drugs. We present a review on the effects of steroids, in particular the antiplasmodial steroids isolated from Solanum nudum, stressing two physiological Plasmodium processes such as the new permeability pathways on the infected red blood cells and the cytosolic pH regulation.
Key words: Plasmodium falciparum, antimalarial drugs, biological membranes, cytosolic pH.
INTRODUCCIÓN
La malaria es una enfermedad causada por parásitos del género Plasmodium, con cuatro especies que infectan al hombre: Plasmodium vivax, Plasmodium falciparum, Plasmodium ovale y Plasmodium malariae. El parásito tiene un ciclo de vida complejo que involucra el desarrollo de la fase sexual en un mosquito vector del género Anopheles; y la fase asexual que ocurre en el humano, inicialmente en el hígado y luego en sangre periférica. Los parásitos en circulación invaden los glóbulos rojos iniciando la fase eritrocítica asexual o se diferencian en gametocitos, forma infectante para la hembra de Anopheles (Bannister y Mitchell, 2003). La malaria constituye un problema de salud pública en varias regiones del mundo, con un reporte anual de 300 millones de enfermos y 1 a 2 millones de muertes; en América se presentan cerca de 1.14 millones de enfermos (OPS/OMS, 2001) y en Colombia al año se reportan más de 100.000 casos de los cuales casi 40% son causados por P. falciparum (Minprotecciónsocial, 2004). Sumado al alto número de casos, se reporta un incremento en las fallas terapéuticas in vivo y la resistencia in vitro de P. falciparum a los antimaláricos usados actual-mente, como cloroquina (CQ), amodiaquina (AQ), quinina (Q), mefloquina (MQ) y sulfadoxina/pirimetamina (SDXP), con extensión a regiones donde antes no se presentaba (Carmona et al., 2006). Por esto, en la actualidad es necesario el desarrollo de nuevos productos farmacológicos con actividad antimalárica, ya sean análogos sintéticos de los ya existentes o compuestos aislados de plantas medicinales. Las plantas usadas por la medicina tradicional para el tratamiento de la malaria constituyen una fuente para la producción de nuevos compuestos antimaláricos (Caniato y Puricelli, 2003), ya que existen antecedentes del aislamiento de compuestos activos altamente efectivos contra P. falciparum como la quinina, un alcaloide aislado en 1820 de la planta Cinchona spp. (Rubiaceae; O’Neill et al., 1998; Tilley et al., 2001). También está la artemisinina o quinghaosu, un antimalárico de tipo sesquiterpeno lactona altamente efectivo en malaria complicada, que se aisló de la planta Artemisia annua (Compositae), usada por la medicina tradicional china por más de 2.000 años para el tratamiento de la fiebre (Haynes y Krishna, 2004). De ambos compuestos se han derivado análogos semisintéticos que son usados actualmente para el tratamiento de la malaria (WHO, 2001). Igualmente, se han reportado compuestos antimaláricos con una naturaleza química heterogénea, que pueden actuar en diver-sos blancos terapéuticos del parásito. El propósito de esta revisión es ofrecer una visión general de los efectos causados por esteroides, discutiendo el caso específico de los esteroides antiplasmodiales aislados de Solanum nudum y revisar dos procesos fisiológicos importantes en el parásito como posibles blancos terapéuticos, la modificación de la permeabilidad del eritrocito infectado y el mantenimiento del pH intracelular en Plasmodium.
GENERALIDADES DE ESTEROIDES
Los esteroides forman un grupo importante de compuestos hidrocarbonados basados en una estructura cíclica conocida como ciclopentanoperhidrofenantreno o esterano (Fig. 1A) y son clasificados como triterpenos modificados derivados del esqualeno. El núcleo esteroidal tiene generalmente grupos metilo en las posiciones C10 y C13, además algunos pueden tener una cadena lateral alquilo en el C17 (Fig. 1B). Por tanto, un amplio número de moléculas hacen parte del grupo de los esteroides, entre ellos los esteroles (colesterol, fitoesteroles y ergosterol); las saponinas esteroidales y triterpenoides (formadas por un esqueleto aglicano conocido como sapogenina al cual se une un azúcar); los alcaloides esteroidales o glicoalcaloides, que incluyen un átomo de nitrógeno en la estructura cíclica o en las cadenas laterales; el grupo de las hormonas esteroideas, dividido en hormonas sexuales (estrógenos, progesterona y andrógenos), y en corticosteroides (cortisona y aldosterona). Adicionalmente se encuentran otros grupos de compuestos esteroidales como brassinosteroides, bufadienolidas, cardenolidas, ecdisteroides y los withasteroides. Los compuestos esteroidales, en general, pueden presentar un amplio rango de efectos biológicos importantes en diferentes modelos celulares dadas sus características anfipáticas, efectos que van desde la inserción en la bicapa lipídica (efectos no genómicos) hasta efectos intracelulares (genómicos), actuando sobre una variedad de vías metabólicas importantes para la célula, lo que hace que estas moléculas tengan potencial quimioterapéutico, actividad que se ha evaluado en células tumorales y en protozoos como Tripanosomátidos y en Apicomplexa.
ACTIVIDAD ANTIPARASITARIA DE ESTEROIDES
Se ha reportado la actividad in vitro contra P. falciparum de análogos del colesterol (aislados de plantas y sintéticos) como lupeol, ácido betulínico y compuestos relacionados (Ziegler et al., 2002; Ziegler et al., 2004). La actividad antiparasitaria de este grupo de compuestos incluye, entre otros, alcaloides esteroidales aislados de la familia Solanaceae como α-tomatina, α-solanina, α-solamargina activos contra Trypanosoma cruzi (Kayser et al., 2003), que alteran la morfología de la mitocondria y glicosomas (Chataing et al., 1998). Las saponinas triterpenoides, glinosidas A y B, aisladas de Glinus oppositifolius activas contra P. falciparum (Traore et al., 2000). Las withanolidas aisladas de Dunalia brachyacantha y Physalis angulata (Solanaceae), activas contra T. cruzi y Leishmania (Bravo et al., 2001; Nagafuji et al., 2004). Los azaesteroles, 22,26-azaesterol y 24,25-(R,S)-epiminolanosterol, actúan contra Toxopasma gondii, Leishmania spp. y T. cruzi (Dantas-Leite et al., 2004; Lorente et al., 2004), mediante la inhibición de síntesis de ergosterol por acción en la enzima Δ24(25)-esterol metiltransferasa (24-SMT), además alteran significativamente la ultraestructura de estos parásitos principalmente membrana plasmática y mitocondria.
En el grupo de hormonas adrenales (corticosteroides) y compuestos análogos, se encuentran la 16-α-bromoepiandrosterona y dehidroepiandrosterona (DHEA), activas contra cepas Cloroquina (CQ) y Mefloquina (MQ) resistentes de P. falciparum y P. berghei (Freilich et al., 2000), posiblemente actúan por tres vías: por la estimulación de fagocitosis de eritrocitos parasitados con anillos de P. falciparum que exponen fosfatidilserina (PS; Ayi et al., 2002), por la inhibición de la actividad enzimática glucosa-6-fosfato deshidrogenasa (G6PD) y la disminución de glutatión reducido (GSH) en el parásito (Safeukui et al., 2004). Se ha reportado que hormonas adrenales pueden afectar el crecimiento y desarrollo de P. falciparum, el tratamiento con cortisol aumenta el número y tamaño de los gametocitos (Maswoswe et al., 1985) mientras que la 16-α-androsterona inhibe el crecimiento del parásito (Freilich et al., 2000). Igualmente hormonas sexuales como estradiol, progesterona y testosterona aumentan el número de gametocitos in vitro de P. falciparum (Lingnau et al., 1993). Además como se discutirá más adelante, en nuestro grupo se han aislado varios compuestos esteroidales de la planta Solanum nudum, que tienen actividad contra Plasmodium sp. (Sáez et al., 1998; Blair et al., 2001; Echeverri et al., 2001; Pabón et al., 2002; Blair y Madrigal, 2005; Arango et al., 2006; Londono et al., 2006) y T. cruzi (Pabón et al., observaciones no publicadas).
ESTUDIOS CON ESTEROIDES DE Solanum nudum
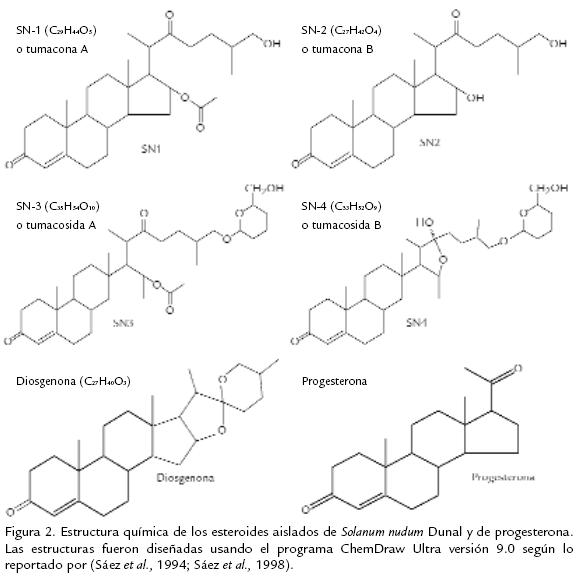
En el Grupo Malaria de la Universidad de Antioquia se ha trabajado desde 1990 en la búsqueda de nuevos antimaláricos a partir de plantas utilizadas por la medicina tradicional en Colombia. El grupo ha identificado y aislado seis nuevos compuestos esteroidales de la planta Solanum nudum Dunal de la familia Solanaceae, conocida como “zapata”, la cual es utilizada para el tratamiento de enfermedades febriles por los curanderos del municipio de Tumaco (Colombia; Sáez et al., 1998; Blair et al., 2001; Blair y Madrigal, 2005). De los compuestos aislados (Fig. 2), cuatro son del tipo coleste-4-ene-3,22-dionas, estructura química similar a la progesterona, denominados tumacona A (SN1) (C29H44O5), tumacona B (SN2) (C27H42O4), tumacosida A (SN3) (C35H54O10) y tumacosida B (SN4) (C33H52O9); una furostenona, denominada tumaquenona (SN5) (C33H52O9), y la diosgenona (C27H40O3) (Sáez et al., 1994; Sáez et al., 1998). Los esteroides de S. nudum son activos in vitro contra la cepa FCB-2 de P. falciparum resistente a cloroquina, con un porcentaje promedio de inhibición del crecimiento hasta de 71%, con valores de IC50 entre 21 y 125,5 µM (Pabón et al., 2002). Igualmente, estos esteroides son activos contra formas exoeritrocíticas (fase hepática) de P. vivax, modelo en el que se encontró que SN2 (47%) y SN4 (39,1%) inhiben el desarrollo de trofozoítos hepáticos durante 24 horas de cultivo, respectivamente (Londono et al., 2006). Ratones infectados con P. berghei cepa ANKA tratados con diosgenona acetilada, SN3 y un extracto acuoso vía oral presentaron una disminución de la parasitemia en 84%, 62% y 75%, respectivamente (Echeverri et al., 2001). Además, SN2 bloquea la esporogonia de P. vivax en Anopheles albimanus, con disminución de 90% en la cantidad de mosquitos infectados y de 60% en el promedio de ooquistes por mosquito (Arango et al., 2006). Recientemente se encontró que los compuestos de S. nudum son activos contra T. cruzi (Pabon et al., observaciones no publicadas).
Además se reportó que estos no inducen mutagénesis (Pabón et al., 2003), clastogénesis (Alvarez et al., 2004) ni citotoxicidad en hepatocitos (Londono et al., 2006) o actividad hemolítica (López, 2005), lo que sugiere que los compuestos podrían ser seguros y demuestran su potencial como antimaláricos. Entre los acercamientos para evaluar posibles mecanismos de acción de estos compuestos y teniendo en cuenta que previamente se ha reportado la alteración morfológica de los eritrocitos normales por antimaláricos análogos de colesterol (Ziegler et al., 2002; Ziegler et al., 2004), se evaluó el efecto de los SNs en la morfología del eritrocito y la membrana plasmática como mecanismo de acción indirecto. Se encontró que tales compuestos no alteran cualitativamente la asociación de proteínas como estomatina, flotilina-1 y flotilina-2/ESA a los microdominios de membrana de eritrocitos normales y parasitados con P. falciparum (López, 2005; López et al., observaciones no publica-das). Igualmente, se observó que los compuestos SN2 y diosgenona no alteran la ultraestructura de eritrocitos normales (López et al., observaciones no publicadas).
Por otra parte, se encontró que los compuestos de S. nudum pueden afectar la lisis inducida por sorbitol en los eritrocitos parasitados con P. falciparum. De cinco compuestos evaluados, SN2 y SN4 inhibieron este ingreso significativamente (> 80%) y dependiente de concentración, con valores de IC50 para hemólisis en sorbitol de 16,18 µM SN2 y 20,9 µM SN4, respectivamente, sugiriendo que posiblemente los compuestos SNs tienen actividad en las nuevas vías de permeabilidad inducidas por P. falciparum en eritrocitos. En contraste, los compuestos SNs no inducen actividad hemolítica en eritrocitos no infectados (López, 2005; López et al., observaciones no publicadas). Los resultados entonces sugieren que la actividad antiplasmodial puede ser explicada en parte por la inhibición de mecanismos de transporte inducidos por el parásito.
INFECCIÓN DEL ERITROCITO POR Plasmodium falciparum: INDUCCIÓN DE NUEVAS RUTASDE PERMEABILIDAD (NPP)
Se conoce que el eritrocito es esencial para la supervivencia de Plasmodium y la integridad de su membrana es necesaria para el adecuado crecimiento del parásito. Como consecuencia de la invasión del glóbulo rojo, se presentan cambios en la composición lipídica de la membrana; con disminución en la cantidad relativa de esfingomielina (47%) y la relación colesterol/fosfolípidos (55%). Simultáneamente, Plasmodium exporta a la membrana eritrocitaria proteínas como PfEMP (proteína de membrana del eritrocito) que actúan como ligandos de receptores en la membrana endotelial y favorecen el secuestro de formas maduras en microcirculación, evitando la depuración de glóbulos rojos parasitados en el bazo (Kirk, 2001). Como consecuencia de la invasión, aumenta la tasa metabólica del eritrocito infectado, con cambios en la permeabilidad de la membrana que permiten el ingreso de solutos necesarios para el desarrollo del parásito, la remoción de productos de desecho, la regulación del volumen celular y/o modificación de la concentración de iones en el citosol del eritrocito (Staines et al., 2001). Este aumento en la permeabilidad se ha atribuido a la(s) nueva(s) vía(s) de permeabilidad, conocidas como NPPs (del inglés New permeability pathways), que son inducidas por el parásito en la célula hospedera (Kirk et al., 1994; Staines et al., 2004b; Thomas y Lew, 2004; Staines et al., 2005). La naturaleza de NPP es aún objeto de debate y para su caracterización se han empleado diferentes metodologías (Kirk, 2001; Ginsburg y Stein, 2004): el influjo de solutos radiomarcados o fluorescentes (Kirk et al., 1994), hemólisis isosmótica (Kirk et al., 1994) y más recientemente mediante técnicas electrofisiológicas como patch-clamp aplicadas inicialmente por el grupo de Desai (Desai et al., 1993). Con las dos primeras técnicas se logró establecer que la permeabilidad del eritrocito infectado aumenta entre las primeras 12 y 15 horas después que el parásito invade el glóbulo rojo, es insaturable en presencia de diversos solutos; no es estereoselectivo, pero presenta preferencias para el transporte de aniones principalmente cloro y permite el paso de solutos de diversa naturaleza química hasta de un tamaño de 10-11 Å, entre los que se encuentran monosacáridos (sorbitol, manitol), aminoácidos, nucleósidos, lactato, ácido pantoténico y amonio cuaternario (Kirk et al., 1994; Staines et al., 2004b; Thomas y Lew, 2004; Staines et al., 2005). Los diferentes enfoques realizados por los cuatro grupos que trabajan en la caracterización de NPP (Desai et al., 2000; Egee et al., 2002; Huber et al., 2002; Verloo et al., 2004), han permitido aclarar que esta ruta se comporta como un canal selectivo para Cl-por lo que se ha denominado canal aniónico de superficie de eritrocito (PSAC) y se ha propuesto como responsable de una única vía de amplia especificidad de permeabilidad inducida en la infección por Plasmodium. En los eritrocitos infectados también se inducen otras vías dependientes de voltaje como la denominada OR (outwardly rectifying), que es derivada posiblemente de canales aniónicos endógenos del eritrocito y que se presenta con la misma frecuencia que PSAC. Los canales tipo OR tienen una alta permeabilidad relativa para lactato similar a PSAC (Huber et al., 2005), se ha especulado que OR se origina a partir de PSAC, aunque PSAC y OR difieren en su selectividad sugiriendo que funcionalmente son diferentes. A pesar de estos esfuerzos aún existe controversia sobre el número y tipos de canales que conforman NPP. Los hallazgos sugieren la participación de otros canales para iones y osmolitos orgánicos; canales de cloro denominados ClC-2, que es activado por cambios en el volumen celular; y un canal catiónico no selectivo permeable para Ca2+. En resumen, se propone que además de los anteriormente mencionados, los factores que contribuyen a la inducción de permeabilidad tipo NPP en el eritrocito infectado con P. falciparum son: la presencia de xenoproteínas codificadas por el parásito que serían las responsables de la actividad iónica de NPP (Alkhalil et al., 2004); activación por fosforilación de canales endógenos dependientes de proteína kinasa A (PKA), puesto que se ha observado activación de la actividad aniónica por PKA e inhibición por fosfatasas (Egee et al., 2002); activación de canales inducidos por lipoperoxidación de membranas (Huber et al., 2002); activación de canales por señalización purinérgica, con estimulación de permeabilidad para aniones y cationes por ATP en eritrocitos normales oxidados y en infectados por P. falciparum (Tanneur et al., 2006). Hasta el momento las evidencias sugieren que los canales aniónicos de superficie de eritrocito (PSAC) pueden ser estimulados por la infección por Plasmodium, y que las vías de señalización que los inducen son similares a las presentes en células nucleadas para activar canales aniónicos y de osmolitos orgánicos durante la regulación del volumen celular (Strange et al., 1996). Teniendo en cuenta la presencia de NPP en glóbulos rojos parasitados y su importancia en el ingreso de nutrientes al parásito, esta vía se ha postulado como blanco terapéutico promisorio (Krishna et al., 2002; Baumeister et al., 2003; Go et al., 2004; Kang et al., 2005). Existen reportes que indican que compuestos químicamente diversos ejercen parcialmente su actividad antiplasmodial por efectos sobre NPP, algunos de ellos son la furosemida y análogos (Staines et al., 2004a), 5-nitro-2-(3-fenilpropilamino) ácido benzoico (NPPB) y derivados (Kirk y Horner, 1995), glibenclamida, niflumato (Kirk et al., 1994), biotina (Baumeister et al., 2003), chalconas (Go et al., 2004) y recientemente dantrolene y sus análogos (Kang et al., 2005; Lisk et al., 2006). Sin embargo, ninguno de estos compuestos como ocurre con glibenclamida (inhibe ATPasa sensible a K+), furosemida (inhibe el transporte de cloro, disminuyendo su especificidad en NPP), niflumato o NPPB, inhibe completamente las corrientes totales de eritrocitos co mo medida de NPP (Desai et al., 2000) o la hemólisis en sorbitol inducida por el parásito (Huber et al., 2002), posiblemente porque son inhibidores inespecíficos que también afectan otro tipo de canales y transportadores encontrados en el eritrocito de ahí la importancia de caracterizar mejor la inhibición de PSAC como blanco terapéutico y desarrollar compuestos que sean altamente específicos para el mismo. Previamente se reportó que PSAC es afectado por el dantrolene, un fármaco de uso clínico como bloqueador de canales iónicos, y algunos de sus derivados (NPF-1 y NPF2; Kang et al., 2005). Estos inhiben la hemólisis en sorbitol inducida por el parásito y las corrientes de Cl-en eritrocitos parasitados y al parecer son específicos de especie pues no inhiben canales iónicos similares en Caenorhabditis elegans ni en Xenopus laevis (Kang et al., 2005). Estudios con este compuesto indican que alteran la transición al estado abierto de PSAC sin afectar el tiempo de apertura del mismo, sugiriendo una inhibición por interacción electrostática que es poco específica con residuos cargados de la cara extracelular de PSAC que imposibilitan su cambio conformacional (Lisk et al., 2006), favoreciendo también su uso para estudios de transporte en eritrocitos parasitados. Actualmente, la utilidad del dantrolene como antimalárico esta siendo estudiada. Adicional al uso de NPP como blanco terapéutico para varios fármacos también se ha propuesto que estas nuevas vías de permeabilidad pueden servir como rutas selectivas para la liberación de compuestos citotóxicos para el parásito, dadas las propiedades únicas que presenta NPP, tema que ha sido ampliamente revisado (Kirk, 2004; Staines, 2005). Un ejemplo de ello son los trabajos realizados por Gero et al. quienes sintetizaron dímeros difosfato dinucleósido (isómero óptico L) conjugados con compuestos antiplasmodiales conocidos como 5’-flurouridina que son altamente tóxicos para Plasmodium pero no ingresan a células no infectadas (Gero et al., 2003).
EFECTO DE ESTEROIDES SOBRE MEMBRANAS BIOLÓGICAS
Se han propuesto modos de acción diferentes a los efectos nucleares para los esteroides, entre los que se propone la inserción en las membranas biológicas con alteraciones en la integridad y función celular (Warber, 1999; Haines, 2001); inhibición de transportadores e interacciones de compuestos como los glicoalcaloides con componentes esteroidales de la membrana celular. En las células los esteroles se incorporan en la bicapa lipídica, modifican la permeabilidad para iones (Na+, K+), glucosa, agua; aumentan la rigidez y fragilidad osmótica (Haines, 2001; Ketomaki et al., 2003), y cambian la forma de la célula como se ha reportado para compuestos análogos del colesterol como lupeol, ácido betulínico y compuestos relacionados (Ziegler et al., 2002; Ziegler et al., 2004). Las avicinas, saponinas triterpenoides, pueden alterar las membranas biológicas por formación de canales en estas, los cuales son dependientes de la composición de fosfolípidos de membrana. En mitocondria, el poro formado no permite la salida de proteínas a través de la membrana externa, pero si cierran el poro VDAC impidiendo el intercambio de nucleótidos y disminuyendo el consumo de oxígeno mitocondrial, evento que altera el potencial de membrana mitocondrial y el pH del espacio intermembranal (Li et al., 2005). Los esteroides también afectan transportadores; compuestos como estigmasterol y 24-metilcolesterol estimulan la bomba H+ ATPasa de la membrana plasmática de células de maíz (Zea mays L.) mientras que el sitosterol la inhibe, con alteración del pH citoplasmático (Grandmougin-Ferjani et al., 1997). La inhibición es explicada por cambios en la composición lipídica, que inducen alteraciones en la bicapa lipídica afectando indirectamente la capacidad de la enzima para sufrir cambios conformacionales. Alternativamente, puede deberse a una interacción directa de los esteroles con la bomba H+ ATPasa, que cambian la funcionalidad de la misma (Grandmougin-Ferjani et al., 1997). Similarmente se ha reportado que el estradiol y otras hormonas sexuales se unen e inhiben la actividad de la ATPasa mitocondrial y de la bomba Na+/K+ ATPasa (Zheng y Ramirez, 1999). Diversos glicoalcaloides aislados de Solanaceas como solamargina y solasonina alteran el potencial de membrana y canales iónicos en embriones de Xenopus laevis (Blankemeyer et al., 1998). Otros como α-solanina y α-chaconina, alteran el potencial de membrana y el transporte activo de sodio en embriones de rana (Blankemeyer et al., 1992; Blankemeyer et al., 1995). Estas moléculas al igual que la α-tomatina, favorecen la pérdida de componentes celulares (iones, Ca2+ y proteínas), por desestabilización de la membrana celular (Roddick et al., 1988; Toyoda et al., 1991). Keukens et al., usando modelos de membranas, reportaron que los glicoalcaloides se insertan con su anillo aglicano en la membrana, mientras los motivos azúcar forman un complejo tipo matriz, que causa la pérdida de función de barrera de la bicapa lipídica (Keukens et al., 1995).
MANTENIMIENTO Y REGULACIÓN DE PH EN P. falciparum
pH intracelular de P. falciparum
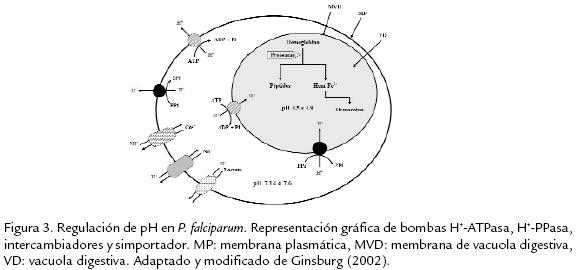
Muchos procesos metabólicos de las células son sensi-bles al pH intracelular (pHi) y variaciones en este parámetro pueden ocasionar daños celulares y cambios en la actividad enzimática (Roos y Boron, 1981), así su regulación es esencial para la supervivencia de la célula. La composición iónica de Plasmodium depende del proceso de transporte a través de tres membranas: la membrana plasmática del eritrocito, la membrana de vacuola parasitófora y la membrana plasmática del pará-sito, por tanto la alteración de las mismas puede afectar la supervivencia del parásito. En las células eucarióticas, son varios los mecanismos que ayudan a regular el pHi, entre los que están las bombas H+-ATPasa ubicadas en la membrana plasmática, como la ATPasa tipo P (P-ATPasa) que usan un intermediario acil-fosfato y las ATPasas ubicadas en membrana de vacuolas tipo V, V-ATPasa (Nelson and Harvey, 1999). Mikkelsen et al. sugirieron que en P. chabaudi el potencial de membrana plasmática y el cambio o la regulación de pH citosólico debía mantenerse a través de una bomba de protones electrogénica localizada en la membrana del parásito y propusieron como posible candidato una bomba tipo H+-ATPasa (Mikkelsen et al., 1982). Posteriormente esto fue confirmado y ahora se conoce que en Plasmodium la V-ATPasa funciona principalmente en la regulación del pH vacuolar (Saliba et al., 2003), mientras la P-ATPasa ubicada en la membrana plasmática del parásito es responsable de la regulación del pH citoplasmático del mismo (Saliba y Kirk, 1999). Adicional a estas bombas, la regulación del pH citoplasmático en Plasmodium está acoplada a la actividad de otros intercambiadores tales como Na+/H+ o Ca2+/H+ y el simporter lactato/H+, que permiten el eflujo de protones y el exceso de lactato producto de la glicólisis como principal fuente energética del parásito (Ginsburg, 2002; Fig. 3). En P. falciparum Bosia et al. reportaron la presencia de un intercambiador Na+/H+, encargado del eflujo (salida desde el citosol) de protones y del mantenimiento de pH citosólico del parásito, que es inhibido por etilisopropilamilorida (EIPA; Bosia et al., 1993). Esta inhibición fue confirmada posteriormente por fotometría de célula única con LSCM (laser scanning confocal microscopy; Wunsch et al., 1998). Posterior-mente, Saliba y Kirk usando parásitos aislados de la cepa de P. falciparum FAF-6 resistente a cloroquina (CQR) encontraron que la medición basal de pHi (7,29 ± 0,01; n=10) y la recuperación del mismo después de la acidificación del citoplasma, son independientes de la presencia de Na+ en el medio, indicando posiblemente la intervención de un transportador diferente al intercambiador Na+/H+ (Saliba y Kirk, 1999). Adicionalmente encontraron que el tratamiento con bafilomicina A1, un inhibidor específico de V-H+-ATPasa, disminuye significativamente el pHi (7,29 vs. 6,7). Estos datos concuerdan con reportes previos que soportan la idea de la presencia de una ATPasa en la membrana plasmática del parásito, la cual estaría encargada del mantenimiento de pHi como principal mecanismo de eflujo de protones desde el citosol (Saliba y Kirk, 1999). Datos que son apoyados por la clonación y caracterización de las subunidades A (Karcz et al., 1993) y B de V-H+-ATPasa en P. falciparum, que en el parásito no están confinadas únicamente a la vacuola digestiva y presentan una distribución heterogénea en el mismo (Karcz et al., 1994). Marchesini et al. mostraron la presencia de una bomba H+-ATPasa tipo V, de origen parasitario que se exporta a la membrana plasmática del eritrocito infectado y con ensayos fluorométricos y enzimáticos, los autores concluyeron que esta bomba ayuda a mantener el pH del eritrocito parasitado y permite el mantenimiento del potencial electroquímico del mismo, que sería usado para el movimiento de iones y solutos a través de la membrana eritrocitaria y que a su vez sirve para la nutrición del parásito, es decir, posiblemente estaría relacionado con PSAC por su función regulatoria del pH en la célula hospedera (Marchesini et al., 2005). Plasmodium cuenta en su membrana plasmática con bombas H+-pirofosfatasa (H+-PPasa), que han sido descritas en plantas, algunas bacterias y desde hace una década en protozoos, kinetoplastideos y apicomplexa (Luo et al., 1999; McIntosh et al., 2001), tales bombas usan la energía libre de puentes fosfoanhidro para el transporte de protones, generando un potencial electroquímico (McIntosh y Vaidya, 2002; Moriyama et al., 2003). En general, las H+-PPasas son de dos tipos: tipo I dependientes de K+ y tipo II independientes de K+. En el genoma de P. falciparum se describieron dos genes que codifican homólogos de H+ - PPasa I (PfVP1) y II (PfVP2) (McIntosh et al., 2001), datos de inmunofluorescencia indican que se localizan en la membrana plasmática del parásito (Luo et al., 1999; McIntosh et al., 2001), y posteriormente también fueron reportadas en la vacuola digestiva (Saliba et al., 2003). El pH citoplasmático de P. falciparum se ha estimado con diversas técnicas, que incluyen el análisis de células en suspensión por citometría de flujo y espectrofotometría, hasta la evaluación fluorométrica de célula única con microscopio de epifluorescencia y LSCM (laser scanning confocal microscopy), usando sondas fluorescentes indicadoras de pH, como BCECF-AM y SNARF-AM (Molecular Probes). En general el pHi estimado varia entre 7,14 y 7,6 (Wunsch et al., 1998; Saliba y Kirk, 1999; Kirk, 2001; Wissing et al., 2002; Bennett et al., 2007) según la metodología y la cepa usada. Se han reportado diferencias entre los valores de pHi para las cepas resistentes y sensibles a cloroquina (CQR y CQS; Wissing et al., 2002; Wunsch et al., 1998); sin embargo estas diferencias no son consistentes. Recientemente Bennett et al. cruzando cepas resistent es con cepas sensibles a CQ analizaron sistemáticamente el pH citoplasmático de las progenies y no encontraron diferencias entre el pH y la actividad del intercambiador Na+/H+ (PfNHE), datos que les permitieron concluir que la resistencia a las quinolinas no está relacionada con la regulación del pHi dependiente del intercambiador Na+/H+ (Bennett et al., 2007).
VACUOLA DIGESTIVA: METABOLISMO DE HEMOGLOBINA Y REGULACIÓN DE PH VACUOLAR
Metabolismo de hemoglobina: proceso crítico para el parásito
La función digestiva en Plasmodium se lleva a cabo en una organela ácida especializada denominada vacuola digestiva, donde degrada al menos 75% de la hemoglobina ingerida del eritrocito parasitado. Este proceso es mediado por proteasas de aspartato, de cisteína y una metaloproteasa de zinc, que le permiten al parásito obtener aminoácidos para la síntesis de proteínas (Francis et al., 1997). Como consecuencia de este proceso digestivo se liberan grupos hem-Fe2+ (ferroprotoporfirina IX) que son autooxidados a grupos hem-Fe3+ (ferriprotoporfirina IX), que son tóxicos para Plasmodium por formación de radicales libres de oxígeno (Atamna y Ginsburg, 1993; Taramelli et al., 1999), los que oxidan enzimas y peroxidan lípidos de membrana (Wei y Sadrzadeh, 1994; Omodeo-Sale et al., 1998). Para evitar los efectos nocivos de los grupos hem3+ libres el parásito tiene tres mecanismos: la formación de un polímero inerte llamado hemozoína, la degradación peroxidativa del hem libre y la degradación del hem libre dependiente de glutatión (Francis et al., 1997; Ginsburg et al., 1998; Loria et al., 1999). Al parecer la polimerización es favorecida por la acidez vacuolar, haciéndose más eficiente con la disminución de 0,2 a 0,4 unidades en el pH de la vacuola digestiva (Dzekunov et al., 2000; Ursos et al., 2001).
Regulación de pH en vacuola digestiva
La vacuola digestiva de P. falciparum es acidificada por dos bombas de protones, las V- H+-ATPasa y las H+-PPasas tipo I (Saliba et al., 2003), cuya función es mantener el pH de la vacuola ácido mediante un mecanismo similar al de tonoplastos (vacuolas ácidas) de células vegetales (Maeshima, 2001). Los valores de pH de vacuola digestiva (pHvd) pueden variar con la cepa del parásito y las metodologías empleadas en su determinación, y es así como se ha reportado que varía de 4,3 hasta 5,67 (Yayon et al., 1984; Krogstad et al., 1985; Geary et al., 1986; Geary et al., 1990; Dzekunov et al., 2000). Sin embargo, los datos más recientes muestran que no hay diferencias significativas entre cepas sensibles y resistentes a cloroquina, con un rango similar de pHvd entre 4,5 y 4,9 (Hayward et al., 2006). Es posible que las diferencias encontradas previamente se deban a que este parámetro puede variar según el indicador fluorescente utilizado (Saliba et al., 2003) y el uso de la naranja de acridina, un indicador comúnmente utilizado para la evaluación de organelas ácidas ha sido fuertemente cuestionado en los últimos años (Bray et al., 2002; Wissing et al., 2002).
Efecto de compuestos antiplasmodiales en el pH intracelular y vacuolar
Son diversos los compuestos con actividad antiplasmodial que tienen efecto en el pH de Plasmodium, ya sea porque tienen un efecto amortiguador dada su naturaleza química, como en el caso de la CQ, o por acción directa en la función de las bombas reguladoras de pH, como los imidazoles. El omeprazol, un conocido inhibidor específico de bombas H+-ATPasa, tiene actividad antiplasmodial in vitro, y su efecto es sinérgico con otros compuestos antimaláricos como la quinina y aditivo con la artemisinina (Skinner-Adams y Davis, 1999; Riel et al., 2002), lo que podría sugerir que la alcalinización de la vacuola digestiva de P. falciparum por estos fármacos esté relacionada con la inhibición de la H+-ATPasa (Choi y Mego, 1988; Skinner-Adams y Davis, 1999), similar a lo sugerido para otros benzimidazoles como lansoprazol, rabeprazol y pantoprazol (Riel et al., 2002). La quinina y la quinacrina inhiben parcialmente la actividad V-ATPasa encontrada en la membrana de vacuola digestiva de P. falciparum (Choi y Mego, 1988), y junto con la mefloquina han sido implicadas en la alcalinización de este organelo, aunque en concentraciones superiores a las que ejercen actividad antiplasmodial, así podría pensarse que alteraciones en el pHvd no siempre son críticas en el mecanismo de acción de las quinolinas (Krogstad et al., 1985; Ginsburg et al., 1989).
CONCLUSIONES
Las escasas alternativas terapéuticas disponibles en la actualidad para el tratamiento de la malaria, hacen necesaria la búsqueda y el desarrollo de nuevos compuestos y la caracterización de blancos terapéuticos no estudiados. Así, los compuestos esteroidales constituyen una posibilidad teniendo en cuenta su actividad antiplasmodial y que dada su naturaleza química, pueden alterar la composición de la bicapa lipídica y sus funciones a través de efectos sobre transportadores, entre otros. Son diversos los blancos que pueden ser aprovechados en Plasmodium, y dada la naturaleza química de los esteroides, sus conocidos efectos sobre la membrana y sabiendo que algunos parámetros fisiológicos como la alteración del pH citoplasmático, de vacuola digestiva del parásito y el transporte de solutos en la membrana del eritrocito hospedero dependen de la funcionalidad de la membrana, se puede proponer que estas moléculas son una opción para el desarrollo de nuevas alternativas quimioterapéuticas antimaláricas, y es en este sentido que se está trabajando en el Grupo Malaria con los esteroides antiplasmodiales aislados de S. nudum, que han mostrado tener efecto en eritrocitos parasitados pero no en aquellos no infectados. Actualmente, se trabaja en la búsqueda de los mecanismos de acción de estos compuestos en P. falciparum, con base a los efectos que pueden presentar los esteroides en los diferentes modelos biológicos.
AGRADECIMIENTOS
Este documento hace parte de una serie de trabajos que se realizan en el Grupo Malaria en el marco de la búsqueda de nuevos antimaláricos a partir de plantas utilizadas por la medicina tradicional en Colombia; dichos trabajos han sido financiados por la Universidad de Antioquia y por Colciencias a través de diversos convenios, entre ellos 1115-05-13667 y 1115-05-16877, donde participan los autores de este documento.
BIBLIOGRAFÍA
ALKHALIL A, COHN JV, WAGNER MA, CABRERA JS, RAJAPANDI T, DESAI SA. Plasmodium falciparum likely encodes the principal anion channel on infected human erythrocytes. Blood. 2004;104:4279-4286.
[ Links ]ALVAREZ G, PABÓN A, CARMONA J, BLAIR S. Evaluation of clastogenic potential of the antimalarial plant Solanum nudum. Phytother Res. 2004;18:845-848.
[ Links ]ARANGO E, LONDONO B, SEGURA C, SOLARTE Y, HERRERA S, SAEZ J, et al. Prevention of sporogony of Plasmodium vivax in Anopheles albimanus by steroids of Solanum nudum Dunal (Solanaceae). Phytother Res. 2006;20:444-447.
[ Links ]ATAMNA H, GINSBURG H. Origin of reactive oxygen species in erythrocytes infected with Plasmodium falciparum. Mol Biochem Parasitol. 1993;61:231-241.
[ Links ]AYI K, GIRIBALDI G, SKOROKHOD A, SCHWARZER E, PRENDERGAST PT, ARESE P. 16alpha-bromoepiandrosterone, an antimalarial analogue of the hormone dehydroepiandrosterone, enhances phagocytosis of ring stage parasitized erythrocytes: a novel mechanism for antimalarial activity. Antimicrob Agents Chemother. 2002;46:3180-3184.
[ Links ]BANNISTER L, MITCHELL G. The ins, outs and roundabouts of malaria. Trends Parasitol. 2003;19:209-213.
[ Links ]BAUMEISTER S, ENDERMANN T, CHARPIAN S, NYALWIDHE J, DURANTON C, HUBER S, et al. A biotin derivative blocks parasite induced novel permeation pathways in Plasmodium falciparum-infected erythrocytes. Mol Biochem Parasitol . 2003;132:35-45.
[ Links ]BENNETT TN, PATEL J, FERDIG MT, ROEPE PD. Plasmodium falciparum Na(+)/H(+) exchanger activity and quinine resistance. Mol Biochem Parasitol. 2007;153:48-58.
[ Links ]BLAIR S, MESA J, CORREA A, CARMONA J, SÁEZ J. Apertura del anillo F de la Diosgenona y actividad antimalárica de los productos de reacción. Rev Colomb Quim. 2001;30:97-107.
[ Links ]BLAIR S, MADRIGAL B. Solanaceae. In: BLAIR-TRUJILLO, S, MADRIGAL, B, editors. Plantas antimaláricas de Tumaco: Costa Pacífica Colombiana. Medellín: Editorial Universidad de Antioquia; 2005. p. 266-270.
[ Links ]BLANKEMEYER JT, STRINGER BK, RAYBURN JR, BANTLE JA, FRIEDMAN M. Effect of potato alkaloids on membrane potential of frog embryos. J Agric Food Chem. 1992;40:2022-2026.
[ Links ]BLANKEMEYER JT, ATHERTON R, FRIEDMAN M. Effect of potato glycoalkaloids a-chaconine and a-solanine on sodium active transport in frog skin. J Agric Food Chem. 1995;43:636-639.
[ Links ]BLANKEMEYER JT, MCWILLIAMS ML, RAYBURN JR, WEISSENBERG M, FRIEDMAN M. Developmental toxicology of solamargine and solasonine glycoalkaloids in frog embryos. Food Chem Toxicol. 1998;36:383-389.
[ Links ]BOSIA A, GHIGO D, TURRINI F, NISSANI E, PESCARMONA GP, GINSBURG H. Kinetic characterization of Na+/H+ antiport of Plasmodium falciparum membrane. J Cell Physiol. 1993;154:527-534.
[ Links ]BRAVO BJ, SAUVAIN M, GIMENEZ TA, BALANZA E, SERANI L, LAPREVOTE O, et al. Trypanocidal withanolides and withanolide glycosides from Dunalia brachyacantha. J Nat Prod. 2001;64:720-725.
[ Links ]BRAY PG, SALIBA KJ, DAVIES JD, SPILLER DG, WHITE MR, KIRK K, et al. Distribution of acridine orange fluorescence in Plasmodium falciparum-infected erythrocytes and its implications for the evaluation of digestive vacuole pH. Mol Biochem Parasitol. 2002;119:301-304; discussion 307-309, 311-303.
[ Links ]CANIATO R, PURICELLI L. Review: Natural Antimalarial Agents (1995-2001). CRC Crit Rev Plant Sci. 2003;22:79-105.
[ Links ]CHATAING B, CONCEPCION JL, LOBATON R, USUBILLAGA A. Inhibition of Trypanosoma cruzi growth in vitro by Solanum alkaloids: a comparison with ketoconazole. Planta Med. 1998;64:31-36.
[ Links ]CHOI I, MEGO JL. Purification of Plasmodium falciparum digestive vacuoles and partial characterization of the vacuolar membrane ATPase. Mol Biochem Parasitol . 1988;31:71-78.
[ Links ]DANTAS-LEITE L, URBINA JA, DE SOUZA W, VOMMARO RC. Selective anti-Toxoplasma gondii activities of azasterols. Int J Antimicrob Agents 2004;23:620-626.
[ Links ]DESAI SA, KROGSTAD DJ, MCCLESKEY EW. A nutrient-permeable channel on the intraerythrocytic malaria parasite. Nature. 1993;362:643-646.
[ Links ]DESAI SA, BEZRUKOV SM, ZIMMERBERG J. A voltage-dependent channel involved in nutrient uptake by red blood cells infected with the malaria parasite. Nature. 2000;406:1001-1005.
[ Links ]DZEKUNOV SM, URSOS LM, ROEPE PD. Digestive vacuolar pH of intact intraerythrocytic P. falciparum either sensitive or resistant to chloroquine. Mol Biochem Parasitol. 2000;110:107-124.
[ Links ]ECHEVERRI M, BLAIR S, CARMONA J, PÉREZ P. Effect of Solanum nudum extracts on the liver of mice infected with Plasmodium berghei. Am J Chin Med. 2001;29:477-484.
[ Links ]EGEE S, LAPAIX F, DECHERF G, STAINES HM, ELLORY JC, DOERIG C, et al. A stretch-activated anion channel is up-regulated by the malaria parasite Plasmodium falciparum. J Physiol. 2002;542:795-801.
[ Links ]FRANCIS SE, SULLIVAN DJ, JR., GOLDBERG DE. Hemoglobin metabolism in the malaria parasite Plasmodium falciparum. Annu Rev Microbiol. 1997;51:97-123.
[ Links ]FREILICH D, FERRIS S, WALLACE M, LEACH L, KALLEN A, FRINCKE J, et al. 16alpha-bromoepiandrosterone, a dehydroepiandrosterone (DHEA) analogue, inhibits Plasmodium falciparum and Plasmodium berghei growth. Am J Trop Med Hyg. 2000;63:280-283.
[ Links ]GEARY TG, JENSEN JB, GINSBURG H. Uptake of [3H]chloroquine by drug-sensitive and -resistant strains of the human malaria parasite Plasmodium falciparum. Biochem Pharmacol. 1986; 35:3805-3812.
[ Links ]GEARY TG, DIVO AD, JENSEN JB, ZANGWILL M, GINSBURG H. Kinetic modelling of the response of Plasmodium falciparum to chloroquine and its experimental testing in vitro. Implications for mechanism of action of and resistance to the drug. Biochem Pharmacol. 1990; 40:685-691.
[ Links ]GERO AM, DUNN CG, BROWN DM, PULENTHIRAN K, GOROVITS EL, BAKOS T, et al. New malaria chemotherapy developed by utilization of a unique parasite transport system. Curr Pharm Des. 2003; 9:867-877.
[ Links ]GINSBURG H, NISSANI E, KRUGLIAK M. Alkalinization of the food vacuole of malaria parasites by quinoline drugs and alkylamines is not correlated with their antimalarial activity. Biochem Pharmacol. 1989;38:2645-2654.
[ Links ]GINSBURG H, FAMIN O, ZHANG J, KRUGLIAK M. Inhibition of glutathione-dependent degradation of heme by chloroquine and amodiaquine as a possible basis for their antimalarial mode of action. Biochem Pharmacol. 1998;56:1305-1313.
[ Links ]GINSBURG H. Abundant proton pumping in Plasmodium falciparum, but why? Trends Parasitol. 2002;18:483-486.
[ Links ]GINSBURG H, STEIN WD. The new permeability pathways induced by the malaria parasite in the membrane of the infected erythrocyte: comparison of results using different experimental techniques. J Membr Biol. 2004;197:113-134.
[ Links ]GO ML, LIU M, WILAIRAT P, ROSENTHAL PJ, SALIBA KJ, KIRK K. Antiplasmodial chalcones inhibit sorbitol-induced hemolysis of Plasmodium falciparuminfected erythrocytes. Antimicrob Agents Chemother. 2004;48:3241-3245.
[ Links ]GRANDMOUGIN-FERJANI A, SCHULER-MULLER I, HARTMANN MA. Sterol modulation of the plasma membrane H+-ATPase activity from corn roots reconstituted into soybean lipids. Plant Physiol. 1997;113:163-174.
[ Links ]HAINES TH. Do sterols reduce proton and sodium leaks through lipid bilayers? Prog Lipid Res. 2001;40:299-324.
[ Links ]HAYNES RK, KRISHNA S. Artemisinins: activities and actions. Microbes Infect. 2004;6:1339-1346.
[ Links ]HAYWARD R, SALIBA KJ, KIRK K. The pH of the digestive vacuole of Plasmodium falciparum is not associated with chloroquine resistance. J Cell Sci. 2006;119:1016-1025.
[ Links ]HUBER SM, UHLEMANN AC, GAMPER NL, DURANTON C, KREMSNER PG, LANG F. Plasmodium falciparum activates endogenous Cl(-) channels of human erythrocytes by membrane oxidation. Embo J. 2002;21:22-30.
[ Links ]HUBER SM, DURANTON C, LANG F. Patch-clamp analysis of the "new permeability pathways" in malaria-infected erythrocytes. Int Rev Cytol. 2005;246:59-134. [ Links ]
KANG M, LISK G, HOLLINGWORTH S, BAYLOR SM, DESAI SA. Malaria parasites are rapidly killed by dantrolene derivatives specific for the plasmodial surface anion channel. Mol Pharmacol. 2005;68:34-40.
[ Links ]KARCZ SR, HERRMANN VR, COWMAN AF. Cloning and characterization of a vacuolar ATPase A subunit homologue from Plasmodium falciparum. Mol Biochem Parasitol. 1993;58:333-344.
[ Links ]KARCZ SR, HERRMANN VR, TROTTEIN F, COWMAN AF. Cloning and characterization of the vacuolar ATPase B subunit from Plasmodium falciparum. Mol Biochem Parasitol. 1994;65:123-133.
[ Links ]KAYSER O, KIDERLEN AF, CROFT SL. Natural products as antiparasitic drugs. Parasitol Res. 2003;90(S2):S55-62.
[ Links ]KETOMAKI AM, GYLLING H, ANTIKAINEN M, SIIMES MA, MIETTINEN TA. Red cell and plasma plant sterols are related during consumption of plant stanol and sterol ester spreads in children with hypercholesterolemia. J Pediatr. 2003;142:524-531.
[ Links ]KEUKENS EA, DE VRIJE T, VAN DEN BOOM C, DE WAARD P, PLASMAN HH, THIEL F, et al. Molecular basis of glycoalkaloid induced membrane disruption. Biochim Biophys Acta. 1995;1240:216-228.
[ Links ]KIRK K, HORNER HA, ELFORD BC, ELLORY JC, NEWBOLD CI. Transport of diverse substrates into malaria-infected erythrocytes via a pathway showing functional characteristics of a chloride channel. J Biol Chem. 1994;269:3339-3347.
[ Links ]KIRK K, HORNER HA. In search of a selective inhibitor of the induced transport of small solutes in Plasmodium falciparum-infected erythrocytes: effects of arylaminobenzoates. Biochem J. 1995;311(Pt3):761-768.
[ Links ]KIRK K. Membrane transport in the malaria-infected erythrocyte. Physiol Rev. 2001;81:495-537.
[ Links ]KIRK K. Channels and transporters as drug targets in the Plasmodium-infected erythrocyte. Acta Trop. 2004;89:285-298.
[ Links ]KRISHNA S, ECKSTEIN-LUDWIG U, JOET T, UHLEMANN AC, MORIN C, WEBB R, et al. Transport processes in Plasmodium falciparum-infected erythrocytes: potential as new drug targets. Int J Parasitol 2002;32:1567-1573.
[ Links ]KROGSTAD DJ, SCHLESINGER PH, GLUZMAN IY. Antimalarials increase vesicle pH in Plasmodium falciparum. J Cell Biol. 1985;101:2302-2309.
[ Links ]LI XX, DAVIS B, HARIDAS V, GUTTERMAN JU, COLOMBINI M. Proapoptotic triterpene electrophiles (avicins) form channels in membranes: cholesterol dependence. Biophys J. 2005;88:2577-2584.
[ Links ]LINGNAU A, MARGOS G, MAIER WA, SEITZ HM. The effects of hormones on the gametocytogenesis of Plasmodium falciparum in vitro. Appl Parasitol. 1993;34:153-160.
[ Links ]LISK G, KANG M, COHN JV, DESAI SA. Specific inhibition of the plasmodial surface anion channel by dantrolene. Eukaryot Cell. 2006;5:1882-1893.
[ Links ]LONDONO B, ARANGO E, ZAPATA C, HERRERA S, SAEZ J, BLAIR S, et al. Effect of Solanum nudum Dunal (Solanaceae) steroids on hepatic trophozoites of Plasmodium vivax. Phytother Res. 2006;20:267-273.
[ Links ]LÓPEZ ML. Efecto de los esteroles aislados de la planta S. nudum sobre la membrana del glóbulo rojo humano y el desarrollo de P. falciparum. Corporación Ciencias Básicas Biomédicas. Medellín: Universidad de Antioquia; 2005. p. 91.
[ Links ]LORENTE SO, RODRIGUES JC, JIMENEZ JIMENEZ C, JOYCE-MENEKSE M, RODRIGUES C, CROFT SL, et al. Novel azasterols as potential agents for treatment of leishmaniasis and trypanosomiasis. Antimicrob Agents Chemother. 2004;48:2937-2950.
[ Links ]LORIA P, MILLER S, FOLEY M, TILLEY L. Inhibition of the peroxidative degradation of haem as the basis of action of chloroquine and other quinoline antimalarials. Biochem J. 1999;339(Pt2):363-370.
[ Links ]LUO S, MARCHESINI N, MORENO SN, DOCAMPO R. A plant-like vacuolar H(+)-pyrophosphatase in Plasmodium falciparum. FEBS Lett 1999;460:217-220.
[ Links ]MAESHIMA M. Tonoplast transportes: Organization and Function. Annu Rev Plant Physiol Plant Mol Biol. 2001;52:469-497.
[ Links ]MARCHESINI N, VIEIRA M, LUO S, MORENO SN, DOCAMPO R. A malaria parasite-encoded vacuolar H(+)-ATPase is targeted to the host erythrocyte. J Biol Chem. 2005;280:36841-36847.
[ Links ]MASWOSWE SM, PETERS W, WARHURST DC. Corticosteroid stimulation of the growth of Plasmodium falciparum gametocytes in vitro. Ann Trop Med Parasitol. 1985;79:607-616.
[ Links ]MCINTOSH MT, DROZDOWICZ YM, LAROIYA K, REA PA, VAIDYA AB. Two classes of plant-like vacuolar-type H(+)-pyrophosphatases in malaria parasites. Mol Biochem Parasitol. 2001;114:183-195.
[ Links ]MCINTOSH MT, VAIDYA AB. Vacuolar type H+ pumping pyrophosphatases of parasitic protozoa. Int J Parasitol. 2002;32:1-14.
[ Links ]MIKKELSEN RB, TANABE K, WALLACH DF. Membrane potential of Plasmodium-infected erythrocytes. J Cell Biol. 1982;93:685-689.
[ Links ]MINPROTECCIÓNSOCIAL. Situación epidemiológica de las enfermedades transmisibles por vectores 2003-2004. Boletín epidemiológico semanal, Semana Epidemiológica No. 8, Sistema de Vigilancia en Salud Pública (SIVIGILA). Bogotá: Instituto Nacional de Salud; 2004.
[ Links ]MORIYAMA Y, HAYASHI M, YATSUSHIRO S, YAMAMOTO A. Vacuolar proton pumps in malaria parasite cells. J Bioenerg Biomembr. 2003;35:367-375.
[ Links ]NAGAFUJI S, OKABE H, AKAHANE H, ABE F. Trypanocidal constituents in plants 4. Withanolides from the aerial parts of Physalis angulata. Biol Pharm Bull. 2004;27:193-197.
[ Links ]NELSON N, HARVEY WR. Vacuolar and plasma membrane protonadenosinetriphosphatases. Physiol Rev. 1999;79:361-385.
[ Links ]O’NEILL PM, BRAY PG, HAWLEY SR, WARD SA, PARK BK. 4-Aminoquinolines-past, present, and future: a chemical perspective. Pharmacol Ther. 1998;77:29-58.
[ Links ]OMODEO-SALE F, BASILICO N, FOLINI M, OLLIARO P, TARAMELLI D. Macrophage populations of different origins have distinct susceptibilities to lipid peroxidation induced by beta-haematin (malaria pigment). FEBS Lett. 1998;433:215-218.
[ Links ]OPS/OMS. Informe de la Situación de los Programas Regionales de Malaria en las Américas. Washington: OMS; 2001; Documento CD43/INF/41.
[ Links ]PABÓN A, CARMONA J, MAESTRE A, CAMARGO M, BLAIR S. Inhibition of P. falciparum by steroids isolated from Solanum nudum. Phytother Res. 2002;16:59-62.
[ Links ]PABÓN A, BLAIR S, CARMONA J, ZULETA M, SÁEZ J. Evaluation of the mutagenicity of antimalarial products isolated from Solanum nudum (Solanaceae). Pharmazie. 2003;58:263-267.
[ Links ]RIEL MA, KYLE DE, BHATTACHARJEE AK, MILHOUS WK. Efficacy of proton pump inhibitor drugs against Plasmodium falciparum in vitro and their probable pharmacophores. Antimicrob Agents Chemother. 2002;46:2627-2632.
[ Links ]RODDICK JG, RIJNENBERG AI, OSMAN SF. Synergistic interaction between potato glycoalkaloids alpha-solanine and alpha-chaconine in relation to destabilisation of cell membranes ecological implications. J Chem Ecol. 1988;14:889-902.
[ Links ]ROOS A, BORON WF. Intracellular pH. Physiol Rev. 1981;61:296-434.
[ Links ]SÁEZ J, ESPINAL D, BLAIR S, MADRIGAL B, MARTÍNEZ A. Diosgenona natural en fracción de hexano de Solanum nudum (Solanaceae). Química, actualidad y futuro. 1994;4:35-39.
[ Links ]SÁEZ J, CARDONA W, ESPINAL D, BLAIR S, MESA J, BOCAR M, et al. Five new steroids from Solanum nudum. Tetrahedron. 1998;54:10771-10778.
[ Links ]SAFEUKUI I, MANGOU F, MALVY D, VINCENDEAU P, MOSSALAYI D, HAUMONT G, et al. Plasmodium berghei: dehydroepiandrosterone sulfate reverses chloroquino-resistance in experimental malaria infection; correlation with glucose 6phosphate dehydrogenase and glutathione synthesis pathway. Biochem Pharmacol. 2004;68:1903-1910.
[ Links ]SALIBA KJ, KIRK K. pH regulation in the intracellular malaria parasite, Plasmodium falciparum. H(+) extrusion via a V-type H(+)-ATPase. J Biol Chem. 1999;274:33213-33219.
[ Links ]SALIBA KJ, ALLEN RJ, ZISSIS S, BRAY PG, WARD SA, KIRK K. Acidification of the malaria parasites digestive vacuole by a H+-ATPase and a H+-pyrophosphatase. J Biol Chem. 2003;278:5605-5612. [ Links ]
SKINNER-ADAMS T, DAVIS TM. Synergistic in vitro antimalarial activity of omeprazole and quinine. Antimicrob Agents Chemother. 1999;43:1304-1306.
[ Links ]STAINES HM, ELLORY JC, KIRK K. Perturbation of the pump-leak balance for Na(+) and K(+) in malaria-infected erythrocytes. Am J Physiol Cell Physiol. 2001;280:C1576-1587.
[ Links ]STAINES HM, DEE BC, OBRIEN M, LANG HJ, ENGLERT H, HORNER HA, et al. Furosemide analogues as potent inhibitors of the new permeability pathways of Plasmodium falciparum-infected human erythrocytes. Mol Biochem Parasitol. 2004a;133:315-318.
[ Links ]STAINES HM, POWELL T, THOMAS SL, ELLORY JC. Plasmodium falciparuminduced channels. Int J Parasitol. 2004b;34:665-673.
[ Links ]STAINES HM, ELLORY JC, CHIBALE K. The new permeability pathways: targets and selective routes for the development of new antimalarial agents. Comb Chem High Throughput Screen. 2005;8:81-88.
[ Links ]STRANGE K, EMMA F, JACKSON PS. Cellular and molecular physiology of volume-sensitive anion channels. Am J Physiol. 1996;270:711-730.
[ Links ]TANNEUR V, DURANTON C, BRAND VB, SANDU CD, AKKAYA C, KASINATHAN RS, et al. Purinoceptors are involved in the induction of an osmolyte permeability in malaria-infected and oxidized human erythrocytes. Faseb J. 2006;20:133-135.
[ Links ]TARAMELLI D, MONTI D, BASILICO N, PARAPINI S, OMODEO-SALE F, OLLIARO P. A fine balance between oxidised and reduced haem controls the survival of intraerythrocytic plasmodia. Parassitologia. 1999;41:205-208.
[ Links ]THOMAS SL, LEW VL. Plasmodium falciparum and the permeation pathway of the host red blood cell. Trends Parasitol. 2004;20:122-125.
[ Links ]TILLEY L, LORIA P, FOLEY M. Choloroquine and other quinoline antimalarials. In: ROSENTHAL, PJ, editor. Antimalarial chemotherapy: mechanisms of action, resistance, and new directions in drug discovery. New Jersey: Human Press Inc; 2001. p. 87-121.
[ Links ]TOYODA M, RAUSCH WD, INOUE K, OHNO Y, FUJIYAMA Y, TAKAGI K, et al. Comparison of solanaceous glycoalkaloids-evoked Ca2+ influx in different types of cultured cells. Toxicol in vitro. 1991;5:347-351.
[ Links ]TRAORE F, FAURE R, OLLIVIER E, GASQUET M, AZAS N, DEBRAUWER L, et al. Structure and antiprotozoal activity of triterpenoid saponins from Glinus oppositifolius. Planta Med. 2000;66:368-371.
[ Links ]URSOS LM, DUBAY KF, ROEPE PD. Antimalarial drugs influence the pH dependent solubility of heme via apparent nucleation phenomena. Mol Biochem Parasitol. 2001;112:11-17.
[ Links ]VERLOO P, KOCKEN CH, VAN DER WEL A, TILLY BC, HOGEMA BM, SINAASAPPEL M, et al. Plasmodium falciparum-activated chloride channels are defective in erythrocytes from cystic fibrosis patients. J Biol Chem. 2004;279:10316-10322.
[ Links ]WARBER S. Modes of action at target sites. In: KAUFMAN, PB, CSEKE, LJ, WARBER, S, DUKE, JA, BRIELMANN, HL, editors. Natural products from plants. USA: CRC Press; 1999. p. 157-181.
[ Links ]WEI N, SADRZADEH SM. Enhancement of hemin-induced membrane damage by artemisinin. Biochem Pharmacol. 1994;48:737-741.
[ Links ]WHO. The use of antimalarial drugs. Report of WHO informal consultation. Geneva: WHO; 2001. Documento WHO/CDS/RBM/2001.2033.
[ Links ]WISSING F, SANCHEZ CP, ROHRBACH P, RICKEN S, LANZER M. Illumination of the malaria parasite Plasmodium falciparum alters intracellular pH. Implications for live cell imaging. J Biol Chem. 2002;277:37747-37755.
[ Links ]WUNSCH S, SANCHEZ CP, GEKLE M, GROSSE-WORTMANN L, WIESNER J, LANZER M. Differential stimulation of the Na+/H+ exchanger determines chloroquine uptake in Plasmodium falciparum. J Cell Biol. 1998;140:335-345.
[ Links ]YAYON A, CABANTCHIK ZI, GINSBURG H. Identification of the acidic compartment of Plasmodium falciparum-infected human erythrocytes as the target of the antimalarial drug chloroquine. Embo J. 1984;3:2695-2700.
[ Links ]ZHENG J, RAMIREZ VD. Rapid inhibition of rat brain mitochondrial proton F0F1-ATPase activity by estrogens: comparison with Na+, K+ -ATPase of porcine cortex. Eur J Pharmacol. 1999;368:95-102.
[ Links ]ZIEGLER HL, STAERK D, CHRISTENSEN J, HVIID L, HAGERSTRAND H, JAROSZEWSKI JW. in vitro Plasmodium falciparum drug sensitivity assay: inhibition of parasite growth by incorporation of stomatocytogenic amphiphiles into the erythrocyte membrane. Antimicrob Agents Chemother. 2002;46:1441-1446.
[ Links ]ZIEGLER HL, FRANZYK H, SAIRAFIANPOUR M, TABATABAI M, TEHRANI MD, BAGHERZADEH K, et al. Erythrocyte membrane modifying agents and the inhibition of Plasmodium falciparum growth: structure-activity relationships for betulinic acid analogues. Bioorg Med Chem. 2004;12:119-127.
[ Links ]













