Print version ISSN 0120-548X
Acta biol.Colomb. vol.13 no.2 Bogotá May./Aug. 2008
EVALUACIÓN DE LA ROTIFEROFAUNA PRESENTE EN EL COMPLEJO DE PAJARALES DURANTE LA ÉPOCA LLUVIOSA, DEPARTAMENTO DE MAGDALENA, COLOMBIA
Assessment Of The Pajarales Complex Rotiferofauna DuringThe Rainy Season, Departamento De Magdalena, Colombia
SEBASTIÁN CELIS1, Biólogo; ERNESTO MANCERA2, M.Sc., Ph. D.; JENNY A. LEÓN1, Bióloga Marina.
1Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia, Sede Bogotá. Ciudad universitaria, Carrera 30 No. 45-03,jscelism@unal.edu.co ; jaleonru@unal.edu.co
2Universidad Nacional de Colombia, Instituto de Estudios Caribeños. San Andrés Islas, Colombia. jemancerap@unal.edu.co
Presentado 3 de octubre de 2007, aceptado 11 de diciembre de 2007, correcciones 23 de febrero de 2008.
RESUMEN
Con miras a evaluar posibles efectos de la recomunicación del río Magdalena con su antiguo delta, se determinó la abundancia y composición de la rotiferofauna del Complejo de Pajarales (CP), durante el período de mayor abundancia anual de zooplancton. El phylum Rotifera fue seleccionado por sus altas tasas reproductivas y eficiencia en procesos de transformación energética. Las muestras se colectaron con botella van Dorn durante la segunda temporada lluviosa de 2006. En cada una de las cuatro estaciones analizadas se registraron la salinidad, temperatura, pH y oxígeno disuelto. La diversidad se calculó empleando el índice de Shannon-Wiener H’ (log10) comparando estaciones y fechas de muestreo para establecer variaciones en el período de estudio. Gráficamente se relacionaron variables fisicoquímicas con valores de diversidad que emplearon un α de 0.05 y 95% de intervalo de confianza. En total, fueron encontrados 20 morfotipos pertenecientes a las familias Brachionidae, Lecanidae, Filiniidae, Synchaetidae, Hexarthriidae y Testudinellidae, siendo Brachionidae y Lecanidae las más abundantes. La relación entre diversidad y variables fisicoquímicas, indica que la salinidad es la principal responsable de la diversidad de rotíferos. En conclusión, la rotiferofauna actual en el CP es más abundante y diversa que hace 16 años, antes de la recomunicación con el río Magdalena. Así mismo, la concentración de oxigeno disuelto, pH y salinidad son diferentes. Teniendo en cuenta que la salinidad es el factor que más influyó en la diversidad de rotíferos, la reapertura de canales probablemente favoreció el incremento en la diversidad de rotíferos en el CP.
Palabras clave: Rotíferofauna, Complejo de Pajarales, río Magdalena, rehabilitación ecológica, Caribe colombiano.
ABSTRACT
In order to assess the potential effects of the Magdalena River recommunication with its former delta, we studied the abundance and composition of the rotiferofauna of the Pajarales Complex (PC) during its highest annual zooplankton abundance. We selected the Rotifera phylum, due to its high reproductive rates and the efficiency in energetic transformation process. We sampled the rotifers with a van Dorn bottle, during the second rainy season in 2006. During each sampling we registered salinity, temperature, pH, and dissolved oxygen. We calculated the rotifer diversity using the Shannon-Wiener H’ (log10) index comparing among sampling sites and sampling dates to establish variations along the study period. The physico-chemical variables were graphically related with the diversity values calculated using 0,05 for α and 95% for the confidence interval. We found a total of 20 morphotypes belonged to Brachionidae, Lecanidae, Filiniidae, Synchaetidae, Hexarthriidae and Testudinellidae families, been Brachionidae and Lecanidae the most abundant. The relationships between diversity and physico-chemical variables, show salinity as the main responsible of the rotifer diversity. In conclusion, the current rotiferofauna in the PC is most abundant and diverse than 16 years ago, before the recommunication with the Magdalena River. Likewise, dissolved oxygen concentration, pH and salinity of the CP waters were different. Taking into account that salinity was the most influent factor in the rotiferofauna diversity, the river recomommunication probably favored the increment of rotiferofauna diversity in the PC.
Key words: Rotíferofauna, Pajarales Complex, Magdalena River, Ecological Rehabilitations, Colombian Caribbean
INTRODUCCIÓN
Históricamente los ecosistemas estuarinos se han constituido en factor de desarrollo humano (Mitsch y Gosselink, 1993). Además de representar cerca del 15% de las costas del mundo (Subba-Rao, 1978), se destacan por su alta producción biológica y capacidad de amortiguamiento, brindando alimento y refugio a importantes poblaciones de invertebrados y peces, de valor ecológico y comercial (Reid y Wood, 1976; Yañez-Aranciabia y Nugent, 1977; Nixon, 1982; Day et al., 1989). Por lo tanto son generalmente objeto de múltiples usos o intervenciones humanas de tipo local, regional y nacional, como la pesca, agricultura y transporte entre otras (Ministerio de Medio Ambiente. 2000). El uso intensivo de bienes y servicios generados por ecosistemas estuarinos, sin el conocimiento suficiente de la estructura y función, ha generado en muchos casos, múltiples problemas entre los que se destacan la sobreexplotación, eutrofización, introducción de especies, contaminación, desecación y pérdida de biodiversidad. Problemas de compleja solución, que hacen necesario mejorar el nivel de entendimiento de estos ecosistemas. Si bien existe extensa literatura sobre procesos de producción primaria en diversos tipos de estuarios (Nixon, 1982; Cloren, 1999), mucha menos atención se ha prestado a entender los mecanismos de transferencia de energía entre productores y consumidores, siendo aún más evidente en estuarios tropicales, como en el caso del Complejo Pajarales. El sistema de ciénagas, caños y pantanos de manglar denominado Complejo de Pajarales (CP) hace parte de la ecorregión Ciénaga Grande de Santa Marta (CGSM), un humedal RAMSAR y reserva Internacional de Biosfera, considerada como una de las lagunas costeras con características estuarinas más productivas del mundo (Knoppers, 1993). Dicha producción estimada en 982 gC/m2/año (Rodríguez, 2007) y 990 gC/m2/año (Hernández y Gocke, 1990) para CP y CGSM, respectivamente, sustenta una importante pesquería artesanal que puede llegar a 10.000 TM/año (Santos-Martínez et al., 1997), constituyendo la principal fuente de alimento e ingresos de aproximadamente 30.000 habitantes (Botero y Salzwedel, 1999). Con miras a evaluar posibles efectos de la recomunicación del río Magdalena con su antiguo delta, se evalúo para el Complejo de Pajarales, la abundancia y composición de la rotiferofauna durante el período del año de mayor abundancia de zooplancton en el ecosistema. Se seleccionó el phylum Rotifera por su predominancia, altas tasas reproductivas y eficiencia en los procesos de transformación energética (Park y Marshall, 2000). Así el presente estudio se orientó a responder: 1) ¿Cómo es actualmente la abundancia y composición de la rotiferofauna en el Complejo Pajarales-CGSM? 2) ¿Existen diferencias en abundancia y composición de la rotiferofauna antes y después de la recomunicación con el río Magdalena? 3) ¿En caso de encontrar diferencias, estas podrían corresponder a respuestas del ecosistema a la recomunicación?
MATERIALES Y MÉTODOS
ÁREA DE ESTUDIO
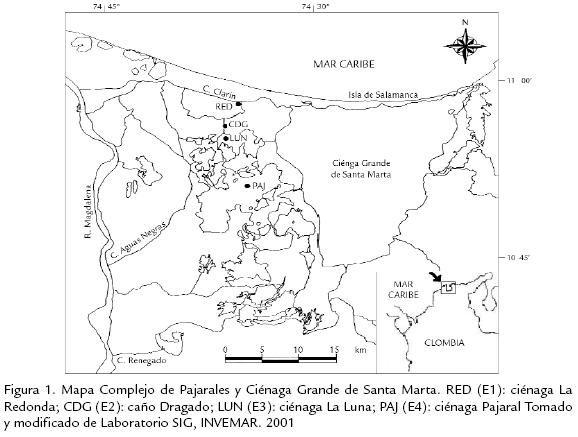
El Complejo de Pajarales (CP) localizado al noroccidente del departamento de Mag-dalena-Colombia, entre los 10º 45’ y 11º 00’ N y los 74º 30’ y 74º 40’ O (IGAC, 1974), hace parte de la Ciénaga Grande de Santa Marta (CGSM), antiguo delta del río Magdalena. Limita al norte con la “Vía Parque Nacional Natural Isla de Salamanca -VIPIS”, al sur con el “Santuario de Fauna y Flora de la CGSM”. Por el costado occidental recibe aportes del río Magdalena e intercambia aguas con la CGSM por la margen occidental. La eco-región fue designada “humedal de importancia internacional RAMSAR (Decreto No. 244 del 2 de febrero de 1998) y Reserva de la Biosfera” en el año 2000, lo cual refleja su importancia nacional y mundial. Las ciénagas y canales del CP están rodeadas por manglar (Avicennia germinans, Rhizophora mangle y Laguncularia racemosa), y presentan una extensión aproximada de 152,79 Km2. La mayor parte del fondo es fangoso y su profundidad oscila entre 5,0 y 1,80 m. El clima es cálido-seco, con temperaturas anuales entre 27-34 ºC, precipitación y evapotranspiración promedio de 400 mm y 1.800 mm respectivamente. La región presenta el más alto brillo solar (2500-2825 horas/año) y la mayor intensidad lumínica del país (2140 kcal/cm2). Las temporadas de sequía y lluvia están bien marcadas, durante los primeros meses del año se presenta la época seca, que alcanza su pico entre marzo y abril; mientras que durante septiembre a noviembre se presenta la temporada lluviosa (Blanco, 2006). El régimen de mareas tiene amplitudes irregulares que varía entre 15 y 30 cm (Cosel, 1985). Descripciones detalladas de la zona de estudio se encuentran en Castaño (1991), Mogollón (1996) y PROCIÉNAGA (1995). El CP ha manifestado fuertes perturbaciones de tipo antrópico, especialmente asociadas con alteraciones hídricas que se originaron en los años 50 por la construcción de la carretera Barranquilla-Ciénaga, que alteró los flujos naturales entre el mar y la CGSM, problema que se agudizó en los años 70 con la construcción de la carretera paralela al río Magdalena (Botero y Mancera, 1996; Blanco et al., 2001). Las alteraciones hídricas generaron pérdida de especies (abundancia y riqueza de invertebrados, peces y aves) y muerte masiva de manglar (Botero, 1989). Con miras a rehabilitar la ecorregión CGSM en términos de su función, procesos, usos y valores, en 1993 se inició un programa interinstitucional, cuyos mayores esfuerzos se centraron en la recomunicación del río Magdalena con su antiguo delta, a través de cinco canales que fueron dados al servicio en 1996 (Clarín, Torno y Almendros) y 1998 (Renegado y Aguas Negras) (PROCIÉNAGA, 1995).
FASE DE CAMPO
La colecta de las muestras se llevó a cabo los días 15 y 29 de septiembre; 23 de octubre; 16 y 23 de noviembre y 12 de diciembre de 2006 correspondientes a la época de lluvia, empleando como muestreador una botella de tipo Van Dorn con capacidad de tres litros a una profundidad de 40 cm aproximadamente, siguiendo la metodología de Boltovskoy (1981). Esta botella permitió obtener la cantidad de agua exacta, facilidad de operación y posibilidad de muestreo cuantitativo del microplancton menor. Los puntos de colecta seleccionados fueron las estaciones E1: ciénaga de la Redonda RED; E2: caño Dragado CDG; E3: ciénaga La Luna LUN y E4: ciénaga Pajaral PAJ, las cuales hacen parte del Complejo de Caños y Ciénagas de Pajarales en el departamento de Magdalena (Fig. 1). Se contó con un total de 24 muestras. Paralelamente en cada estación, se tomaron datos de las variables: salinidad, temperatura, pH y oxígeno disuelto empleando sondas multiparámetro (WTW). Las muestras fueron almacenadas en recipientes de plástico con capacidad de 500 mL. A cada uno de los recipientes se les añadió de 5 mL a 7,5 mL de solución de Lugol desacificada, según Steidinger y Melton (1999). Las muestras fueron fijadas y preservadas en solución de formaldehído al 4% (UNESCO, 1966). Todos los recipientes fueron marcados con las coordenadas, datos de profundidad, nombre del colector y fecha.
MANEJO DE MUESTRAS
Las muestras se centrifugaron siendo posteriormente concentradas en envases de 50 mL. El conteo e identificación de los morfotipos se realizó empleando una placa SR de 0,6 mL mediante microscopio de contraste de fase binocular estándar. De cada morfotipo se registró su frecuencia por muestra y los más frecuentes fueron fotografiados empleando una cámara digital marca Canon Power Shot Ref. A530. La identificación se realizó a partir de las fotografías y de las imágenes directas del microscopio empleando las claves de Edmonson (1966), Boltovskoy (1981) y Heinz (1987). No se tuvieron en cuenta estados larvales ni huevos de insectos, peces y ácaros. Con base en los conteos de los individuos se obtuvo la abundancia por morfotipo.
ANÁLISIS DE LA INFORMACIÓN
Se estableció inicialmente la composición por Phylum para la totalidad de los grupos zooplanctónicos encontrados en las muestras. En el caso de los rotíferos se determinaron a nivel taxonómico de familia. Esta información se comparó con los reportes de trabajos anteriores a la reapertura de los canales de comunicación del río Magdalena y el CP. Posteriormente se determinó el porcentaje de abundancia relativa de cada taxa y su contribución a la comunidad zooplanctónica. Para obtener las densidades, el número total de morfotipos por muestra fue dividido por tres para obtener el número de individuos por litro. Posteriormente este dato fue multiplicado por 1.000 para obtener el número de individuos por metro cúbico (ind/m3). Con la información de la densidad de las especies de rotíferos se realizó por muestra una valoración de diversidad a través del índice de Shannon-Wiener H’ (Log 10) tomando como referencia el número de individuos por unidad de volumen. Estos cálculos se realizaron empleando el programa Biodiversity Professional® versión 2. Los valores de diversidad calculados se compararon entre las estaciones y fechas de muestreo para establecer variaciones a lo largo del período de estudio. Se relacionaron gráficamente las variables fisicoquímicas con los valores de diversidad calculados empleando un valor α de 0.05 y un intervalo de confianza del 95%.
RESULTADOS
CARACTERIZACIÓN FISICOQUÍMICA
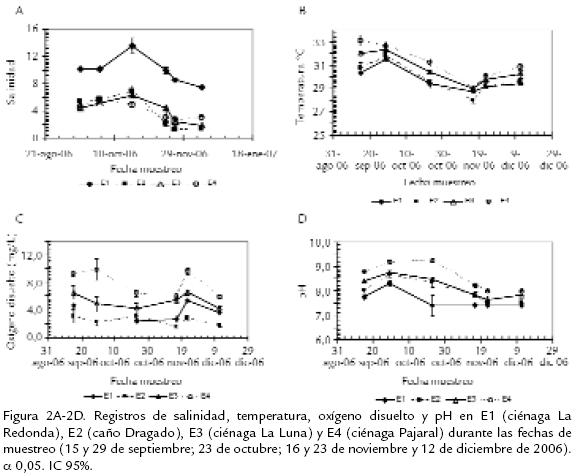
La salinidad en E1 (ciénaga La Redonda) fue significativamente mayor con respecto a los demás sitios de muestreo, registrando valores entre 13,65 y 7,40, mientras que para E2 (caño Dragado), E3 (ciénaga La Luna) y E4 (ciénaga Pajaral) se registraron valores entre 6,87 y 1,20 (Fig. 2A). Estos resultados difieren cualitativamente de los reportados por Gocke et al. (2003), respondiendo a la diferencia entre épocas climáticas, ya que su estudio se llevó a cabo durante la época seca. En este la salinidad en ciénaga Pajaral fue evidentemente mayor a la encontrada en ciénaga La Luna y esta a su vez mayor a la encontrada en ciénaga La Redonda, ya que la primera presenta una conexión permanente con la CGSM, mientras que las otras dos representan una transición entre los sistemas salobres y dulceacuícolas adyacentes. Castaño (1991) reportó una amplia variación de la salinidad para el sistema, con salinidades bajas desde noviembre hasta febrero, presentando su valor mínimo en diciembre (0,3‰) en ciénaga Pajaral y La Redonda, coincidiendo cualitativamente con los observados en el presente estudio. Para el resto del año reportó un aumento constante de febrero a junio, alcanzando un valor máximo de 32,9‰ en caño Dragado. Rondón (1991) registró entre octubre de 1988 y septiembre de 1989 promedios de salinidad de 15,32 (27,80 máximo, 0,40 mínimo). Estos valores fueron más altos respecto a los reportados en el presente estudio. Se registró una variación de la temperatura de 4,7 ºC durante el período actualmente estudiado. Castaño (1991) reportó para el CP una variación superior de 10,5 ºC para el período noviembre/88-octubre/89. La temperatura presentó su valor más bajo entre noviembre y diciembre para las cuatro estaciones de muestreo. El valor mínimo 27,9 ºC, se obtuvo en caño Dragado en noviembre durante el período más lluvioso, mientras que el máximo, 32,6 ºC, se registró en la ciénaga Pajaral en septiembre en el comienzo de la época lluviosa (Fig. 2B). Estas fuertes variaciones en temperatura también fueron registradas durante las noches, con descensos de temperatura notables hasta de 5 ºC, durante el período lluvioso en la ciénaga de Pajaral (Castaño, 1991). Respecto a la concentración de oxígeno (Fig. 2C) se registró un valor máximo en ciénaga Pajaral (9,94 mg/L) el 29 de septiembre, mientras el valor mínimo (1,53 mg/L) se presentó en caño Dragado el 16 de noviembre. Este rango de concentración fue menor al reportado por Rondón (1991) para el Complejo de Pajarales, cuya concentración promedio de oxígeno disuelto fue de 8,19 mg/L (15,52 mg/L máximo, 4,71 mg/L mínimo). En general, se observó que la ciénaga Pajaral presentó la mayor concentración de oxígeno en comparación con las demás estaciones durante el período de muestreo. Para todas las estaciones se vio un ligero aumento en la concentración de oxígeno el 23 de noviembre, coincidiendo con una disminución de la temperatura. Todas las estaciones mostraron un pH ligeramente alcalino (Fig. 2D) durante la época lluviosa. Los mayores valores se presentaron para la ciénaga Pajaral (9,24 máx. 8,01 mín.) aunque los valores para las demás estaciones no estuvieron muy alejados a los registrados en ciénaga Pajaral. El valor mínimo (7,3) se registró el 23 de octubre en ciénaga La Luna.
COMUNIDAD ZOOPLANCTÓNICA
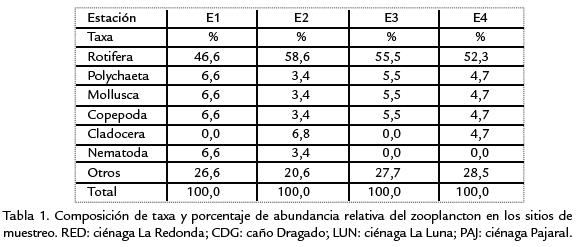
La composición taxonómica del zooplancton en los diferentes sitios de estudio se presenta en la Tabla.1. La abundancia relativa de los taxa identificados es dada como porcentaje del número total de individuos. En los cuatro sitios de muestreo el grupo de los rotíferos constituyó la fracción más abundante del zooplancton, siendo superior al 46% en todas las estaciones. El aporte de poliquetos, moluscos y copépodos en conjunto no superó el 22%. Respecto a los cladóceros solo se presentaron con una baja frecuencia en caño Dragado (E2) y en ciénaga Pajaral (E4). Grupos de clasificación incierta, otros, como protozoos tuvieron un gran aporte (>20%) constituyéndose, después de los rotíferos, en los más frecuentes en las muestras. En general, se observó que existe poca diferencia en cuanto al aporte de los taxa encontrados en el muestreo para cada estación (Tabla.1). Además la mayoría de los grupos estuvo presente durante todo el período de muestreo, coincidiendo con los resultados de Castaño (1991). Resultado similar obtuvo Renteria (1977) para la CGSM. En este caso se entiende como una adaptación planctónica a los fenómenos ambientales, y una tolerancia amplia del plancton a las variaciones ambientales. Otros estudios en la adyacente CGSM como el de León-Rubriche (2004) mostraron frecuencias bajas para el Phylum rotifera con porcentajes de abundancia inferiores al 6% empleando como muestreador redes de 250 µm.
COMUNIDAD DE ROTÍFEROS
En total, fueron encontrados 20 morfotipos pertenecientes a las familias Brachionidae, Lecanidae, Filiniidae, Synchaetidae, Hexarthriidae y Testudinellidae. La familia más abundante en todas las estaciones fue Brachionidae, seguida por Lecanidae y Filiniidae. Las demás familias presentaron bajas abundancias. En la ciénaga la Redonda se observó una clara dominancia durante el período de estudio de las familias Brachionidae, con un promedio de 75.000 individuos por metro cúbico (59.738,6 SD), y Lecanidae con 37.555,5 ind/m³ promedio (34.800,1 SD). La familia Filiniidae tuvo una baja frecuencia, con un promedio de 166,6 ind/m³ (182,5 SD). Las demás familias no fueron detectadas en esta estación. Para la estación caño Dragado, la familia Brachionidae fue la más abundante con 50.500 ind/m³ (41.772,2 SD) en promedio. En esta estación, a diferencia de las demás, la familia Filiniidae fue más abundante que la familia Lecanidae, con abundancias promedio de 15.611,1 (15.403,3 SD) y 10.888,8 (14.519,9 SD) respectivamente. También se debe resaltar que las familias restantes tuvieron las mayores abundancias (3.888,8 individuos promedio) (5.443,3 SD) respecto a los demás sitios de muestreo. En general, se observó que en esta estación la abundancia promedio de familias fue la menor. Ciénaga La Luna presentó un notable aumento en la abundancia promedio de la familia Filiniidae, (30.888,8 ind/m³ promedio, 39.031,9 SD) constituyéndose en el sitio de muestreo con la mayor abundancia para esta familia. La familia Lecanidae y las restantes familias presentaron abundancias promedio de 51.447,2 ind/m³ (51.447,2 SD) y 888,8 ind/m³ (2.177,3 SD) respectivamente. Para la ciénaga Pajaral 4 se observó una abundancia promedio de las familias similar a la encontrada en ciénaga La Luna, con valores de 70.277,7 ind/m³ (52.149,1 SD) para Brachionidae, 47.666,6 ind/m³ (44.853,3 SD) para Lecanidae, 15.777,7 ind/m³ (18.125,0 SD) para Filiniidae y 277,7 (680,4 SD) para las restantes familias.
Respecto a la abundancia en general de rotíferos en cada estación de muestro durante el período de estudio, se observó para la E1 (RED) un valor inicial de 136.000 ind/m³, valor que disminuyó para las siguientes dos fechas de muestreo (29 de septiembre y 23 de octubre) y 80.666 en el mes de septiembre, siendo este último el valor mínimo para esta estación. Para el 16 de noviembre se registró un pico de 202.000 ind/m³ que disminuyó para las dos últimas fechas de muestreo, con valores de 167.000 y 37.333 ind/m³. La E2 (CDG) mostró valores bajos para las dos primeras fechas de muestreo (31.333,3 ind/m³ el 15 de septiembre y 28.333,3 ind/m³ el 29 de septiembre) que aumentó a valores entre 96.000 el 23 de octubre y 86.000 ind/m³ el 16 de noviembre. El valor máximo para esta estación se presentó el 23 de noviembre, con una abundancia de 177.666,6 ind/m³ para decaer a 65.333,3 2 ind/m³ el 12 de diciembre. En la E3 (LUN) se registró el máximo valor observado para todas las estaciones durante todo el estudio (429.000 ind/m³) en la segunda fecha de muestreo. Para el resto del período se registraron valores que variaron entre 87.333,3 y 38.666,6 ind/m³. Para la E4 (PAJ) se observó una disminución evidente durante las tres primeras fechas de muestreo (de 264.333 2 ind/m³el 15 de septiembre a 37.333 2 ind/m³el 23 de octubre). Durante las siguientes tres fechas de muestreo el valor aumentó hasta llegar finalmente a 152.333 2 ind/m³el 12 de diciembre. En otro trabajo en el complejo de Pajárales Castaño (1991) registró un pico de densidad de rotíferos entre septiembre y octubre con un valor de 1’835.646 2 ind/m³para la ciénaga de Pajaral. Asimismo se reportaron valores de abundancia para la ciénaga La Luna y ciénaga La Redonda de 20’871.924 y 16’734.700 2 ind/m³respectivamente, entre septiembre y octubre.
DIVERSIDAD DE SHANNON-WIENER H’ (LOG10)
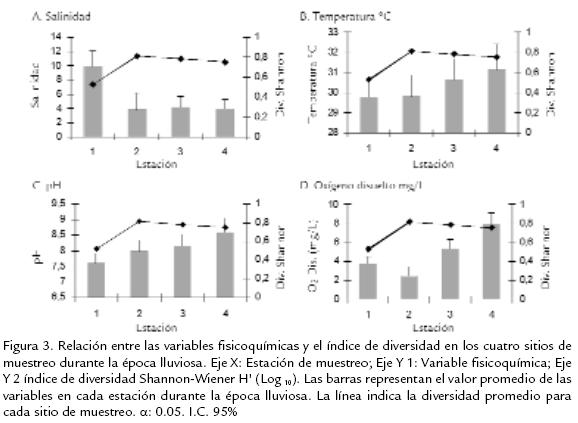
La evaluación de la diversidad mostró los valores más bajos en la ciénaga La Redonda. Para las dos primeras fechas de muestreo se registraron valores de 0,45 Bits y 0,48 Bits disminuyendo a 0,13 Bits el 23 de octubre. Desde el 16 de noviembre hasta el 12 de diciembre se observó un aumento del valor de diversidad de 0,25 Bits a 0,49 Bits. Estos valores bajos de diversidad coincidieron con valores elevados de salinidad para esta estación. Los valores registrados el 15 de septiembre y el 23 de octubre en caño Dragado se mostraron dentro del rango visto en la ciénaga La Redonda. En el resto de fechas los valores se encontraron entre 0,80 (12 de diciembre) y 0,87 bits (29 de septiembre). La estaciones ciénaga La Luna y ciénaga Pajaral evidenciaron valores variables, entre 0,52 (ciénaga Pajaral, 29 de septiembre) y 0,91bits (ciénaga La Luna, 12 de diciembre). La relación entre la diversidad encontrada y la salinidad promedio en los cuatro sitios de estudio mostró para la ciénaga la Redonda (E1) una salinidad promedio mayor (9,9) y un índice de diversidad menor (0,52 Bits) en comparación a las demás estaciones. En caño Dragado (E2), ciénaga La Luna (E3) y ciénaga Pajaral (E4) los valores de salinidad fueron menores a 4,1 y los valores de diversidad oscilaron entre 0,8 y 0,75 Bits. Lo anterior puede sugerir una relación inversa entre la salinidad y la diversidad de rotíferos durante el período de estudio. Este resultado concuerda con la premisa del incremento en la salinidad que causa una disminución significativa de la diversidad de los rotíferos (Park y Marshall, 2000). La temperatura promedio en las estaciones durante la época lluviosa osciló entre 29,7 ºC y 31,1 ºC. Este rango de temperaturas no mostró un efecto claro sobre la diversidad (Fig. 3B). El aumento de temperatura adelanta el tiempo de reproducción, incrementando la tasa intrínseca de crecimiento, todo lo anterior como consecuencia de la tasa metabólica (Bosque et al., 2001). El pH y el oxígeno disuelto no tuvieron un efecto determinante en los valores de diversidad calculados para cada estación (Fig. 3C-D), por lo que se puede sugerir que la salinidad presentó una incidencia mayor para la composición de la comunidad de rotíferos en los sitios de estudio durante la época lluviosa.
DISCUSIÓN
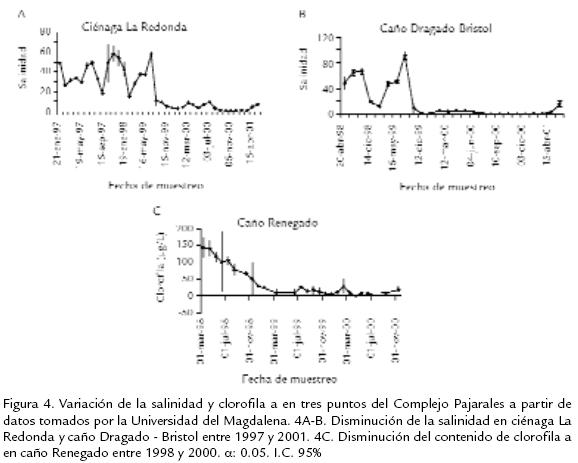
La salinidad es quizás la variable que mejor describe los cambios hidrológicos en un sistema estuarino (Blanco et al., 2006). Su incremento o disminución depende de la cantidad de agua dulce que entra o deja al sistema. Blanco et al. (2006) registraron un déficit hidrológico de -1.146,8 mm/año y de -211,6 mm/año para el área norte y sur respectivamente del sistema CGSM-CP para el período 1967-1984. Si se asume un comportamiento similar al descrito anteriormente para el año 2006, se podría explicar la salinidad mayor en ciénaga La Redonda, que debido a su ubicación sufre de déficit hidrológico mayor al presentado en ciénagas ubicadas al sur. Conclusión similar planteó Castaño (1991) incluyendo las características de los suelos y la escasa profundidad de ciénagas y caños de la zona como factores que influenciaron la salinidad. Asimismo, para el comportamiento de la salinidad en esta ciénaga (La Redonda) se debe tener en cuenta el efecto del fenómeno del Niño y los aportes fluviales por parte del río Magdalena a través de los canales de comunicación entre este y el CP. El año 2006 fue afectado por el fenómeno del Niño, el cual se ha demostrado, afecta la circulación atmosférica en la Cuenca del Caribe (Giannini et al., 2001), este hecho, más la ocurrencia de varios escenarios con condiciones sinérgicas y antagónicas (climáticas -hidráulicas) influencian la salinidad del sistema CGSM-CP (Blanco et al., 2006). De acuerdo a este escenario, se podría sugerir que los valores altos de salinidad en ciénaga La Redonda probablemente se debieron al taponamiento con sedimento y restos de vegetación de los canales de comunicación con el río Magdalena y al efecto del fenómeno del Niño, como se registró en el período 1999-2000 por Blanco et al., (2006). En las demás estaciones, la salinidad presentó valores muy similares entre sí, con una disminución hacia el final del período de estudio posiblemente originada por al aumento del aporte del agua dulce proveniente del río Magdalena. No se consideró el aporte de agua dulce por parte de la precipitación local, ya que se asume que es insignificante para los cambios medios de salinidad en el sistema CGSM-CP (Blanco et al., 2006). Castaño (1991) sugirió que el Complejo de Pajarales tiende a aumentar la salinidad más que la CGSM después del invierno. Estos resultados evidenciaron la disminución de la salinidad después de la reapertura de los canales de comunicación del CP con el río Magdalena. Esta conclusión se reafirma con los datos de salinidad y contenido de clorofila a tomados por la Universidad del Magdalena entre 1997 y 2001 en ciénagas y caños del CP (Fig. 4). En estos se observó una notable disminución en el valor de la salinidad a partir del año 1999, alcanzando valores por debajo de 20 ‰, similares a los reportados en este estudio. Paralelamente se detectó una disminución del contenido de clorofila a (µg/L) en caño Renegado (Fig. 4C) a partir del año 1998. Esta disminución pudo obedecer al aumento del caudal y flujo de agua, que alteraron la dinámica hídrica del caño, favoreciendo una mayor concentración de algas y bacterias fotosintéticas.
De acuerdo con la tendencia gráfica (Fig. 3A ) la variable fisicoquímica que mejor se relacionó con la diversidad de rotíferos fue la salinidad. En este estudio se observaron los mayores valores de diversidad en las estaciones con las salinidades más bajas (caño Dragado, ciénaga La Luna y ciénaga Pajaral), mientras que la ciénaga La Redonda mostró los valores de Shannon-Wiener más bajos. Este resultado es coherente con lo reportado por la literatura ya que el incremento de la salinidad disminuye significativamente la diversidad y abundancia de rotíferos (Park y Marshall, 2000; Margaleff, 1983; Bosque et al., 2001). Estudios sobre el efecto de la salinidad en rotíferos fueron realizados principalmente sobre B. plicatilis (Brachionidae) observando que la duración de la vida decreció a medida que aumentó la salinidad, mientras que la fecundidad de la hembras y la tasa de crecimiento intrínseca disminuyó (Serra et al., 1994. En Bosque et al., 2001). El mayor flujo de agua dulce desde el río Magdalena después de la reapertura de la comunicación con las ciénagas del CP permitió disminuir la salinidad del sistema afectando de manera positiva la diversidad de rotíferos, ya que antes de las medidas de recuperación Castaño (1991) reportó dos familias (Filiniidae y Brachionidae) mientras que en el presente estudio se presentaron seis familias (Brachionidae, Lecanidae, Filiniidae, Synchaetidae, Hexarthriidae y Testudinellidae).
La temperatura presentó los menores valores hacia el final del período de estudio, época del verano en que los vientos Alisios soplan con mayor intensidad y el sistema está influenciado por las aguas dulces (Castaño 1991). Los mayores valores se registraron a comienzos de septiembre, contrario a lo registrado por Castaño (1991) que presentó las mayores temperaturas en octubre. Sin embargo, la menor influencia de los Alisios durante el invierno sumado a la escasa profundidad del CP explican estos valores. En estudios como los de Ávila (1973) y Castaño (1991) se presentaron comportamientos de temperatura muy semejantes a los descritos en este estudio. El efecto de la temperatura sobre la diversidad no fue significativo, aunque se ha reportado que este factor influencia de manera clara tanto la diversidad como la abundancia de rotíferos (Bosque et al., 2001). Ya que la variación de temperatura en horas del día a través del período de estudio no fue extrema, su efecto sobre la comunidad no fue significativo. Este resultado es lógico, puesto que el rango de variación de temperatura diario reportado por Castaño (1991) fue de aproximadamente 10 ºC por lo que los organismos deben ser capaces de tolerar las variaciones diarias y estacionales de temperatura.
Los valores de concentración de oxígeno disminuyeron en sentido sur-norte respecto a la ubicación relativa de las estaciones de muestreo. Este comportamiento se puede explicar en el hecho de que los cuatro puntos de estudio están interconectados por pequeños caños y ciénagas de transición. Los mayores registros se presentaron en ciénaga Pajaral, adyacente a la CGSM. El mayor contacto entre ciénaga Pajaral y la CGSM puede explicar el mayor contenido de oxígeno en la primera, ya que el flujo de aguas hacia ciénaga Pajaral desde la CGSM y desde el canal Renegado fue mayor en relación a las demás ciénagas. El aporte de agua de la ciénaga Pajaral a la ciénaga La Luna fue menor al mencionado inicialmente, lo que explica que ciénaga La Luna haya presentado valores menores a ciénaga Pajaral. El comportamiento anteriormente expuesto puede ser aplicado a las otras dos estaciones, con lo que se podría hablar de un “gradiente” de concentración de oxígeno, que aumentó en sentido norte-sur a través de ciénagas y caños del CP, ya que la oxigenación que se logra en la parte norte del sistema por la entrada de agua marina a través de la boca de la barra a la CGSM oxigena el sistema, y este a su vez por el mismo patrón de circulación habría llevado el oxígeno disuelto a la parte norte del CP. El 23 de noviembre se registró un aumento simultaneo de la concentración de oxígeno para las cuatro estaciones (Fig. 2C ), coincidiendo con una disminución de la temperatura. Este resultado pudo obedecer, por una parte, al hecho de que al disminuir la temperatura del agua aumenta la solubilidad de oxígeno, y a la influencia de la cantidad de agua recibida por parte de las precipitaciones, que en esta época del año presentan el mayor pico. En este estudio la temperatura y el oxígeno no tuvieron un efecto claro sobre la diversidad de los rotíferos, si bien se sugiere que la temperatura (un factor condicional) y el oxígeno (un factor material) son los principales pero no los únicos factores determinantes que influencian la ocurrencia y diversidad de los rotíferos (Hofmann, 1977. En Arora, 2003). El anterior resultado puede ser explicado con base en la suposición de Holland et al. (1983) la cual dice que la influencia de la temperatura y el oxígeno sobre la abundancia de los rotíferos es menos manifestada en climas cálidos como también en aguas poco profundas, características propias de las ciénagas del CP.
Un comportamiento similar al descrito para el oxígeno puede aplicarse para el pH. En este también se observó un aumento gradual en sentido Norte-Sur. La ciénaga Pajaral presentó los mayores valores de pH debido a que recibe aguas con mayor concentración de sales disueltas. En ciénaga La Redonda, además de encontrarse más alejada de la influencia de ciénaga Pajaral y de la CGSM, recibe aportes de agua dulce a través de canal Clarín por parte del río Magdalena. En general, el pH para los cuatro sitios de estudio fue ligeramente alcalino. Se observó una disminución de pH para las estaciones caño Dragado, ciénaga La Luna y ciénaga Pajaral entre el 23 de octubre y el 12 de diciembre, mientras ciénaga La Redonda mantuvo valores casi constantes para este mismo período de tiempo. Probablemente un aumento del aporte de agua dulce ocasionado por el aumento del caudal por el invierno en el río Magdalena desde el norte, a través de ciénaga La Redonda explicaría el descenso de los valores de pH para estas estaciones. En general, aguas alcalinas contienen pocas especies pero gran número de individuos, mientras aguas ácidas contienen gran número de especies y pocos individuos (Sladecek, 1983). Esta afirmación no se cumple en este estudio, en el cual se presentaron valores de diversidad altos en aguas con pH alcalino, lo que indica que los morfotipos hallados en este estudio presentaron rangos de tolerancia de pH amplios, lo que permitió una diversidad alta a pesar de la ligera alcalinidad del agua. De acuerdo al grado de tolerancia de los rotíferos al pH, se distinguen tres grupos ecológicos: 1) especies de aguas alcalinas, entre las que se encuentran los géneros Brachionus y Filinia entre otros; 2) especies de transición que ocurren tanto en aguas alcalinas como ácidas (la mayoría de los rotíferos) y 3) especies de aguas ácidas con representantes del género Lecane (Sladecek, 1983). De acuerdo con lo anterior, y teniendo en cuenta la frecuencia de morfotipos hallada en el presente trabajo, se puede sugerir que el Complejo de Pajarales pertenece al primer grupo ecológico, ya que los géneros Brachionus y Filinia fueron los más frecuentes en las cuatro estaciones de muestreo. Parámetros de calidad del agua como el pH pueden influenciar la disponibilidad de rotíferos; sin embargo, es más probable que los cambios de disponibilidad sean causados por la salinidad (Fielder, 2000) apoyando los resultados obtenidos en este estudio.
Según lo plantea Boltovskoy (1981), los escasos estudios comparativos de los resultados de las muestras de botella comparados con las obtenidas con redes o bombas de succión son escasos y sumamente contradictorios. Tal es así que las aplicaciones y características del muestreo se fundamentan más en deducciones hipotéticas que en datos empíricos. La anterior afirmación permite explicar porqué en las muestras no hubo una mayor representación de organismos que se esperarían obtener en ambientes como el estudiado. Es por esto que la presencia de grupos como crustáceos (copépodos y cladóceros) y moluscos del meroplancton fue baja. En su estudio sobre el cambio en la estructura de la comunidad zooplanctónica Lam - Hoai et al. (2006) reportaron para el estuario del río Kaw (Guyana francesa), durante la temporada lluviosa, un dominio en términos de abundancia de los rotíferos, mientras que en la época seca los tintínidos y otros grupos marinos como copépodos se constituyeron como los grupo dominantes. Argumentaron que esta alternancia de comunidades se debió principalmente a los fuertes cambios hidrodinámicos influenciados por la marea en la época seca, y los aportes fluviales en la época lluviosa. Como el CP se ve poco influenciado por las mareas en las épocas climáticas, se puede sugerir que estas no constituyen un vehiculo de transporte importante, tanto cualitativa como cuantitativamente de grupos marinos hacia el CP, aunque Castaño (1991) empleando redes y botellas de forma alternada, obtuvo representaciones mayores de copépodos, cladóceros y grupos marinos en su trabajo en el CP.
En este estudio, se observó que la mayoría de los grupos identificados permanecieron en el CP durante casi todo el período de estudio, coincidiendo con Castaño (1991). Este resultado puede estar indicando una condición eurihalina y una amplia tolerancia a los cambios de temperatura por parte de estos grupos. Los estudios sobre rotíferos en el Neotrópico generalmente evalúan su sistemática y solo tratan con especies de aguas continentales (De Paggi, 1989; Zoppi de Roa, 1993; Rougier, 2005). Cuando se ha considerado el zooplancton en los estuarios tropicales los estudios a menudo se limitan a grupos o poblaciones específicas, en el caso de los rotíferos por Neumann-Leitao et al., (1992) en el área estuarina de Suape (Pernambuco-Brasil), donde los rotíferos dominaron en el estuario del río Ipojuca, también se encontró que los factores hidrológicos influenciaron la ocurrencia y distribución de algunas especies además se encontró que la polución en el río Ipojuca contribuyo a la diversidad.
Dentro de la comunidad de rotíferos se destacaron las mayores abundancias para las familias Brachionidae y Lecanidae. La primera registró los máximos valores de frecuencia y abundancia para todas las estaciones de muestreo, coincidiendo con lo reportado por Castaño (1991) en el CP y Ávila (1973), Carmona (1988) y León-Rubriche (2004) para la CGSM. En total se identificaron 20 morfotipos de rotíferos pertenecientes a seis familias, contrario a lo reportado por Castaño (1991), que registra solo las familias Filiniidae y Brachionidae representadas por los géneros Platyas, Filinia y Polyarthra. El comportamiento de la comunidad de rotíferos para la ciénaga la Redonda mostró la presencia principalmente de las familias Brachionidae y Lecanidae, quizás los nutrientes, condiciones fisiológicas o ambientales favorecieron su mantenimiento en el sitio de muestreo, como se observó en el estudio de Puigagut (2007) que determinando los efec-tos de partículas y compuestos solubles sobre poblaciones de microfauna encontró que entre los metazoos, particularmente los rotíferos de la familia Lecanidae se encontraron las mayores abundancias cuando el sistema fue enriquecido con granos microscópicos de hidratos de carbono (fécula) usados para simular partículas orgánicas. También se sugiere que el incremento de la familia Lecanidae pudo haber tenido algún efecto negativo sobre los procesos de remoción de nitrógeno. Este resultado puede indicar que esta familia encuentra favorable condiciones de turbidez debida a detritus orgánico, como en el caso de las ciénagas del CP, que se ven afectadas por el aporte orgánico por parte de los asentamientos palafíticos, de las descargas provenientes del río Magdalena y de tres fuentes potenciales de contaminación orgánica en el sistema CGSM-CP: la vertiente occidental de la Sierra Nevada mediante las descargas de los ríos Frío, Sevilla, Aracataca y Fundación y otras escorrentías menores. Estos afluentes terrestres introducen al complejo residuos agro-químicos provenientes de los cultivos de banano y residuos del proceso de extracción de aceite de palma. Para las demás estaciones se observó la presencia de todas las familias, aunque Brachionidae, Lecanidae y Filiniidae fueron las dominantes. Respecto a la abundancia, el comportamiento fue irregular para todas las estaciones durante el período de estudio. Este comportamiento puede explicarse en cambios en la distribución a lo largo de la columna de agua por parte de los rotíferos, como observaron Ignoffo et al., (2005) que demos-traron que la distribución vertical de los rotíferos estuvo afectada por la distribución vertical del alimento disponible. Este inconveniente no lo presentan las redes, ya que el arrastre minimiza esta fuente de error (Boltovskoy, 1981). Trabajos en la zona como el de Castaño (1991) reportaron abundancias mayores a las registradas en este estudio, esto en razón a las diferencias en cuanto a la técnica de muestreo empleada. En conclusión, la rotiferofauna actual en el CP es más abundante y diversa que hace 16 años, antes de la reapertura de los canales de comunicación entre el río Magdalena y su antiguo delta. Así mismo, la concentración de oxigeno disuelto, pH y salinidad de las aguas del CP es diferente. Teniendo en cuenta que la salinidad es el factor que más influyó en la diversidad de rotíferos, la reapertura de canales probablemente favoreció el incremento en la diversidad de rotíferos en el CP.
AGRADECIMIENTOS
Los autores desean agradecer a Héctor Jaime López y Johann Rodríguez, del Instituto de Investigaciones Tropicales -INTROPIC de la Universidad del Magdalena por su colaboración en la recolección de las muestras en campo. Lilia Castellanos, del laboratorio de Ecología del Departamento de Biología de la Universidad Nacional de Colombia, por facilitar los equipos e instalaciones durante la realización del trabajo. De forma especial, a la Universidad Nacional de Colombia. Este trabajo hace parte del programa de trabajo del Grupo Modelación de Ecosistemas Costeros, financiado por la Vicerrectorìa de Investigación de la Universidad Nacional de Colombia.
BIBLIOGRAFÍA
ÁVILA G. Variación y frecuencia de algunas especies de rotíferos provenientes de la ciénaga Grande de Santa Marta (Colombia). En Mitt. Inst. Colombo-Alemán Invest. Cient. 1973;7:15-29.
[
Links ]
ÁVILA G. Variación de grupos planctónicos presentes en la ciénaga Grande de Santa Marta (Junio 1971 -Mayo 1973). Divulgación Pesquera. Bogotá. Inderena. 1978;12:4-5.
[
Links ]
ARORA J, MEHRA N. Seasonal dynamics of rotifers in relation to physical and chemical conditions of the river Yamuna (Delhi), India. Hydrobiología. 2003;491:101-109.
[
Links ]
BLANCO J, VILORIA E, NARVÁEZ J. ENSO and salinity changes in the Ciénaga Grande de Santa Marta coastal lagoon system, Colombian Caribbean. Estuar., coast. shelf sci. 2006;66:157-167.
[
Links ]
BOLTOVSKOY D. Atlas del zooplancton del Atlántico Sudoccidental y métodos de trabajo con el zooplancton marino. Publicación especial de INIDEP. Mar del Plata, Argentina. 1981.
[
Links ]
BOSQUE R, HERNANDEZ R, PEREZ R, TODOLI R, OLTRA R. Effects of salinity, temperature and food level on the demographic characteristics of the Seawater rotifer Synchaeta littoralis Rousselet. J Exp Mar Bio Ecol. 2001;258:55-64.
[
Links ]
BOTERO L. Massive mangrove mortality on the Caribbean coast of Colombia. Vida Silvestre Neotropical. 1990;(2):77-78.
[
Links ]
BOTERO E, BOTERO, L. Problemática ambiental del sistema ciénaga Grande de Santa Marta, Delta Exterior del río Magdalena. En: Colombia y el agua: tres aspectos. FESCOL. Bogotá. 1989;5:9-28.
[
Links ]
BOTERO L, MANCERA J. Síntesis de los cambios de origen antrópico ocurridos en los últimos 40 años en la ciénaga Grande de Santa Marta (Colombia). Rev. Acad. Colomb. Cienc. 1996;20(78):465-474.
[
Links ]
BOTERO L, SALZWEDEL H. Rehabilitation of the Ciénaga Grande de Santa Marta, a mangrove-estuarine system in the Caribbean coast of Colombia. Ocean & Coastal Management. 1999;42:243-256.
[
Links ]
CASTAÑO J. Estudio de la composición y abundancia del zooplancton en el Complejo de ciénagas y caños de Pajarales (CCCP). [Tesis de pregrado]. Universidad de Bogotá Jorge Tadeo Lozano, Facultad de Biología Marina. Santa Marta. 1991. 210p.
[
Links ]
CARMONA G. Dinámica del zooplancton en la ciénaga Grande de Santa Marta a través del cambio de las estaciones del año. Informe final. Santa Marta: Invemar. 1988.
[
Links ]
CARDONA P, BOTERO L. Soil characteristics and vegetation structure in a heavily deteriorated mangrove forest in the Caribbean coast of Colombia. Biotropica. 1998;30(1):24-34.
[
Links ]
CLOREN JE. The relative importance of light and nutrient limitation of phytoplankton growth: a simple index of coastal ecosystem sensitivity to nutrient enrichment. Aquatic Ecol. 1999;33:3-16.
[
Links ]
COSEL RV. Moluscos de la región de la Ciénaga Grande de Santa Marta (costa del Caribe de Colombia). An. Inst. Invest. Mar Cost. Punta Betín, 1985;15/16:79-370.
[
Links ]
DE PAGGI S. Rotíferos de algunas provincias del Noroeste argentino. Rev. Hydrohiol. trop. 1989;22(3):223-238.
[
Links ]
DAY J, HALL M, KEMP, YAÑEZ-ARANCIBIA A. 1989. Estuarine Ecology. Jhon Willey y Sons, Inc., New York, USA. 558 p.
[
Links ]
EDMONSON W. (Ed.). Freshwater Biology. Wiley. New York. 1966.
[
Links ]
GIANNINI A, CHIANG J, CANE M, KUSHIR Y, SEAGER R. The ENSO teleconnection to the tropical Atlantic Ocean: contributions of the remote and local SSTs to rainfall variability in the tropical Americas, J. Clim. 2001;(14):4530-4544.
[
Links ]
FIELDER D, PURSER G, BATTAGLENE S. Effect of rapid changes in temperature and salinity on availability of the rotifers Brachionus rotundiformis and Brachionus plicatilis. Aquaculture. 2000;191(4):387.
[
Links ]
GOCKE K, MANCERA J, VIDAL L, FONSECA, D. Phytoplankton Composition in Coastal Lagoons of Different Trophic Status in Northern Colombia Determined By Microscope and HPLC-Pigment Analysis. Bol. Invest. Mar. Cost. 2003;32:263-278.
[
Links ]
GOCKE K, MANCERA J, VALLEJO A. Heterotrophic microbial activity and organic matter degradation in coastal lagoons of Colombia. Rev. Biol. Trop. 2003;51(1):85-98.
[
Links ]
HEINZ S, KRAUTER, D. Atlas de los Microorganismos de agua dulce. Ediciones Omega. 1987.
[
Links ]
HERNÁNDEZ J, HILDEBRAND P, ÁLVAREZ R. Problemática del manejo de los manglares con especial referencia al sector occidental de la Ciénaga Grande de Santa Marta, Magdalena, Colombia. Memorias del seminario sobre estudios científicos e impacto humano en el ecosistema de manglares. UNESCO, Cali, Colombia. 1980;363-386.
[
Links ]
HERNÁNDEZ C, GOCKE K. Productividad primaria en la Ciénaga Grande de Santa Marta, Colombia. An. Inst. Invest. Mar. Punta Betin. 1990;19-20:101-119.
[
Links ]
HOLLAND L, BRYAN C, PRESTON NEWMAN JR. Water quality and the rotifer populations in the Atchafalaya river Basin, Louisiana. Hydrobiologia. 1983;98:55-69.
[
Links ]
IGNOFFO T, BOLLENS S, BOCHDANSKY A. The effects of thin layers on the vertical distribution of the rotifer, Brachionus plicatilis. J Exp Mar Bio Ecol. 2005;316:167-181.
[
Links ]
KNOPPERS B. Aquatic primary production in coastal lagoons. pp. 219-260. In: B. Kjerfve (ed.). Coastal Lagoons Processes. 1993. Elsevier Science Publisher B.V.
[
Links ]
LAM-HOAI T, GUIRAL D, ROUGIER C. Seasonal change of community structure and size spectra of zooplankton in the Kaw River estuary (French Guiana). Estuar., coast. shelf sci. 2006;68 (1-2):47-61.
[
Links ]
LEON-RUBRICHE JA. Atributos Estructurales de la comunidad mesozooplanctónica de la ciénaga Grande de Santa Marta Durante el período de agosto de 2001 a mayo de 2002. [Tesis Pregrado Biología Marina]. Universidad Jorge Tadeo Lozano. Facultad de Biología Marina, Santa Marta, D.T.C.H. 2004. 141 p.
[
Links ]
MARGALEF R. Limnología. Ediciones Omega S.A. Barcelona. 1983.
[
Links ]
MITSCH W, GOSSELINK J. Wetlands. 2nd ed. Van Nostrand Reinhold, New York. 1993. 722 p.
[
Links ]
MINISTERIO DE MEDIO AMBIENTE. Memorias Curso de Entrenamiento en Manejo de Humedales. Coveñas (Sucre), Suesca (Cundinamarca). Abril 3 al 13, 2000.
[
Links ]
MOGOLLÓN A. Estructura de la comunidad fitoplanctónica del complejo Pajarales y Salamanca. [Tesis de pregrado]. Santa Marta. Universidad de Bogotá Jorge Tadeo Lozano, Facultad de Biología Marina. 1996.
[
Links ]
NEUMANN-LEITÃO, PARANAGUÁ M, VALENTIN J. The planktonic rotifers of the estuarine lagunar complex of Suape (Pernambuco, Brazil). Hydrobiologia. 1992;232 (2):133-143.
[
Links ]
NIXON SW. Nutrients dynamics, primary production and fisheries yield of lagoons. Oceanol. Acta. 1982;125:357-371.
[
Links ]
PUIGAGUT J, SALVADÓ H, TARRATS X, GARCÍA J. Effects of particulate and soluble substrates on microfauna populations and treatment efficiency in activated sludge systems. Water Res. 2007;41(14):3168-3176.
[
Links ]
PARK G, MARSHALL H. The Trophic Contributions of Rotifers in Tidal Freshwater and Estuarine Habitats. Estuar., coast. shelf sci. 2000;51:729-742.
[
Links ]
PROCIÉNAGA. Proyecto de rehabilitación de la ciénaga Grande de Santa Marta. Plan de manejo ambiental de la Subrregión Ciénaga Grande de Santa Marta 1995-1998. Santa Marta. 1995. 119p.
[
Links ]
REID W, WOOD R. Ecology of Inland Waters and Estuaries. Second Edition. Van Nostran Company; New York. 1976. 485 p.
[
Links ]
RENTERIA B. Fauna planctónica de la Ciénaga Grande de Santa Marta y su relación con el medio. En Divulgación Pesquera. Bogotá: Inderena, 1977; Vol 10 (4-5):1-41.
[
Links ]
RIVERA M, ROBERT R, MANCERA E, ALCANTARA A, CASTAÑEDA E, CASAS O, et al. Aventuras y Desventuras en Macondo: Rehabilitación de la Ciénaga Grande de Santa Marta, Colombia. ECOTROPICOS. 2006;19(2):72-93.
[
Links ]
RODRÍGUEZ JD. Producción primaria fitoplanctónica y respiración pelágica en el Complejo Pajarales-Ciénaga Grande de Santa Marta, después de su recomunicación con el río Magdalena. [Tesis pregrado]. Universidad del Magdalena, Santa Marta, Colombia. 2007; 101 p.
[
Links ]
RONDÓN E. Estimación de la productividad primaria fitoplanctónica en las ciénagas del Complejo Pajarales, Caribe Colombiano. [Tesis pregrado]. Universidad Javeriana, Bogotá, Colombia. 1991; 80 p.
[
Links ]
ROUGIER C, POURRIOT R, LAM-HOAI T, GUIRAL D. Ecological patterns of the rotifer communities in the Kaw River estuary (French Guiana). Estuar., coast. shelf sci. 2005;63(1-2):83-91
[
Links ]
SANTOS-MARTINEZ A, BATEMAN E, VILORIA M, RUEDA L, GRIJALBA R, TIJARO JC, et al. Variación temporal y espacial de la estructura de la comunidad íctica de algunas ciénagas del Complejo de Pajarales-Delta Exterior del río Magdalena. En: J.E. Mancera (ed.). Monitoreo del efecto ambiental de la construc-ción de canales en el Delta Exterior del río Magdalena. Inf. Avance. 1997; INVEMAR, Santa Marta 91 p. SLADECEK V. Rotifers as indicators of water quality. Hidrobiologia. 1983;100:169-201.
[
Links ] [
Links ]
STEIDINGER K, MELTON H. Harmful microalgae and Associated Public Health Risks in the Gulf of Mexico. United States Environmental Protection Agency Gulf of Mexico Program. 1999. St. Petersburg, FL: Marine Research Institute.
[
Links ]
SUBBA-RAO. Coastal Lagoon Research, present and future. UNESCO technical paper in marine science 33. Proceeding of a seminar Duke University Marine Laboratory Beaufort, NC, USA. 1978; p 191-231.
[
Links ]
UNESCO. Determinations of photosynthetic pigments in sea water. Monographs on Oceanographic methodology. UNESCO. Paris. 1966;1:11-18.
[
Links ]
VALDERRAMA R. Aspectos ecológicos de la comunidad del zooplancton nerítico en el departamento de Magdalena. [Tesis de maestría]. Universidad Nacional de Colombia, sede Bogotá. 1994; 72 p.
[
Links ]
YAÑEZ-ARANCIBIA R, NUGENT R. El papel de los peces en estuarios y lagunas costeras. An. Centro.Cienc. Mar. Limnol. Universidad Autónoma de México. 1977;4(1):107-114.
[
Links ]
ZOPPI DE ROA E, PARDO M, VÁSQUEZ W. Nuevas adiciones a la fauna de rotíferos de Venezuela. Reu. Hydrobiol. Trop. 1993;20(3):165-173.
[
Links ]
 Cited by SciELO
Cited by SciELO  Access statistics
Access statistics
 Cited by Google
Cited by Google  Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google 


















