Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.13 no.2 Bogotá May./Aug. 2008
CARACTERIZACIÓN Y EVALUACIÓN in vivo E in vitro DEL LIPOPOLISACÁRIDO DE Aeromonas hydrophila
In Vitro/In Vivo Characterization And Evaluation Of Aeromonas hydrophila Lipopolysacharides (LPS)
JIMÉNEZ AP1, IREGUI CA1, FIGUEROA J1.
Universidad Nacional de Colombia, Facultad de Medicina Veterinaria y de Zootecnia, Departamento de Ciencias para la salud animal, Grupo de Investigación en Fisiopatología Veterinaria, Bogotá D.C., Colombia. Carrera 30 No. 45-03, edificio 481. Tel.: 57 1 316 55 75 apjimenezle@unal.edu.co -dcairegui@veterinaria.unal.edu.co
Presentado 7 de marzo de 2006, aceptado 23 de febrero de 2008, correcciones 31 de marzo de 2008.
RESUMEN
A partir de una cepa de A. hydrophila aislada de un brote de enfermedad septicémica en Tilapia nilótica (Piaractus brachypomusoreochromis niloticus), se obtuvieron extractos de lipopolisacárido (LPS) crudo (29,5 mg/ml) y semipurificado (106,5 mg/ml) mediante la técnica fenol-agua caliente descrita por Westphal, Jann (1965). La presencia de proteína fue del 2,3% para el extracto crudo y de 0,1% para el semipurificado; la concentración de polisacáridos osciló entre el 15 y 26%. En electroforesis (SDS-PAGE) se observaron bandas de 14 Kd correspondientes al oligosacárido central y al lípido A del LPS. Tres ratones de 25-35 g fueron inoculados intraperitonealmente con 25 mg/Kg de LPS cru-do, a partir de la primera hora todos los animales mostraron erizamiento, taquipnea e inapetencia; microscópicamente se detectó congestión hepática y pulmonar, hemorragias pulmonares y renales, marginación leucocitaria en hígado y pulmón con predominio de polimorfo-nucleares neutrófilos (PMN) en todos los animales, mostrando un mayor efecto que el control inoculado con LPS de E. coli (Sigma®) a la misma concentración. In vitro el LPS crudo a concentración de 10, 20 y 30 µg/ml indujo proliferación de células mono-nucleares murinas (2 x 10 5 en 200 µl de medio DMEM) por incorporación de timidina tritiada; tanto el LPS control (E. coli), como el LPS crudo de A. hydrophila mostraron cuentas por minuto (CPM ) ascendentes de manera dosis dependiente, el LPS de A. hydrophila desencadeno una proliferación muy similar a la inducida por el control.
Palabras clave: lipopolisacárido (LPS), Aeromonas hydrophila, peces, endotoxemia, proliferación de mononucleares.
ABSTRACT
Aeromonas hydrophila isolated from a septicemic disease outbreak in tilapia (Piaractus brachypomusoreochromis niloticus) was used to prepare crude (29.5 mg/ml) and semipurified (106.5 mg/ml) lipopolysacharide extracts (LPS) based on the phenol-hot water protocol (Westphal and Jann, 1965). Protein contents were 2.3% and 0.1% for the crude and the semipurified extracts, respectively, while the polysacharides ranged from 15 to 26%. SDS-PAGE showed 14 Kd bands for the central oligosacharide and lipid A of the LPS. Mice (n=3) (25 ~ 35 g) that were intraperitoneally injected (25 mg crude LPS) showed after the first hour bristled fur, tachypnea and loss of appetite. Congestion (liver, lung), hemorrhages (kidney, lung), leukocytes margination -mainly PMN neutrophils-(liver, lung) were the most remarkable microscopic features. These effects were more evident than those found in controls injected with E. coli LPS (Sigma®). Crude LPS at 10, 20 and 30 mg/ml induced In vitro proliferation of murine mononuclear cells (2 x 105 in 200 ml DMEM) by use of tritiated thymidine. Both the crude A. hydrophila and the control E. coli LPS extracts showed dosed-dependent increasing counts per minute. The A. hydrophila LPS elicited a proliferation very similar to the one induced by the control.
Key words: Lipopolysacharide (LPS), A. hydrophila, fish, endotoxemia, mononuclear proliferation.
INTRODUCCIÓN
La Aeromonas hydrophila es un cocobacilo Gram(-) que pertenece a un grupo de bacterias (familia Aeromonidae) móviles, anaerobias facultativas implicadas en una gran variedad de infecciones que afectan a los peces y al ser humano. En los peces ocasiona un cuadro típico de septicemia hemorrágica debido a la acción de la bacteria, factores de superficie y productos extracelulares de cierta virulencia. Puede producir enfermedad como patógeno primario y en ocasiones como oportunista, ocasionando grandes pérdidas económicas en el ámbito mundial (Dooley et al., 1987; Loghothetis y Austin, 1996; Makapú, 1996). En humanos induce patologías de importancia como: gastroenteritis, meningitis y endocarditis, entre otras (Dooley et al., 1986; Hernández y Rodríguez,1997; Garcia et al., 1999; Popovic et al.,2000). El LPS o endotoxina ubicado en la membrana externa de la pared celular de todas las bacterias G(-) es un factor importante en el desencadenamiento de patologías en mamíferos y aves (Luderits et al., 1984; Freeman, 1989; Risco y Pinto, 1995). Esta molécula ayuda a mantener la integridad de la bacteria ante condiciones adversas, pero por otro lado representa la parte responsable de la inducción de efectos nocivos en el hospedero. Sin embargo, en algunas especies de peces la endotoxina parece no tener los mismos efectos adversos (Cahill, 1990; Dalmo y Bogwald,1996). El objetivo de este trabajo es la extracción, caracterización y evaluación in vitro e in vivo del LPS de A. hydrophila, lo cual sirvió de base para estudios paralelos de la patogénesis inducida por esta molécula en especies de peces nativas como la cachama blanca (Piaractus brachypomus) y en exóticas como la tilapia roja (Piaractus brachypomusoreochromis spp.).
MATERIALES Y MÉTODOS
CEPA
Se utilizó una cepa de A. hydrophila aislada de un brote de enfermedad septicémica en tilapia nilótica (Piaractus brachypomusoreochromis niloticus). Fue evaluada en cuanto a su pureza, características de cultivo y bioquímicas típicas del género y especie (Pellitero et al., 1988). Se complementó la identificación por el sistema Cristal de BBL® . La cepa fue virulentada mediante pasajes tanto en tilapias rojas (Piaractus brachypomusoreochromis spp.) como en cachamas blancas (Piaractus brachypomus) (Rey, 2002; Verjan,2002). Se empleó una solución bacteriana madre que contenía 109 UFC. Se utilizaron grupos de animales (con cinco individuos en cada grupo), se les inoculó 0.1ml intraperitoneal de diferentes diluciones de la solución bacteriana y fueron mantenidos hasta la presentación de sintomatología, momento en el cual fueron retirados para aislamiento de la bacteria a partir de órganos como hígado, riñón y bazo.
OBTENCIÓN BIOMASA BACTERIANA
Se hicieron siembras seriadas en cajas de petri, frascos Roux y tubos de ensayo de 30 mm con agar soya tripticasa (AST), incubando a 28 ºC durante 24 horas. La suspensión bacteriana se inactivó con 0,1% (p/v) de timerosal. Las bacterias fueron colectadas por centrifugación a 7.000 rpm/50 min y lavadas tres veces con SSF.
OBTENCIÓN Y SEMIPURIFICACIÓN DEL LPS
Se practicó la extracción fenol agua caliente descrita por Whesphal y Jann (1965). A la biomasa bacteriana cultivada en agar soya tripticasa (AST) se adicionó 40 ml de agua destilada estéril precalentada a 68 ºC, se adicionó un volumen igual de fenol al 90% a la misma temperatura, la mezcla fue mantenida al baño maría a 68 ºC durante 30 min con agitación permanente, se refrigeró a 4 ºC durante 24 h, se centrifugó a 7.000 rpm/50 min. a 4 ºC (Rodríguez, 1992), después de lo cual fueron visibles cuatro fases: fase acuosa, interfase, fase fenólica y precipitado. Se recuperó la fase acuosa y el resto se sometieron de nuevo en conjunto al procedimiento anterior para una segunda extracción, finalmente se recolectaron las fases acuosas. A éstas se les adicionó etanol al 95% en proporción 1:10, se mantuvieron a -20 ºC/18 horas para precipitar el LPS crudo y se centrifugaron a 3.500rpm/30 min. (Rodríguez, 1992). El procedimiento fue repetido para obtener finalmente dos extractos crudos, uno se almacenó a -20 ºC y el segundo fue semipurificado con 100 mg/ml de proteinasa K (Sigma ®) y ultracentrifugación a 32.000 rpm/3 horas.
CARACTERIZACION DE LOS EXTRACTOS
Cuantificación de la concentración de LPS. Se cuantificó el LPS mediante el método descrito por Lee y Tsai (1999), quienes adaptaron el ensayo colorimétrico propuesto por Quesenberry y Lee (1996). La oxidación con metaperiodato produce formaldehído y LPS-aldehído, el formaldehído reacciona con Purpald (Sigma®) (4-amino-3-hydrazino-5-mercapto-1,2,4-triazole) formando un compuesto que con una fuerte oxidación con NaIO4 es convertido en un producto final de color púrpura que absorbe a 550 nm. Se construyó una curva de calibración con LPS comercial de Escherichia Coli (Sigma®), empleando concentraciones cada 50 µg desde 0 hasta 500 µg /ml.
Concentración de polisacáridos y proteínas. Se cuantificó la concentración de polisacáridos mediante el procedimiento colorimétrico de Dubois et al. (1956), construyendo una curva de calibración con D-glucosa a concentración de 1.000, 500, 250, 125, 62,5, 31,25 y 0 µg/ml. A cada dilución o extracto de LPS se adicionó 1 ml (volumen igual) de fenol al 5% (p/v) y 5 ml de ácido sulfúrico absoluto, se incubó a temperatura ambiente por 30 minutos y se midió la absorbancia a 500 nm. Para determinar la concentración de proteínas se empleó la técnica de Bradford (1976). Se construyó una curva de calibración con albúmina sérica bovina a concentraciones desde 0 hasta 400 µg/ml, aumentando 40 mg cada vez. A 50 µl de cada dilución y del LPS se adicionó 200 µl de reactivo de Bradford (Bradford, 1976), se incubó a temperatura ambiente por 25 minutos y se midió la absorbancia a 595 nm. Para la cuantificación de los extractos se tuvo como control el LPS de E. coli (Sigma®).
Electroforesis en gel de poliacrilamida con dodecil sulfato de sodio (SDS-PAGE). El sistema utilizado fue el descrito por Laemmli (1970), se empleó un gel de enfoque o partida y un gel de separación. La concentración de acrilamida en el gel de enfoque o partida fue de 4,5% (también llamado gel de concentración) y de 12,5% en el gel de separación (o de resolución). Las muestras de LPS fueron mezcladas en proporción 1:5 con buffer de muestra: (Tris HCl 1M pH 6,8, SDS al 20%, glicerol, B-mercaptoetanol, agua desmineralizada, azul de bromofenol al 0,02%) y puestas a ebullición por 5 min (Dooley et al., 1985; Dooley et al., 1986; Dooley y Trust,1987). En cada carril del gel de concentración se colocaron 15 µl (60 µg) tanto del LPS crudo como del semipurificado de A. hydrophyla y 160 µg del LPS de E. coli (Sigma®). Se utilizó un patrón de proteínas de bajo peso molecular: fosforilasa B (97 Kd), albúmina sérica bovina (66Kd), ovoalbúmina (45 Kd), anhidrasa carbónica (31 Kd), tripsinógeno (24 Kd) y lisozima (14 Kd). La electroforesis se llevó a cabo a 100 voltios por 90 minutos (Moreno y Mejía, 1989). Para visualizar el LPS se practicó tinción de plata según la metodología descrita por Tsai y Frasch (1982). Finalmente se tiñó una segunda vez con azul brillante de Coomasie para colorear las proteínas.
PRUEBAS DE ACTIVIDAD BIOLÓGICA CON EL LPS CRUDO
Prueba in vivo: efecto en ratones inoculados intraperitonealmente. Se inocularon intraperitonealmente tres ratones machos y hembras entre 25 a 35 g de peso con 25 mg/kg (0,5 ml) de LPS crudo de A. hydrophila; se inyectó un ratón control con SSF y uno con LPS de E. coli (25 mg/kg). Se observaron por un periodo de 48 horas, después se practicó necropsia y toma de muestras para histopatología por hematoxilina eosina.
Prueba in vivo: proliferación mononuclear por incorporación de timidina tritiada. La respuesta proliferativa frente al LPS se evaluó en células mononucleares murinas utilizando el LPS de E.coli y el extracto crudo obtenido en este trabajo mediante la técnica practicada por Parra (2002). El bazo de ratones Balb/c se colocó en medio de cultivo DMEM con glutamina, bicarbonato y piruvato de sodio (ICN ®) con 3% de suero bovino fetal (SFB) (GIBCO gold ®) y 0,01% de B-mercaptoetanol (ICN ®). Las células mo-nonucleares (MN) se obtuvieron por separación de las esplénicas en gradientes de ficollhypaque(Lymphoset ICN ®) y se cultivaron en placas de 96 pozos fondo U (NUNC ®)a una concentración de 2x105 células/pozo en 200 µl de medio DMEM suplementadocon glutamina y 6% de SFB, 100 µg de estreptomicina, 100 UI de penicilina y 10 UI degentamicina (GIBCO ®). Los controles para inducir proliferación fueron phytohe-moaglutinina (PHA) 5 µg/pozo (ICN ®)y LPS de E. coli10, 20 y 30 µg. Se determinó laproliferación para 10, 20 y 30 µg de LPS crudo. El ensayo se realizó por triplicado. Elcontrol negativo eran células MN no estimuladas. Las placas se incubaron durante 72horas a 37 °C en 5% de CO2y luego se agregó a cada pozo 1 µCi de timidina tritiadadiluida en DMEM sin suero (ICN ®) y se incubó durante 16 horas. Los cultivos fueronrecolectados con un cosechador de células (NUNC ®) para 8 pozos y depositados enfiltros de celulosa (NUNC ®). Cada uno de los pozos, que corresponde a un filtro in-dividual, se depositó en viales de plástico a los cuales se adicionó líquido de centelleoBCS (AMERSHAM ®). La emisión de radioactividad beta fue medida en un contadorde centelléo (COUNTER SERIE 2000), durante un minuto para cada vial.
RESULTADO
CEPA
La Tabla.1 describe los resultados de las diferentes pruebas bioquímicas y de cultivode la cepa, las cuales siempre correspondieron al perfil patrón reportado internacionalmente.
En los diferentes pases por peces se comprobó la patogenicidad de la cepa, a partir de la primera hora de inoculados los animales mostraron la sintomatología descrita para la enfermedad. La cepa inoculada se recuperó de bazo, hígado y riñón de ani-males moribundos. La dosis que se demostró como infectiva para tilapias fue de 5,9x107 y de 5,8x107 UFC para cachamas (Rey, 2002; Verjan, 2002).
OBTENCIÓN Y CARACTERIZACIÓN DEL LPS
Extracción del LPS. Después de las siembras seriadas de la cepa se obtuvieron 276 ml y 321 ml de suspensión bacteriana en las dos extracciones practicadas, de las cuales a su vez se obtuvieron 9,49 g y 18,24 g de peso bacteriano en materia húmeda. Al finalizar el procedimiento de extracción se observaron cuatro fases: precipitado, fase fenólica, interfase y fase acuosa. Después de la extracción y reextracción se colec taron 83 y 75 ml de fases acuosas en los dos ensayos. Después de centrifugar las fases acuosas a 3.500 rpm/30 minutos se obtuvo un precipitado viscoso blanquecino que según lo reportado por la literatura corresponde al LPS crudo. El extracto crudo y el semipurificado fueron suspendidos en agua destilada estéril y mantenidos a -20 ºC.
Cuantificación de los extractos. La concentración de LPS en el extracto crudo fue de 29,5 mg/ml y de 106,5 mg/ml en el semipurificado. El contenido polisacárido del LPS de E. coli fue del 32%, del LPS crudo 26% y del semipurificado 15%. La fase acuosa mostró mayor concentración de polisacáridos: 2.811 mg/ml en comparación con la fenólica: 2.000 mg/ml. Mediante la técnica de Bradford (1976) no se detectaron proteínas en el LPS de E. coli, mientras que el LPS crudo de A. hydrophila contenía 371,3 mg/ml (2,3%) y el semipu rificado 274,2 mg/ml (0,1%). Las fases acuosas contenían una concentración menor de proteínas (407,9 mg/ml) en comparación con las fenólicas (1.735 mg/ml).
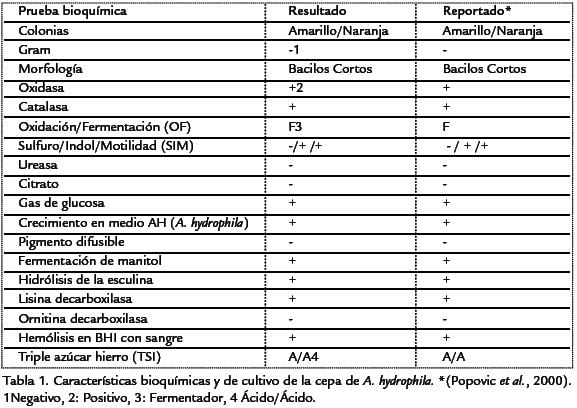
Identificación del LPS por SDS-PAGE. Para ambos extractos de LPS (crudo y semipu rificado) se identificaron bandas de migración rápida (bajo peso molecular: 14 Kd) de color marrón a la tinción de plata, no se observaron bandas definidas de baja migración (alto peso molecular: 66 Kd a 97 Kd). El LPS de E. coli también mostró bandas definidas de alta migración (Fig. 1 ). Tanto en el LPS de E. coli como en los dos extractos de LPS de A. hydrophila no se detectaron proteínas con azul brillante de Coomasie. En contraste, fueron claramente detectables las proteínas del patrón de peso molecular (Fig. 1 ).
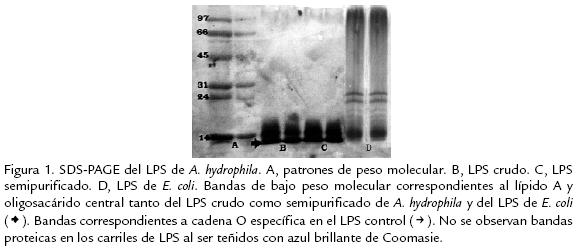
Comprobación de la actividad biológica del LPS crudo.
in vivo. A partir de la primera hora los ratones inoculados con LPS crudo mostraron signos como depresión, erizamiento, inapetencia, letargia, taquipnea y cierre de los párpados con secreción serosa. Macroscópicamente no se apreciaron cambios, microscópicamente se demostró congestión hepática y pulmonar, hemorragias pulmonares y renales, marginación leucocitaria en hígado y pulmón con predominio de polimorfonucleares neutrófilos (PMN), además de un aumento de la celularidad en los septos alveolares (Fig. 2 ). Hubo una reacción inflamatoria con predominio de PMN en el sitio de la inoculación.
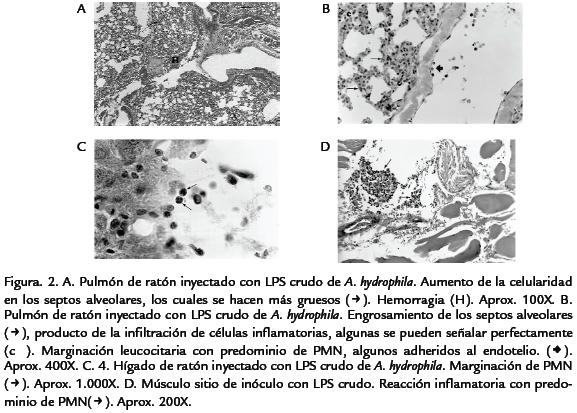
El control negativo inyectado con SSF no mostró síntoma alguno, ni lesiones macro ni microscópicas (Fig. 2 ). El control positivo al que se le administró LPS de E. coli expresó erizamiento y letargia en las primeras horas después de inoculado. Microscópicamente solo hubo aumento leve de la celularidad de los septos alveolares.
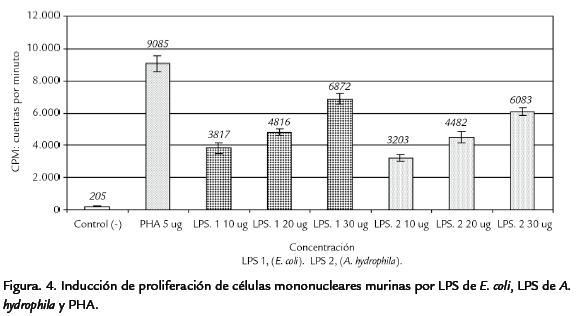
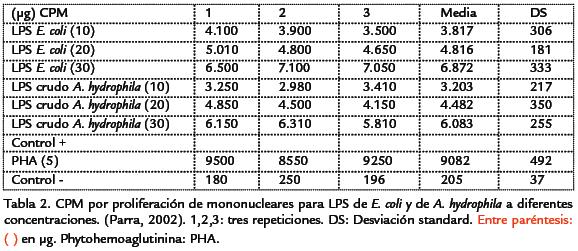
In vitro. En el ensayo (por triplicado) se obtuvo proliferación de células mononucleares para las distintas concentraciones de LPS de E. coli y LPS crudo de A. hydrophila. La Tabla.2 resume los datos del ensayo. En la Figura. 4 se grafica la media y sus respectivas cuentas por minuto (CPM).
DISCUSIÓN
Los signos clínicos en los peces inoculados con la bacteria revelaron la virulencia dela cepa, los mismos concuerdan con lo reportado por Doukas et al.(1998), talescomo nado anormal, palidez de las branquias, inflamación abdominal con acúmulode líquido en la cavidad peritoneal, eritema y protusión del ano y hemorragias pete-quiales en el costado del cuerpo y base de las aletas.
Las cuatro fases obtenidas por el procedimiento fenol agua caliente para la extraccióndel LPS descrito por Westphal y Jann (1965) fueron demostradas por Moreno y Mejía(1989) y Rodríguez (1992) en la extracción del LPS de Brucella abortusy E. coli, respec-tivamente. Éstas fueron: fase acuosa con presencia de LPS, polisacáridos y ácidos nu-cléicos; fase fenólica rica en proteínas y compuestos fuertemente ligados a ellas, inter-fase en la que se encuentran proteínas precipitadas y un precipitado conformado porrestos de la biomasa bacteriana. Esta distribución de los componentes de la pared bac-teriana de la A. hydrophilaen la fase acuosa y fenólica se comprobó por la cuantificaciónde polisacáridos y proteínas. La concentración de proteínas en la fase fenólica fuemucho mayor que en la fase acuosa y si se tiene en cuenta que ella fue medida antes dela reextracción, seguramente la concentración de proteínas disueltas en este último casosería más alta. Por el contrario, la concentración de polisacáridos fue mayor en la faseacuosa. Lo anterior corresponde con lo reportado por diferentes autores (Chart et al.,1984; Dooley et al., 1985; Fricker, 1987; Merino et al., 1992; Dalmo y Bogwald,1996; Merino et al., 1996; Aguilar et al., 1997). Además, muchos autores han logrado extraer LPS crudos de la misma bacteria de esta fase por el mismo método. El gel viscoso blanquecino precipitado por la adición de etanol correspondiente al LPS crudo, es similar al reportado por Moreno y Mejía (1989), Rodríguez (1992) y Teran y Tibata (1996). En nuestro trabajo se comprobó que este precipitado posee, aunque en pequeña proporción, otros componentes bacterianos como proteínas y que la remoción de éstas por digestión enzimática, ampliamente utilizada por otros autores (Fukushi et al., 1963; Morrison y Leive, 1975; Dooley et al., 1985; Phillips et al., 1989) disminuye casi a cero el contenido de proteínas. Nuestros resultados concuerdan con los de Morrison y Leive (1975) y Phillips et al. (1989), quienes encontraron menos del 1% de proteína en LPS de Brucella abortus y E. coli. Dooley et al. (1985) reportaron concentraciones de 1,0 y 1,4% en extractos de LPS de A. hydrophila tratados con esta misma enzima. El extracto crudo tuvo cerca del 2% de proteínas pero en comparación con otros trabajos con el mismo método de extracción, se obtuvo una concentración menor de proteínas. Phillips et al. (1989) reportaron 8-15% de proteínas en extractos sin tratamiento enzimático. La concentración de polisacáridos en el LPS varía dependiendo de la cepa, el método de cultivo, el proceso de extracción, etc. En nuestro caso la concentración fue del 15 al 26% y para el LPS control fue del 32%, valores que se encuentran dentro de los documentados (Fukushi et al., 1963; Morrison y Leive, 1975). Fukushi et al. (1963) encontraron gran variabilidad en las concentraciones de polisacáridos para el LPS de E. coli entre el 10 al 70%, dependiendo del método de extracción; según este mismo autor el LPS de E. coli extraído con fenol contiene cerca del 40% de carbohidratos. En contraste, para LPS de cepas de Brucella abortus extraídos por el mismo método Phillips et al. (1989) obtuvieron concentraciones menores de polisacáridos (13 al 20%). La concentración de polisacáridos dependerá básicamente del número de unidades oligosacáridas que contenga la cadena O específica, Fomsgaard et al. (1990) afirman que preparaciones de LPS lisos pueden tener un rango de 0 a 40 unidades repetidas de oligisacáridos en la cadena O. Para el LPS de A. hydrophila Dooley et al. (1985) obtuvieron aproximadamente 10 unidades repetidas. Existen variaciones en los perfiles electroforéticos del LPS de diferentes cepas de A. hydrophila, pero la mayoría de autores reportan bandas de bajo peso molecular (14 Kd), las cuales aparecen en todos los LPS de todas las cepas analizadas por SDSPAGE y que corresponden al oligosacárido central y al lípido A. Las otras bandas, que corresponden a la cadena O específica, muestran bastantes diferencias entre cepas: algunos autores reportan cepas con LPS de cadena O con longitudes muy similares (un número significativo de cepas corresponden a este grupo), otras cepas consideradas como de menor virulencia muestran cadenas de longitudes diferentes, pueden encontrarse otras cepas mutantes cuyo perfil electroforético únicamente muestra bandas de bajo peso molecular ya que carecen de cadena O específica (Mittal et al.,1980; Dolley et al., 1985; Dooley et al., 1986; Dooley y Trust, 1986; Khashe et al., 1996; Aguilar et al., 1997). Las SDS PAGE practicadas en este trabajo detectaron bandas de alta migración, bajo peso molecular (14 Kd) tanto en el LPS control de E. coli como en los extractos de LPS de A. hydrophila, estas bandas marrón concuerdan con las reportadas para el mismo tipo de electroforesis y tinción del LPS de Aeromonas y muchas otras bacteria G (-) (Dooley et al., 1985; Kido et al., 1989).
A diferencia del LPS control, en los extractos de LPS de A. hydrophila no se detectaron bandas de mayor peso molecular correspondientes a la cadena O (Chart et al., 1984), esto puede deberse a que el polisacárido O no haya sido identificado por la tinción utilizada; algunos autores limitan la sensibilidad de la tinción de plata: Kido (1989) sostiene que cadenas O de algunas enterobacterias tienen poca sensibilidad a esta tinción, más comúnmente se detectan las bandas que representan al lípido A y al oligosacárido central; no es claro el mecanismo por el cual se interfiere la unión de los iones plata a la cadena O específica. Aunque se sugiere que la porción sacárida es el componente reactivo en esta tinción, algunos proponen que serían los ácidos grasos del lípido A el sitio de unión de los iones plata a través de la formación de complejos π (Kropinski et al., 1986). Fomsgaard et al. (1990) afirman que el LPS de algunas enterobacterias no tiñe por este método, pero al practicar immunoblotting son visualizados claramente lo que indica que algunas preparaciones de LPS aunque son inmunoreactivas no son detectables por el método tradicional. Este hecho podría explicar la dificultad para identificar la cadena O del LPS de A. hydrophila en nuestro trabajo. La tinción con azul de Coomasie no detectó bandas de proteínas en el LPS patrón ni en el extracto crudo ni en el semipurificado del LPS de A. hydrophila, esto coincide con la baja concentración de proteínas determinada en los extractos. Khashe et al. (1996) reportaron que bandas de proteínas de la pared celular de cepas de A. hydrophila son resueltas por SDS-PAGE con un rango de peso molecular de 30-85 Kd y se les observa principalmente en el rango de 58-60 Kd y 38-45 Kd. Se reportó que la mayoría de proteínas de superficie en diferentes cepas de A. hydrophila tienen un peso molecular de 3055 Kd. Merino et al.(1996) reportaron un rango similar. En nuestro trabajo en el área correspondiente a estos pesos moleculares no se demostró ningún tipo de bandeo, lo que concuerda con la baja concentración proteica de los extractos, puesto que en la extracción la gran mayoría de proteínas de la pared celular son disueltas en el fenol.
El hecho de que todos los ratones inoculados con LPS de A. hydrophila mostraron signología, lesiones macro y microscópicas, nos da certeza que el extracto mantuvo sus características químicas y biológicas durante y después del proceso de extracción. El LPS una vez llega al plasma desencadena la liberación de mediadores, reacciona con células del sistema fagocítico mononuclear al ser reconocido mediante el complejo LBP-LPS por el CD14 de membrana. El CD14 soluble en el suero une LPS para estimular otro tipo de células como las endoteliales y del músculo liso (Schletter et al., 1995). Las lesiones como marginación, adhesión al endotelio, infiltración perivascular con predominio de neutrofilos, focos de congestión, hemorragias, etc. en los ani-males inoculados con LPS crudo, se explican por la liberación de estos mediadores. Todos estos hallazgos fisiopatológicos que involucran la microvasculatura han sido reportados como consecuencia de la estimulación con LPS (Goodman et al., 1979; Dahinden et al., 1983; Mark, 1985; Ryan y Morrison, 1987). La principal célula de respuesta de defensa en los ratones de este estudio fueron los PMN, según Mark (1985) los neutrófilos son unas de las células blanco más importantes para las endotoxinas, por radioautografia demostró la unión de LPS de E. coli conjugado con H3 (tritio) a granulocitos en sangre periférica de ratones, además la endotoxina en asocio con granulocitos se encontró en la vasculatura de pulmón, hígado, riñón y bazo. Mathison y Ulevitch (1979) examinaron la distribución celular de endotoxina conjugada con 125 en ratones, después de dos minutos de la inyección endovenosa el LPS se unió al 40% de PMN en sangre periférica, además de unir monocitos y macrófagos. La proliferación de células mononucleares inducida con el LPS control y el LPS de A. hydrophila, también confirmó que nuestros extractos son biológicamente activos, estimulando la liberación de mediadores que inducen proliferación celular y aumento de la reacción inflamatoria. La habilidad del LPS para inducir mitogénesis de células del sistema inmune in vitro e in vivo ha sido ampliamente demostrada (Anderson et al., 1973; Yeh y Jacobs, 1992; Souvannavong et al., 1999, Parra, 2002). Yeh y Jacobs (1992) utilizaron 5 µg/ml de LPS de Salmonella typhimurium e indujeron mitogénesis esplénica en ratón. Parra (2002) obtuvo 5.000 CPM en células mononucleares de ratón empleando 20 µg de LPS de Pasteurella multocida. Estos reportes concuerdan con la mitogénesis desencadenada por el LPS de A. hydrophila y de E. coli en este trabajo. Según Anderson et al. (1973) el lípido A sería el componente activo para la mitogénesis en células murinas; Yeh y Jacobs (1992) sostienen que la cadena O modularía la mitogénesis de linfocitos inducida por el lípido A; LPS de cadenas O de mayor longitud tienen mayor efecto proliferativo que LPS de cadenas O cortas. En este trabajo tanto el LPS de E. coli como el de A. hydrophila mostraron CPM ascendentes de una manera dosis dependiente, la repetibilidad en las tres réplicas unido a que los controles positivos y negativos se comportaron como tales, da certeza de la confiabilidad de la prueba. La media demostró que el LPS de A. hydrophila desencadenó una proliferación muy similar a la inducida por el LPS de E. coli control, tal es lo esperado por la similitud entre los LPS de diferentes bacterias G(-).
AGRADECIMIENTOS
A COLCIENCIAS, entidad financiadora de esta investigación; a los miembros del Grupo de Investigación en Fisiopatología Veterinaria de la Universidad Nacional de Colombia; al Dr. Gerardo Pérez y a los integrantes del laboratorio de Proteínas -Facultad de Química, Universidad Nacional de Colombia y a la Dra. Claudia Marcela Parra, Facultad de Ciencias, Pontificia Universidad Javeriana. La caracterización del LPS de A. hydrophila y la evaluación de su actividad biológica, permiten el inicio de estudios encaminados a dilucidar el papel en peces de esta molécula determinante en la patogénesis de enfermedades causadas por bacterias G(-) en mamíferos y aves.
BIBLIOGRAFÍA
AGUILAR A, MERINO S, RUBIRES X, TOMAS J. Influence of osmolarity on lipopolysaccharides and virulence of Aeromonas hydrophila serotype O:34 strains grow at 37 ºC. Infect.Immun. 1997;65:1245-1250.
[ Links ]ANDERSON J, MELCHERS F, GALANOS C, LUDERITZ O. The mitogenic effect of lipopolysaccharide on bone marrow derived mouse lymphocytes . Lipid A as mitogenic part of the molecule. J. Exp. Med. 1973;137:943-953.
[ Links ]BRADFORD MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 1976;72:248-254.
[ Links ]CAHILL M. Virulence factors in motile Aeromonas species. J. Appl. Bacteriol. 1990;69:1-16.
[ Links ]CHART H, SHAW DH, ISHIGURO E, TRUST TJ. Structural and immunochemical homogeneity of Aeromonas salmonicida lipopolysaccharide. J. bacteriol. 1984;158:16-22.
[ Links ]DAHINDEN C, GALANOS C, FEHR J. Granulocyte activation by endotoxin. J. Immunol. 1983;130:857-862.
[ Links ]DALMO RA, BOGWALD J. Distribution of intravenously and perorally administered Aeromonas salmonicida lipopolysaccharide in atlantic salmon, Salmo salar. Fish. Shellfish. Immunol. 1996;6:427-441.
[ Links ]DOOLEY J, LALLIER R, SHAW, TRUST TJ. Electrophoretic and immunochemical analyses of the lipopolysaccharides from various strains of Aeromonas hydrophila. J. Bacteriol. 1985;164:263-269.
[ Links ]DOOLEY J, LALLIER R, TRUS T. Surface antigens of strains of Aeromonas hydrophila. Vet. Immunol. Immunopathol. 1986;12:339-344.
[ Links ]DOUKAS V, ATHANASSOPOULOU F, KARAGOUNI E, DOTSIKA E. Aeromonas hydrophila infection in cultured sea bass, Dicentrarchus labrax L., and Puntazzo puntazzo cuvier from the aegean sea. J. Fish. Dis. 1998;21:317-320.
[ Links ]DUBOIS M, GILLES KA, HAMILTON JK, REBERS PA, SMITH F. Colorimetric method for determination of sugars and related substances. Anal. Chem. 1956;28:350-356.
[ Links ]FOMSGAARD A, FREUDENBERG MA, GALANOS C. Modification of the silver staining technique to detect lipopolysaccharide in polyacrylamide gels. J. Cl. Microbiol. 1990;28:2627-2631.
[ Links ]FREEMAN BA. Microbiología de Burrows. Editorial Interamericana. Edición 22. México. 1989.
[ Links ]FRICKER CR. Serotyping of mesophilic Aeromonas spp. On the basis of lipopolysaccharide antigens. Lett. Appl. Microbiol. 1987;4:113-116.
[ Links ]FUKUSHI K, ANACKER RR, HASKINS WT. Purification of endotoxin from enterobacteriacea: A comparision of selected methods and sources. J. Bacteriol. 1963;87:391-400.
[ Links ]GARCÍA CL, CLAVIJO AM, SANTANDER J. Incidencia del complejo Aeromonas spp. en algunas especies piscícolas en los estados Aragua, Carabobo, Monagas y Cojedes en Venezuela. Acuicultura 99, II congreso sur-americano de acuicultura. 1999. Resúmenes, 218-221.
[ Links ]GOODMAN ML, WAY BA, IRWIN JW. The inflammatory response to endotoxin. J. Pathol. 1979;128:7-14.
[ Links ]HERNÁNDEZ P, RODRÍGUEZ R. Prevalencia de Aeromonas spp. en agua de superficie. Arch. Latin. Nutr. 1997;47:44-46.
[ Links ]KHASHE S, HILL W, JANDA M. Characterization of Aeromonas hydrophila strains of clinical, animal, and environmental origin expressing the O:34 antigen. Current Microbiol. 1996;33:104-108.
[ Links ]KIDO N, OHTA M, KATO N. Detection of lipopolysaccharides by Ethidium bromide staining after sodium dodecyl sulfate-polyacrylamide gel electrophoresis. J. Bacteriol. 1989;172:1145-1147.
[ Links ]KROPINSKI AM, BERRY D, GREENBERG EP. The basis of silver staining of bacterial lipopolysaccharides in polyacrylamide gels. Curr. Microbiol. 1986;13:29-31.
[ Links ]LAEMMLI UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature (London). 1970;227:680-685.
[ Links ]LEE CH, TSAI CM. Quantification of bacterial lipopolysaccharides by the purpald assay: measuring formaldehyde generated from 2-keto-3- deoxyoctonate and heptosa at the inner core by periodate oxidation. Anal. Biochem. 1999;267:161-168.
[ Links ]LOGHOTHETIS PN, AUSTIN B. Variations in antigenicity of Aeromonas hydrophila strains in rainbow trout (Oncorhynchus mykiss, walbaum): An association with surface characteristics. Fish & Shellfish Immunol. 1996;6:455-464.
[ Links ]LUDERITS O, TANAMOTO K, GALANOS C. Lipopolyssaccharide: Structural principles and biological activities. Rev. Infec. Dis. 1984;6:428-431.
[ Links ]MAKAPÚ P. Bacterial Diseases in Chinese Catfish. CTSA publication center for tropical and subtropical aquaculture. 1996;122:1-2.
[ Links ]MARK EW. Effects of bacterial endotoxins on neutrophil function. Rev. Infec. Dis. 1985;7:404-416.
[ Links ]MATHISON JC, ULEVITCH RJ. The clearance, tissue distribution, and cellular localization of intravenously injected lipopolysaccharide in rabbits. J. Immunol. 1979;123:2133-2143.
[ Links ]MERINO S, RUBIRES X, AGUILAR A, ALBERTÍ S, ALLÉS SH, BENEDÍ VJ, TOMÁS JM. Mesophilic Aeromonas sp. Serogroup O:11 Resistance to complement-mediated killing. Infect. Immun. 1996;64:5302-5309.
[ Links ]MITTAL KR, LALONDE G, LEBLANC D, OLIVIER G, LALLIER R. Aeromonas hydrophila in rainbow trout: relation between virulence and surface characteristics. Can. J. Microbiol. 1980;26:1501-1503.
[ Links ]MORENO AL, MEJIA UG. Ensayo de purificación de LPS de Brucella abortus cepa 19. [Tesis de grado], Facultad de Química, Universidad Nacional de Colombia, Bogotá. 1989.
[ Links ]MORRISON DC, LEIVE L. Fractions of lipopolysaccharide from Escherichia coli O111:B4 prepared by two extraction procedures. J. Biol. Chem. 1975;250:2911-2919.
[ Links ]PARRA C. Estudio de la respuesta humoral in vivo frente a la infección por Cryptococcus neoformans: Evaluación del posible papel de TGF B e IL 10 en la regulación de la resistencia y susceptibilidad a la infección. Tesis. Facultad de Ciencias Básicas. Pontificia Universidad Javeriana. Colombia, Bogotá. 2002.
[ Links ]PELLITERO A, BARJA JL, TORANZO E, FIGUERAS AJ. Patología en acuicultura. Plan de formación de técnicos superiores en acuicultura. 1988. pp 485489.
[ Links ]PHILLIPS M, PUGH GH, DEYOE BL. Chemical and protective properties of Brucella lipopolysaccharide obtained by butanol extraction. American J. Vet. Research. 1989;50:311-316.
[ Links ]POPOVIC NT, TESKEREDZIC E, PEROVIC IS, RAKOVAC RC. Aeromonas hydrophila isolated from wild freshwater fish in Croatia. Vet. Res. Communi. 2000;24:371-377.
[ Links ]QUESENBERRY MS, LEE YC. A rapid formaldehyde assay using purpald reagent: application under periodation conditions. Anal. Biochem. 1996;234:50-55.
[ Links ]REY A. Sistematización y caracterización de las enfermedades de la tilapia roja (Piaractus brachypomusoreochromis spp) y estudio de la enfermedad septicémica. [Tesis de Maestría], Facultad de Medicina Veterinaria y Zootecnia. Universidad Nacional de Colombia. Bogotá. 2002.
[ Links ]RISCO C, PINTO P. Cellular functions during activation and damage by pathogens: immunogold studies of the interaction of bacterial endotoxins whith target cells. Micr. Res. And Tech. 1995;31:141-158.
[ Links ]RODRÍGUEZ N. Extracción del LPS de la Escherichia coli y demostración de su capacidad inmunogénica. [Tesisde grado], Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional de Colombia, Bogotá. 1992.
[ Links ]RYAN J, MORRISON D. Endotoxins and disease mechanisms. Ann. Rev. Med. 1987;38:417-432.
[ Links ]SCHLETTER J, HEINE H, ULMER AJ. Molecular mechanisms of endotoxin activity. Arch. Microbiol. 1995;164:383-389.
[ Links ]SOUVANNAVONG V, ANDREAU K, ADAM A, CHABY R. Effect of synthetic lipids on phosphatase in B-lymphocytes: influence on lipopolysaccharide action. Fems. Immunol. Med. Microbiol. 1999;26:37-47.
[ Links ]TERAN P, TIBATA R. Extracción del LPS de Pasterella multocida y valoración de su capacidad inmunogénica. [Tesis de grado], Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional de Colombia, Bogotá. 1996.
[ Links ]VERJAN N. Sistematización y caracterización de las enfermedades de la cachama blanca (Piaractus brachypomus) y estudio de la enfermedad septicémica. [Tesis de Maestría], Facultad de Medicina Veterinaria y Zootecnia. Universidad Nacional de Colombia. Bogotá. 2002.
[ Links ]WESTPHAL O, JANN. Bacterial lipopolysaccharides: extraction with phenol-water and further applications of this procedure. Methods Carbohydr. Chem. 1965;5:83-91.
[ Links ]YEH HY, JACOBS DM. Characterization of lipopolysaccharide fractions and their interactions with cells and model membranes. J. Bacteriol. 1992;174:336-341.
[ Links ]













