Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.13 no.2 Bogotá May./Aug. 2008
DETERMINACIÓN DE LA DEPENDENCIA MICORRIZAL DEL LULO
Determination Of Mycorrhizal Dependency Of Lulo
OCTAVIO GONZÁLEZ1,3, M. Sc.; WALTER OSORIO2,3, Ph.D.
1 Universidad de Medellín, Facultad de Ingeniería. oagonzalez@udem.edu.co
2 Universidad Nacional de Colombia, Sede Medellín, Facultad de Ciencias, Calle 59A 63-20, Bloque 19-311, Medellín, Colombia, nwosorio@unal.edu.co
3 Grupo de Investigación Microbiología del Suelo
Presentado 1 de agosto de 2007, aceptado 16 de mayo de 2008, correcciones 11 de junio de 2008.
RESUMEN
Se realizó un experimento de invernadero para determinar la dependencia micorrizal del lulo (Solanum quitoense Lam.) híbrido “La selva”. Se utilizó un diseño experimental completamente al azar, los tratamientos tuvieron un arreglo factorial 3x2 con tres repeticiones; estos consistieron en la combinación de tres niveles de fósforo (P) en la solución del suelo (0,002, 0,02 y 0,2 mg L-1) con dos niveles de inoculación del hongo micorrizal Glomus aggregatum (inoculado y no inoculado). Se emplearon como variables respuesta el contenido de P foliar en función del tiempo, la masa seca aérea y de raíces, la colonización micorrizal, la dependencia micorrizal y la morfología del sistema de raíces al momento de la cosecha. Los resultados indican que esta especie puede ser clasificada como moderadamente dependiente de la asociación micorrizal. La dependencia micorrizal fue mayor a 0,002 mg L-1. Todas las plantas inoculadas con G. aggregatum exhibieron colonización micorrizal, mientras que ninguna de las plantas no inoculadas desarrollaron la asociación micorrizal. La inoculación modificó significativamente la longitud y área superficial del sistema de raíces en las plantas de lulo en los niveles 0,002 y 0,02 mg L-1.
Palabras clave: fósforo, Solanum quitoense, Glomus aggregatum, micorriza.
ABSTRACT
A greenhouse experiment was carried out to determine the mycorrhizal dependency of lulo (Solanum quitoense Lam.). An experimental design completely randomized was used, treatments were arranged in factorial combination 3x2, which consisted of the combination of three soil solution phosphorus (P) concentration (0.002, 0.02 and 0.2 mg L-1) and two levels of inoculation with the mycorrhizal fungus Glomus aggregatum (inoculated and uninoculated). Foliar P content was monitored as a function of time.
At harvest, shoot and root dry weight, shoot P content, mycorrhizal colonization, mycorrhizal dependency, and root morphology were determined. The results indicated that lulo can be classified as moderately dependent on the mycorrhizal association. However, increases in soil solution P concentration decreased the mycorrhizal dependency of all plants. All inoculated plants showed mycorrhizal colonization. None of the control plants (uninoculated) exhibited mycorrhizal colonization. Increases in soil solution P significantly decreased mycorrhizal colonization. Mycorhizal inoculation significantly modified the root morphology. At 0.002 and 0.02 mg L-1 root length and surface area significantly increased with the inoculation.
Key words: Phosporus, Solanum quitoense, Glomus aggregatum, mycorrhiza
INTRODUCCIÓN
El cultivo del lulo es considerado una de las actividades agrícolas más promisorias para el país en el contexto de la internacionalización de la economía. Sin embargo, el rendimiento de éste es relativamente bajo debido a problemas del cultivo, particular-mente a la baja disponibilidad de fósforo (P) en los suelos en los cuales comúnmente se cultiva. La alta capacidad de retención de P que exhiben los suelos del trópico andino limita la eficiencia de la fertilización fosfórica ya que el ión fosfato rápidamente es precipitado o adsorbido (Ozane y Shaw, 1967). Dada la baja eficiencia en la fertilización fosfórica (3-5%), los agricultores deben aplicar altas dosis de fertilizantes fosfóricos, lo que aumenta los costos de producción. Las plantas en suelos fijadores de P se adaptan incrementando su habilidad para competir por nutrientes estableciendo asociación simbiótica con microorganismos del suelo como los hongos formadores de micorriza arbuscular (HMA) (Muthukumar et al., 2003). Según varios autores (Blal et al., 1990, Olusola y Osonubi, 2002, Zakaria y Abbott, 2002) el uso de HMA es una alternativa viable para el manejo de sistemas agrícolas ya que con su inoculación se incrementa la eficiencia de la fertilización fosfórica. Además, Yano y Takaki (2005) reportan que los HMA están involucrados en la tolerancia de las especies a suelos ácidos ya que la simbiosis mejora el desarrollo de la raíz de las plantas. Sin embargo, antes de usar esta biotecnología es necesario determinar el grado de dependencia micorrizal (DM) de la especie vegetal de interés con el fin de conocer su potencial respuesta al uso de los HMA. El objetivo de este experimento fue determinar la dependencia micorrizal de lulo híbrido “La Selva”.
MATERALES Y MÉTODOS
El experimento se realizó en el invernadero de la Estación Experimental Piedras Blancas (Medellín, Colombia) perteneciente a la Universidad Nacional de Colombia. La estación esta localizada en el corregimiento de Santa Elena (6º 15’ 38” N, 75º30’ 23” W, altitud de 2.484 m), temperatura promedio de 17 ºC y precipitación anual de 1.700 mm. El sitio se encuentra en una zona de vida de bosque húmedo montano bajo (Espinal, 1977).
Como sustrato de crecimiento se utilizó una mezcla de suelo, cuarzo y cascarilla de arroz, en proporción 2:1:0.3, respectivamente. El suelo correspondió a una muestra del horizonte subsuperficial (Bt) de un Ultisol del cerro el Volador, Medellín, para así reducir la influencia del P orgánico sobre el P disponible. El suelo se secó al aire, se tamizó a 4 mm y luego de mezclarse con cuarzo y cascarilla se analizó en el Laboratorio de Suelos de la Universidad Nacional de Colombia, Sede Medellín. Los resultados fueron: Arena 68%, Limo 12%, Arcilla 20%, textura FArA (Bouyucos), pH 4,7 (agua, 1:1, V:V), materia orgánica 0,1 % (Walkley y Black), Ca, Mg y K, 1,2, 0,7 y 0,04 cmolc kg-1 (acetato de amonio 1M, pH 7), respectivamente; Al 0,9 cmolc kg-1 (KCl 1M); P 2 mg kg-1 (Bray II); Fe, Mn, Cu y Zn 19,16,1 y 1 mg kg-1, respectivamente, (Olsen-EDTA); B 0,1 mg kg-1 (Agua Caliente); NO3-2 mg kg-1 (sulfato de aluminio 0,025 M) y NH4+ 3,0 mg kg-1 (KCl 1M). El sustrato se esterilizó dos veces en autoclave a 120 ºC y 0,1 MPa, una hora cada vez. Luego 3 kg (base seca) del sustrato estéril se trasfirieron a potes plásticos de 2,5 L de capacidad (15 x 17 cm). La fertilización del sustrato consistió en la adición de 2.000 mg de CaCO3, 436 mg de (NH4)2SO4, 1.548 mg de CaSO4.2H2O, 984 mg de MgSO4.7H2O, 160 mg de MgO, 5 EDTA-Fe(II), 5 mg de EDTA-Cu(II), 5 mg de EDTA-Zn y 5 mg de Na2B8O13.4H2O por kg de sustrato. Así mismo, se aplicó P en forma de KH2PO4 para obtener tres concentraciones de P en la solución del suelo (0,002, 0,02 y 0,2 mg L-1) según lo propuesto por Habte y Manjunath (1991) para estudios de DM. Para este fin se realizó una isoterma de adsorción de P de acuerdo al método de Fox y Kamprath (1970) (Fig. 1 ) con muestras del suelo fertilizado. Las cantidades de KH2PO4 requeridas fueron 0,953 y 2.810 mg kg-1; para ajustar una cantidad de potasio similar en los tratamientos de aplicó 1.533, 1.066 y 0 mg kg-1, respectivamente. Cada pote recibió semanalmente 50 cm3 de la solución nutritiva Hoagland libre de P que tenía las siguientes concentraciones (mg L-1): N 50, K 132, Mg 106, S 204, Zn 10, Cu 5, B 0.8 y Mo 0.5. El sustrato se mantuvo a 50-60% de su máxima capacidad de retención de agua (44 %), para lo cual se aplico agua destilada ó la solución nutritiva mencionada.

Las plántulas de lulo híbrido “La Selva” fueron obtenidas por micropropagación in vitro de un productor local. Se trasplantaron dos plántulas por pote y 15 días después se raleo y se dejó una planta por pote. Se utilizó un inoculo crudo de G. aggregatum de efectividad comprobada en otros estudios de DM (Miyasaka et al., 1993) el cual contenía esporas, fragmentos de raíces infectadas e hifas del hongo suspendidas en una matriz sólida compuesta por suelo y cuarzo (1:1). El inoculo tuvo 8.500 propágulos micorrizales infectivos por kg determinado por el método del número más probable (NMP) (Porter, 1979). Este hongo fue original-mente suministrado por Dr. M. Habte de la Universidad de Hawaii (Honolulu, USA) y multiplicado en raíces de sorgo y kudzu. La efectividad de éste HMA para incrementar la absorción de P y el crecimiento vegetal en suelos con bajo contenido de P soluble ha sido comprobada por Pérez et al. (2004) y Jaramillo et al. (2004). Al momento de la siembra 50 g del inóculo de G. aggregatum se mezclaron con los 1.000 g más superficiales del sustrato del pote. Los potes no inoculados recibieron 50 g de arena esterilizada y filtrados de una suspensión del inóculo crudo (al 10%) luego de remover las estructuras de los hongos con papel filtro Schleicher y Schuell (tamaño de poro: 2 µm). Se utilizó un diseño experimental completamente al azar, los tratamientos tuvieron un arreglo factorial 3x2, cada tratamiento tuvo tres repeticiones; los tratamientos consistieron en la combinación de tres niveles de P en la solución del suelo (0,002, 0,02 y 0,2 mg L-1) y dos niveles de inoculación micorrizal (inoculado y no inoculado). Se emplearon como variables de respuesta: (i) contenido de P foliar en función del tiempo, para esto se tomaron muestras de hojas jóvenes completamente maduras con un perforador (6 mm de diámetro) a los 21, 40, 65, 89, 102 y 115 días después del transplante (Habte et al., 1987). El P fue determinado por el método del azul de molibdato (Murphy y Riley, 1962) luego de reducir las muestras foliares a cenizas en una mufla a 500 ºC por 3 h. Este método de muestreo no destructivo fue originalmente propuesto por Aziz y Habte (1987); (ii) masa seca aérea y de raíces al final del periodo de crecimiento (115 días), para esto las muestras se llevaron a una estufa y se secaron a 60 ºC durante 96 horas. Luego se determinó la masa seca aérea (MSA), de raíces (MSR) y total (MST); (iii) colonización micorrizal de raíces finas; las cuales se sometieron a KOH para aclaración (Phillips y Hayman, 1970), luego se tiñeron con fucsina ácida (Kormanik et al., 1980) y posteriormente se determinó la colonización micorrizal siguiendo el método del intercepto de cuadricula propuesto por Giovannetti y Mosse (1980); (iv) dependencia micorrizal (DM) para lo cual se utilizó la masa seca total y se empleo la formula propuesta por Plenchette et al. (1983), luego se consideró la clasificación de DM propuesta por Habte y Manjunath (1991); (v) La morfología del sistema de raíces se determinó al momento de la cosecha, el sistema de raíces se separó en dos grupos: raíces gruesas (g) y finas (f). Luego, se obtuvo una imagen digital de cada grupo de raíces mediante un escáner (HP psc 1210), la cual se procesó con el software Rootedge versión 2.3b. Con este software se determinó la longitud de cada grupo de raíces: longitud de raíces gruesas (Lg), longitud de raíces finas (Lf) y la longitud total (Lt), el diámetro promedio y el área superficial de cada grupo (Ag, Af y At, respectivamente). Los datos obtenidos fueron sometidos a análisis de varianza (Prueba F) para determinar si existían diferencias significativas en función de los tratamientos. La prueba de LSD se usó para separar promedios con respecto al control no inoculado en cada uno de los niveles de P en solución. Para los análisis estadísticos se empleó un nivel de significancia (P≤0,05) y estos fueron realizados con el paquete estadístico Statgraphics versión 4.0.
RESULTADOS
El incremento en la concentración de P en la solución del suelo y la inoculación con G. aggregatum incrementaron significativamente (P≤0,05) la MSA, MSR y MST del lulo en los tres niveles de P evaluados. Al nivel más bajo P disponible (0,002 mg L-1) las plantas que crecieron en el sustrato inoculado tuvieron una MST 4,8 veces mayor que aquellas del sustrato no inoculado; igualmente a 0,02 y 0,2 mg L-1 el incremento con la inoculación micorrizal sobre la MST fue del 71 y 40% respectivamente (Fig. 2 ).

En términos absolutos el incremento fue mayor al nivel de 0,02 mg L-1 (Fig. 2 ). Así mismo, el incremento en la concentración de P en la solución del suelo aumentó significativamente (P≤0,05) la longitud de raíces gruesas (Lg), finas (Lf) y raíz total (Lt) en las plantas de lulo. La Lg incrementó significativamente en el nivel de 0,02 mg L-1; sin embargo, al nivel más bajo (0,002 mg L-1) y más alto (0,2 mg L-1) no hubo efecto significativo. La inoculación micorrizal incrementó significativamente (P≤0.05) Lf y Lt a los niveles de 0,002 y 0,02 mg L-1, pero no a 0,2 mg L-1. El efecto de la inocu-lación micorrizal fue significativamente (P≤0,05) mayor a 0,02 mg L-1 (Fig. 3 ).

El área superficial de las raíces gruesas (Ag), finas (Af) y raíz total (At) también se incrementó significativamente (P≤0,05) con el aumento en la concentración de P en la solución del suelo. La inoculación micorrizal incrementó significativamente (P≤0,05) el área superficial de raíces finas (Af) y el área superficial total (At) en todos los niveles de P disponible. El efecto de la inoculación fue significativamente (P≤0,05) mayor al nivel de 0,02 mg L-1 (Fig. 4 ).

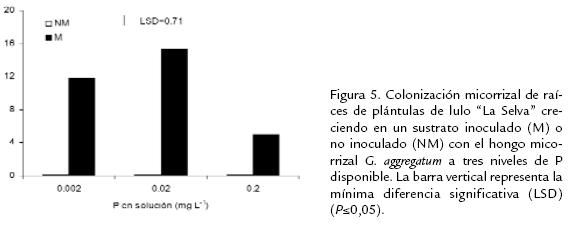
Todas las plantas que crecieron en el sustrato inoculado presentaron colonización micorrizal, mientras que las plantas del sustrato no inoculado no desarrollaron la asociación micorrizal. La colonización fue significativamente (P≤0,05) menor al más alto nivel de P (0,2 mg L-1) (Fig. 5 ).
El incremento de la concentración de P disponible en el sustrato aumentó significativamente el contenido de P foliar. La inoculación tuvo efecto significativo (P≤0,05) sobre el contenido de P en las hojas en algunos días de muestreo pero no al momento de la cosecha a todas las concentraciones de P disponible. Las plántulas de lulo exhibieron dependencia micorrizal (DM), pero esta disminuyó con el incremento en la concentración de P en la solución del suelo (Fig. 6 ). El valor de DM a 0,02 mg L-1 fue de 41,4%, lo que permite clasificar esta especie vegetal como moderadamente dependiente de la asociación micorrizal.

DISCUSIÓN
Los resultados claramente ofrecen evidencia de que las plantas de lulo “La Selva” exhiben dependencia a la asociación micorrizal. La razón para dicha dependencia puede radicar en el limitado sistema de raíces de esta especie. Los hongos micorrizales pueden modificar morfológica y anatómicamente la planta huésped; en especial los tejidos radicales. Los beneficios de estos hongos sobre las plantas huésped no son sólo explicables a través del mejoramiento en la captación de nutrientes de la planta si no que obedecen a efectos metabólicos más profundos y complejos dada la integración intima de los simbiontes (Rodríguez et al., 2003). Aunque los beneficios de la asociación micorrizal para especies de la familia solanaceae están documentados (Bryla y Koide, 1998; Edathil et al. 1996) es muy poco lo publicado con relación a la DM de las especies de esta familia. Los estudios de DM (Monzón y Azcon 1996; Habte 1995; Khalil et al. 1994; Duponnois et al. 2001), no solo hacen posible conocer la respuesta micorrizal a diferentes niveles de P, sino que permiten estudiar relaciones entre la planta y el hongo en el ambiente suelo. En este trabajo se ha incluido, para el cálculo de la DM la masa seca total, es decir la suma de la parte aérea y de raíces. Esta decisión se ha tomado por los beneficios observados sobre la masa seca del sistema de raíces con la inoculación micorrizal (Fig. 3 y Fig. 4 ). Esta aproximación difiere de estudios de DM realizados por otros autores (Habte y Manjunath 1991; Zangaro et al. 2005; Yano et al. 1998) que no tuvieron en cuanta los efectos sobre el sistema de raíces. Incluir las raíces en el cálculo de la DM permite una explicación integral del efecto de los hongos micorrizales sobre la planta. Es bien sabido que el sistema de raíces puede cambiar en función de la condición del suelo, particularmente de la disponibilidad de P y así mismo, ser más eficiente en la captación de nutrientes de baja movilidad por aumentar la superficie absorbente. Los cambios en la morfología del sistema de raíces con la inoculación micorrizal han sido comprobados en plantas de lulo en este trabajo y reportados en otras especies por otros autores (Baon et al. 1994; y Barker et al. 1998).
Zangaro et al. (2005) estudiado la relación entre HMA y las características morfológicas de la raíz, plantean que especies vegetales que exhiban raíces finas con densos y largos pelos absorbentes, presentan alta respuesta micorrizal. En contraste, Saif (1987) reportó que los pastos tropicales con largos pelos absorbentes son más beneficiados por los hongos micorrizales que las especies de cortos pelos absorbentes. Duponnois et al. (2001) mostraron una correlación positiva entre la respuesta a HMA de leguminosas tropicales y la longitud y densidad de las raíces. Siqueira y Saggin-Junior (2001) reportaron que algunas especies nativas tropicales en Brasil con gruesas raíces y pocos pelos absorbentes no respondieron a los HMA, en tanto otras especies con finas raíces y abundantes pelos absorbentes fueron de muy alta respuesta. Los resultados obtenidos en lulo dado su sistema de raíces, coinciden con lo planteado por Zangaro et al. (2005) y por Baon et al. (1994), que reportan que plantas de raíces con largos y numerosos pelos absorbentes, tienden a exhibir alta colonización micorrizal. Los resultados obtenidos con S. quitoense híbrido “La Selva”, indican que exhibe una moderada DM (25-50%), según la categoría propuesta por Habte y Manjunath (1991). Este resultado sorprende porque se esperaba una mayor DM, ya que los suelos en donde crecen naturalmente esta especie son muy bajos en P disponible. Pero igualmente las plantas inoculadas presentaron una baja tasa de absorción de P, lo que podría explicar la DM obtenida. Evento este diferente a resultados encontrados por Smith, et al. (2003) que reportan el incremento en la incorporación de P, de la solución del suelo por plantas colonizadas con estos hongos. Khalil et al. (1999) reportaron una correlación entre la colonización micorrizal y el contenido de P en la parte aérea. Bryla y Koide, (1998) evaluaron dos genotipos de tomate dependientes y no dependientes y encontraron marcadas diferencias en su crecimiento; la característica que determinó la no dependencia en algunos de estos materiales fue la gran longitud y densidad de raíz. Las plantas pueden desarrollar diferentes estrategias para captar P a bajas concentraciones en el suelo (Marschner, 1998). Una alternativa es la producción de un sistema fibroso, de raíces finas ampliamente ramificado y con abundancia de pelos absorbentes, como las observadas en las plantas de lulo estudiadas. Se encontró que las raíces exhiben una dominancia de raíces finas terciarias y de mayor nivel que les per-mite explorar mayor volumen de suelo y penetrar los agregados del mismo (Parniske, 2004). La inoculación micorrizal afectó la morfología de las raíces significativamente en lulo. Estos resultados se relacionan con la respuesta a la inoculación micorrizal en esta planta para producción de MSA, MSR y MST. Los resultados permiten concluir que se presentó un efecto de la concentración de P disponible en el sustrato sobre el crecimiento y la DM de las plantas de lulo “La Selva”. En general se observa que al incrementar la concentración de P en la solución disminuye la DM. En lulo la mayor DM se presentó al nivel más bajo de P en solución (0,002 mg L-1), lo que podría explicarse como una estrategia de estas plantas de establecer la asociación con HMA para mejorar la absorción de P. Igualmente, Zandavalli et al. (2004), reportan que el grado de colonización micorrizal es controlado por el nivel de P en el tejido del hospedero y que una alta disponibilidad de P para las plantas reduce la colonización de la raíz por HMA. La concentración de P en la solución del suelo, afectó el grado de colonización micorrizal; los valores más altos de infección se obtuvieron en el nivel bajo (0,002 mg L-1) y medio (0,02 mg L-1) de P en solución. Estos resultados sugieren que a niveles altos de P en la solución del suelo, la colonización de la raíz por HMA disminuye, es decir a un nivel alto de P se deprime la colonización micorrizal y la planta no requiere establecer la asociación. Presumiblemente a este nivel alto de P se pueden “apagar” los transportadores de P de las hifas micorrizales no realizando absorción de P. En el crecimiento de las plantas, no se evidenció relación entre la masa y el contenido de P. Esto podría sugerir un efecto de dilución del elemento en toda la planta requerido para aumentar la masa de la raíz. Resultados similares han sido reportados por Khalil et al., (1999) y por Zandavalli et al., (2004). La colonización disminuyo al aumentar el nivel de P, probablemente esto se puede asociar con un bajo suministro de fotosintatos de la planta al HMA, reafirmando que es la planta quien controla y regula el desarrollo del hongo. La estrategia de la planta puede ser reducir el drenaje de carbono o de fotosintatos hacia el hongo bajo condiciones de alta disponibilidad de P. Especies con una DM mayor deberían exhibir una mayor colonización micorrizal, es decir una mayor masa fungal. El grado de colonización de la raíz es controlado por el nivel de P en el tejido del hospedero (Zandavalli et al., 2004). Una alta disponibilidad de P para las plantas se expresa en una reducción del porcentaje de colonización por los HMA, reportes similares han sido hechos por Yano et al. (1998), al afirmar que las plantas translocaron más cantidad de fotosintatos al sistema de raíces que a la parte aérea, probablemente adaptándose a un estrés ambiental. Se recomienda para futuros estudios de DM, que involucren especies vegetales adaptadas a suelos con baja disponibilidad de P, establecer la concentración de P en la solución del suelo entre 0,002 y 0,02 mg L-1. Este aspecto se justifica por los niveles tan bajos de P en la solución del suelo que se encuentran para los hábitat donde crecen las especies vegetales tropicales y por la alta aplicación de P vía fertilizante que es necesario adicionar al suelo en los sistemas agrícolas de producción en el trópico.
AGRADECIMIENTOS
Este trabajo se realizó con el apoyo financiero de la Dirección de Investigaciones (DIME) de la Universidad Nacional de Colombia, Sede Medellín, en el marco del proyecto “Determinación de la dependencia micorrizal de frutales de clima frío” (30802731).
BIBLIOGRAFÍA
AZIZ T, HABTE M. Determining vesicular-arbuscular micorrizal effectiveness by monitoring P status of leaf disk. Can J Microbiol. 1987;33:1097-1101. [ Links ]
BAON JB, SMITH SE, ALSTON AM. Growth response and phosphorus uptake of rye with long and short root hairs: interactions whit mycorrhizal infection. Plant Soil. 1994;167:247-254. [ Links ]
BARKER SJ, TAGU D, DELP G. Regulation of root and fungal morphogenesis in mycorrhizal symbiosis. Plant Physiol. 1998;116:1201-1207. [ Links ]
BLAL B, GIANINAZZI-PEARSON V, FARDEAU JC, GIANINAZZI S. Influence of vesicular-arbuscular mycorrhizae on phosphate fertilizer efficiency in two tropical acid soils planted with micropropagated oil palm (Elaeis guineensis jacq.). Biol Fertil Soils. 1990;9:43-48. [ Links ]
BRUNDRETT MC. Coevolution of roots and mycorrhizas of land plants. New Phytol. 2002;14:275-304. [ Links ]
BRYLA RD, KOIDE RT. Mycorrhizal response of two tomato genotypes relates to their ability to acquire and utilize phosphorus. Ann Bot London. 1998;82:849-857. [ Links ]
DUPONNOIS R, PLENCHETTE C, BA AMADOU M. Growth stimulation of seventeen fallow leguminous plants inoculated with Glomus aggregatum in Senegal. Eur J Soil Biol. 2001;37:181-186. [ Links ]
EDATHIL THOMSON T, MANIAN S, UDAIYAN K. Interaction of multiple VAM fungal species on root colonization, plant growth and nutrient status of tomato seedlings (Lycopersicon esculentum Mill.) Agr Ecosyst Environ. 1996;59:63-68. [ Links ]
ESPINAL S. Zonas de vida: formaciones vegetales del departamento de Antioquia. Medellín: Universidad Nacional de Colombia; 1977. [ Links ]
FOX R, KAMPRATH E. Phosphate sorption isotherms for evaluating the phosphate requirements of soils. Soil Sci Soc Am Proc. 1970;34:902-907. [ Links ]
GAHOONIA TS, NIELSEN N E, JOSHI P A, JAHOOR A. A root hairless barley mutant for elucidating genetics of root hairs and phosphorus uptake. Plant Soil. 2001;235:211-219. [ Links ]
GIOVANNETTI M, MOSSE B. An evaluation of techniques for measuring vesicular-arbuscular mycorrhizal infection in roots. New Phytol. 1980;84:489-500. [ Links ]
HABTE M, FOX RL, HUANG RS. Determining vesicular-arbuscular mycorrhizal effectiveness by monitoring P status of subleaflets of an indicator plant. Communn Soil Sci Plan. 1987;18(12):1403-1420. [ Links ]
HABTE M, MANJUNATH A. Categories of vesicular-arbuscular mycorrhizal dependency of host especies. Mycorrhiza. 1991;1:3-12. [ Links ]
HABTE M. Dependency of Cassia siamea on vesicular arbuscular mycorrhizal fungi. J. Plant Nutr. 1995;18(10):2191-2198. [ Links ]
JARAMILLO PS, SILVA BM, OSORIO NW. Potencial simbiotico y efectividad de hongos micorrizo arbusculares de tres suelos sometidos a diferentes usos. Rev Fac Nac Agron. 2004;57:2203-2214. [ Links ]
KHALIL S, LOYNACHAN TE, TABATABAI MA. Mycorrhizal dependency and nutrient uptake by improved and unimproved corn and soybean cultivars. Agron J. 1994;86:949-958. [ Links ]
KHALIL S, LOYNACHAN TE, TABATABAI MA. Plant determinants of mycorrhizal dependency in soybean. Agron J. 1999;91:135-141. [ Links ]
KORMANIK PP, McGRAW AC, SCHULTZ RC. Procedure and equipment for staining a large number of plant samples for endomycorrhizal assay. Can J Microbiol. 1980;26:536-538. [ Links ]
MARSCHNER H. Role of root growth, arbuscular mycorrhiza, and root exudates for the efficiency in nutrient acquisition. Field Crop Res. 1998;56:203-207 [ Links ]
MIYASAKA S, HABTE M, MATSUYAMA D. Mycorrhizal dependency of two hawaian endemic tree species: koa and mamane. J Plant Nutr. 1993;16:1339-1355. [ Links ]
MONZÓN A, AZCÓN R. Relevance of mycorrhizal fungal origin and host plant genotype to inducing growth and nutrient uptake in Medicago species. Agr Ecosyst Environ. 1996;60:9-15. [ Links ]
MURPHY J, RILEY JP. A modified single solution method for the determination of phosphate in natural waters. Anal Chim Acta. 1962;27:31-35. [ Links ]
MUTHUKUMAR T, SHA L, YANG X, CAO M, TANF J, ZHENG Z. Distribution of roots and arbuscular mycorrhizal associations in tropical forest types of Xishuangbanna, southwest China. Appl Soil Ecol. 2003;22:24-53. [ Links ]
OLUSOLA SA, OSONUBI O. Improving the traditional land use system through agrobiotechnology: a case study of adoption of vesicular arbuscular mycorrhiza (VAM) by resource-poor farmers in Nigeria. Technovation. 2002;22:725-730. [ Links ]
OZANE PG, SHAW TC. Phosphate sorption by soils as a measures of the phosphate requirement for pasture growth. Aust J Agric Res. 1967;18:601-612. [ Links ]
PARNISKE M. Molecular genetics of the arbuscular mycorrhizal symbiosis. Plant Biol. 2004;7:414-421. [ Links ]
PÉREZ JC, OSORIO NW, ÁLVAREZ CL. Inoculación micorrizal cambia la morfología de la raíz de espárrago e incrementa el crecimiento y la absorción de fósforo en un Andisol. Rev Fac Nac Agron. 2004;57:2373-2381. [ Links ]
PHILLIPS JM, HAYMAN DS. Improved procedures for clearing and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. T Brit Mycol Soc. 1970;55:158-161 [ Links ]
PLENCHETTE C, FORTÍN JA, FURLAN V. Growth responses of several plant species to mycorrhizae in a soil of moderate P-fertility. Plant Soil 1983; 70: 211-217. [ Links ]
PORTER W. The Most Probable Number method for enumerating infective propagules of vesicular arbuscular mycorrhizal fungi in soil. Aust J Soil Res. 1979;17:515-519. [ Links ]
RODRÍGUEZ H, FRAGA R, GONZÁLEZ T, BASHAN Y. Genetics of phosphate solubilization and its potential applications for improving plant growth-promoting bacteria. Appl Soil Ecol. 2003;26:249-255. [ Links ]
SAIF SR. Growth responses of tropical forage plant species to vesiculararbuscular mycorrhizae. Plant Soil. 1987;97:25-35. [ Links ]
SIQUEIRA JO, SAGGIN OJ. Dependency on arbuscular mycorrhizal fungi and resposiveness of some Brazilian native woody species. Mycorrhiza. 2001;11:245-255. [ Links ]
SMITH SE, SMITH A, JAKOBSEN I. Mycorrhizal Fungi Can Dominate Phosphate Supply to Plants Irrespective of Growth Responses. Plant Physiol. 2003;133:16-20. [ Links ]
YANO K, TAKAKI M. Mycorrhizal alleviation of acid soil stress in the sweet potato (Ipomoea batatas). Soil Biol Biochem. 2005;37:1569-1572. [ Links ]
YANO K, YAMAUCHI A, LIJIMA M, KONO Y. Arbuscular mycorrhizal formation in undisturbed soil stress for pigeon pea. Appl Soil Ecol. 1998;10:95-102. [ Links ]
ZAKARIA SM, ABBOT LK. Phosphorus uptake by a community mycorrhizal fungi in jarrah forest. Plant Soil. 2002;246:313-320. [ Links ]
ZANDAVALLI RB, DILLENBURG LRD, DE SOUZA PV. Growth responses of Araucaria angustifolia (Araucariaceae) to inoculation with the mycorrhizal fungus Glomus clarum. Appl Soil Ecol. 2004;25:245-255. [ Links ]
ZANGARO W, NISHIDATE FP, SPAGO FR, ROMAGNOLI G, VANDRESSEN G. Relations among arbuscular mycorrhizas, root morphology and seedling growth of tropical native woody species in southern Brazil. J Trop Ecol. 2005;21:529-540. [ Links ]














