Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Biológica Colombiana
versão impressa ISSN 0120-548X
Acta biol.Colomb. v.13 n.3 Bogotá set./dez. 2008
DETERMINACIÓN DE Salmonella Typhimurium EN COMPOST INOCULADO ARTIFICIALMENTE EMPLEADO EN UN CULTIVO DE LECHUGA
Salmonella Typhimurium determination in compost artificially inoculated in a lettuce crop
DIANA MARCELA RODRÍGUEZ1, FRANCY ELAINE TORRES1, EDNA VIVIANA GUTIÉRREZ1, MARITZA PAOLA LÓPEZ1, MARIA MERCEDES MARTÍNEZ1, M. Sc.; ANA KARINA CARRASCAL2, M. Sc.
Facultad de Ciencias, Departamento de Microbiología, Grupo de Biotecnología Ambiental e Industrial.Laboratorio de Microbiología Ambiental y de Suelos. Pontificia Universidad Javeriana, Bogotá, Colombia.
Laboratorio de Microbiología de Alimentos. Pontificia Universidad Javeriana. Carrera 7 No. 43-82. Edificio Félix Restrepo. Bogotá, Colombia. mmmartin@javeriana.edu.co
Presentado 12 de abril de 2008, aceptado 12 de mayo de 2008, correcciones 24 de junio de 2008.
RESUMEN
Salmonella enterica serovariedad Typhimurium, se ha asociado a brotes por el consumo de frutas y vegetales contaminadas a partir de agua de riego, manipuladores, bioabono y suelo. En esta investigación se inoculó artificialmente un bioabono aplicado a un cultivo de lechuga para determinar la capacidad de transferencia a las plantas, así como establecer el efecto del uso de cubiertas de polietileno en la protección del cultivo frente a este patógeno. Para ello, se utilizaron plántulas de lechuga de ocho semanas y se establecieron cuatro tratamientos y dos controles: T1 y T2, con y sin cubierta de polietileno respectivamente, contenían una concentración de Salmonella enterica Serovariedad Typhimurium ATCC 13176 inoculada en el compost en concentración de 0,04 mo/g, T3 y T4 con y sin cubierta de polietileno respectivamente con 100 mo/g de compost y finalmente C1 y C2 con y sin cubierta pero sin inoculación.
El seguimiento del microorganismo en suelo se realizó durante las ocho semanas del cultivo, mediante la técnica de NMP/4 g (EPA, 2006) al cabo de este tiempo se evaluó el total de plantas cultivadas mediante la misma técnica. Se determinó que Salmonella enterica serovariedad Typhimurium ATCC 13176 se transmite a la lechuga, a partir del bioabono contaminado (OR=2,53) sin importar la concentración inicial del microorganismo en el bioabono; así mismo se encontró que existe asociación entre la contaminación y la condición de cubierta del cultivo (p=0,002). Por otra parte, al analizar las raíces no se encontró asociación de transmisión.
Palabras clave: compost, lechuga, Salmonella enterica serovariedad Typhimurium, inocuidad.
ABSTRACT
Salmonella enterica serovariedad Typhimurium, has been associated with outbreaks because of the ingestion of fruits and vegetables and those outbreaks have been related due to contamination sources like irrigation water, farm workers influence and the soil itself. In this investigation it was artificially inoculated in a compost and later applied to a lettuce crop, in order to determine the transfer capacity of this microorganism to the plants, as well as to establish if the polyethylene cover protected the crop. In this study, four treatments were made with two controls, T1 and T2 - with and without polyethylene cover - these treatments and controls were inoculated with Salmonella enterica Serovariedad Typhimurium ATCC 13176 0,04 mo/g de compost, T3 y T4 - with and without polyethylene cover - each one with 100 mo/g de compost, and finally C1 and C2 - with and without polyethylene cover -, but without inoculation. At 8 weeks the microorganism was determine by the MPN/4g technique (EPA, 2006).
Salmonella enterica serovariedad Typhimurium ATCC 13176 is capable to transfer itself to the lettuce, through the contaminated compost (OR=2.53) regardless of microorganism concentration in the compost, and there was an association between the contamination and the crop cover condition (p=0.002). The analysis of the roots and the irrigation water, demonstrated that it does not exist any transference association.
Key words: Compost, lettuce, Salmonella enterica serovariedad Typhimurium, safety.
INTRODUCCIÓN
En la última década, ha aumentado el número de brotes alimentarios siendo una de las principales causas, el consumo de vegetales frescos contaminados con bacterias como Salmonella spp., Escherichia coli O157:H7, Listeria monocytogenes, entre otras (Magnuson et al., 1990; Himathongkam et al.,1999; Solomon et al., 2002; Islam et al., 2004b; Sivapalasingam et al., 2004; Ibenyassine et al., 2007). Salmonella spp. es la bacteria que causa el mayor número de enfermedades transmitidas por alimentos (ETA) en el mundo (Tauxe et al., 1997) y tradicionalmente se ha asociado a alimentos de origen animal, aunque en la última década se ha asociado al consumo de vegetales y frutas frescas contaminadas con aguas recicladas y abonos orgánicos de baja cali-dad (Solomon et al., 2002; Natving et al., 2002; Warriner et al., 2003; Mukherjee et al., 2004; Franz et al., 2005).
Los abonos orgánicos y las materias primas que se emplean para el cultivo de vegetales juegan un rol muy importante en la posible introducción de patógenos humanos dentro de la cadena alimentaria (Solomon et al., 2002; Natving et al., 2002; Islam et al., 2004a; Franz et al., 2005; Lemunier et al., 2005), pues en aquellos procesos de compostaje donde el proceso térmico es deficiente pueden persistir y al no ser destruidos, pueden reactivarse al final del proceso cuando la temperatura desciende (Gale, 2002; Lemunier et al., 2005). Este resultado afecta directamente la calidad del bioabono obtenido, convirtiéndose en un riesgo para los cultivos de consumo directo y por ende para la salud pública. Se ha sugerido que patógenos como Salmonella spp.,
Escherichia coli O157:H7 y Listeria monocytogenes son introducidos como resultado de malas prácticas higiénicas, durante la producción o procesos del manejo post-cose-cha (Beuchat, 2006); también desde 1961, Angelotti et al., 1961, indicaron que Salmonella spp. persiste en bioabonos mal compostados por su habilidad para tolerar un rango amplio de temperatura (7 °C y 49,5 °C) y a su capacidad de adherencia a partículas pequeñas del suelo (Wilkinson, 2007).
La lechuga, por ser una hortaliza de ciclo corto, que se consume directamente, sin ser sometida a ningún tratamiento de inactivación de patógenos, se ha constituido en un excelente modelo para la evaluación de abonos y su calidad microbiológica referida esta a la presencia de patógenos de interés como Salmonella spp. Varias investigaciones han logrado encontrar la asociación entre los patógenos de bioabonos y los mecanismos de contaminación de estos a los vegetales (Lemunier et al., 2005; Islam et al., 2004a; Ibenyassine et al., 2007), permitiendo desarrollar estrategias de monitoreo de estos microorganismos como parte del mejoramiento de la cadena agrícola y de las exportaciones, si se tiene en cuenta que en Colombia desde el 2004 ha bajado sus exportaciones de lechuga en 5 toneladas por año aproximadamente, lo que hace que estas estrategias puedan mejorar la cuota de exportaciones (CCI, 2006). Por tal motivo, el propósito de esta investigación fue realizar el seguimiento de Salmonella enterica serovariedad Typhimurium inoculada artificialmente en un bioabono utilizado en un cultivo de lechuga, para determinar la posibilidad de transmisión del microorganismo al vegetal.
MATERIALES Y MÉTODOS
MICROORGANISMO DE ESTUDIO
Se utilizó Salmonella enterica serovariedad Typhimurium ATCC 13176, la cual se adquirió del banco de cepas del Instituto Nacional de Salud (INS).
PRODUCCIÓN DEL INÓCULO
Para la producción del inóculo de Salmonella enterica serovariedad Typhimurium ATCC 13176 se sembraron 25 mL de preinóculo en 225 mL de caldo infusión cerebro corazón (BHI) y se incubó a 35 °C, 150 rpm durante 24 h; se realizó coloración de Gram para determinar pureza del inóculo y se ajustó la absorbancia 0,25 población cercana a 108 microorganismos/mL (Delgado et al., 2004). Se realizaron diluciones seriadas para contaminar manualmente el compost de flores con una solución de 0,04 y 100 micro-organismos/g de compost respectivamente. Terminada la inoculación se corroboró la concentración de microorganismo inoculado mediante la técnica de NMP/4g (EPA, 2006)
FASE DE CAMPO
La prueba de campo se realizó en un lote de invernadero de 4 x 7 metros en la estación experimental San Javier de la Pontificia Universidad Javeriana, ubicado en el municipio de Cogua en la vereda El Mortiño, Cundinamarca, Colombia con temperatura promedio de 15 °C y una altitud de 2.631 msnm (Van der Hammen y Rangel, 1997).
Preparación del suelo. Se realizó un análisis fisicoquímico para suelo y compost, en elcual se determinó nitrógeno total, carbono orgánico (CO; Walkley y Black, 1934),nitrógeno amoniacal (N-NH4+), nitratos (N-NO3) y textura. De acuerdo a los resulta-dos fisicoquímicos obtenidos se planteó el siguiente plan de fertilización: materiaorgánica (compost vegetal procedente de flores: 2 kg/cama de suelo), 1,2 kg H2PO4,0,6 kg K2PO40,6, 0,2 kg MgNO3y 0,2 CaNO3/tratamiento; Balcaza, 1997). La mezclase colocó en el suelo a una profundidad de 17,5 cm, en camas de (80 cm ancho x 180cm largo). Posteriormente se distribuyeron los tratamientos en bloques al azar (Tabla.1) T1, T3 y el control C1, se cubrieron con polietileno negro de alta densidad utilizadocomo capa aislante entre las hojas de la lechuga y el suelo.

Población de estudio y muestra. La población de estudio fueron 90 plántulas de(Lactuca sativa l var. crispa l) de ocho semanas de germinación donadas por una empresaproductora de hortalizas. Las plántulas fueron trasplantadas en bloques de 15 indivi-duos a cada tratamiento a distancia de 20 cm una de la otra (Johannessen et al.,2004). Los tratamientos con microorganismo fueron inoculados antes de realizar lasiembra; el tiempo de cultivo fue de ocho semanas (Colom y Pons, 2003). Igualmentese evaluaron muestras de suelo, compost de flores y agua de riego, durante las ochosemanas de experimentación, las cuales fueron tomadas mediante un muestreo alea-torio simple (Martínez et al., 2007).
Determinación de temperatura y pH del suelo. La determinación de la temperaturadel suelo de cada tratamiento y sus respectivos controles se realizó en la mañana y enla tarde diariamente utilizando un termómetro de punzón a 10 cm de la superficie. Ladeterminación de pH se llevó a cabo semanalmente por medio del método de pastade saturación (Lin et al., 1995).
Cuantificación de Salmonella enterica serovariedad Typhimurium ATCC 13176. Antes de realizar el ensayo, se procedió a evaluar la concentración de Salmonella spp. en suelo pormedio de NMP Salmonellaspp./4 g (EPA, 2006) y al agua de riego y plántulas por elmétodo Ausencia/Presencia Salmonella spp. (Palacios, 1999). Durante las ocho semanas de estudio se tomaron semanalmente 50 g de suelo aleatoriamente (forma de X),de cada tratamiento y control a una profundidad de 10 cm; y se determinó Salmonellaspp., mediante la técnica de NMP 1684 (EPA, 2006), al igual que en planta, realizandoel análisis de la población total de lechugas sembradas (n=15) por tratamiento.
Se llevó a cabo la determinación de Salmonellaspp., en raíces de lechuga, las cualesfueron separadas de las hojas con un cuchillo estéril; para su análisis se tuvo en cuentaque el peso de estas es muy bajo, razón por la cual se procedió a realizar un enjuague 65de las raíces en 100 mL de agua peptonada al 0,1% durante 15 minutos; el aguapeptonada de enjuague se adicionó en caldo BHI (Scharlau®) para realizar el pre-enriquecimiento durante 6 horas; posteriormente se tomó 1 mL de este cultivo y sesembró en caldo Rappaport y los aislamientos se realizaron en agar XLD (Scharlau®)y Hectoen (Scharlau®), posteriormente se procedió a su identificación bioquímica yserotipificación. Finalmente para la determinación del patógeno en agua de riego setomaron 100 mL del agua a utilizar, los cuales fueron analizados siguiendo la meto-dología propuesta por Palacios, 1999.
ANÁLISIS ESTADÍSTICO
Para el análisis estadístico se llevó a cabo un test de Kruskal-Wallis para evidenciardiferencias entre las medias de los tratamientos (con y sin cubierta de polietileno) y susrespectivos controles respecto a la concentración de Salmonella entericaSerovariedadTyphimurium ATCC 13176 con un nivel de significancia de 0,05. Adicionalmente, serealizó la prueba Odds Ratiopara evidenciar el riesgo de contaminación y el porcentajede transferencia del patógeno del suelo a la lechuga (Morris y Gadner, 1988). Losdatos fueron procesados empleando en el programa JMP versión 6.0 para Windows.
RESULTADOS
El suelo utilizado para la experimentación presentó valores de carbono orgánico pro-medio de 5,11%, nitrógeno total 0,53% y una textura franco arcillosa (Tabla.2), mien-tras que el compost procedente de residuos de flores presentó valores de carbonoorgánico de 17,3%, nitrógeno total de 1,3%, con una humedad de 39,4 % (Tabla.3).
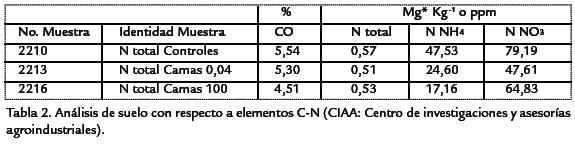
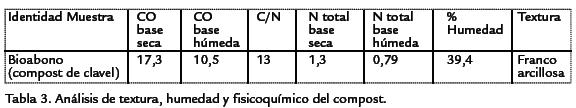
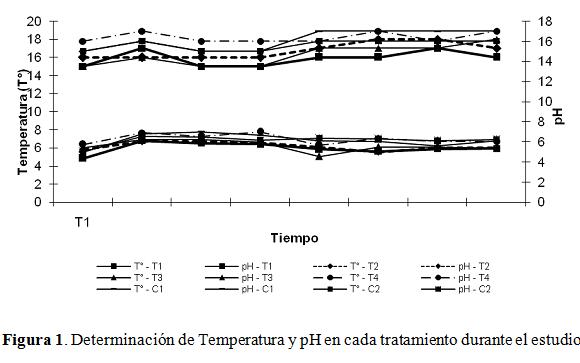
Durante las ocho semanas del ensayo el comportamiento del pH del suelo se caracterizópor ser ácido con valores entre 5,9 y 6,3, el tratamiento 4 (0,04 mo/g suelo descubierto) fue el que presentó valores de pH más altos (6,3; Fig. 1), mientras que en el tratamiento1 (100 mo/g de suelo) se observaron valores más bajos (5,9). La temperatura semantuvo con valores entre 15 °C y 16,7 °C (Fig. 1) sin diferencias significativas entrelos tratamientos respecto a las concentraciones de microorganismos evaluadas (0,04) mo/g de suelo y 100 mo/g de suelo) (p=0,08541) como tampoco respecto a la presencia o no de cubierta (p=0,6524; 0,3968) igualmente con la variable pH (p=0,46).
CUANTIFICACIÓN DE Salmonella enterica SEROVARIEDAD TYPHIMURIUM ATCC 13176 EN LAS DIFERENTES MATRICES EVALUADAS
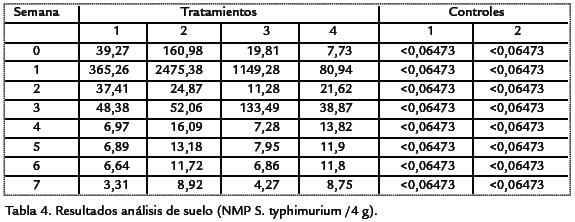
Al analizar el compost y el suelo antes de la inoculación con Salmonella entericaserovariedad Typhimurium ATCC 13176, no se logró la recuperación del patógenomostrando valores de NMP <0,06473 Salmonellaspp./4 g suelo; en el caso del agua deriesgo y plántula no se aisló Salmonellaspp. El bioabono mezclado en el suelo reportóvalores de NMP de Salmonellaspp./4 g suelo en tiempo 0, de 39,27 para T1, T2(160,98), T3 (19,81), T4 (7,73), C1 (<0,06473) y C2 (<0,06473), concentraciones quefueron disminuyendo a lo largo de la experimentación como se muestra en la Tabla.4.
Se cosecharon las 15 lechugas de cada tratamiento observando que en el tratamiento1, el 20% de las lechugas estaban contaminadas con el patógeno con un promedio de(X: 426 NMP/4 g), en los tratamientos 2 y 3 se contaminaron 13,3% de las lechugascon promedios de (X: 17,441 NMP/4 g) y (X: 12,83 NMP/4 g) respectivamente; y enel tratamiento 4 se contaminaron 6,6% con un promedio de (X: 0,0467 NMP/4 g) enC1 y C2 no se presentó contaminación.
Para el tratamiento 2 y 4 se encontró un índice de OR=1,625 y proporcionalidad de P=61,9%, para el tratamiento 1 y 3 OR = 2,153 y proporcionalidad P=68,3%. Por otra parte se determinó la presencia del patógeno en los tratamientos T1 Y T3 en un 7% de la población evaluada y en los T2 y T4 en un 18% con, OR de 0,22 y 0,125 respectivamente sin detectarlo en los controles.
DISCUSIÓN
Durante la experimentación se observó el 100% de crecimiento de Lactuca sativa L var. crispa L, el rango de temperatura osciló entre15 °C y 16,75 °C, el pH entre 5,9 y 6,3, así como suelos con buena retención de humedad y buena cantidad de materia orgánica, lo que favoreció no solo el buen desarrollo de las plantas sino también del patógeno (Sarquis et al., 1997), Este microorganismo puede desarrollarse cuando la relación C:N es 15:1, concentraciones similares a las encontradas en el compost (13,1; Wilkinson, 2007). Con relación a la textura Natvig et al., 2002 y Franz et al., 2005, encontraron que suelos con texturas arcillosas favorecen las posibilidades de colonización de S. typhimurium en vegetales como la lechuga por el tamaño de la partícula, la formación de agregados, retención de agua y tensión de oxígeno, factores que probablemente permitieron la adherencia del microorganismo y su mantenimiento durante las ocho semanas del cultivo.
Respecto a la temperatura, los tratamientos 2, 4 y el control 2, presentaron mayores temperaturas (16,7 °C, 16,4 °C y 16,2 °C), incrementos que pudieron estar asociados al uso de la cubierta protectora de polietileno, la cual aunque es permeable, no per-mite un flujo rápido de gases y productos de la respiración del suelo induciendo un leve aumento de la temperatura; durante la experimentación a pesar que se presentó mayor temperatura en los tratamientos cubiertos con polietileno, no se encontró asociación de esta variable con la concentración del microorganismo; tal vez, en épocas de mayor calor la concentración del patógeno hubiera aumentado notablemente pues según Chang y Fang, 2007, S. tyhimurium disminuye su crecimiento en una unidad logarítmica (UL) cada 14 días si se encuentra en temperaturas de 4 °C y aumenta en 3 UL en temperaturas cercanas de 22 °C.
Al comparar el NMP/4 g Salmonella spp. de suelo de la primera semana con el recuento inicial se observó un incremento, el cual puede estar relacionado con factores como: concentración de nutrientes y la procedencia del inóculo; no obstante a partir de la segunda semana en todos los tratamientos se observó un descenso de la población el cual se mantuvo casi constante durante el resto del ensayo; es posible que este descenso esté asociado a la degradación de materia orgánica realizada por los microorganismos propios del suelo, los cuales al ser nativos poseen una alta actividad metabólica adaptada a las condiciones propias de la matriz que los convierte en fuertes competidores de Salmonella spp. por nutrientes y espacio. Estudios realizados por Weissinger et al., 2000, indican que el pH óptimo para Salmonella spp. oscila entre 5,5 y 7,4, en la segunda semana de cultivo, el crecimiento de Salmonella spp. se vió incrementado, a pesar del pH ácido, generado por la transformación de la materia orgánica presente en el medio (Islam et al., 2004a).
Durante la experimentación dos factores pudieron contribuir en la disminución del microorganismo, el riego periódico que genera percolación a través de la matriz (Natvig et al., 2002) y disminución en la concentración de nutrientes como nitritos, fosfatos y materia orgánica (Holley et al., 2006). Salmonella spp. al no encontrar los nutrientes necesarios sufre de injuria bacteriana por lo que la concentración, en términos de cuantificación puede ser menor a los existentes en el suelo (Doyle y Beuchat, 2007). Es importante tener en cuenta que la inoculación del suelo y bioabono sólo se realizó en la fase inicial del cultivo, sin adicionar carga microbiana alguna o fertilización química después de la primera inoculación y de la siembra de las plántulas, lo que, al igual que en los trabajos reportados por Johannessen et al., 2005, permite determinar que no es necesario fertilizar en repetidas ocasiones para que se presente el patógeno, pues es capaz de utilizar la materia orgánica presente como sustrato y medio de propagación (Islam et al., 2004a). Según Ibenyassine et al., 2007, es importante considerar que con una segunda fertilización como es tradicional en este cultivo, la concentración del microorganismo se incrementa por la presencia de nutrientes rápidamente disponibles, lo que a su vez se constituye en un factor importante que aumentaría la probabilidad de contaminación de las plantas de lechuga.
Los resultados obtenidos semanalmente para las matrices bioabono y suelo, según la técnica de NMP de Salmonella/4 g suelo (EPA, 2006) indicaron menores concentraciones del microorganismo en las plantas cosechadas con respecto a las presentadas en el suelo abonado.
Tradicionalmente la búsqueda de Salmonella spp., en alimentos se hace utilizando la técnica de ausencia/presencia, siendo este microorganismo de cero tolerancia, sin embargo, en este estudio, se utilizó la técnica de NMP en el alimento, para realizar un seguimiento y homologar los datos del bioabono con los obtenidos en planta. Los resultados demostraron valores bajos del patógeno presentados en el vegetal, que pueden limitar su comercialización y consumo, al ser considerado un microorganismo de cero tolerancia en alimentos de consumo directo. Las concentraciones encontradas son suficientes para causar enfermedad pues según la dosis infectante del microorganismo (102 mo/g alimento; Kowall, 1985) y la dosis ingerida promedio de lechuga por persona (aproximadamente 25-50 g), al expresar el resultado en 4 g, las concentraciones presentadas son más que suficientes para que el microorganismo cause enfermedad en el consumidor.
En concordancia con otros estudios en los que también han investigado el riesgo de usar abonos contaminados con microorganismos patógenos a lo largo del cultivo de hortalizas frescas, se ha encontrado que la transmisión puede ocurrir en cualquier etapa del cultivo, tanto en condiciones de invernadero como en campo abierto (Baloda et al., 2001; Solomon et al., 2002; Lemunier et al., 2005). Se destacan como factores críticos la cantidad y calidad de bioabono aplicado (Islam et al., 2004a), la inoculación de las plantas desde la semilla y reinoculación del microorganismo de prueba a lo largo del cultivo (Johannessen et al., 2004; Franz et al., 2006), la calidad de agua durante el riego, cosecha o distribución (McMahon y Wilson, 2001). Weissinger et al., 2000, Natvig et al., 2002, Solomon et al., 2002, realizando estudios similares con bioabono inoculados artificialmente en cultivo de lechuga, concluyen que estos materiales son fuente directa de contaminación de la planta a través del tiempo de cultivo.
De igual manera el análisis realizado a las raíces de las plántulas cosechadas indicó colonización del sistema radicular por parte del patógeno, con concentraciones finales de 0,04 mo/g como 100 mo /g. Barak et al., 2005 y Franz et al., 2006, encontraron que cepas de Salmonella spp. varían en su capacidad de colonización en plantas de lechuga y alfalfa, pues esta propiedad depende de los factores de virulencia de la cepa así como del sistema de defensa de la planta. La expresión de dichos genes aún no es clara, pero en varios estudios referencian su expresión con mayor frecuencia en microorganismos Gram negativos, por la presencia en la pared de liposacaridos y proteínas que ofrecen resistencia a diversos factores ambientales como cambios de pH, humedad y temperatura (Plotnikova et al., 2000; Melnikov et al., 2000; Cao et al., 2001; Iniguez et al., 2005).
Según Klerks et al., 2007, hay factores más allá del área de contacto de la lechuga con el suelo y bioabono ya que en Salmonella spp. los factores de virulencia favorecen tanto la colonización como la internalización en las plantas en condición de endófito. Esto explica el hecho que en el presente estudio, al determinar la presencia del patógeno en plantas este fue detectado en camas con cubierta y si ella, sin influir significativamente factores como temperatura, pH o concentración del microorganismo (Thanassi y Hultgren, 2000). Así, se determinó que no hay relación entre la cubierta con polietileno y la contaminación de las lechugas, las barreras físicas entre la planta y la matriz contaminada no evitan la contaminación del cultivo por microorganismos patógenos como Salmonella enterica serovariedad Typhimurium ATCC 13176.
Este estudio demuestra que a pesar que las matrices a utilizar en cultivos de alimentos de consumo directo cuenten con concentraciones mínimas (0,04 mo/g y 100 mo/g) de S. typhimurium se produce contaminación del alimento poniendo en peligro la salud del consumidor, por lo que en estos cultivos es necesario asegurar la calidad de los bioabonos a utilizar para reducir el riesgo de contaminación de los consumidores con Salmonella spp. y determinar no solo por técnica A/P, sino también por NMP/4 g, pues existen muchos factores que se combinan para enmascarar el microorganismo, en especial en matrices tan complejas como los abonos orgánicos.
CONCLUSIONES
Se evidenció la permanencia de Salmonella enterica Serovariedad Typhimurium ATCC 13176 inoculada en concentraciones (0,04 mo/g bioabono/suelo y 100 mo/g bioa-bono/suelo) en suelo y bioabono por un tiempo de ocho semanas. Se logró determinar que existe transferencia de Salmonella enterica Serovariedad Typhimurium ATCC 13176 a la planta de lechuga tanto en camas cubiertas como descubiertas. El uso de la cubierta de polietileno durante el cultivo protege la planta físicamente pero no es un factor determinante en el aislamiento de la misma frente a la coloniza-ción por parte de patógenos como Salmonella enterica Serovariedad Typhimurium ATCC 13176.
AGRADECIMIENTOS
A la productora de hortalizas Hortícola Frutos de Mi Tierra de Hoy, a la Federación Internacional de Universidades Católicas (CIC-FIUC) proyecto 000158 y al Instituto Colombiano para el Desarrollo de Ciencia y Tecnología COLCIENCIAS.
BIBLIOGRAFÍA
ANGELOTTI R, FOTER MJ, LEWIS KH. Time-temperature effects on Salmonellae and Staphylococci in foods. II. Behavior at warm holding temperatures. Am J Pub Health. 1961;51(1):83-88.
[ Links ]BALCAZA L. Hortalizas de hoja: La fertilización de cultivos y pasturas. Editorial Hemisferio Sur. España; 1997. p. 207-210.
[ Links ]BALODA S, CHRISTENSEN L, TRAJCEVSKA S. Persistence of a Salmonella enterica serovar Typhimurium DT12 clone in a piggery and in agricultural soil amended with Salmonella-contaminated slurry. Appl Environ Microbiol. 2001;67:2859-2862.
[ Links ]BARAK D, GORSKI L, ARANI P, CHARKOWSKI O. Salmonella enterica virulence are required for bacterial attachment to plant tissue. Appl Environ Microbiol. 2005;71(10):5685-5691.
[ Links ]BEUCHAT LR. Vectors and conditions for preharvest contamination of fruits and vegetables with pathogens capable of causing enteric diseases. Br Food J Hyg Rev. 2006;108:38-53.
[ Links ]CAO H, BALDINI RL, RAHME LG. Common mechanisms for pathogens of plants and animals. Annu Rev Phytopathol. 2001;39:259-284.
[ Links ]CHANG J, FANG T. Survival of Escherichia coli O157:H7 and Salmonella enterica serovars Typhimurium in iceberg lettuce and the antimicrobial effect of rice vinegar against E. coli O157:H7. Food Microbiol. 2007;03:(005):2-7.
[ Links ]COLOM M, PONS R. El cultivo de la lechuga en Mallorca. España, Govern De Les Illes Balears; 2003. p. 20-52.
[ Links ]CCI - CORPORACIÓN COLOMBIA INTERNACIONAL. Perfil productivo de las hortalizas. Ministerio de Agricultura y Desarrollo Rural. Bogotá .Colombia. 2006.
[ Links ]DELGADO B, FERNANDEZ P, PALOB P, DERIAGO P. Effect of thimol and cyneme on Bacillus cereus vegetative cell evaluated through use on frequency distribution. Food Microbiol. 2004;21:327-334.
[ Links ]DOYLE M, BEUCHAT L. Food microbiology: fundamentals and frontiers. ASM Press. XVIII:78. Washington; 2007.
[ Links ]ENVIRONMENTAL PROTECTION AGENCY (EPA). Method 1682: Salmonella in Sewage Sludge (Biosolids) by Modified Semisolid Rappaport-Vassiliadis (MSRV) Medium. Consulta: junio 27 de 2007. Disponible en línea http://www.epa.gov/waterscience/methods/biosolids/EPA.Method.1682; 2006.
[ Links ]FRANZ E, VAN DIEPENINGEN A, DE VOS OJ, VAN BRUGGEN AHC. The effect of cattle feeding regime and soil management type on the fate of Escherichia coli O157:H7 and Salmonella enterica serovar Typhimurium in manure, manure-amended soil and lettuce. Appl Environ Microbiol. 2005;71:6165-6174.
[ Links ]GALE P. Using event trees to quantify pathogen levels on root crops from land application of treated sewage sludge. J Appl Microbiol. 2002;94 (1):35-47.
[ Links ]HOLLEY R, ARRUS K, OMINSKI K, TENUTA M, BLANK G. Salmonella Survival in Manure-Treated Soils during Simulated Seasonal Temperature Exposure. J Environ Qual. 2006;35:1170-1180.
[ Links ]IBENYASSINE K, MHAND R, KARAMOKO Y, ANAJJAR B, CHOUIBANI M, ENNAJI M. Bacterial pathogens recovered from vegetables irrigated by wastewater in Moroco. J Environ Health. 2007;69(10):47-51.
[ Links ]INIGUEZ A L, DONG Y, CARTER H, AHMER B, STONE J, TRIPLETT EW. Regulation of enteric endophytic bacterial colonization by plant defenses. Mol Plant Microbe Interact. 2005;18:169-178.
[ Links ]ISLAM M, DOYLE P, PHATAJ P, MILLNER P, JIANG X. Persistence of enterohemorragic Escherichia coli O157:H7 in soil and on leaf lettuce and parsley grow in fields treated with contaminated manure compost or irrigation water. J Food Prot. 2004a;67:1365-1370.
[ Links ]ISLAM M, MORGAN J, DOYLE M. Fate of Salmonella enterica serovar Typhimurium on carrots and Radishes grow in fields treated with contaminated manure Compost or irrigation Water. Appl Environ Microbiol. 2004b;70(4):2497-2502.
[ Links ]JOHANNESSEN S, BENGSTON G, HEIER B, BREDHOLT S, WASTESON Y, RORVIK L. Potential of Escherichia coli O157:H7 from organic manure into crisphead lettuce. Appl Environ Microbiol. 2005;71(5):221-2225.
[ Links ]JOHANNESSEN S, FROSETH R, SOLEMDAL L, JARP J, WASTESON Y, ROVIK L. Influence of bovine manure as fertilizer on the bacteriological quality of organic iceberg lettuce. J Appl Microbiol. 2004;96:787-794.
[ Links ]KLERKS MICHEL. Quantitative detection of Salmonella enterica and the specific interaction with Lactuca sativa [Doctoral thesis-Biological Farming Systems]. Group -Wageningen University - The Netherlands; 2007. p. 134-156.
[ Links ]KOWALL NF. Health Effects of Land Application of Municipal Sludge. En: EPA /600/1_85/015:US.EPA Health Effects Research Laboratory. Research Triangle Park. NC:Also:NTIS PB86_197456/78: National Technical Information Service, Springfield, VA; 1985.
[ Links ]LEMUNIER M, FRANCOU C, ROUSSEAUX S, HOUOT S, DANTIGNY P, PIVENTEAU P, GUZZO J. Long term survival of pathogenic and sanitation indicador bacteria in experimental biowaste compost. J Appl Microbiol. 2005;71(10):5779-5786.
[ Links ]LIN J, LEE I, FREY J, SLONCZEWSKI J, FOSTER J. Comparative Analysis of Extreme Acid Survival in Salmonella typhimurium, Shigella flexneri, and Escherichia coli. American Society of Microbiology. 1995;177(14):4097-4104.
[ Links ]MAGNUSON A, HING D, TOROK T. Microflora of partially processed lettuce. Appl Environ Microbiol. 1990;56(12):3851-3854.
[ Links ]MARTÍNEZ M, MERCADO M, VALENCIA N, GONZALEZ F, CARRASCAL A. Análisis microbiológicos de suelos y abonos orgánicos, énfasis en microorganismos patógenos. Instituto de hidrología, meteorología y estudios ambientales. Javergraf. Pontificia Universidad Javeriana. Bogotá; 2007. p. 5-17
[ Links ]MARTÍNEZ A, IRALA J, FAULIN F. Bioestadística amigable. Madrid, España: Díaz de Santos. 2001:XVII,501.
[ Links ]MCMAHON M, WILSON I. The occurrence of enteric pathogens and Aeromonas species in organic vegetables. Int J Food Microbiol. 2001;70:155-162.
[ Links ]MELNIKOV A, ZABORINA O, DHIMAN N, PRABHAKAR B, CHAKRABARTY A. Clinical and environmental isolates of Burkholderia cepacia exhibit differential cytotoxicity towards macrophages and mast cells. Mol Microbiol. 2000;36:1481-1493.
[ Links ]MORRIS J, GADNER J. Calculating confidence intervals for relative risks (oddsnratios) and standardized ratios and rates. Br Med J. 1988;293:1313-1316.
[ Links ]MUKHERJEE A, SPEH D, DIK E, DIÉZ P, GONZALEZ F. Pre-harvest evaluation of coliforms, Salmonella and Escherichia coli in organic conventional and conventional produce growth by Minnesota farmers. J Food Protection. 2004;67,894-900.
[ Links ]NATVIG E, INGHAM S, INGHAM H, COOPERBAND L, ROPER T. Salmonella enterica serovar Typhimurium and Escherichia coli contamination of root and leaf vegetables grown in soil with incorporated bovine manure. App Environ Microbiol. 2002;68,2737-2744.
[ Links ]PALACIOS L, LUPIOLA P, DEL NERO E, PARDO A. Primeros resultados del estudio de Salmonella en la zona no saturada. Estudios de la Zona No Saturada del Suelo. Eds. R. Muñoz-Carpena, A. Ritter, C. Tascón. ICIA. Tenerife; 1999.
[ Links ]PLOTNIKOVA JM, RAHME LG, AUSUBEL FM. Pathogenesis of the human opportunistic pathogen Pseudomonas aeruginosa PA14 in Arabidopsis. Plant Physiol. 2000;124:1766-1774.
[ Links ]SARQUIS M, VERGARA L, CARRASCAL A. Identificación de Listeria monocytogenes en hortalizas crudas y procesadas lechugas y repollos [Trabajo de grado]. Pontificia Universidad Javeriana. Facultad de Ciencias. Bogotá; 1997.
[ Links ]SIVAPALASINGAM S, FRIEDMAN C, COHEN L, TAUXE R. Fresh produce: a growing cause of outbreaks of foodborne illness in the United States, 1973 through 1997. J Food Protection. 2004;67:2342-2353.
[ Links ]SOLOMON E, B YARON, S MATTHEWS, KR. Transmission of Escherichia coli O157:H7 from contaminated manure and irrigation water to lettuce plant tissue and its subsequent internalization. Appl Environ Microbiol. 2002;68:397-400.
[ Links ]TAUXE R, KRUSE H, HELBERT C, POTTER M, MADDEN J, WACHSMUTH K. Microbial hazards and emerging issues associated with product and preliminary report to the National Advisory Committee on Microbiology Criteria for Foods. J Food Prot. 1997;60:1400-1408.
[ Links ]THANASSI DG, HULTGREN SJ. Multiple pathways allow protein secretion across the bacterial outer membrane. Curr Opin Cell Biol. 2000;12:420-430.
[ Links ]VAN DER HAMMEN T, RANGEL-CH JO. El Estudio de la Vegetación en Colombia (Recuento Histórico-Tareas futuras). En: J.O Rangel. Colombia Diversidad Biótica II. Instituto de Ciencias Naturales, Universidad Nacional de Colombia & IDEAM. Santafé de Bogotá; 1997. p. 17-46.
[ Links ]WALKLEY A, BLACK IA. An examination of the Degtjareff method for determining soil organic matter a proposed modification of the cromic acid irritation method. Soil Science. 1934;34:39-38.
[ Links ]WARRINER K, IBRAHIM M, DICKINSON C, WAITES M. Inetraction of Escherichia coli with growing salad spinach plants. J Food Prot. 2003;56:1970-1979
[ Links ]WEISSINGER W, CHANTARAPANONY L, BEUCHAT R. Survival and growth of Salmonella baildon in shredded lettuce and diced tomatoes, and effectiveness of chlorinated water as a sanitizer. J Food Microbiol. 2000;62:123-131.
[ Links ]WILKINSON KG. The biosecurity of on-farm mortality composting. J Applied Microbiol. 2007;102:609-618.
[ Links ]













