Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.13 no.3 Bogotá Sep./Dec. 2008
RESPUESTAS FENOTÍPICAS DE Lippiaalba Y Lippiaoriganoides(VERBENACEAE) A LA DISPONIBILIDAD DE AGUA EN EL SUELO
Phenothypical Responses of Lippiaalbaand Lippiaoriganoides(Verbenaceae) to Water Availability in the Soil
ANDRÉS ALEJANDRO CAMARGO PARRA1, NELSON RODRÍGUEZ LÓPEZ1.
1 Grupo Nacional de Investigación de Ecofisiologia y Metabolismo Vegetal TropicalGIEFIVETCENIVAM. Escuela de Biología, Facultad de Ciencias, Universidad Industrial de Santander, Calle 9a Carrera 27, Bucaramanga, Colombia. aacamargo@tux.uis.edu.co; fisionel@uis.edu.co
Presentado 24 de enero de 2008, aceptado 11 de junio de 2008, correcciones 29 de octubre de 2008.
RESUMEN
La capacidad de un genotipo particular de producir diferentes fenotipos es conocido como plasticidad fenotípica (PF). Este trabajo evaluó la PF a través de la ontogenia vegetativa en dos especies de la familia Verbenaceae, Lippia alba ampliamente distribuida en habitats favorables y Lippia origanoides ampliamente distribuida en habitats con bajo disponibilidad de recursos. Se evaluó si la PF está correlacionada con distribución ecologica, en respuesta al contenido relativo de agua en el suelo. Se distribuyeron aleatoriamente 40 clones por tratamiento en tres condiciones experimentales que variaron en la disponibilidad de agua en el suelo, evaluándose distintos caracteres morfológicos y de asignación de biomasa. Los resultados demuestran una falta de asociación entre PF y distribución ecología de ambas especies. Se observó una mayor PF en L. alba en la etapa temprana de la ontogenia vegetativa, demostrando que la PF a través de la ontogenia vegetativa no se presenta de forma uniforme, la amplia distribución ecológica de esta especie se explica por una mayor PF y asignación de biomasa en los diferentes componentes de la tasa de crecimiento relativa (RGR), ya que estos pueden ser ventajosos para alcanzar una rápida madurez sexual y colonizar nuevos hábitats con condiciones favorables. Contrario a nuestra hipótesis, L. origanoides presentó una mayor PF durante la ontogenia vegetativa, los resultados demuestran una posible estrategia de tolerancia al estrés que le permite un bajo desempeño en el RGR en habitats con baja disponibilidad de recursos.
Palabras clave: plasticidad fenotípica, distribución ecológica, ontogenia, agua, Lippia sp.
ABSTRACT
The capacity of genotype to produced different phenotypes is denominated Phenotypic Plasticity (PP). The present study evaluates the PP during the vegetative ontogeny in two species of the family Verbenaceae, Lippia alba which occurs in favorable habitats and L. origanoides which occurs in unfavorable habitats. We compare the PP and its ecological distribution, in response to availability of water in the soil. Forty plants were distributed randomly into three different treatments which had different availabilities of water in the soil. The results indicate a poor association between the PP and the ecological breadth. L. alba presents a high PP in the early stage of the ontogeny demonstrating that it does not exist uniformity in the PP through the vegetative ontogeny, the wide ecological distribution in this specie is explained for a higher allocation of mass in the component the relative growth rate RGR, because this might be an advantage for reaching sexual maturity faster and colonized new favorable habitats. Contrary to our hypothesis of work L. origanoides shows a PP, during the vegetative ontogeny and probably are associated to some mechanisms of tolerance to stress that allow a lower rate in the RGR in unfavorable habitats.
Key word: Phenotypic Plasticity, ecological distribution, ontogeny, water, Lippia sp.
INTRODUCCIÓN
La plasticidad fenotípica (PF) es la capacidad de un genotipo particular de producir diferentes fenotipos en respuesta a la variación ambiental (Pigliucci, 2001; Diggle, 2002; Fuller, 2003; DeWitt y Scheiner, 2004). En plantas la variación ambiental sobre un genotipo determinado involucra cambios en su morfología, fisiología y patrones de asignación de biomasa (Gianoli, 2004; Pigliucci, 2001; Pigliucci, 2005; Sultan, 2000). La PF en plantas puede determinarse a través de la ontogenia, transición de fase vegetativa a fase reproductiva, o en el estado adulto de su desarrollo, donde se observa una mayor expresión de los caracteres asociados con la variación del fenotipo, en respuesta a la heterogeneidad ambiental (Grime y Mackey, 2002; Sultan 2000, McConnaughay y Coleman, 1999), algunos autores han sugerido que la PF aumenta a través de la ontogenia (Pigliucci et al., 2005), y principalmente en la etapa adulta donde existen diversos caracteres morfológicos, de asignación de biomasa o fisiológicos que aportan al fitness (Sultan, 2000). Las diferencias en la distribución ecológica de las especies vegetales se presenta como consecuencia de la divergencias en los patrones de PF (Alpert y Simms, 2002). Por lo tanto, especies con una amplia distribución ecológica presentarían una mayor PF, que las especies de limitada distribución (Futuyma y Moreno, 1988; Gianoli, 2004; Niinemets y Valladares, 2004). Sin embargo, algunas especies de restringida distribución presentan una amplia respuesta en su expresión fenotípica con respecto a la variación ambiental (González y Gianoli, 2004). La hipótesis de distribución ecológica se ha evaluado, en estado adulto, de especies congenéricas de las familia Poligonaceae en respuesta a la disponibilidad de humedad en el suelo (Sultan et al., 1998a; Sultan et al., 1998b; Sultan y Bazzaz, 1993). En esos trabajos ha sido reportado, que las diferencias interespecíficas e intra poblacionales en los patrones de PF, están asociados a una mayor distribución ecológica. No obstante, otros autores sugieren que la hipótesis de PF asociada con la distribución ecológica debe ser evaluada a través de la ontogenia, ya que la PF puede manifestarse de forma uniforme o no, durante la misma (Wright y McConnaughay, 2002). La disponibilidad de agua en el suelo es uno de los factores ambientales de mayor importancia para las plantas, ya que determina la abundancia y distribución de las especies vegetales en los diferentes hábitats (Larcher, 1995). Además, la disponibilidad hídrica varía espacial y temporalmente proporcionando diferentes patrones de PF en plantas, que contribuyen a las diferencias en la distribución ecológica entre especies (Cook et al., 1980; Sultan y Bazzaz, 1993). Varios autores han reportado que la disponibilidad de agua en el suelo, establece el grado de respuesta fenotípica en plantas, principalmente en los caracteres asociadas a la raíz, que determinan el establecimiento y distribución geográfica de las especies vegetales (Guan et al., 2004; Sultan y Bazzaz, 1993; Gianoli, 2004; Fuller, 2003; Pigliucci, 2001). L. alba y L. origanoides, son especies promisorias en la producción de metabolitos secundarios aromáticos de interés para la industria farmacéutica y cosmética (Stashenko et al., 2003). Sin embargo, son pocos los estudios ecofisiológicos realizados hasta el momento con estas especies congenéricas. L. alba, se encuentra ampliamente distribuida, presentándose en lugares con alta a media disponibilidad de agua en el suelo (Woodson et al., 1973). En tanto que, L. origanoides, se encuentra como una especie dominante en suelos con baja disponibilidad de agua en el suelo, especialmente, en zonas semiáridas (Albesiano et al., 2003). En el presente trabajo consideramos que la amplia distribución ecológica, en L. alba estaría asociada con una mayor expresión fenotípica durante su ontogenia vegetativa, comparada con L. origanoides, especie de limitada distribución, en respuesta a la de disponibilidad de agua en el suelo. Para probar esa hipótesis nosotros respondimos dos interrogantes: i ¿La expresión de la PF es uniforme a través de la ontogenia entre dos especies congenéricas de la familia Verbenaceae? y ii. ¿La magnitud de la PF asociada a la distribución ecológica es mayor en L. alba que en L. origanoides?
MATERIALES Y MÉTODOS
ÁREA Y ESPECIES EXPERIMENTALES
La investigación se realizó bajo condiciones de invernadero en el área experimental del Laboratorio de Ecofisiología Vegetal, Universidad Industrial de Santander, Bucaramanga, Colombia. Se propagaron por medio de estacas, 120 clones de L. alba y 120 clones de L. origanoides. La longitud de los clones fue de 20 cm y el peso de 5±0,5 g (Albuquerque et al., 2001). Los clones de L. alba se obtuvieron a partir de una población ubicada en la Granja Experimental Guatiguará, Universidad Industrial de Santander, municipio de Piedecuesta (Santander; 6°59'16,20'' Norte y 73°2' 51,66'' Oeste). Los clones de L. origanoides se obtuvieron a partir de una población ubicada en la zona del cañón del río Chicamocha, corregimiento de Pescadero (6°48'42.6'' Norte y 73°00'29,6'' Oeste), municipio de Piedecuesta, Santander. Las características climáticas de estas dos localidades se reportan en la Tabla.1. Los clones se plantaron en recipientes plásticos con un diámetro de 40,5 cm y 17 cm de profundidad. El sustrato utilizado contenía una mezcla de tierra, arena y materia orgánica, en proporción (1:3:1) para todos los tratamientos. Las condiciones ambientales de luz, temperatura y humedad relativa en suelo, fueron las mismas para el crecimiento de los clones durante un período 15 días y posteriormente se distribuyeron de forma aleatoria en cada uno de los tratamientos.

DISEÑO EXPERIMENTAL
El experimento fue conducido bajo un esquema factorial utilizando un diseño experimental aletaorizado con tres niveles que variaron en la disponibilidad de agua en el suelo. Para establecer los diferentes tratamientos, se determinó la capacidad de retención de humedad del sustrato (CRH; Guan et al., 2004). En cada tratamiento, las plantas se irrigaron hasta saturación (100% CRH) y posteriormente, por evaporación del agua, se alcanzaron los valores de contenido relativo de agua en el suelo (RWC: Soil water content) requeridos para cada tratamiento (Guan et al., 2004). El primer tratamiento se mantuvo a una saturación constante del 90% CRH, el segundo a una saturación constante del 70% CRH y el tercer a una saturación constante del 30% CRH. Para el primer tratamiento se irrigó con 500 mL de agua por planta, transcurrido 24 horas. Para el segundo tratamiento, se irrigó con 500 mL de agua transcurrido 48 horas y para el tercer tratamiento, se procedió de igual forma irrigando con 500 mL agua transcurrido 72 horas. Para evitar la evaporación excesiva del suelo, las irrigaciones de cada uno de los tratamientos se realizaron a las 6:00 p.m. (Guan et al., 2004). Cada tratamiento se conformó con un total de 40 clones de ambas especies. La cantidad de agua disponible en suelo en cada uno de los tratamientos se interpretó en términos RWC. Los valores en cada uno de los tratamientos de CRH se corroboraron con mediciones sucesivas realizadas con un sensor de humedad del suelo Water Marker (Irrometer, USA). Los rangos de RWC utilizados en los tres tratamientos se presentan en la Tabla.2.
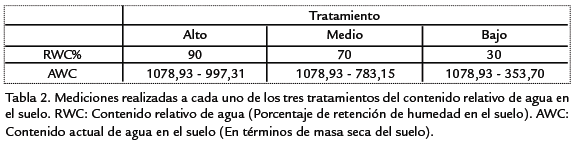
CARACTERES MORFOLÓGICOS Y DE ASIGNACIÓN DE BIOMASA EVALUADOS
Los clones crecieron durante un período total 75 días posteriores a la fecha de siembra, bajo los diferentes tratamientos de RWC. El primer muestreo destructivo se realizó el día 30 bajo los diferentes tratamientos de RWC, el segundo y último muestreo se realizó el día 45. En cada uno de los muestreos, se colectaron un total de 15 plantas por tratamiento para un total de 45 réplicas por especie, posteriormente se separaron en cada una de las diferentes estructuras de la planta (raíz, vástago y hojas) y a continuación se secaron a una temperatura de 80 °C durante 72 horas, hasta peso constante, para determinar la biomasa en cada una de las estructuras de la planta (Guan et al., 2004). Los caracteres morfológicos medidos fueron: Altura apical (AP), número hojas (NH), longitud promedio de ramas (LPR), área foliar (AF), área foliar específica (SLA). El AF se estimó a través del programa Eye, Leaf & Symptom Area Software (Bakrem, 2005). El SLA fue el resultado de la estimación del AF dividido en la biomasa seca de hojas. Con el registro de la biomasa seca en cada una de las estructura de la planta se estimaron los siguientes caracteres de asignación de biomasa: Fracción biomasa hojas (FMH: biomasa hojas/biomasa total), fracción biomasa vástago (FMV: biomasa vástago/biomasa total), fracción biomasa raíz (FMR: biomasa raíz/biomasa total) y biomasa raíz/ biomasa vástago (R/S: biomasa raíz/biomasa vástago; Camargo y Rodríguez, 2006; Poorter y Nagel, 2002). La tasa de crecimiento relativo (RGR) se estimó a través de la aproximación funcional (Hunt y Parsons, 1974).
ANÁLISIS ESTADÍSTICO
Los caracteres morfológicos y de asignación de biomasa se sometieron a una prueba de normalidad. Para los caracteres AP, NH y LPR fue necesaria una transformación a logaritmo natural (Ln) para cumplir con las asunciones de normalidad y homogeneidad de varianzas. Posteriormente, se llevó a cabo un análisis de varianza (ANAVA), para los caracteres morfológicos y de asignación de biomasa que determinaría si existen diferencias significativas en cada una de las especies, en cada uno de los tratamientos durante la ontogenia vegetativa y la interacción tratamiento por muestreo. Un efecto significativo del tratamiento sobre un carácter es indicativo de plasticidad fenotípica, mientras que, un efecto significativo en la interacción tratamiento por muestreo, indica variación fenotípica durante la ontogenia vegetativa. Como algunas variables de asignación de biomasa varían con el tamaño de la planta, se utiliza la biomasa total como una covariante (Coleman et al., 1994).
MAGNITUD DE LA PLASTICIDAD FENOTÍPICA
La cuantificación de la magnitud de la plasticidad fenotípica interespecífica se realizó, mediante el índice de distancias fenotípicas relativa (RDPI: Relative distance plasticity index; Valladares et al., 2006). El RDPI se calculó a partir de la menor y mayor respuesta fenotípica en cada uno de los tratamientos de RWC, para los caracteres morfológicos y de asignación de biomasa durante la ontogenia vegetativa (Valladares et al., 2006). Para las comparaciones de los RDPI en cada una de las especies, se utilizaron los caracteres morfológicos y de asignación de biomasa de ambas especie, realizando una comparación no paramétrica para en cada uno de los muestreos realizados durante la etapa vegetativa. (i.e., U MannWhitney; Camargo y Rodríguez, 2006).
RESULTADOS
CARACTERES MORFOLÓGICOS Y DE ASIGNACIÓN DE BIOMASA
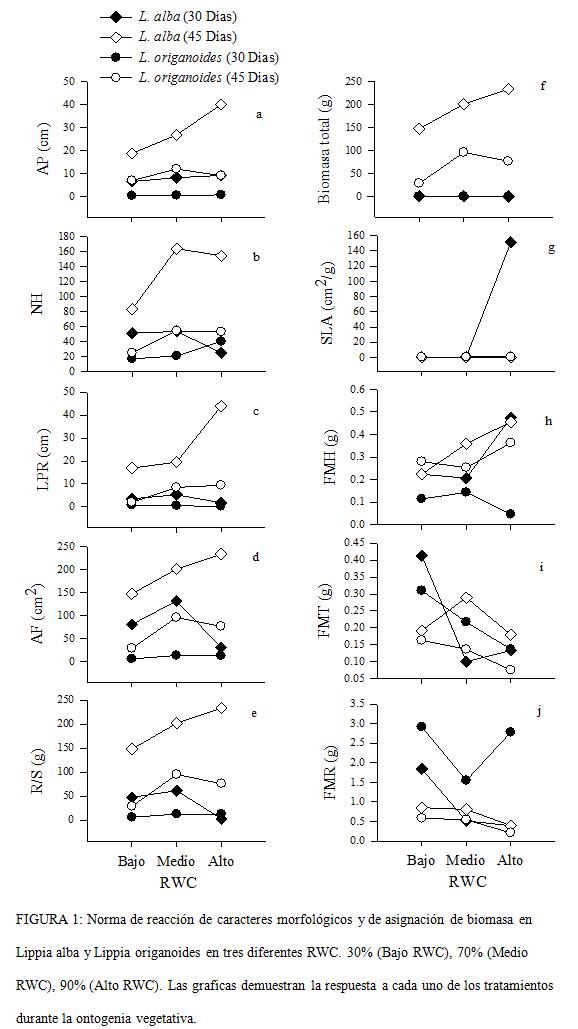
Los diferentes caracteres evaluados en L. alba y L. origanoides presentaron variación fenotípicas en respuesta a los diferentes tratamientos de RWC (Fig. 1). El ANAVA demuestra un efecto significativo en la disponibilidad de agua en suelo, sobre los caracteres morfológicos y de asignación de biomasa en ambas especies, excepto en FMV, para L. origanoides (Tabla.3b), la ontogenia vegetativa de ambas especies, se observaron diferencias significativas sobre los diferentes caracteres evaluados, excepto en el AF para L. origanoides (Tabla.3b). Las normas de reacción para ambas especies presentaron variación y diferencias significativas en el fenotipo promedio (Fig. 1; Tabla.3). Sin embargo, L. alba presentó, una mayor expresión del fenótipo promedio en caracteres morfológicos y de asignación de biomasa en los diferentes tratamientos de RWC (Fig. 1). Los caracteres asociados con la captación de luz, NH, AF, LPR y SLA, presentaron una mayor respuesta en los tratamiento de alto y medio RWC, contrarios los resultados observados en el tratamiento de bajo RWC en L. alba durante su fase vegetativa (Fig. 1b c, d, g; , Tabla.3a), los resultados observados en L. origanoides para estos caracteres demuestran poca variación y expresión fenotípica durante la fase vegetativa (Fig. 1b, c, d, g, Tabla.3b). Los caracteres asociados con la captura del recurso hídrico, FMR y R/S demuestra una mayor asignación de biomasa en respuesta a la disminución del RWC, en L. alba (Fig. 1j), al inicio de la ontogenia vegetativa contrario a lo observado en los clones de L. origanoides que no presentaron variación alguna (Fig. 1e; día 30). Posterior al día 30, la relación R/S aumenta los tratamientos de medio y alta RWC, para ambas especies

TASA DE CRECIMIENTO RELATIVO
Presentó un mayor desempeño para los clones de L. alba en el tratamiento de alto RWC, comparado con L. origanoides que demuestra un mayor desempeño en los tratamientos de bajo y medio RWC (Fig. 2).

MAGNITUD DE LA PLASTICIDAD
El análisis de la magnitud de la PF en términos del RDPI durante la ontogenia vegetativa demuestra diferencias significativas en ambas especies, y una mayor plasticidad en L. origanoides (Tabla.4). La variación ínterespecífica de los índices de plasticidad, presentó diferencias significativas en varios caracteres morfológicos y de asignación de biomasa durante la ontogenia vegetativa. Para L. alba en los caracteres BT, FMH, FMR y R/S, en el día 30 (Fig. 3a). En tanto que, L. origanoides presentó una mayor PF en los caracteres LPR, NH, AF, BT, SLA y R/S, en el día 45 (Fig. 3b).


DISCUSIÓN
RESPUESTAS PLÁSTICAS
El rango de respuesta fenotípica observado en L. alba y L. origanoides, en las normas de reacción durante la ontogenia vegetativa, en los diferentes tratamientos de RWC demuestran, variación en caracteres morfológicos y de asignación de biomasa en a bas especies, influenciados drásticamente por la disponibilidad de agua en el suelo, estos resultados apoyan el postulado de McConnaughay y Coleman, 1999 y Wright y McConnaughmay, 2002, que indican que las repuestas fenotípicas no se comporta de forma uniforme a través de la ontogenia y varían en función del crecimiento, influenciado drásticamente por la variación ambiental, que ajusta el crecimiento y trayectoria de la ontogenia en plantas.
La norma de reacción para los caracteres asociados con la captación de luz, como el NH, LPR, AF y SLA, demuestran un aumento a través de la ontogenia vegetativa en los tratamientos de alto y medio RWC para ambas especies. Según Valladares, 2004, estos caracteres, permiten una mejor captación de luz en respuesta a una buena disponibilidad hídrica en el suelo y una disminución en dichos caracteres en función de la disminución del RWC, evidencian mecanismos de evasión al estrés hídrico, estrategia que permite disminuir, la pérdida excesiva de agua por evaporación del agua en las hojas. La reducción en estos caracteres tendrían ventajas en habitats con escasez de nutrientes o agua y sugiere una mayor capacidad de supervivencia en habitats con baja disponibilidad de recursos (Fig. 4; Larcher, 1995; Chapin, 1991; Chapin et al., 1993; Valladares, 2004).

Los resultados obtenidos a partir de la asignación de biomasa, son concordantes con la predicción de la teoría de partición óptima, la cual ha sugerido un balance funcional en la asignación de biomasa, los cuales podrían ser considerados adaptativos, ya que permite la captura de un recurso limitante durante el crecimiento de la planta (Camargo y Rodríguez, 2006; Poorter y Nagel, 2002; Reich, 2002). Resultados reportados por McConnaghay y Coleman, 1999, quienes evaluaron la asignación de biomasa en tres especies anuales (Abutilon theophrastis, Chenopodium album y Polygonum pensylvanicum), en respuesta a la disponibilidad de agua, luz y nutrientes, demostraron no tolerarlo. La estrategia de tolerancia conlleva a una limitación en el RGR e involucran diferentes mecanismos fisiológicos, comparado con la estrategia evitación que conlleva un crecimiento limitado e involucra caracteres morfológicos (Tomado y modificado de Valladares, 2004; Larcher, 1995). Estas respuestas son observdas en L. alba en respuesta a la baja disponibilidad de agua en el suelo. que la asignación de biomasa era concordante con la teoría de partición optima, indicando que la asignación de biomasa hacia las hojas principalmente, SLA no fue significativo entre los diferentes tratamientos de disponibilidad de agua en el suelo durante la trayectoria ontogenia de dichas especies. Contrarios a los resultados reportados en este trabajo, para el área foliar específica (SLA), también se determinaron diferencias significativas y un aumento en la asignación de biomasa a la raíz (FMR) en función de la disminución del RWC. Resultados similares a los reportados en este trabajo, de igual forma que los resultados reportados por Gonzáles y Gianoli, 2004, Bell y Sultan, 1999, en especies congenéricas de la familia Convolvulaceae y Polygonaceae respectivamente, demuestran que la relación R/S aumenta a medida que disminuye el RWC, debido a una asignación de biomasa constante hacia la raíz, que le permite una mayor exploración del recurso hídrico (Fig. 5), estos resultados son similares a los observados en L. alba durante la etapa temprana de la ontogenia vegetativa (30 días), demostrando un balance funcional, en la asignación de biomasa en la raíz y la disminución de un recurso particular en etapas tempranas de la ontogenia vegetativa (Gedroc et al., 1996).

Resultados reportados por Guan et al., 2004, para Mosla chinensis, especie aromática de amplia distribución en zonas semiáridas en el sudeste de China, demuestran que la relación R/S, no era significativa en cada uno de los tratamiento de RWC, e invariante en la asignación de biomasa a la raíz, frente a la disminución o aumento del RWC. Estos resultados son similares a los reportados en este trabajo durante la ontogenia vegetativa de L. origanoides (Fig. 1e), esta repuestas sugieren desde el punto de vista funcional, que especies de zonas o regiones semiáridas, demuestren poca variación fenotípica frente a condiciones ambientales limitantes, y que algunos caracteres como en este caso la raíz, demuestren procesos de asignación de biomasa lentos y "aparentemente" invariantes que determinan su distribución y adquisición de recursos bajo condiciones ambientales limitantes, y sugieren la presencia de mecanismos de tolerancia que permiten su prevalencia en condiciones ambientales estresantes. Desde el punto de vista adaptativo, esta respuestas son comunes en especies de habitats estresantes (i. e., ambientes mediterráneos) y determinan la permanencia de poblaciones vegetales, que compiten por diversos recursos ambiéntales en ecosistemas áridos (Cook et al., 1980; Larcher, 1995; Bell y Sultan 1999; Kroon y Visser, 2003).
TASAS DE CRECIMIENTO RELATIVO E IMPLICACIONES ECOLÓGICAS (RGR)
Los resultados obtenidos para los caracteres de asignación de biomasa en L. alba sugieren, que su amplia distribución ecológica en hábitats favorables se debe una mayor PF en estos caracteres; los cuales son gran importancia ecológica, principalmente los asociados al RGR que le permiten amoldarse rápidamente a condiciones medioambientales optimas para su crecimiento (Pigliucci, 2001; Sultan, 2004), permitiéndole un mayor aporte sobre los componentes asociados al fitness en la etapa adulta de la planta (Poorter y Nagel, 2002). En este contexto L. alba, presentó un mayor desempeño del RGR en el tratamiento de alto RWC, al igual que sus diferentes componentes (BT, AF y FMH), que a su vez determina el tiempo fenológico de madurez sexual, y permiten en condiciones ambientales favorables una rápida y mayor asignación de biomasa a dichos componentes, que favorecería la dispersión a nuevos hábitats que no presentan deficiencias hídricas o deficiencias en varios factores que favorezcan su crecimiento (Poorter y Nagel, 2002; Poorter, 2002).
Los resultados obtenidos en L. origanoides para los tratamiento de bajo RWC sugieren mecanismo de tolerancia en condiciones ambientes limitantes, que permiten su supervivencia en condiciones ambiental limitantes, debido una menor asignación de biomasa a los diferentes componentes asociados al RGR (AF y FMH). Una menor asignación de biomasa a los componentes del RGR, sugieren ajustes fisiológicos como en la conductancia estomatica, tasa fotosintética, asignación de biomasa foliar (Chapín et al., 1993), acumulación de metabolitos secundarios, una mayor cutícula foliar que evita la pérdida excesiva de agua por evaporación bajo condiciones de estrés luminoso y hídrico (Peñuelas y Lluisa, 1999a; Peñuelas y Lluisa, 1999b). Este tipo de ajuste es conocido como síndrome de tolerancia al estrés, característica que permiten la tolerancia a hábitats áridos y semiáridos (Chapin, 1991; Chapin et al., 1993), como el caso de L. origanoides, es de aclarar que este trabajo no se cuantificaron mediciones del tipo fisiológico. Aunque esta planta presenta varias características de una planta adaptada a condiciones ambientales limitantes, la información fisiológica disponible es limitada para establecer una sólida hipótesis que está especie tolera condiciones ambientales estresantes.
En consideración con el bajo desempeño observado en condiciones de baja disponibilidad de agua en el suelo, en L. alba, sugieren la ausencia de mecanismos fisiológicos que permitirían tolerar habitats con baja disponibilidad de agua en el suelo (Fig. 6) (Kroon y Visser, 2003; Valladares, 2004). Estos resultados en términos de RGR, en ambas especie son concordantes con los postulados por Chapín et al., 1993, quien establece que las plantas distribuidas condiciones ambientales favorables presentarán un mayor RGR, debido a la ausencia de competencia por recursos, contrario a especies que se encuentren en condiciones ambientales desfavorables, sujetas a la competencia por recurso ambiental, mecanismos de tolerancia y costos de cada uno de los mecanismos que permiten su prevalencia bajo estas condiciones (Fig. 7).


MAGNITUD DE LA PLASTICIDAD FENOTÍPICA Y DISTRIBUCIÓN AMBIENTAL
Los resultados observados durante la fase vegetativa de L. alba y L. origanoides en términos de RDPI no demuestran una clara asociación de PF y distribución ecológica en las especies evaluadas, siendo concordante con otro estudio realizado en especies congenéricas con diferencias en su distribución ecológica, donde se analizaron la expresión de caracteres morfológicos y de asignación de biomasa en plantas de la familia Convolvulaceae (González y Gianoli, 2004). Las diferencias interespecíficas en la PF total del RDPI, demostró falta de asociación entre PF, amplitud ecológica y uniformidad a través ontogenia vegetativa. Se encontró que algunos caracteres como el SLA, FMH y R/S permiten en términos de RDPI diferenciar las especies en términos de PF (Fig. 3); estos resultados demuestran que la variación en el RWC, ajustan en gran medida el crecimiento y trayectoria de la ontogenia en ambas especies (Wright y McConnaughay, 2002). En consideración con la hipótesis de nuestro trabajo los resultados demostraron que L. origanoides presentó una mayor PF; esta especie presenta una limitada distribución ambiental, en hábitats de baja disponibilidad de agua en el suelo (Albesiano et al., 2003), resultado contradictorio a los reportados por (Guan et al., 2004; Sultan, 1998a; Sultan 1998b; Sultan y Bazzaz, 1993; Sultan, 2001; Bell y Sultan, 1999), quienes reportan que la PF está correlacionada con una mayor distribución ecológica. Estos resultados son una clara idea de la presencia de mecanismos de tolerancia y especialización en especies de hábitats con baja disponibilidad de recursos, pero la ausencia de datos ecofisiológicos limitan la predicción de especies de habitats semiáridos como L. origanoides.
CONCLUSIÓN
En este trabajo no se corroboró la hipótesis que PF es asociada directamente con la distribución ecológica de L.alba y L. origanoides en respuesta a la disponibilidad de agua en el suelo. De igual forma que no existe uniformidad en la PF a través de la ontogenia vegetativa, ya que este último componente está determinado por la variación del RWC sobre el crecimiento y trayectoria de la ontogenia de ambas especies, esto es corroborado por las diferencias interespecífica interpretados en términos de PF. El RGR para L. alba explica la amplia distribución en hábitats de alta disponibilidad de agua en el suelo, debido a una mayor asignación de biomasa en cada uno de sus componentes, que permiten una rápida colonización de habitats con condiciones favorables. Un mayor índice de plasticidad en L. origanoides debe estar asociado a mecanismos de tolerancia al estrés que le permiten adaptarse a condiciones ambientales adversas. Estas respuestas fenotípicas deben interpretar e inferirse a escala ecológica ya que presentan un impacto directo sobre las poblaciones vegetales, que permiten aumentar la tolerancia a hábitats extremos, contribuyendo al fitness de los genotipos dados en una población. Es claro que variaciones ambientales como la disponibilidad de agua en el suelo, nutrientes, luz y temperatura o la interacción entre ellos, podrían influenciar drásticamente la respuesta en la PF de estas especies y determinar diferencias relacionadas con su distribución ecológica.
AGRADECIMIENTOS
Al CENIVAM, a COLCIENCIAS CO432 CENIVAM, por su apoyo económico, a mi familia por su apoyo, a los Biólogos Iván Darío Camargo, Jhon Jairo Díaz Olarte por su colaboración en los análisis estadísticos, a los integrantes del GIEFIVET.
BIBLIOGRAFÍA
ALPERT P, SIMMS E. The relative advantages of plasticity and fixity in different environments: when is it good for a plant to adjust? Evol Ecol. 2002;16:285297.
[ Links ]ALBESIANO S, RANGEL C, CADENA A. La vegetación del cañón del río Chicamocha (Santander, Colombia). Caldasia. 2003;25:7399.
[ Links ]ALBUQUERQUE H. Enraizamento de estacas de ervacidreira quimiotipo III(citrallimoneno). Hort Brasileira. 2001;19 (2):245.
[ Links ]BAKREM A. New software for measuring leaf area, and area damaged by Tetranychus urticae Koch, J Appl Entomol. 2005;129:173175.
[ Links ]BELL D, SULTAN S. Dynamic phenotypic plasticity for root growth in Polygonum: A comparative study. Amer J Bot. 1999;86:807819.
[ Links ]CAMARGO I, RODRÍGUEZ N. Nuevas perspectivas para el estudio de la asignación de biomasa y su relación con el funcionamiento de plantas en ecosistemas neotropopicales. Acta biol Colom. 2006;11:7587.
[ Links ]CHAPIN S. Integrated responses of plants to stress. Bioscience. 1991;41:2936.
[ Links ]CHAPIN S, AUTUMN K, PUGNAIRE F. Evolution of suites of traits in response to environmental stress. Am Nat. 1993;42:7892.
[ Links ]COOK J, MARK A, SHORE B. Responses of Leptospermum scoparium and L. ericoides (Myrtaceae) to waterlogging. New Zealand J Bot. 1980;18:233246.
[ Links ]COLEMAN J McCONNAUGHAY K, ACKERLEY D. Interpreting phenotypic variation in plants. Trends Ecol Evol. 1994;9:187191.
[ Links ]DEWITT T, SCHEINER S. Plasticity. Functional and Conceptual Approaches. Oxford University Press; 2004.
[ Links ]DIGGLE P. Developmental morphologists perspective on plasticity. Evol Ecol. 2002;16:267283.
[ Links ]FUTUYMA D, MORENO G. The Evolution of Ecological Specialization. Ann Rev Ecol Syst. 1988;19:207233
[ Links ]FULLER T. The Integrative Biology of Phenotypic Plasticity. Biol Philos. 2003;18:381389.
[ Links ]GIANOLI E. Plasticidad fenotípica adaptativa en plantas. En: Cabrera, H. M. editor. Fisiología ecológica en plantas: mecanismos y respuestas a estrés en ecosistemas. Valparaíso, Chile. 2004;1325.
[ Links ]GONZÁLEZ A, GIANOLI E. Morphological plasticity in response to shading in three Convolvulus species of different ecological breadth. Acta Oecol. 2004; 26:185190.
[ Links ]GUAN B, GE Y, CHANG J. Phenotypic plasticity of Mosla chinensis and M. scabra (Labiatae) response to soil water status. Bot Bull Acad Sinica. 2004;45:229236.
[ Links ]GRIME J, MACKEY J. The role of plasticity in resource capture by plants. Evol Ecol. 2002;16:299307.
[ Links ]HUNT R, PARSONS I. Computer program for deriving growth funtions in plant growth analysis. J Appl Ecol. 1974;11:297304.
[ Links ]KROON H, VISSER E. W. Root Ecology (Eds.). Springer Verlag Berlin Heidelberg; 2003.
[ Links ]LARCHER W. Physiological plant ecology: ecophysiology and stress physiology of function groups (3rd edition). Springer Verlag. Berlin Heidelberg; 1995.
[ Links ]McCONNAUGHAY K, COLEMAN J. Biomass allocation in plants: ontogeny or optimality? A test along three resources gradients. Ecology. 1999;80:25812593.
[ Links ]NIINEMETS U, VALLADARES F. Photosynthetic acclimation to simultaneous and interacting environmental stresses along natural light gradients: optimality and constraints. Plant Biol. 2004;6:254268.
[ Links ]PEÑUELAS J, LLUSIÀ J. Seasonal emission of monoterpenes by the Mediterranean tree Quercus ilex in field conditions. Relations with photosynthetic rates, temperature and volatility. Physiol Plantarum. 1999a;105:641647.
[ Links ]PEÑUELAS J, LLUSIÀ J. Shortterm responses of terpene emission rates to experimental changes in Pinus halepensis and Quercus ilex in summer field conditions. Environ Exp Bot. 1999b;42:6168.
[ Links ]PIGLIUCCI M. Phenotypic Plasticity: Beyond Nature and Nurture. John Hopkins University Press, Baltimore; 2001.
[ Links ]PIGLIUCCI M. Evolution of phenotypic plasticity: where are we going now?. Trends Ecol Evol. 2005;20:481486.
[ Links ]POORTER H. Plant Growth and Carbon Economy. En: John Wiley & Sons, Ltd; 2002.
[ Links ]POORTER H, NAGEL O. The role of biomass allocation in the growth response of plants to different levels of light, CO2, nutrients and water: a quantitative review. Aust J Plant Physiol. 2002;27:595607.
[ Links ]REICH P. Root Shoot Relations: Optimality in Acclimation and Adaptation or the "Emperor's New Clothes"? En: Weisel Y, Eshel A, Kafkafi U, editors. Plant Roots, The Hidden Half. New York: Marcel Dekker, Inc; 2002.
[ Links ]SULTAN S. Promising directions in plant phenotypic plasticity. Perspectives in Plant. Ecology, Perspect. Plant Ecol Evol Syst. 2004;6:22723.
[ Links ]SULTAN S. Phenotypic plasticity for plant development, function, and lifehistory. Trends Plant Sci. 2000;5(12):537542.
[ Links ]SULTAN S, WILCZEK A, BELL D, HAND G. Physiological response to complex environments in annual Polygonum species of contrasting ecological breadth. Oecologia. 1998a;115:564578.
[ Links ]SULTAN S, WILCZEK M, HAHN D, BROSI B. Contrasting ecological breadth of cooccurring annual Polygonum species. J Ecol. 1998b;86:363373.
[ Links ]SULTAN S, BAZZAZ F. Phenotypic plasticity in Polygonum persicaria. I. Diversity and uniformity in genotypic norms of reaction to light. Evolution. 1993;47:10091031.
[ Links ]STASHENKO E, JARAMILLO B, MARTÍNEZ J. Comparación de la composición química y de la actividad antioxidante in vitro de los metabolitos secundarios de plantas de la familia Verbenaceae. Rev Acad Colomb Cienc. 2003;27:579597.
[ Links ]VALLADARES F. Ecología del bosque mediterráneo en un mundo cambiante. Ministerio de Medio Ambiente, EGRAF, S. A, Madrid; 2004.
[ Links ]VALLADARES F, SÁNCHEZ D, ZAVALA M. Quantitative estimation of phenotypic plasticity: bridging the gap between the evolutionary concept and its ecological applications. J Ecol. 2006; 94(6):11031116.
[ Links ]WRIGHT S, McCONNAUGHAY. Interpreting phenotypic plasticity: the importance of ontogeny. Plant Species Biol. 2002;17:119131.
[ Links ]WOODSON R, SCHERY, MOLDENKE H. Flora of Panama. Part IX. Family 168. Verbenaceae. Ann Mo Bot Gard. 1973;60(1):41148.
[ Links ]













