Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.14 no.1 Bogotá Jan./Apr. 2009
LARVAS DE DIGENEA EN Melanoides tuberculata (GASTROPODA: THIARIDAE) EN MEDELLÍN, COLOMBIA
Larval stages of digenea from Melanoides tuberculata (Gastropoda: Thiaridae) in Medellín, Colombia
DANIELA VERGARA1, Microbióloga, Estudiante Ph. D.; LUZ ELENA VELÁSQUEZ1,2, Bióloga M.Sc.
1 Programa de Estudio y Control de Enfermedades Tropicales PECET. Sede de Investigación Universitaria SIU Universidad de Antioquia. Calle 62 No. 52-69.
2 Escuela de Microbiología/UdeA Correspondencia: Luz Elena Velásquez. luzelena333@yahoo.com Sede de Investigación Universitaria SIU Universidad de Antioquia. Calle 62 No. 52-69, Torre 2, laboratorio 730. Teléfono: 219 65 14. Fax 219 65 11. Medellín, Colombia.
Presentado 14 de agosto de 2008, aceptado 20 de octubre de 2008, correcciones 10 de diciembre de 2008.
RESUMEN
Se describen las larvas de digeneos que se obtuvieron en Melanoides tuberculata (Gastropoda: Thiaridae), molusco dulceacuícola del que se colectaron 125 especímenes en el lago del Jardín Botánico Joaquín Antonio Uribe de Medellín. En el laboratorio se individualizaron y se estimuló la emisión cercariana con una fuente luminosa. El 9,6 % de los caracoles emitió cercarias. Los moluscos emisores se sacrificaron para obtener los demás estadios larvarios. Las larvas se montaron al microscopio, se midieron y luego se dibujaron. Los caracteres morfológicos permitieron establecer la presencia de Centrocestus formosanus (Heterophyidae) y de dos Philophthalmidae. Uno de estos es primer registro para Colombia. Se confirma la sensibilidad de M. tuberculata a infecciones por digeneos, así como la especificidad de los filoftálmidos por moluscos hospedadores de la superfamilia Cerithioidea.
Palabras clave: cercarias, digenea, Melanoides tuberculata, Philophthalmidae, Redias.
ABSTRACT
The larvae of two trematodes found in the freshwater mollusk Melanoides tuberculata (Gastropoda: Thiaridae) are described. 125 snails from the Medellin’s Botanical Garden Joaquín Antonio Uribe were collected. In the laboratory, each individual was placed alone and stimulated with light in order to have cercaria emission. 9.6% of the snails released cercariae. These were separated in three morphologies. From each one, 15 individuals were measured and drawn. Photographs were taken. Based on their morphological characteritics the presence of Centrocestus formosanus (Heterophyidae) was determined. The other two morphologies were classified in the family Philophthalmidae. One of them constitutes the first register for Colombia. The sensibility of M. tuberculata to infections by digeneans, and the specificity of the family Philophthalmidae to mollusk hosts of the superfamily Cerithioidea are confirmed.
Key words: Cercariae, Digenea, Melanoides tuberculata, Philophthalmidae, Rediae.
INTRODUCCIÓN
Los tremátodos digéneos son endoparásitos que en su ciclo de vida presentan al menos dos hospedadores: uno intermediario, en la gran mayoría de los casos molusco; y uno definitivo, que siempre será un vertebrado (Schmidt y Robert, 2000). A nivel mundial algunas especies de digeneos son responsables de pérdidas económicas, significativas en diferentes sectores productivos. Por lo tanto se buscan estrategias para su prevención y control. Entre estas se ha implementado la reducción de las poblaciones de moluscos, al demostrase la especificidad de los digeneos por el caracol hospedador (Sapp y Loker, 2000).
Entre los estadíos intramolusco de los digeneos, la cercaria por lo general abandona el caracol para transformarse en la forma infectiva para el hospedero definitivo (Schell, 1970). Por ello numerosas cercarias han sido descritas e ilustradas, en especial las de interés epidemiológico. De otro lado, la riqueza de cercarias en los ecosistemas acuáticos se viene proponiendo como indicadora de calidad ambiental, bajo el supuesto de que a mayor número de ciclos de vida de tremátodos en un ambiente determinado, menor perturbación del ecosistema (Faltýnková y Haas 2006).
Respecto a los caracoles, exigen atención especial las especies que en forma simultánea son invasoras y hospedadoras de tremátodos, como Melanoides tuberculata (Orthogastropoda: Thiaridae), molusco distribuido en regiones tropicales y subtropicales del mundo (Murray, 1964; Lo y Lee, 1996; Facon et al., 2003; Pointier et al., 2003); y señalado como hospedador de digeneos de importancia ecológica y epidemiológica (Gold y Lengy, 1974; Vaz et al., 1986; Lo y Lee 1996; Radev et al., 1999; Dimitrov et al., 2000; Radev et al., 2000). é
En Colombia, Areiza et al., 2000, registran poblaciones de M. tuberculata hospedadoras de digéneos en Cali y en el lago del Jardín Botánico Joaquín Antonio Uribe de Medellín-JBJAU. Posteriormente Velásquez et al., 2006, demuestran en este lago la presencia de Centrocestus formosanus (Digenea: Heterophyidae) en dichos moluscos. Una evaluación más reciente en M. tuberculata del mismo ecosistema, señala la presencia de nuevas cercarias, lo que motiva la realización del presente estudio, con el objetivo de describirlas.
METODOLOGÍA
Entre julio de 2005 y febrero de 2006 se recolectaron 125 individuos de M. tuberculata en el JBJAU, de la ciudad de Medellín, ubicado a 6°16’ 15” N y 75°33’46” O, sobre 1.486 msnm, con temperatura promedio de 22 ºC (Velásquez et al., 2006). Los animales se instalaron en el laboratorio en acuarios con agua declorinada y ai-reada, a 24-26 °C, con un fotoperíodo 12:12. Se alimentaron con lechuga fresca. Tres días Entre julio de 2005 y febrero de 2006 se recolectaron 125 individuos de M. tuberculata en el JBJAU, de la ciudad de Medellín, ubicado a 6°16’ 15” N y 75°33’46” O, sobre 1.486 msnm, con temperatura promedio de 22 ºC (Velásquez et al., 2006). Los animales se instalaron en el laboratorio en acuarios con agua declorinada y ai-reada, a 24-26 °C, con un fotoperíodo 12:12. Se alimentaron con lechuga fresca. Tres días después, se individualizaron en recipientes con agua declorinada y se pusieron bajo una fuente luminosa para estimular la emisión cercariana durante 16 horas. Cada molusco se observó al estéreomicroscopio cada cuatro horas; los emisores se aislaron en acuarios según la morfología de las cercarias. El procedimiento de estimulación se realizó cada mes durante cinco ocasiones. Los moluscos no emisores se regresaron al lugar de procedencia.
Para la obtención de los estadios larvarios de los parásitos, los moluscos emisores se relajaron en Nembutal al 0,05%. Luego de cuatro horas se sacrificaron por inmersión en agua a 2 °C, por cinco minutos, a continuación se rompió la concha con un martillo pequeño para liberar la parte blanda de los caracoles y localizar las formas intramolusco de los digéneos (método estandarizado en el Laboratorio de Malacología Médica del PECET). Las formas larvarias se extrajeron y se observaron in vivo al microscopio, donde se estimaron algunas dimensiones, de las que se presentan el rango y la media, en micrómetros. Se dibujaron bajo una cámara lúcida y se realizaron registros fotográficos. Las descripciones de redias y cercarias se hicieron con base en 15 individuos; se determinaron según la clave de Schell, 1970.
RESULTADOS
De los moluscos evaluados, 9,6 % emitieron cercarias, entre las que se estableció la presencia de tres formas diferentes, aunque con una tasa de infección similar (Tabla 1). Una de ellas corresponde a C. formosanus, ya descrita (Velásquez et al., 2006), por lo tanto a continuación se describen las dos restantes y sus redias respectivas. Todos los estadios larvarios se localizaron en el hepatopáncreas de los caracoles. Cabe señalar que no se observaron metacercarias enquistadas dentro de los moluscos ni sobre sus conchas.
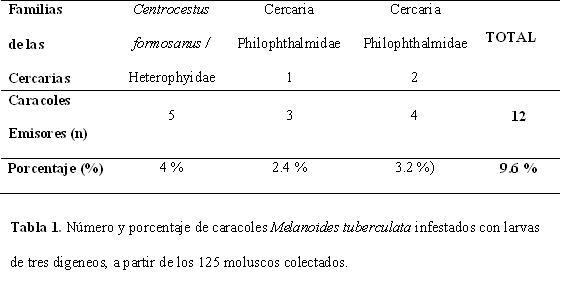
DESCRIPCIÓN DE REDIA SP. 1 En forma de saco simple. Mide 1.205-2.610 (1.810) de largo por 241-421 (327) de ancho. En su interior se observan entre 60 y 80 cercarias en formación (Fig. 1).
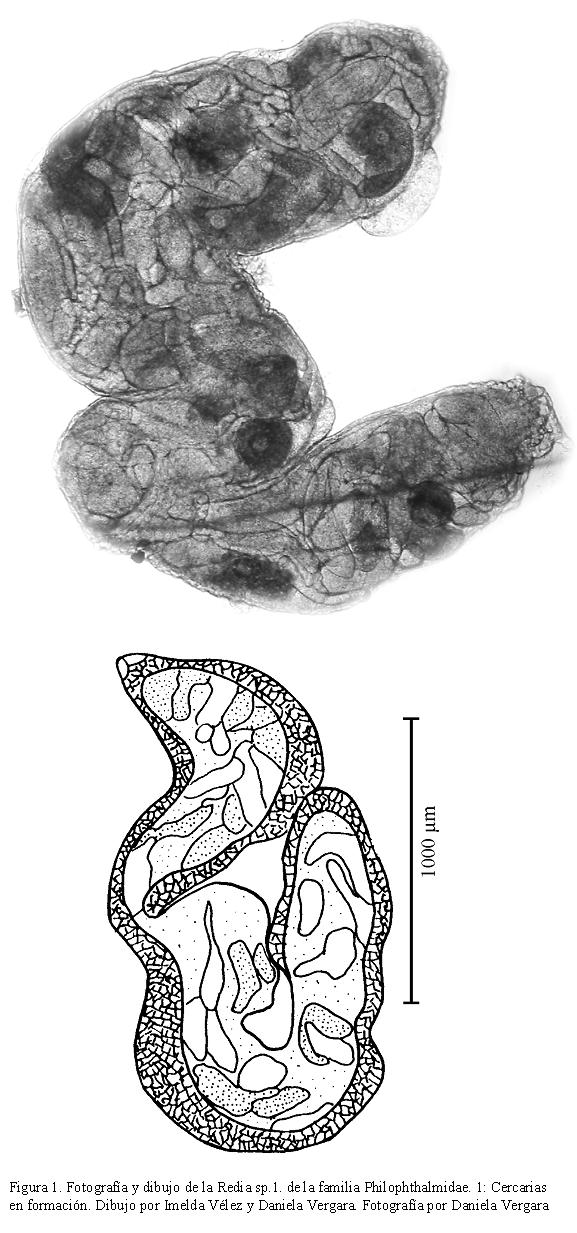
DESCRIPCIÓN DE CERCARIA SP. 1
Cuerpo rugoso cubierto de espinas, región anterior más ancha que la posterior, mide 235-408 (301) de largo por 110-157 (138) de ancho. Ventosa oral mide 24-55 (37) de largo por 24-47 (36) de ancho. Faringe muscular, esófago corto de donde se bifurcan dos ciegos intestinales que rodean el acetábulo y terminan en la parte posterior del cuerpo. Acetábulo prominente y ecuatorial, mide 24-47 (35) de largo, por 24-39 (35) de ancho. Distancia entre las ventosas 78-156 (115). Color marrón con gránulos. Sistema excretor tipo mesostomata (Schell, 1970). Cola un poco más corta que el cuerpo, con punta en forma de cono, rugosa, mide 173-243 (200) de largo por 31-47 (40) de ancho (Fig. 2). Esta cercaria es muy activa, presenta movimientos de elongación y contracción, con fase de reposo corta, donde tanto la cola como el cuerpo permanecen en forma de media luna.
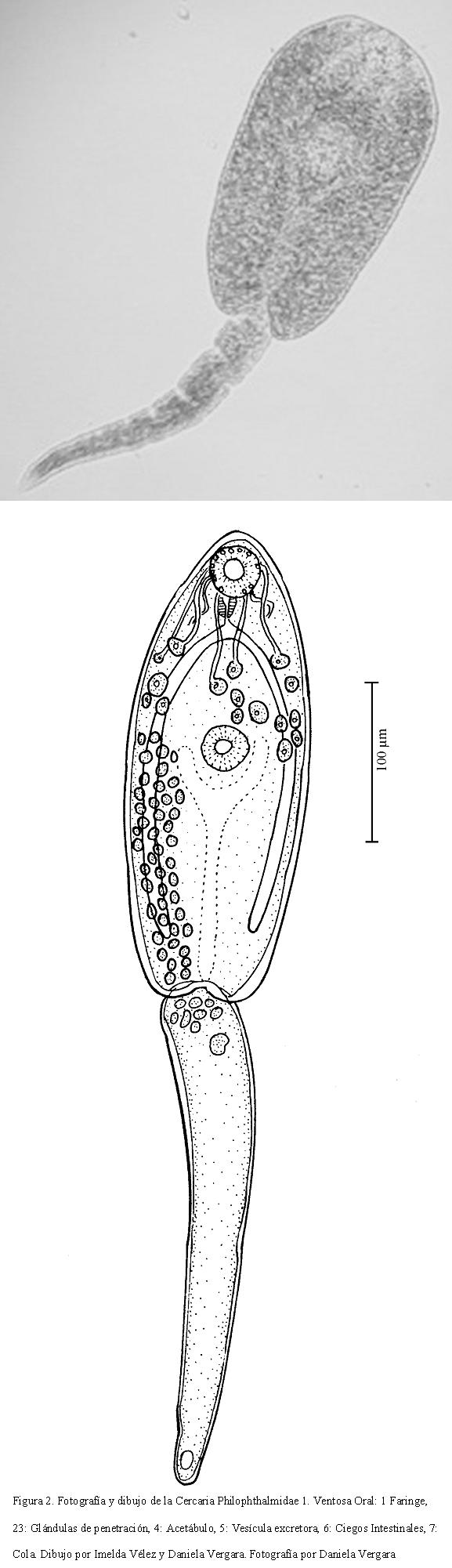
DESCRIPCIÓN DE REDIA SP. 2
Cuerpo alongando con dos a tres proyecciones pequeñas en la parte posterior (prucusculi); mide 1.165-1.446 (1.279) de largo por 181-241 (207) de ancho. Faringe de 58-70 (62) de largo por 58 -70 (65) de ancho. Contiene entre 15 y 20 cercarias. No se observó poro de nacimiento (Fig. 3).
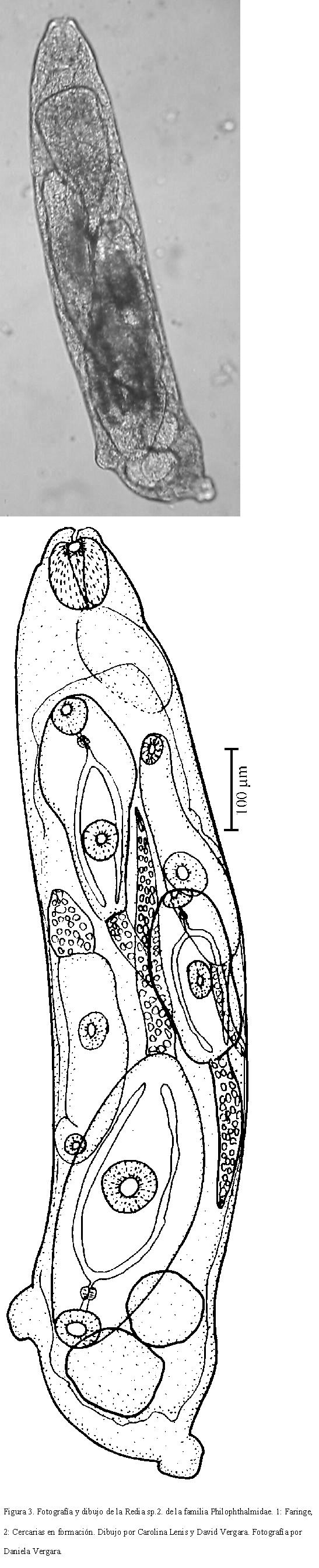
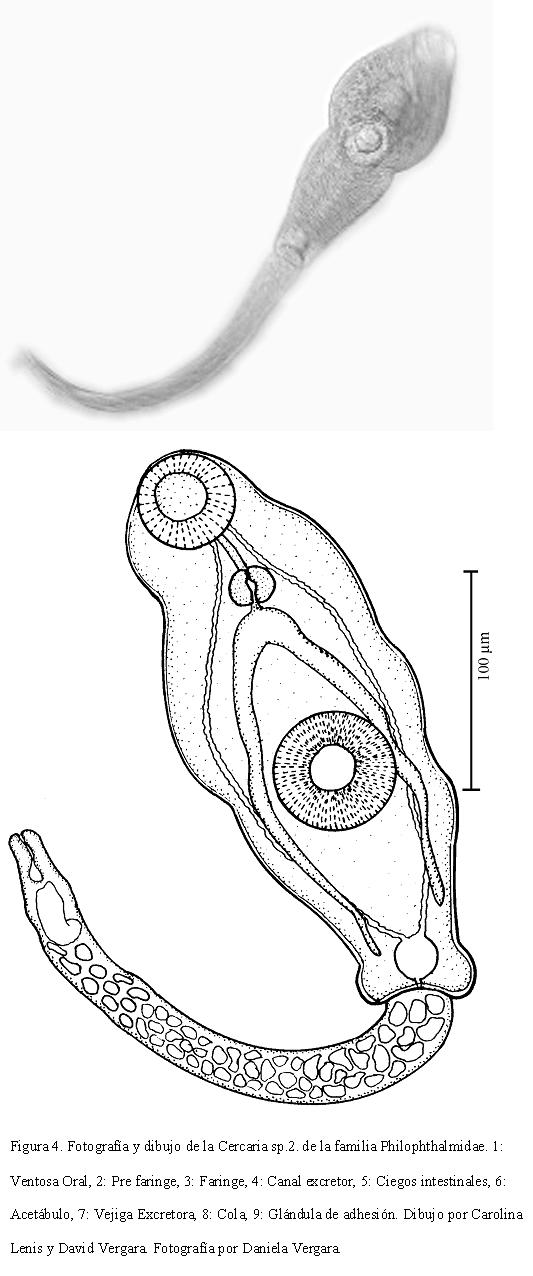
DESCRIPCIÓN DE LA CERCARIA SP. 2
Cuerpo de 275-533 (346) de largo por 149-282 (180) de ancho. Ventosa oral mide 39-78 (54) de largo por 31-86 (51) de ancho. Prefaringe larga, faringe de 31-47 (35) de largo por 24-39 (31) de ancho, de donde se bifurcan los ciegos intestinales.
Acetábulo ecuatorial, mide 47-94 (69) de ancho por 47- 94 (53) de largo. Distancia entre ventosas de 71-227 (101). Vesícula excretora ovalada en el extremo posterior del cuerpo. Cola casi tan larga como el cuerpo, mide 227-329 (257) de largo por 55-78 (70) de ancho. Presenta una glándula de adhesión en la punta. Bastante activa, se impulsa en el agua con movimientos de elongación y contracción. Forman grupos en la superficie del agua, unidas por las puntas de las colas, por medio de las glándulas de adhesión. En cuanto se les perturba, cada cercaria se recubre con una pared gruesa y adquiere forma ovalada y (Fig. 4).
DISCUSIÓN
Durante esta investigación se destaca la susceptibilidad del molusco invasor M. tuberculata, a la infección por digeneos, como lo evidencian la taza de infección (9,6%) y la diversidad de cercarias encontradas. Estos resultados demuestran además, la variedad de nichos en el lago del JBJAU, que a pesar de encontrarse en un sector urbano, conserva una muestra significativa de biodiversidad vegetal y animal, incluyendo parásitos y especies tanto nativas, como exóticas.
Entre los digeneos encontrados C. formosanus presenta la mayor prevalencia: 4%, sin embargo este registro es ostensiblemente más bajo que el 70%, reseñado por Velásquez et al., 2006, en la misma localidad. Las causas de semejante diferencia no se han establecido, pero es posible que obedezcan a los períodos de lluvia y de sequía que se presentan durante diferentes épocas del año y al proceso acelerado de eutroficación que el lago está sufriendo y que es motivo de preocupación para la administración del JBJAU. En lo que respecta a las otras dos cercarias encontradas, su morfología permite asignarlas a la familia Philophthalmidae Looss 1899, compuesta por cinco subfamilias, de las cuales cuatro parasitan aves y una parasita reptiles (Kanev et al., 2005). Sin embargo hay algunos registros de estos digéneos en los ojos de mamíferos neotropicales, como el capibara, Hydrochoerus hydrochaeris (Pinto et al., 2005) e incluso en las personas (Kanev et al., 2005).
Las características morfológicas de la Cercaria Philophthalmidae 1 son similares a las descritas por Gold y Lengy, 1974, para la Cercaria Levantina 12, también encontrada en M. tuberculata en Israel. Coinciden tanto en el tamaño como la forma, coloración y los movimientos de contracción. En cuanto a la cercaria Philophthalmidae 2, la morfología y el comportamiento concuerdan con los descritos por Díaz et al., 2002, para Philophthalmus gralli, hallada en M. tuberculata en Venezuela. Este digeneo parasita la membrana nictitante de aves. La cercaria Philophthalmidae 2 también presenta una gran semejanza con la descrita por Urabe, 2005, en el molusco Semisulcospira libertina, en Japón. Tanto en su caso como en el nuestro es imposible establecer la especie de digeneo por no disponer de las formas adultas. Con base en los parásitos adultos, Travassos et al., 1969, registra en Brasil cuatro especies de Phylophthalmidae, en seis especies de aves que también se encuentran en Colombia. Esto induce a proponer como posibles hospedadores definitivos de los filoftálmidos del JBJAU, algunas de las 122 especies de aves que se han registrando en él, de las cuales 47 son migratorias (Sociedad Antioqueña de Ornitología-SAO, com. pers.). Esta investigación confirma la afinidad de los Philophthalmidae con moluscos de la superfamilia Cerithioidea, como S. libertina en Japón, Melanopsis praemorsa en Israel (Radev et al., 1999, Dimitrov et al., 2000; Urabe, 2005) y M. tuberculata en Israel, Venezuela y Colombia (Gold y Lengy, 1974; Díaz et al., 2002). Finalmente se recomienda hacer monitoreos de cercarias en el lago del JBJAU, como estrategia para aproximarse al conocimiento sobre la dinámica de las poblaciones de digeneos y su posible impacto sobre la fauna del lugar. Así mismo se propone establecer el ciclo de vida de estos parásitos para su determinación taxonómica y para la identificación de otros hospedadores. De otro lado, cabe anotar que ante la falta de formas adultas de los parásitos, se puede recurrir a los mapas quetotáxicos en las cercarías, como lo sugieren Dimitrov et al., 2000 y al uso de marcadores moleculares que día a día se hace más certero.
AGRADECIMIENTOS
Agradecemos a la Trematóloga Imelda Vélez Escovar PhD, por su acompañamiento en la descripción de los digeneos. Al Dr. Iván Darío Vélez Bernal, director del PECET, por su apoyo permanente a las investigaciones en Tremátodos y sus hospedadores; a las directivas del Jardín Botánico Joaquín Antonio Uribe de Medellín, por facilitar el acceso al lugar. A Carolina Lenis y David Vergara por las ilustraciones. Al grupo de Malacología Médica y Tremátodos del PECET por cofinanciar el proyecto.
BIBLIOGRAFÍA
AREIZA A, VÉLEZ I, VELÁSQUEZ LE. Melanoides tuberculata (Müller 1774), in Colombia, an epidemiological risk?. XVth International Congress for Tropical Medicine and Malaria, Cartagena, Colombia, Noviembre de 2000. Tropical Health in the New Millenium. 2000;2:94.
[ Links ]DÍAZ MT, HERNÁNDEZ LE, BASHIRULLAH-ABUL K. Experimental life cycle of Philophthalmus gralli (Trematoda: Philophthalmidae) in Venezuela. Rev Biol Trop. 2002;50:629-641.
[ Links ]DIMITROV V, KANEV I, PANAIOTOVA M, RADEV V, GOLD D. Argentophilic structures of miracidia and cercariae of Philophtalmus lucipetus (Philophtalmidae: Trematoda) from Israel. J Parasitol. 2000;86:255-261.
[ Links ]FACON B, PONTIER JP, GLAUBRECHT M, PUX C, JARNE SP, DAVID P. A molecular phylogeography approach to biological invasions of the New World by parthenogenetic Thirarid snails. Mol Ecol. 2003;12:3027-3039.
[ Links ]FALTÝNKOVÁ A, HAAS W. Larval trematodes in freshwater molluscs from the Elbe to Danube (Southeast Germany): before and today. Parasitol Res. 2006;99: 572-582.
[ Links ]GOLD D, LENGY J. Studies on larval stages of digenic trematodes in aquatic molluscs of Israel. 4. on five cercariae from the freshwater snail Melanoides tuberculata (Müller, 1774). Isr J Zool. 1974;23:143-161
[ Links ]KANEV I, RADEV V, FRIED B. Family Philophthalmidae Looss, 1899. En: Jones, A., Bray, R. A., Gibson, D.I. (eds.). Keys to the Trematoda Vol 2. CABI Publishing and The Natural History Museum, Londres, Inglaterra; 2005;87-97.
[ Links ]LO CT, LEE KM. Pattern of Emergence and the effects of temperature and Light on the emergence and survival of Heterophyid cercariae (Centrocestus formosanus and Haplorchis plumilio) J Parasitol. 1996;82:347-350
[ Links ]MURRAY HD. Tarebia granifera and Melanoides tuberculata in Texas. Annual Report to the American Malacological Union. 1964;53:15-16.
[ Links ]PINTO RM, CORREIA L, DOS SANTOS RT, MENEZES C R, DE MORAES W, JUVENAL JC, GOMES DC. Pathology and first report of natural infections of the eye trematode Philophthalmus lachrymosus Braun, 1902 (Digenea, Philophthalmidae) in a non-human mammalian host. Mem Inst Oswaldo Cruz. 2005;100:679-683
[ Links ]PONTIER JP, FACON B, JARNE P, DAVID P. Les Thiaridés, des Gastéropodes Envahisseurs Des Eaux Douces Tropicales. Xenophora. 2003;104:14-20
[ Links ]RADEV V, KANEV I, GOLD D. Life cycle and identification of an eyefluke form Israel transmitted by Melanoides tuberculata (Müller, 1774). J Parasitol. 2000;86:773-776.
[ Links ]RADEV V, KANEV I, NOLLEN PM, GOLD D. Life History and Identification of Hilphthalmus lucipetus from Israel. J Parasitol. 1999;85:291-294
[ Links ]SAPP KK, LOKER S. Mechanisms Underlying Digenean-Snail Specificity: Role of Miracidial Attachment and Host Plasma Factors. J Parasitol. 2000;86:1012-1019.
[ Links ]SCHELL SC. The Trematodes. Dubuque, WM. C. Brown Company Publishers. 1970.
[ Links ]SCHMIDT G, ROBERT L. Foundations of Parasitology. Sixth Edition. McGraw-Hill. Comp. 2000.
[ Links ]TRAVASSOS L, TEXEIRA DE FRETTAS J F, KOHN A. Trematódeos do Brasil. Mem Inst Oswaldo Cruz. 1969;525-530.ƒ
[ Links ]URABE M. Cercariae of a species of Philophthalmus detected in a freshwater snail Semisulcospira libertina, in Japan. Parasitol Int. 2005;54:55-57
[ Links ]VAZ JF, TELLES MS, CORRÊA MA, LEITE SP. S. Ocorrência no Brasil de Thiara (Melanoides) tuberculata (O. F. Muller, 1774) (Gastropoda: Prosobranchia), primeiro hospedeiro intermediário de Clonorchis sinensis (Cobbold, 1875) (Trematoda: Platyhelminthes). Rev Saude Publica. 1986;20:318-322.
[ Links ]VELÁSQUEZ LE, BEDOYA JC, AREIZA A, VÉLEZ I. Primer registro de Centrocestus formosanus (Digenea: Heterophyidae) en Colombia. Rev Mex Biodivers. 2006;77:119-121
[ Links ]VELASQUÉZ OL. Cercarias de Digeneos en caracoles dulceacuícolas de la reserva Natural Laguna de Sonso (Valle del Cauca) [Tesis]. 2004;1-2.
[ Links ]













