Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.14 no.1 Bogotá Jan./Apr. 2009
REGENERACION Y SENSIBILIDAD A MANOSA EN ENTRENUDOS DE PAPA (Solanum tuberosum spp. andígena Var Diacol Capiro).
REGENERATION AND MANNOSE SENSIBILITY IN POTATO INTERNODAL EXPLANTS (Solanum tuberosum spp. andígena Var Diacol Capiro)
MARY LUZ YAYA-LANCHEROS1, M.Sc.; ALEJANDRO CHAPARRO- GIRALDO1,2, Ph. D.
1 Grupo de Ingeniería Genética de Plantas, Departamento de Biología, Universidad Nacional de Colombia. Bogotá Colombia.
2 Instituto de Genética. Universidad Nacional de Colombia, Sede Bogotá. Bogotá, Colombia. mlyayal@unal.edu.co; achaparrog@bt.unal.edu.co
Presentado 12 de bril de 2008, aceptado 20 de octubre de 2008, correcciones 21 de enero de 2009.
RESUMEN
Se estableció un sistema de organogénesis indirecta para la obtención de brotes múltiples a partir de segmentos internodales de la variedad Diacol Capiro. La ubicación de explantes en medio Murashige y Skoog (MS) suplementado con 2 mg/l de zeatina ribosido (ZR), 0,02 mg/l de ácido naftalenácetico (ANA) y 0,02 mg/l de ácido giberélico (AG3), permite la obtención de plántulas entre la séptima y novena semana con una efectividad del 80-100%. Mediante ubicación de explantes previamente cocultivados con la cepa LBA4404 de Agrobacterium tumefaciens que contiene el plásmido recombinante pNOV022, se verificó la utilidad del medio para procesos de transformación, obteniéndose tasas hasta del 100% de regeneración. Finalmente, con el objetivo de determinar el uso potencial de la manosa como agente selectivo en procesos de transformación, se evaluó el efecto de diferentes concentraciones de manosa sobre la viabilidad y capacidad regenerativa de explantes.
Palabras clave: organogénesis indirecta, selección positiva, plantas transgénicas, Agrobacterium tumefaciens.
ABSTRACT
A system of indirect organogenesis for the multiple buds production from internode stem sections in Diacol Capiro variety was established. Explants on Murashige & Skoog (MS) medium with zeatine riboside (ZR) 2 mg/l, naftalenacetic acid (NAA) 0.02 mg/l and giberelic acid (GA3) 0.02 mg/l, produced plants ranging between 7 to 9 weeks with 80-100% effectiveness. In the same medium, explants infected with Agrobacterium LBA4404 strain which carries recombinant plasmid pNOV022, produced regeneration rates reached 100%, thus, the medium utility for trnsformation processes was verified. Finally, to determine the potential use of the mannose as selective agent in transformation processes, the effect of different mannose concentrations on explant viability and regenerative capacity was evaluated.
Key words: Indirect organogenesis, positive selection, transgenic plants, Agrobacterium tumefaciens.
INTRODUCCIÓN
Según la Organización de las Naciones Unidas para la Alimentación y la Agricultura FAO, la papa representa el cuarto alimento básico a nivel mundial después del trigo, el arroz y el maíz; razón por la que declaró el 2008 como año internacional de la papa (FAO, 2006). En Colombia es el producto agrícola de mayor consumo per cápita y el cuarto en productividad, siendo la variedad Diacol Capiro la de mayor importancia para el campo industrial y de exportación (Martinez et al., 2003). Aunque actual-mente las exportaciones colombianas de papa no son representativas en el mercado internacional, los nuevos retos a los que se enfrentan los agricultores colombianos en el contexto global y la alta demanda interna del producto, hacen de las variedades colombianas cultivares claves de investigación en el área del mejoramiento mediante técnicas de ingeniería genética, más aun teniendo en cuenta la necesidad de obtener variedades resistentes a distintos patógenos cuyo control es difícil mediante métodos convencionales, y que actualmente causan graves pérdidas económicas y riesgos ambientales y de salubridad por la sobreaplicación de agroquímicos que hace la mayoría de agricultores para su control (Martínez et al., 2003).
La investigación en procesos de transformación para papa de la subespecie andígena es escasa y aun más para cultivares colombianos. La Universidad Nacional de Colombia sede Bogotá y la Corporación de las Investigaciones Biológicas en convenio con la Universidad Nacional Sede Medellín, actualmente adelantan trabajos tendientes a la obtención de cultivares transformados. Este último grupo ha reportado la obtención de plantas de distintas variedades entre ellas la Diacol Capiro transformadas con el gen Gus (Trujillo et al., 2001). Dentro del proceso para la obtención de plantas transgénicas, la etapa de selección juega un papel fundamental, puesto que permite identificar durante la fase de regeneración el material potencialmente transformado (Brasileiro y Aragão, 2001). La eficiencia del proceso selectivo depende en gran medida de la capacidad del medio de cultivo para estimular el crecimiento y desarrollo de las células transformadas, por lo que un paso previo a la transformación es la optimización del medio según el genotipo y clase de explante (Carputo et al., 1995; Dale y Hampson, 1995; Lin y Zhang, 2005).
Los sistemas selectivos generalmente utilizados, confieren resistencia en las células transformadas a sustancias tóxicas como antibióticos o herbicidas. La utilización de este tipo de sistemas, denominados de selección “negativa” (puesto que solo sobreviven las células transformadas), ha sido ampliamente debatida, principalmente por aspectos de bioseguridad relacionados con la posibilidad de transferencia del gen marcador a otros organismos. Adicionalmente, se han planteado posibles efectos inhibitorios sobre el desarrollo de las células transformadas, debido principalmente a la producción de tejido necrótico resultante del proceso selectivo (Jaiwal et al., 2002; Penna et al., 2002). Como respuesta a estas inquietudes, se han venido desarrollando los llamados sistemas de selección “positiva”; que se basan en la capacidad de las células transformadas de metabolizar un compuesto (un fitoregulador o carbohidrato) que es utilizado para estimular su crecimiento y desarrollo. El sistema de selección positiva pmi/manosa desarrollado y licenciado por la compañía Syngenta, identifica plantas transformadas por su capacidad de utilizar manosa como fuente de carbono, gracias a la expresión en las células transformadas de la enzima fosfomanosa isomerasa (PMI). El sistema ha demostrado alta efectividad en especies como remolacha, maíz, arroz y trigo entre otros, generando frecuencias de transformación mayores con respecto a métodos de selección convencionales (Joersbo et al., 1998; Wright et al., 2001; Gadaleta et al., 2006) lo que constituye otra ventaja para su implementación. Su versatilidad y bajo costo en relación con otros sistemas de selección hacen de este una alternativa importante a los sistemas convencionales (Todd y Tague, 2001).
En el presente documento se reporta la optimización de un medio de regeneración para segmentos internodales de la variedad Diacol Capiro, sometidos a procesos de cocultivo con Agrobacterium tumefaciens. Adicionalmente como parte del establecimiento del sistema de selección pmi/manosa que actualmente se encuentra en desarrollo, y con el objetivo de corroborar la utilidad de la manosa como agente selectivo, se describen los efectos de diferentes concentraciones de manosa sobre la regeneración de segmentos internodales.
METODOLOGÍA
MICROPROPAGACIÓN
La propagación del material se realizó mediante multiplicación de segmentos nodales en medio con sales MS, suplementado con tiamina (0,1 mg/l), ácido D-pantoténico (2 mg/l), inositol (100 mg/l) y sacarosa (20 g/l; Trujillo et al., 2001). Se adicionó además AG3 (0,2 mg/l) con el fin de estimular la elongación de los tallos. En las primeras etapas de la investigación, el medio de micropropagación se gelificó con agar (6 g/l) pero posteriormente se utilizó fitagel (2,5 g/l), este cambio mejoró notoriamente la calidad de las plántulas micropropagadas, por lo cual se siguió utilizando en los procesos de micropropagación. Los explantes micropropagados se ubicaron en un cuarto de crecimiento con temperatura de 20 ± 3 ºC y fotoperíodo de 12 horas.
EVALUACIÓN DEL MEDIO DE REGENERACIÓN
Se aislaron segmentos internodales de 0,5-0,8 cm (excluyendo el nudo) a partir de plántulas micropropagadas de cuatro a cinco semanas de edad, los explantes se ubicaron en cajas de petri con el medio de regeneración sugerido por M. Ghislain (Centro Internacional de la Papa, comunicación personal, 2003): 4.4 g/l de sales MS, 0,1 mg/l de tiamina, 0,5 mg/l de ácido nicotínico, 0,5 mg/l de piridoxina, 100 mg/l de inositol, 2 mg/l de ZR, 0,02 mg/l de ácido giberélico AG3, 0,02 mg/l de ANA, 20 g/l de sacarosa y 6 g/l de agar. Las cajas se ubicaron en un cuarto de crecimiento con temperatura de 20±3° y fotoperíodo de 12 horas. El cambio de medio se realizó cada tres semanas. La evaluación del comportamiento callogénico y regenerativo se realizó durante nueve semanas.
Transformación con Agrobacterium tumefaciens. Con el fin de determinar sí el medio de regeneración es adecuado para los procesos de transformación, se ubicaron en él explantes cocultivados con la cepa LBA4404 de A. tumefaciens que contiene el vector pNOV022 (Santos-Rodríguez, 2003), desarrollado por Syngenta y caracterizado por tener dentro de su región T-DNA el gen marcador de selección pmi (Fig. 1).
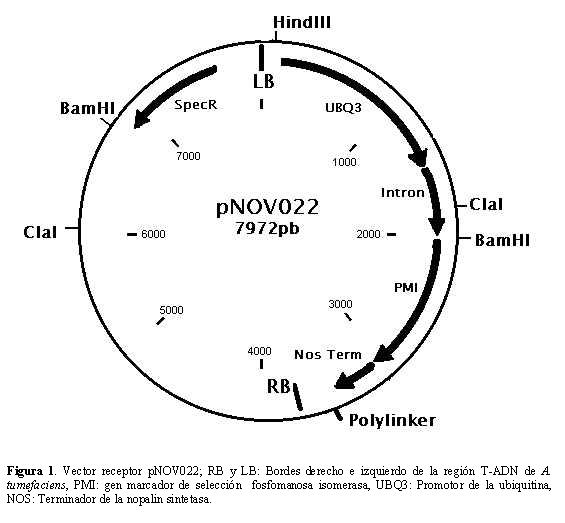
Los ensayos de cocultivo se realizaron tomando como base el protocolo sugerido por M. Ghislain (comunicación personal). Previamente, la bacteria se cultivó en medio Luria-Bertani con 25 mg/l de espectinomicina y estreptomicina durante 20 horas a 28 ºC con agitación constante (150 rpm; Santos-Rodríguez, 2003), la suspensión bacteriana se diluyó en medio MS en proporciones 1/10 y 1/50 y se adicionaron 20 mg/l de acetosiringona; los explantes se ubicaron y agitaron en las suspensiones por 30 minutos tras lo cual se secaron en papel absorbente, se trasladaron a medio MS sólido y se dejaron en oscuridad por 48 horas a 20±3 °C, posteriormente se ubicaron en el medio de regeneración con 250 mg/l de cefatoxina. El cambio de medio se realizó cada tres semanas.
SENSIBILIDAD A MANOSA
Con el fin de determinar una potencial concentración de manosa para la selección de plantas transgénicas, se evaluó la respuesta de viabilidad callogénica y regenerativa (porcentaje de explantes con buen aspecto general que potencialmente podrían originar callo o regenerantes) de segmentos internodales ubicados en medio de regeneración suplementado con diferentes combinaciones de manosa-sacarosa (Tabla 1), establecidas de manera similar a los experimentos descritos por Negrotto y colaboradores (2000), y tomando en cuenta la equivalencia osmótica entre manosa y sacarosa (1 g de manosa equivale a dos de sacarosa: Wright et al., 2001; Kennedy et al., 2004) completando la carga total de carbohidratos a 20 g/l. Solo en un experimento se completó la carga a 25 g/l. Cada tratamiento se replicó cinco veces con 20 explantes por cada réplica, en un diseño completamente aleatorizado. Las diferencias estadísticas se detectaron mediante la prueba W de Mann Whitney, utilizando un nivel de confiabilidad del 90%.
RESULTADOS Y DISCUSIÓN
SISTEMA DE REGENERACIÓN
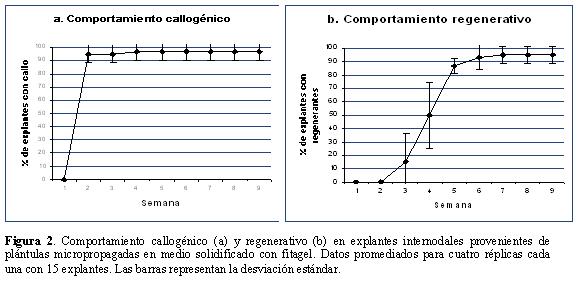
Los procesos de callogénesis y regeneración se optimizaron al utilizar como material fuente de explantes plántulas micropropagadas en medio con fitagel, en el que se observó un desarrollo más rápido y vigoroso de los segmentos nodales con respecto a los segmentos micropropagados en medio con agar. De manera similar, la formación de callos y regenerantes se presentó más tempranamente. Los primeros indicios de proliferación celular se observaron en los extremos de los explantes a lo largo de la primera semana, y el callo fue evidente hacia el final de la segunda (promedio 96%; Fig. 2a), la regeneración comenzó a evidenciarse hacia la tercera semana (15% de los explantes presentaban regenerantes) y se incrementó progresivamente alcanzando un máximo del 95% al final de la séptima semana (Fig. 2b); al utilizar segmentos de plantas micropropagadas en agar, la callogénesis y regeneración fueron evidentes hacia la tercera y quinta semana respectivamente y solo un 47,5% de los explantes produjeron regenerantes después de nueve semanas de observación (datos no mostrados); además el porcentaje de explantes afectados por oxidación fue del 42%, mientras que en el caso de los explantes provenientes de plantas micropropagadas en medio con fitagel, el porcentaje se redujo a menos del 1% y no representó un problema para el proceso regenerativo. Los resultados fueron reproducibles en otros dos ensayos independientes donde se registraron porcentajes de regeneración del 86% (± 10) y del 90% (± 1,73). Por cada explante se produjeron en promedio 15 regenerantes con un rango de variación entre siete y 20.
EXPLANTES COCULTIVADOS
En el caso de los explantes sometidos a cocultivo con la suspensión bacteriana en proporción 1:10, se presentó un fuerte efecto de clorosis sobre todos los segmentos. Puesto que previamente se había observado la eficacia del medio de regeneración, se atribuye que el proceso clorótico se debió a una sobreinfección bacteriana, por lo que en ensayos posteriores solamente se utilizó la concentración del inóculo bacteriano en una proporción 1:50 según recomendaciones de Ramírez, 2003.
En estas condiciones, los procesos de callogénesis y regeneración comenzaron a evidenciarse al final de la primera y segunda semana respectivamente, aumentando de manera progresiva (Fig. 3; Fig. 4). Al final de la novena semana, el 100% de los explantes produjo un promedio de 15 (± 6) regenerantes de más de 3 cm (Fig. 3b). En otros dos experimentos independientes se registraron tasas de regeneración promedio del 80 y 95% respectivamente.
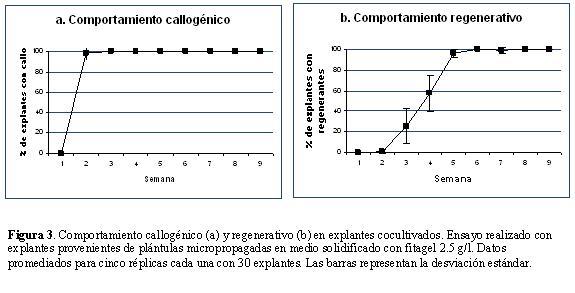

Los altos porcentajes de regeneración (hasta del 100%) y el gran número de regenerantes por explante (en promedio 15), indican que el proceso es altamente efectivo, obteniendo entre la séptima y novena semana plántulas totalmente desarrolladas. Un factor relevante para el éxito del protocolo es la calidad del explante fuente. Esto se reflejó en el aumento en los porcentajes de regeneración de los ensayos donde se utilizaron entrenudos provenientes de plantas micropropagadas en fitagel caracterizadas por su buen aspecto general con tallos gruesos y amplio desarrollo foliar.
De manera similar al protocolo reportado por Trujillo et al., 2001, para segmentos foliares, el proceso de regeneración con entrenudos solo requiere un tipo de medio para las fases de callogénesis y regeneración, generalmente inducidas en medios distintos como en el protocolo reportado por Banerjee et al., 2006. Sin embargo presenta una ventaja adicional puesto que se requiere una menor cantidad de fitoreguladores lo que puede ayudar a reducir los costos del proceso.
SENSIBILIDAD A MANOSA
Para identificar plántulas regeneradas potencialmente transgénicas, se utilizan sistemas de selección in vitro. Tales sistemas están basados bien en la adición de una sustancia tóxica a las células no transformadas, que son eliminadas durante el proceso, o en la adición de una sustancia que inhibe la regeneración a partir de células no transformadas. En el primer caso se trata de sistemas de selección negativa, en el que un antibiótico o un herbicida es el agente de selección, que elimina las células incapaces de metabolizar el agente activo, permitiendo sobrevivir a las células capaces de inhibirlo, mediante la transferencia de un gen. En el segundo caso, se trata de sistemas de selección positiva, en el que el agente de selección es un compuesto químico, que permite la regeneración solo en células transformadas con un gene que codifica para una enzima capaz de metabolizar el compuesto.
Los sistemas de selección negativa han tenido problemas de percepción pública, debido a la probabilidad (extremadamente baja) que transfieran la característica de resistencia al antibiótico a bacterias del sistema digestivo humano, cuando productos derivados de cultivos transgénicos son usados en la alimentación humana. Este problema en la comercialización, se intenta solucionar con los sistemas de selección positiva, que excluyen el uso de este tipo de genes. De ahí la importancia de los estudios del uso de sistemas de selección positiva, para aplicarlos al desarrollo de cultivos transgénicos con especies usadas en la alimentación humana.
Con el fin de mantener condiciones similares a las utilizadas en el proceso de regeneración, en los tratamientos se adicionó una carga total de manosa-sacarosa equivalente a 20 g/l de sacarosa, teniendo en cuenta la equivalencia osmótica entre los dos azucares (Wright et al., 2001; Kennedy et al., 2004). La mayoría de autores no tienen en cuenta esta característica en el momento de establecer sus ensayos de sensibilidad. Sin embargo, puede ser relevante en el sentido de que una posible infra o sobreaplicación de carbohidrato, a nivel osmótico puede incidir en efectos fisiológicos adicionales al efecto que tiene la adición de manosa per se.
La viabilidad de los explantes se redujo progresivamente con relación al aumento en la concentración de manosa (Fig. 5a). La oxidación fue el principal efecto observado, aunque también se presentó clorosis en explantes ubicados en las concentraciones más altas sin adición de sacarosa. Probablemente estos efectos surgen como respuesta a daños a nivel respiratorio y fotosintético como lo sugieren Reed et al., 2001.
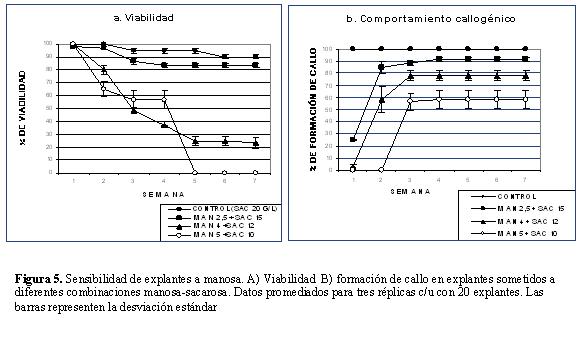
Concentraciones mayores o iguales a 7,5 g/l fueron letales para el 100% de los explantes durante la primera semana, demostrando su alta toxicidad para el genotipo estudiado. Concentraciones menores de manosa fueron perjudiciales para los explantes a medida que transcurrió el tiempo. De manera similar, la respuesta callogénica se redujo (Fig. 5b) y fue distinta de acuerdo a la concentración de manosa adicionada en el medio (Fig. 6). Se presentó formación de callo con producción de regenerantes, solo en los tratamientos control (sacarosa 20 g/l) y uno (manosa 2,5 + sac 15 g/l). En el tratamiento dos (manosa 4 g/l + sacarosa 12 g/l) se observó ensanchamiento de los explantes pero con poca proliferación de tejido, mientras que en el tratamiento tres (manosa 5 g/l + sacarosa 10 g/l) se presentó formación de callo inviable debido a procesos de oxidación y clorosis en la base de los explantes (Fig. 6).

La regeneración se inhibió completamente a concentraciones iguales y superiores a 4 g/l de manosa. En el tratamiento uno, solo un 5% de los explantes produjo entre uno y dos regenerantes después de seis semanas, una respuesta significativamente distinta (p=0,072, α=0,1) con respecto al tratamiento control (90 ± 1,7 % de regeneración, seis regenerantes promedio por explante; Fig. 6). Los fuertes efectos inhibitorios sobre los procesos de callogénesis y regeneración demuestran el deterioro causado a nivel del crecimiento celular atribuido a la carencia de fosfato inorgánico (Reed et al., 2001), y confirman la incapacidad de los explantes para utilizar manosa como una fuente de carbono, de lo cual se infiere que puede ser utilizada como agente selectivo.
Puesto que la combinación manosa 5 g/l + sacarosa 10 g/l generó respuesta callogénica en el 60% de los explantes, pero estos eran inviables como potenciales productores de regenerantes, se sugiere la adición de esta combinación en el medio de selección. Hay que anotar que aunque el callo generado era anómalo probablemente otra consecuencia fisiológica de la acumulación de manosa 6- fosfato, su formación se consideró como una baja respuesta de multiplicación celular, una característica utilizada por la mayoría de autores para la escogencia de la concentración de selección. Dependiendo del tipo de variable evaluada, en las pruebas de sensibilidad generalmente se seleccionan concentraciones en las cuales se inhibe la multiplicación celular (medida como ganancia en peso de callo, producción de callo embriogénico, porcentaje de regeneración o crecimiento de líneas germinales, según el caso) en más de un 70% de los explantes, es el caso de trabajos como el de Negrotto et al., 2000, Todd y Tague, 2001, Zhang y Puonti-Kaerlas, 2001, Kim y et al., 2002 o Gadaleta et al., 2006. Sin embargo Wright et al., 2001, escogieron la concentración en la cual no hubo evidencia de multiplicación celular (medida como crecimiento de callo), e igualmente fue efectiva en el proceso selectivo de plantas transgénicas de maíz. Esto sugiere que pueden funcionar para el sistema según la especie y el genotipo, tanto concentraciones de selección con cierta permisividad como lo indican Joersbo et al., 1998, como concentraciones mínimas en las cuales el crecimiento celular se blo-quea totalmente.
A partir de este análisis, se infiere la importancia de la prueba de sensibilidad en el desarrollo del sistema selectivo, puesto que permite determinar el grado de tolerancia a manosa del genotipo a transformar, y por tanto de situar una o un rango de potenciales concentraciones de selección. Este último es el caso de Joersbo et al., 1998, quienes después de ubicar un rango posible de concentraciones de selección a partir de la prueba de sensibilidad, determinaron la concentración óptima de acuerdo a las frecuencias de transformación obtenidas con cada una de las concentraciones.
AGRADECIMIENTOS
Los autores agradecen a SENA-COLCIENCIAS y a la Dirección de Investigación de la sede Bogotá (DIB) de la Universidad Nacional de Colombia por la financiación del proyecto “Desarrollo de Sistemas de Ingeniería genética para variedades colombianas de papa”, dentro del cual se realizo el presente trabajo, y al laboratorio de Biología Molecular del departamento de Biología de la Facultad de Ciencias y al laboratorio de Biotecnología de Facultad de Agronomía, ambas facultades de la Universidad Nacional de Colombia, Sede Bogotá.
BIBLIOGRAFÍA
BANERJEE A, PRAT S, HANNAPEL D. Efficient production of transgenic potato (S. tuberosum L. ssp. andigena) plants via Agrobacterium tumefaciens-mediated transformation. Plant Science. 2006;170:732:738.
[ Links ]BRASILEIRO A, ARAGÃO L. Marker genes for in vitro selection of transgenic plants. J Plant Biotechnol. 2001;3(3):113-121.
[ Links ]CARPUTO D, CARDI T, CHIARI T, FERRAIOLO G, FRUSCIANTE L. Tissue culture in various wild and cultivated Solanum germplasm accessions for exploitation in potato breeding. Plant Cell Tissue Organ Cul. 1995;41:151-158.
[ Links ]DALE P, HAMPSON K. An assessment of morphogenic and transformation efficiency in a range of varieties of potato (Solanum tuberosum L.). Euphytica. 1995;85:101-108.
[ Links ]GADALETA A, GIANCASPRO A, BLECHL A, BLANCO A. Phosphomannose isomerase, pmi, as a selectable marker gene for durum wheat transformation. J Cereal Sci. 2006;43:31-37.
[ Links ]JAIWAL P, SAHOO L, SINGH D, SINGH R. Strategies to deal with the concern about marker genes in transgenic plants: Some environment friendly approaches. Current Science. 2002;83(2):128-136.
[ Links ]JOERSBO M, DONALDSON I, KREIBER G, PETERSEN S, BRUNSTEDT J, OKKELS F. Analysis of mannose selection used for transformation of sugar beet. Mol Breed. 1998; 4: 111-117.
[ Links ]KENNEDY M, BURGER J, BOTHA F. Pearl Millet transformation system using the positive selectable marker gene phosphomannose isomerase. Plant Cell Rep. 2004;22:684-690.
[ Links ]KIM J, JUNG M, KIM H, LEE Y, CHOI S, LIM Y, et al. A new selection system for pepper regeneration by mannose. J Plant Biotechnol. 2002;4(3):129-134.
[ Links ]LIN Y, ZHANG Q. Optimizing the tissue culture conditions for high efficiency transformation of indica rice. Plant Cell Rep. 2005;23:540-547.
[ Links ]MARTÍNEZ H, BARRIOS C, ACEVEDO X. Características y estructura de la cadena de la papa en Colombia. 2003; 14 p. Disponible en http://www.agrocadenas.gov.co.
[ Links ]NEGROTTO D, JOLLEY M, BEER S, WENK A, HANSEN G. The use of phosphomannose-isomerase as a selectable marker to recover transgenic maize plants (Zea mayz I) via Agrobacterium transformation. Plant Cell Rep. 2000;19:798-803.
[ Links ]ORGANIZACIÓN DE LAS NACIONES UNIDAS PARA LA ALIMENTACIÓN Y LA AGRICULTURA FAO. Conference Thyrty-third Session, first report of the resolutions comité. 2006. Disponible en http://www.fao.org/docrep/meeting/010/ j6705E.html.
[ Links ]PENNA S, SAGI L, SWENNEN R. Positive selectable marker genes routine planttransformation. In Vitro Cell Dev Biol-Plant. 2002;38:125-128.
[ Links ]RAMIREZ H. Incorporación de resistencia al cogollero en la variedad de tomate Unapal-Arreboles por transformación genética vía Agrobacterium [tesis de doctorado]. Palmira: Facultad de Agronomía, Universidad Nacional de Colombia; 2003.
[ Links ]REED J, PRIVALLE L, POWELL M, MEGHJI M, DAWSON J, DUNDER E, et al. Phosphomannose isomerase: An efficient selectable marker for plant transformation. in vitro Cell. Dev Biol- Plant. 2001;37:127-132.
[ Links ]SANTOS-RODRIGUEZ J. Transformación de Agrobacterium tumefaciens cepa LBA4404 con el vector binario pNOV022, selección in vitro y caracterización molecular [trabajo de grado]. Bogotá: Departamento de Biología, Universidad Nacional de Colombia; 2003.
[ Links ]TODD R, TAGUE B. Phosphomannose isomerase: a versatile selectable marker for Arabidopsis thaliana germ-line transformation. Plant Mol Biol Rep. 2001;19:307-319.
[ Links ]TRUJILLO C, RODRIGUEZ-ARANGO E, JARAMILLO S, HOYOS R, ORDUZ S, ARANGO R. One- step transformation of two Andean potato cultivars (Solanum tuberosum L. ssp andigena). Plant Cell Rep. 2001;20:637-641.
[ Links ]WRIGHT M, DAWSON J, DUNDER J, SUTTIE J, REED J, KRAMER C, et al. Efficient biolistic transformation of maize (Zea mays L.) and wheat (Triticum aestivum L.) using the phosphomannose isomerase gene, pmi, as the selectable marker. Plant Cell Reports. 2001;20:429-436.
[ Links ]ZHANG P, PUONTI-KAERLAS J. PIG-mediated cassava transformation using positive and negative selection. Plant Cell Rep. 2000;19:1040-1048.
[ Links ]













