Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Biológica Colombiana
versão impressa ISSN 0120-548X
Acta biol.Colomb. v.14 n.2 Bogotá maio/ago. 2009
VACUNAS CONTRA EL HERPESVIRUS BOVINO-1: UNA MIRADA DESDE EL PASADO HACIA EL FUTURO DE LA INMUNIZACIÓN
Bovine Herpesvirus-1 Vaccine’s: A Look From The Past To The Immunization Future
JULIÁN RUIZ-SAENZ1,2, MV, M.Sc.; JAIRO JAIME2, MV, M.Sc., Ph. D.; VÍCTOR VERA2, MV, M.Sc., Ph. D.
1Estudiante de Doctorado, Facultad de Medicina Veterinaria y de Zootecnia, Universidad Nacional de Colombia, Sede Bogotá.
2Grupo de investigación en Microbiología y Epidemiología Universidad Nacional de Colombia, Sede Bogotá. julianruizsaenz@gmail.com
Presentado 10 de diciembre de 2008, aceptado 29 de junio de 2009, correcciones 11 de julio de 2009.
RESUMEN
El herpesvirus Bovino-1 (BHV-1) es uno de los principales patógenos que afecta el ganado; la infección primaria se acompaña de varias manifestaciones clínicas tales como la rinotraqueitis, aborto, vulvovaginitis/balanopostitis pustular y en algunos casos, enfermedad neurológica. Luego de la recuperación, la infección persiste durante toda la vida del individuo en un estado de latencia en ganglios nervioso trigémino o sacro. La Organización Mundial de Sanidad Animal (OIE) reporta que la vacunación contra el BHV-1 puede ser efectiva en reducir las manifestaciones clínicas y en consecuencia las pérdidas económicas, pero no logra proteger completamente de la infección. Es por esto que durante los últimos años se han desarrollado gran cantidad de agentes vacunales que van desde las vacunas clásicas inactivadas hasta aquellas que usan tecnología de DNA recombinante. El presente artículo se enfoca en presentar una actualización acerca de las vacunas más usadas desde hace ya varios años y resumir los avances más importantes en la generación de nuevas vacunas contra el BHV-1; tratando así de abrir un nuevo panorama para la generación de vacunas en Colombia.
Palabras clave: Herpesvirus bovino, vacuna, inmunógeno, recombinante
ABSTRACT
Bovine herpesvirus-1 is one of the most important pathogens of cattle; the primary infection is characterized by clinical manifestations such as infectious bovine rhinotracheitis, abortion, infectious pustular vulvovaginitis and in some cases, neurological signs. After recovering, the virus establishes viral latency in sensory neurons of trigeminal or sacral ganglia. The World Organization for Animal Health (OIE) reports that vaccination against BHV-1 could be useful to reduce the clinical manifestations and in consequence the economic looses, but it can not protect against the infection. Therefore, a huge amount of vaccines have been developed that includes from classic inactivation to recombinant DNA technologies. This paper makes an updated review about the most used vaccines since many years and try to resume the most important advances in BHV-1 vaccine’s generation; trying to open a window for new vaccine’s generation in Colombia.
Key words: Bovine herpesvirus, vaccine, immune, recombinant.
INTRODUCCIÓN
El herpesvirus Bovino es un virus de genoma DNA perteneciente a la familia Herpesviridae, subfamilia Alfaherpesvinae (Wyler et al., 1989); el cual posee una amplia diversidad de cepas, las cuales son serológicamente indiferenciables; sin embargo, con base en el análisis del genoma con endonucleasas de restricción y sus respectivos patrones de migración, se han clasificado en tres tipos y 5 subtipos: BHV-1.1, BHV-1.2a, BHV-1.2b, BHV-1.3a, y BHV-1.3b (Wyler et al., 1995). Actualmente, los subtipos BHV-1.3a y BHV-1.3b han sido reclasificados como BHV-5, el cual presenta un alto potencial neuropatogénico (Büchen-Osmond, 1995).
El BHV-1 afecta naturalmente al bovino, especie en la que provoca un amplio espectro de manifestaciones conocidas como rinotraqueitis (IBR), vulvovaginitis pustular infecciosa (IPV), balanopostitis (IPB), conjuntivitis, aborto, enteritis y encefalitis (Fig. 1). La distribución de la infección es mundial y la prevalencia de reactores serológicos indica que prácticamente todos los bovinos mayores de tres años han estado en contacto con el virus (Pidone et al., 1999). Se han registrado brotes de la forma respiratoria en EE.UU. y Canadá; la IPV es común en Europa y se notificaron brotes importantes de meningoencefalitis en Argentina, Australia, EE.UU., Canadá, Siria, Hungría, Uruguay, Italia y Brasil (OIE, 2004).

El BHV-1 se transmite en forma directa de un animal a otro, dado que gran cantidad de virus se excreta principalmente por secreciones respiratorias, oculares y reproductivas de animales infectados; sin embargo también puede diseminarse en forma indirecta, a través de personas o equipos. El período de incubación varía entre 2 y 6 días, pues depende de la dosis y ruta de inoculación, entre otros. Aunque se acepta que, para el caso de la IBR, el virus se excreta en las secreciones nasales por aproximadamente 12-14 días posinfección, se ha recuperado el virus en forma intermitente por un período de hasta 578 días (Wyler et al., 1989). Otras fuentes importantes de diseminación son el semen y la transferencia embrionaria (Bielanski et al., 1994). Se ha podido comprobar que toros serológicamente positivos sin sintomatología son portadores del virus, el que se ha logrado aislar de muestras de semen congelado (Bielanski et al., 1988; van Oirschot et al., 1993), incluso 12 meses después de su almacenamiento a -196 ºC. El bovino es el principal reservorio del BHV-1; sin embargo, muchas especies de rumiantes, caprinos, ovinos, etc., e incluso el cerdo, son susceptibles a este virus (Wyler et al., 1989).
El diagnóstico de la infección se puede lograr usando técnicas clásicas de virología como son el aislamiento viral en cultivos celulares, pruebas de inmunoperoxidasa e inmunofluorescencia, técnicas serológicas como ELISA y seroneutralización, la cual es la técnica recomendada por la OIE como estándar internacional. También es posible realizar un diagnóstico óptimo utilizando técnicas convencionales de amplificación de regiones específicas del genoma viral como PCR, que tienen la mayor sensibilidad y especificidad (OIE, 2004).
En Colombia, se han realizado diferentes estudios seroepidemiológicos, los cuales además de demostrar la extensión de la infección, han permitido el aislamiento de algunas cepas nativas, las cuales fueron aisladas a comienzos de los años 70 (CIAT, 1972; CIAT, 1975); En la mitad de los años noventas (Molano et al., 1995); y más recientemente una aislada en 2001 (Piedrahita et al., 2005). Estas dos últimas han sido sujeto de caracterización molecular por el Grupo de Microbiología y Epidemiología de la Universidad Nacional, clasificando los aislamientos como BHV-1.1 a la cepa de los Llanos orientales y BHV-1.2a para la cepa de la sabana de Bogotá (Piedrahita et al., 2005). Sin embargo, es necesario realizar nuevos aislamientos que permitan evaluar con actualidad cuales son la(s) cepa(s) que circula(n) en las ganaderías del país; además es necesario, obtener cepas nativas de diferentes regiones epidemiológicas de Colombia, para poder formular vacunas que sean eficientes en la inmunización de bovinos de todo el país.
VACUNAS TRADICIONALES
Desde hace mucho tiempo, existen en el comercio vacunas tradicionales contra el BHV-1 y se utilizan en muchos países en sus distintas variantes: generadas a partir de virus vivo modificado o inactivado, mono o polivalente. Dependiendo de la capacidad del producto de inducir inmunogenicidad, la vacuna puede ser efectiva en reducir las manifestaciones clínicas y en consecuencia las pérdidas económicas, pero no logra proteger completamente de la infección (OIE, 2004). Entre estas vacunas “tradicionales” están las atenuadas y las inactivadas.
Las vacunas atenuadas son aquellas que tienen una capacidad de multiplicación limitada en el organismo, pero suficiente para generar respuesta inmune (similar a la que proporciona la enfermedad). Debido a su atenuación, el virus disminuye la capacidad de causar enfermedad, reduciéndose también su eliminación o contagio por parte de los animales vacunados. Luego de la vacunación, la protección se establece en unas 2 a 3 semanas, obteniendo protección sistémica y en mucosas (oral, nasal, genital, etc.) por períodos prolongados de tiempo, los cuales pueden ir de meses hasta años (Wyler et al., 1989).
En cuanto a la atenuación clásica de agentes virales para vacunas existen varias técnicas; la primera consiste en la atenuación mediante pasajes seriados en cultivos de células para seleccionar las variantes menos virulentas, aunque no se conocen con exactitud los mecanismos por los cuales se introducen las mutaciones durante la replicación viral de los diferentes agentes (Sabin y Boulger, 1973). Otra técnica consiste en generar cepas mutantes virales que son incapaces de crecer a temperaturas superiores a 37 °C (temperature-sensitive, ts) o que pueden crecer a temperaturas más bajas [p. ej. 25 °C] (cold-adapted, ca). Se asume que los virus ts o ca tienen menor capacidad replicativa y por lo tanto son atenuados. Ésta característica garantiza la replicación estrictamente local y permite que las cepas vacunales puedan ser distinguidas de las cepas de campo gracias al marcador ts o ca (Wyler et al., 1989).
Una de las ventajas más importantes de este tipo de vacunas son su forma de administración y la posibilidad de realizar combinaciones con virus de otras familias, las cuales recientemente, han demostrado generar una inmunidad duradera tanto para el BHV-1 como para los demás agentes virales incluidos en una formulación comercial (Peters et al., 2004).
Aunque las vacunas atenuadas inducen una protección eficiente, poseen algunas desventajas tales como el riesgo de reversión a la virulencia y la imposibilidad de aplicarlas a hembras gestantes, dado el riesgo de inducción de aborto (Miller et al., 1991). Adicionalmente, éste tipo de vacunas pueden inducir latencia de la cepa vacunal, pudiéndose reactivar luego de una inmunosupresión con corticoides, generando así reinfecciones con dicha cepa vacunal (van Drunen Littel-van Den Hurk et al., 1993).
Se han desarrollado algunas vacunas atenuadas para aplicación intranasal; estas vacunas confieren una rápida protección local al provocar una infección sistémica con el virus. La gran ventaja de este tipo de vacunas, comparada con las de aplicación parenteral, es su seguridad para las hembras gestantes; sin embargo, se han reportado algunas desventajas como la dificultad para optimizar la vía de administración, la transmisión de virus vacunal a animales no inmunizados y algunas reacciones adversas, como fiebre o descenso temporal de la producción láctea (Wyler et al., 1989).
Los inconvenientes de las vacunas con virus atenuado se han minimizado con el uso de vacunas con virus inactivado, las cuales se desarrollan a partir del virus completo pero inactivado por algún método físico o químico. Hasta la fecha, se han utilizado varios agentes inactivantes para la producción de vacunas contra el BHV-1, tales como la formalina, etanol, y la inactivación con calor o luz UV. También se ha empleado la ß-pro-piolactona como agente inactivante; sin embargo, se ha reportado que puede provocar oncogénesis por hidrólisis deficiente o mala dosificación (OMS-OPS, 1976). Uno de los agentes de mayor uso en la actualidad es la etilenimina binaria (BEI), un inactivante de primer orden, que garantiza la inactivación completa del virus. Dado que el agente se encuentra inactivado, no presentan riesgo biológico y son seguras y eficientes en la aplicación en hembras gestantes, ya que no provocan aborto ni diseminación viral luego de la vacunación. El establecimiento de infección latente por la cepa vacunal es imposible, además de permitir la fabricación de vacunas multivalentes, pues no hay interferencia con la producción de anticuerpos contra otro antígeno inactivado (Wyler, 1989).
Sin embargo, la protección que brinda al feto este tipo de vacunas es motivo de controversias, pues por el proceso de inactivación, estas no generan inmunidad completa en mucosas o inmunidad mediada por células y por tanto requieren adyuvantes y dosis múltiples para inducir una protección óptima. A pesar de esto, algunos investigadores las postulan como altamente efectivas para el control de la infección con BHV-1 (Schudel et al., 1987).
En Colombia el mercado de biológicos es muy amplio y diverso, permitiéndole al productor, a los técnicos y a los veterinarios escoger entre una gama amplia de productos nacionales e importados los cuales pueden ser atenuados o inactivados principalmente dependiendo de la casa manufacturera y del uso recomendado por dicha casa; encontrándose comercialmente en el país el BHV-1 asociado siempre con otros agentes tales como el Virus de la Diarrea Viral Bovina (DVB), el Virus de Parainfluenza tipo 3 (PI3), el Virus sincitial respiratorio (BRSV) y con agentes bacterianos como Pasteurella spp., Leptospira spp., entre otros (Tabla 1).
ESTRATEGIAS VACUNALES ACTUALES
Los problemas concernientes tanto a las vacunas atenuadas como a las vacunas inactivadas, impulsaron la producción de nuevas alternativas vacunales que contienen sólo determinados componentes virales los cuales previamente han mostrado ser altamente inmunogénicos, como son las diferentes glicoproteínas virales. Dichas glicoproteínas son las encargadas de la interacción con las células blanco y con el sistema inmune. En este campo se incluyen las “vacunas Recombinantes”, las cuales pueden ser replicativas o no replicativas de acuerdo a su capacidad de replicar el agente viral en el individuo vacunado. Entre las replicativas se encuentran las vacunas marcadoras, las atenuadas y las portadas por un vector bacteriano o viral. Por las no replicativas están las de subunidades proteicas y las de subunidades génicas. En la fabricación de vacunas recombinantes, se han logrado grandes avances mediante el uso de células de mamífero e insecto, incorporando a ellas una determinada secuencia codificante del virus para expresarla en estas (van Drunen Littel-van Den Hurk et al., 1990; van Drunen Littel-van Den Hurk et al., 1993).
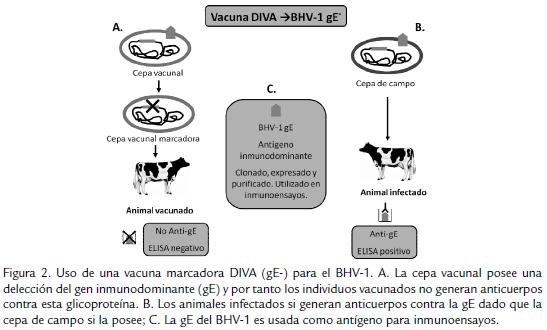
Este tipo de productos biológicos tienen entre sus ventajas, el que no contiene virus vivo (intacto) y por lo tanto no puede ser transmitido a otros animales, causar aborto o establecer infección latente. Estas alternativas incluyen la generación de cepas con delecciones en diferentes regiones del genoma, ya sea con el objetivo de eliminar las regiones inductoras de patogenicidad (atenuadas), con el objetivo de favorecer la inmunogenicidad o generar las comúnmente llamadas DIVA (del inglés: Differentiating Infected From Vaccinated Animals), las cuales son vacunas marcadoras que permiten diferenciar los animales infectados naturalmente de los animales vacunados por la presencia o ausencia de anticuerpos contra una región específica del genoma del virus la cual ha sido delectada en la cepa vacunal (Fuchs et al., 1999)
VACUNAS MARCADORAS
Para el caso del BHV-1 el uso de las DIVA ha sido una de las alternativas más utilizadas en los planes de vacunación y erradicación de la enfermedad, siempre acompañados del desarrollo y empleo de pruebas serológicas, permitiendo así la diferenciación de animales vacunados de no vacunados (Chowdhury et al., 1999; Fig. 2). También ha sido posible su aplicación en animales jóvenes aún en presencia de anticuerpos calostrales (Pidone et al., 1999). Bosch et al., 1998, demostraron que el uso de estas vacunas reducía significativamente la transmisión de la infección en condiciones de campo (Bosch et al., 1998). Actualmente, la vacuna DIVA con mayor aceptación internacional es la vacuna con delección en la gE (gE-), dado que los animales infectados naturalmente presentan anticuerpos contra dicha glicoproteína mientras que los individuos vacunados no lo hacen (van Drunen Littel-van Den Hurk, 2006); estudios realizados por Mars et al., 2001, demuestran que una vacuna viva gE- puede ser re-excretada a través de secreciones nasales, luego de una reactivación, llevando a esta a ser uno de los candidatos más útiles en este tipo de vacunas, dado que la re-excreción podría permitir el establecimiento de una inmunidad de hato (Mars et al., 2001).
Recientemente, el Grupo de Vacunas y Patogenia en Herpesvirus bovino del Instituto Nacional de Tecnología Agropecuaria -INTA (Buenos Aires, Argentina), desarrolló una vacuna marcadora atenuada contra BHV-1, generada a partir de una delección del marco abierto de lectura completo de la proteína gE; la vacuna atenuada resultó altamente segura en cuanto a los riesgos de generación de abortos y transmisión a animales no vacunados, y completamente inocua en cuanto a la generación de efectos colaterales en el bovino; y a diferencia de lo descrito para otras cepas de BHV1 negativas para la gE, al emplear la cepa desarrollada por este grupo como vacuna atenuada, no se detectó el virus vacunal en excreciones nasales durante el período post-vacunación (INTA, 2005).
Sin embargo, estudios recientes desarrollados por Muylkens et al., 2006a, demuestran que la infección nasal doble con una cepa vacunal gE negativa y una cepa silvestre del virus puede generar cepas recombinantes intraespecíficas, las cuales poseen in vitro una virulencia inferior a la de las cepas silvestres (Muylkens et al., 2006a); sin embargo in vivo, presentan una virulencia mayor que las cepas parentales, confirmando que los fenómenos de recombinación pueden restaurar la virulencia de las cepas vacunales gE negativas (Muylkens et al., 2006b), y ratificando las dificultades para la aplicación de este tipo de recombinantes en campo, o en zonas de alta circulación de cepas silvestres.
VECTORES VIRALES
Recientemente se han desarrollado algunos vectores virales los cuales por sus características biológicas y replicación son óptimos para expresar proteínas foráneas. Entre estos vectores virales se resalta el uso del Herpesvirus Bovino-4 (BHV-4), un miembro de la subfamilia Gammaherpesvirinae el cual ha sido aislado de una gran variedad de muestras de bovinos clínicamente sanos y de bovinos con signos clínicos de aborto, metritis, neumonía entre otros, y cuya patogenicidad no ha sido claramente dilucidada (Thiry et al., 1989). A diferencia de otros gammaherpesvirus, no causa efecto citopático, se replica en una amplia gama de líneas celulares bovinas y de otras especies, y no se ha logrado demostrar que tenga algún papel en oncogénesis o transformación celular (Gillet et al., 2005). En estudios realizados por la Universidad de Liege, Bélgica, se evidenció que el uso de un recombinante del BHV-4 expresando la gD del BHV-1 y acompañado de un elemento regulatorio post-trascripcional en la región 3’ de la gD es altamente inmunogénico e induce la producción de anticuerpos neutralizantes anti-gD del BHV-1 en un modelo leporino, postulándose como uno de los modelos vectores más interesantes para desarrollar un candidato vacunal. Además, en animales vacunados no se detectaron anticuerpos neutralizantes anti-BHV-4, lo cual ratifica su papel como candidato vacunal pues no habría ningún tipo de interferencia ni competencia en la generación de anticuerpos (Donofrio et al., 2006).
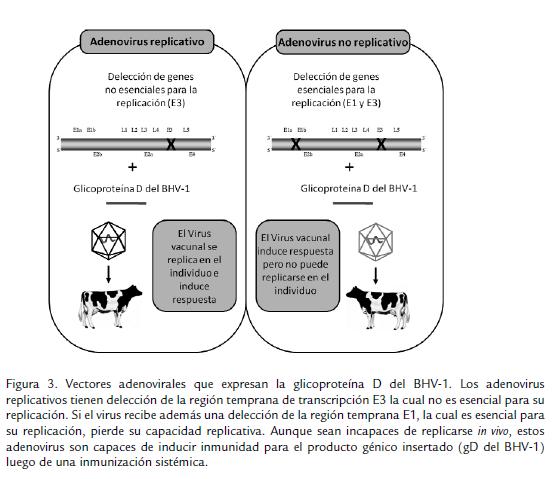
Otra alternativa ampliamente explorada ha sido el uso de vectores adenovirales que expresen glicoproteínas del BHV-1. Estos vectores han sido desarrollados usando como principal modelo el adenovirus humano 5 (hAd5), el cual es un excelente sistema para la expresión de antígenos; desarrollándose dos tipos de vectores de acuerdo a su capacidad replicativa (replicativos y no replicativos). Sin embargo, los no replicativos han sido principalmente usados por ser altamente seguros (Fig. 3). Papp et al., 1999, usando un modelo de rata algodonera (Sigmodon hispidus), evaluaron la respuesta inmunológica inducida por dos tipos de vectores adenovirales previamente desarrollados, los cuales expresaban la gD del BHV-1, uno de ellos replicativo (Mittal et al., 1996) y otro no replicativo (van Drunen Littel-van Den Hurk et al., 1993), encontrando que los replicativos fueron más eficientes que los no replicativos para inducir presencia de anticuerpos tanto en el suero como en el tracto respiratorio de los individuos inmunizados por vía intranasal. Además, la inmunización intranasal con adenovirus replicativos demostró completa protección ante el reto con el BHV-1, mientras que la inmunización con el adenovirus no replicativo solo indujo una protección parcial.
Contradictoriamente, Gogev et al., 2002, usando un modelo bovino, encontraron que la mejor respuesta de anticuerpos neutralizantes anti-gD del BHV-1 se lograba al inmunizar terneros con un adenovirus no replicativo el cual expresaba la gD del BHV-1 bajo el control del promotor del citomegalovirus humano, encontrando que los terneros inmunizados con este vector y retados con el virus tres semanas después de una segunda inmunización por vía intranasal, tenían una buena protección clínica luego del reto, altos niveles de anticuerpos neutralizantes, aun mayores que los inducidos por una vacuna comercial atenuada, y una reducción significativa en la excreción de virus luego del reto. Además se evidenció que los individuos inmunizados con este vector desarrollan una prevalencia muy baja de anticuerpos antiadenovirus, postulándose así como una de las alternativas vacunales más prometedoras en el campo veterinario (Gogev et al., 2004b). Sin embargo, estudios recientes utilizando microscopía de inmunofluorescencia, microscopía confocal y RT-PCR, para evaluar la distribución de la gD en tracto respiratorio de terneros luego de la inmunización con el mencionado vector, evidenciaron una expresión transitoria de la proteína (solo 5 días), la cual se limitaba a las células epiteliales localizadas en el epitelio de la mucosa nasal, sugiriendo la necesidad de un adyuvante que mejore la eficiencia del vector para generar una mejor inmunidad y una mejor expresión de la gD del BHV-1 (Gogev et al., 2004a).
Sin embargo, no solo se han utilizado vectores adenovirales de origen humano; también se ha desarrollado un vector adenoviral de origen bovino (BAdv-3); éste es un miembro del género Mastadenovirus, familia Adenoviridae, el cual ha sido involucrado en casos de infecciones subclínicas de tipo respiratorio y entérico (Reddy et al., 1999); el vector desarrollado a partir de este, es un adenovector replicativo y puede expresar la gD del BHV1, y su evaluación en un modelo de rata algodonera inmunizada por la vía intranasal demostró que generaba una fuerte respuesta de inmunoglobulinas específicas tipos IgG e IgA anti gD y anti BAdv-3 (Zakhartchouk et al., 1998). Adicionalmente, se ha demostrado que es un buen vector para generar inmunidad anti-gD en bovinos vacunados intranasalmente, llevando a la generación de anticuerpos específicos anti-gD en suero y secreciones nasales de los terneros y reduciendo la excreción de virus y la presentación clínica luego del reto con virus de campo; aun en individuos vacunados y con altos niveles preexistentes de anticuerpos anti BAdv-3 (Zakhartchouk et al., 1999).
Posteriormente, el mismo grupo de investigación desarrolló un BAdv-3 no replicativo que expresaba la gD del BHV-1; su evaluación en un modelo bovino demostró utilizando inmunización intratraqueal que al compararlo con el BAdv-3 replicativo expresando la misma gD, induce bajos niveles de anticuerpos neutralizantes sistémicos y aunque induce una respuesta anamnésica ante el reto, la tasa de anticuerpos específicos en suero y en secreciones nasales es superior para el BAdv-3 gD replicativo, indicando que posiblemente, este tipo de vector y de vía de administración no sean las más efectivas para conseguir una buena respuesta inmune y controlar el BHV-1 en campo (Reddy et al., 2000).
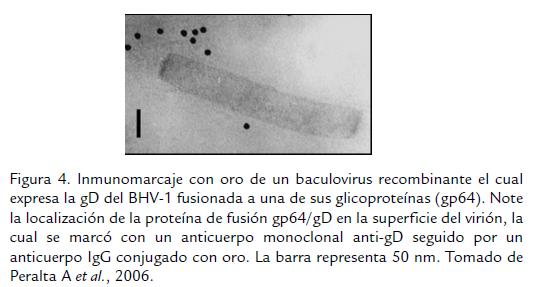
En 1998, se reportó el desarrollo de un baculovirus (Autographa californica nuclear polyhedrosis virus) como un sistema de expresión de las gC, gB y gD del BHV-1 in vitro en células de insecto, tratando de maximizar los sistemas de expresión de proteínas con objetivos diagnósticos (Abdelmagid et al., 1998a) y como sistemas de producción de subunidades vacunales proteicas (Abdelmagid et al., 1998b). Este adelanto fue aprovechado por el Instituto de Biotecnología del Instituto Nacional de Tecnología Agropecuaria -INTA (Castelar, Argentina), para desarrollar Baculovirus recombinantes como inmunógenos que llevan en su superficie moléculas quiméricas entre la glicoproteína de superficie gp64 del baculovirus y la gD derivada del BHV-1; este virus puede ser usado como estructura transportadora de antígenos heterólogos, y es posible formular vacunas con antigenicidad aumentada debido a su naturaleza particulada, a la presentación multimérica de los epítopes y a la conformación adecuada de los antígenos en la superficie del virión (Peralta et al., 2006; Fig. 4). Este grupo de investigadores logró inducir anticuerpos capaces de neutralizar el virus in vitro, luego de inmunizar ratones BALB/c con 5 x 108 unidades formadoras de placa del recombinante. Además, la respuesta humoral medida por la técnica de ELISA fue diez veces mayor que la registrada para los ratones inmunizados con una vacuna inactivada comercial, indicando que la gD expresada en los viriones es altamente inmunogénica. Considerando que los Baculovirus son incapaces de replicarse en células de mamífero, se asume que los mamíferos no tienen una respuesta inmune preexistente a estos vectores, lo cual amplia la seguridad de este vector (Peralta et al., 2007). Actualmente este recombinante se encuentra, en fase de evaluación en terneros; sin embargo la dificultad para obtener un grupo homogéneo de animales seronegativos al BHV-1 en Argentina ha dificultado la evaluación a los investigadores.
VACUNAS DE SUBUNIDADES GÉNICAS SUBUNIDADES PROTEICAS
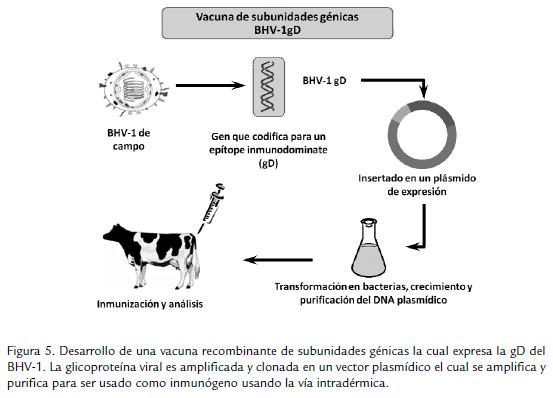
Paralelamente con estos desarrollos, una fuerte corriente ha crecido en la producción de vacunas recombinantes enfocándose principalmente en la producción de vacunas de subunidades, las cuales no tienen potencial de replicación y por tanto no poseen ningún riesgo biológico en su aplicación y se descartan las probabilidades de recombinación con cepas de campo (Fig. 5). Estas vacunas deben ser aplicadas vía intradérmica, dado que por vía intramuscular no inducen una respuesta inmune eficiente, pues éstas deben entrar directamente al sitio donde puedan ser reconocidas por células presentadoras de antígeno, principalmente células dendríticas, las cuales se encuentran mayormente en el espacio intradérmico (van Drunen Littel-van Den Hurk et al., 1993; van Drunen Littel-van Den Hurk et al., 1998). Si bien los primeros ensayos de este tipo de vacunas mostraron poca eficiencia en bovinos (Cox et al., 1993), los últimos ensayos han logrado alcanzar grados de protección eficientes ante un nuevo reto con el virus (van Drunen Littel-van Den Hurk, 2006). En los comienzos, se logró vacunar los ani-males con una versión truncada de la gD, la cual estaba truncada en el aminoácido 355, eliminando así el dominio de anclaje de membrana; ésta versión truncada de la proteína fue expresada en células MBDK bajo el control del promotor del gen bovino heat shock protein 70A (hsp70; Kowalski et al., 1993); este sistema permitió alcanzar niveles de protección óptimos en bovinos. Casi una década más tarde, Pontarrollo et al., 2002, demostraron que el uso de la forma truncada de la gD de BHV-1 en un vector cuyo esqueleto había sido modificado adicionándole un número controlado de oligodeoxinucleótido CpGs, aumentaba la generación de respuestas inmunes celular y humoral eficientes en un modelo bovino. El mismo grupo de investigadores logró demostrar que esta formulación de subunidad génica en combinación con Emulsigen®, un aceite mineral en solución acuosa y un oligodeoxinucleótido CpG, inducían un incremento en la respuesta inmunitaria llegando a la protección completa contra la infección y contra la enfermedad. Recientemente investigadores de la Universidad de Saskatchewan demostraron que esta formulación, es capaz de inducir anticuerpos neutralizantes protectores aun en presencia de anticuerpos maternales circulantes (van Drunen Litter-van Den Hurk et al., 2008).
Aunque esta aplicación es una referenciada internacionalmente, 10 años atrás se había reportado un método para inmunizar animales con glicoproteínas virales, las cuales generaban una inmunidad sistémica parcial luego de la inyección intramuscular o de la administración intranasal de las tres glicoproteínas mayores gB, gC y gD junto con un adyuvante efectivo (Zhu y Letchworth, 1996). Similarmente, se ha descrito que el uso de recombinantes de gD de BHV-1, utilizando una variante secretora de dicha glicoproteína viral induce una mayor respuesta inmune en bovinos que la versión recombinante que usa la forma completa de la gD; además, se ha descrito que aunque gC del BHV-1 es una de las glicoproteínas mayores, su uso como recombinante en vacunas genera menor título de anticuerpos neutralizantes in vivo. Por otra parte, los investigadores han intentado generar vacunas utilizando otros componentes del virus como la proteína VP8, la cual es el componente más abundante al interior de los viriones y se localiza en el tegumento del BHV-1 entre la nucleocápside y la envoltura y ha demostrado tener un papel importante en la generación de inmunidad celular. Sin embargo, aunque el recombinante de VP8 induce mayor linfoproliferación y producción de INF-γ que los recombinantes de gD y gC, los títulos de anticuerpos neutralizantes in vivo no alcanzan a ser significativamente diferentes de los controles sin vacunación y son muy inferiores a los generados por los recombinantes que usan gD (Toussaint et al., 2005). Estos resultados sugieren que el uso de la versión secretora de la gD es el mejor candidato para generación de una respuesta inmune neutralizante de la infección y plantean la necesidad de usar adyuvantes que mejoren la respuesta celular necesaria para proporcionar protección a largo plazo.
Teniendo en cuenta que las vacunas de subunidades génicas inducen predominantemente una respuesta inmune humoral (van Drunen Littel van Den Hurk et al., 1993), múltiples grupos de investigación han trabajado en el desarrollo nuevos métodos para hacer más efectiva la inmunización con DNA usando diversos adyuvantes, a fin de conseguir la generación de un respuesta óptima tanto a nivel humoral como celular. Teniendo en cuenta que los lipopolisacáridos bacterianos son agentes con un alto potencial inmunomodulador y con propiedades adyuvantes ampliamente descritas, aun cuando son administrados en sitios y tiempos diferentes en los cuales se aplica el antígeno, Zamorano et al., 2002 reportaron el uso del RN-205, un inmunomodulador generado a partir de fracciones ribosomales y fracciones de membranas ricas en lipopolisacáridos provenientes de una cepa de baja patogenicidad de E. coli demostrando un incremento significativo en la respuesta inmune celular, cuando se administra en combinación con plásmidos que codifican para diferentes versiones de la gD de BHV1, convirtiéndose en uno de los adyuvantes más atractivos para obtener inmunidad celular y humoral eficientes luego de la vacunación con vacunas de subunidades génicas del BHV-1 (Zamorano et al., 2002).
CONCLUSIÓN
La infección por el BHV-1 es una de las más devastadoras en la industria bovina y su prevención y control ha siso fundamental en los procesos de desarrollo de las diferentes ganaderías tanto a nivel nacional como internacional. En este proceso de prevenir la infección se han utilizado todas las herramientas que la virología ha desarrollado, desde la inactivación química de agentes virales hasta el desarrollo de agentes recombinantes con capacidad para presentar e inmunizar contra productos génicos foráneos introducidos al nivel molecular en su genoma.
Aunque en América Latina ha avanzado fuertemente en estos desarrollos vacunales, Colombia en la actualidad, cuenta con vacunas comerciales que podríamos denominar de primera generación (inactivadas y modificadas); ninguna de las vacunas comerciales que se encuentra en el país incluye en su formulación cepas locales y se suma a esto que en el país no se han realizado evaluaciones del grado de inmunogenicidad y de seguridad de las vacunas para el BHV-1 presentes en el país. Teniendo en cuenta que todas las vacunas nacionales para bovinos se encuentran en formulación polivalente (Tabla 1), es de vital importancia la evaluación epidemiológica de la presencia e impacto de los demás agentes virales y bacterianos presentes en los biológicos de venta nacional, para poder así tener herramientas para decidir si son necesarios los polivalentes o si debemos proponer la comercialización de biológicos monovalentes útiles a las condiciones de los diferentes tipos de explotaciones ganaderas del país.
Sumado a esta problemática nacional, vemos con gran preocupación la introducción reciente al país de vacunas a virus vivo modificado, las cuales a pesar de inducir una inmunidad eficiente como se mencionó anteriormente, pueden acarrear graves problemas como la inducción de latencia de cepas vacunales, recombinación de cepas vacunales con cepas de campo entre otras, hechos que harán más complicada la epidemiología de esta infección en el país. Es por tanto, el área de la generación y evaluación de vacunas una de las áreas de investigación en las cuales se debe invertir gran cantidad de esfuerzos, tratando así de prevenir y (en un futuro no muy lejano) pensar en erradicar una de las infecciones virales que genera mayor cantidad de pérdidas económicas al sector pecuario nacional.
AGRADECIMIENTOS
A la Universidad Nacional de Colombia.
BIBLIOGRAFÍA
ABDELMAGID OY, MANSOUR MM, MINOCHA HC, VAN DRUNEN LITTELVAN DEN HURK S. Evaluation of baculovirus-expressed bovine herpesvirus-1 (BHV-1) glycoproteins for detection and analysis of BHV-1-specific antibody responses. Vet Microbiol. 1998a;61:249-59. [ Links ]
ABDELMAGID OY, MANSOUR MM, OKWUMABUA O, VAN DRUNEN LITTEL-VAN DEN HURK S. Expression and cellular distribution of baculovirusexpressed bovine herpesvirus 1 (BHV-1) glycoprotein D (gD) sequences. Arch Virol. 1998b;143:2173-87. [ Links ]
BIELANSKI A, DUBUC C. In-Vitro Fertilization and Culture of Ova from Heifers Infected with Bovine Herpesvirus-1 (BHV-1). Theriogenology. 1994;41(6):1211-1217. [ Links ]
BIELANSKI A, LOEWEN KG AND HARE WCD. Inactivation of bovine herpesvirus-1 (BHV-1) from in vitro infected bovine semen. Theriogenology. 1988;30,(4):649-656. [ Links ]
BOSCH JC, DE JONG MC, FRANKEN P, FRANKENA K, HAGE et al.,An inactivated gE-negative marker vaccine and an experimental gD-subunit vaccine reduce the incidence of bovine herpesvirus 1 infections in the field. Vaccine. 1998;16:265-71. [ Links ]
BÜCHEN-OSMOND C. Alphabetical List of ICTV approved Virus Families and Genera. Created April, 1995. Última actualización: 8 de abril de 1998. Revisado julio de 2009. [ Links ]
CHOWDHURY SI, ROSS CS, LEE BJ, HALL V, CHU HJ. Construction and characterization of a glycoprotein E gene-deleted bovine herpesvirus type 1 recombinant. Am J Vet Res. 1999;60:227-232. [ Links ]
CIAT - Centro Internacional de Agricultura Tropical. Informe anual de salud animal; 1972. [ Links ]
CIAT - Centro Internacional de Agricultura Tropical. Informe anual de salud animal; 1975. [ Links ]
COX GJ, ZAMB TJ, BABIUK LA. Bovine herpesvirus 1: immune responses in mice and cattle injected with plasmid DNA. J Virol. 1993;67:5664-7. [ Links ]
DONOFRIO G, CAVIRANI S, VANDERPLASSCHEN A, GILLET L, FLAMMINI CF. Recombinant bovine herpesvirus 4 (BoHV-4) expressing glycoprotein D of BoHV1 is immunogenic and elicits serum-neutralizing antibodies against BoHV-1 in a rabbit model. Clin Vaccine Immunol. 2006;13:1246-54. [ Links ]
FUCHS M, HUBERT P, DETTERER J, RZIHA HJ. Detection of bovine herpesvirus type 1 in blood from naturally infected cattle by using a sensitive PCR that discriminates between wild-type virus and virus lacking glycoprotein E. J Clin Microbiol. 1999;37:2498-2507. [ Links ]
GILLET L, DAIX V, DONOFRIO G, WAGNER M, KOSZINOWSKI UH, CHINA B, et al. Development of bovine herpesvirus 4 as an expression vector using bacterial artificial chromosome cloning. J Gen Virol. 2005;86:907-917. [ Links ]
GOGEV S, DE FAYS K, VERSALI MF, GAUTIER S, THIRY E. Glycol chitosan improves the efficacy of intranasally administrated replication defective human adenovirus type 5 expressing glycoprotein D of bovine herpesvirus 1. Vaccine. 2004a;22:1946-53. [ Links ]
GOGEV S, GEORGIN JP, SCHYNTS F, VANDERPLASSCHEN A, THIRY E. Bovine herpesvirus 1 glycoprotein D expression in bovine upper respiratory tract mediated by a human adenovirus type 5. Vet Res. 2004b;35:715-21. [ Links ]
GOGEV S, VANDERHEIJDEN N, LEMAIRE M, SCHYNTS F, D’OFFAY J, DEPREZ I, et al. Induction of protective immunity to bovine herpesvirus type 1 in cattle by intranasal administration of replication-defective human adenovirus type 5 expressing glycoprotein gC or gD. Vaccine. 2002;20:1451-65.
INTA. 2005. Instituto Nacional de Tecnología Agropecuaria. Desarrollo de nuevas tecnologías para estudio de patogenia de virus genéticamente modificados. En: http://www.inta.gov.ar/virologia/investiga/proyectos/ar1.htm Revisado en julio de 2009. [ Links ]
KOWALSKI J, GILBERT SA, VAN DRUNEN-LITTEL-VAN DEN HURK S, VAN DEN HURK J, BABIUK LA, ZAMB TJ. Heat-shock promoter-driven synthesis of secreted bovine herpesvirus glycoproteins in transfected cells. Vaccine. 1993;11:1100-7. [ Links ]
MARS MH, DE JONG MCM, FRANKEN P, VAN OIRSCHOT JT. Efficacy of a live glycoprotein E-negative bovine herpesvirus 1 vaccine in cattle in the field, Vaccine. 2001;19:1924-1930. [ Links ]
MILLER JM, WHETSTONE CA, BELLO JJ, LAWRENCE WC. Determination of ability of a thymidine kinase-negative deletion mutant of bovine herpesvirus-1 to cause abortion in cattle. Am J Vet. 1991;52:1038-1043. [ Links ]
MITTAL SK, PAPP Z, TIKOO SK, BACA-ESTRADA ME, YOO D, et al. Induction of systemic and mucosal immune responses in cotton rats immunized with human adenovirus type 5 recombinants expressing the full and truncated forms of bovine herpesvirus type 1 glycoprotein gD. Virology. 1996;222:299-309. [ Links ]
MOLANO D, RODRÍGUEZ JL, RAMÍREZ G, VILLAMIL LC. Caracterización electroforética e inmunológica de una cepa de campo del virus de la rinotraqueitis infecciosa bovina y su comparación con cepas de referencia. Rev Med Vet Zootec. 1996;44:35-8. [ Links ]
MUYLKENS B, MEURENS F, SCHYNTS F, DE FAYS K, POURCHET A, THIRY J, et al. Biological characterization of bovine herpesvirus 1 recombinants possessing the vaccine glycoprotein E negative phenotype. Vet Microbiol. 2006a;31;113:283-91. [ Links ]
MUYLKENS B, MEURENS F, SCHYNTS F, FARNIR F, POURCHET A, BARDIAU M, et al. Intraspecific bovine herpesvirus 1 recombinants carrying glycoprotein E deletion as a vaccine marker are virulent in cattle. J Gen Virol. 2006b;87:2149-54. [ Links ]
OIE -ORGANIZACIÓN MUNDIAL DE SANIDAD ANIMAL. Manual of Diagnostic Tests and Vaccines for Terrestrial Animals, 5a edición. OIE, París; 2004. p. 1178. [ Links ]
OMS-OPS. Centro Panamaricano de Zoonosis. Primer seminario sobre rabia paralítica de las Américas. Buenos Aires, Argentina; 1976. [ Links ]
PAPP Z, BABIUK LA, BACA-ESTRADA ME. The effect of pre-existing adenovirus-specific immunity on immune responses induced by recombinant adenovirus expressing glycoprotein D of bovine herpesvirus type 1. Vaccine. 1999;17:933-43. [ Links ]
PERALTA A, MOLINARI MP, TABOGA O. Baculovirus recombinantes como inmunogenos. Rev Argent Microbiol. 2006;38:74. [ Links ]
PERALTA A, MOLINARI P, CONTE-GRAND D, CALAMANTE, G, TABOGA O. A chimeric baculovirus displaying bovine herpesvirus-1 (BHV-1) glycoprotein D on its surface and their immunological properties. Appl Microbiol Biotechnol. 2007;75:407-14. [ Links ]
PETERS AR, THEVASAGAYAM SJ, WISEMAN A, SALT JS. Duration of immunity of a quadrivalent vaccine against respiratory diseases caused by BHV-1, PI3V, BVDV, and BRSV in experimentally infected calves. Prev Vet Med. 2004;66:63-77. [ Links ]
PIDONE CL, GALOSI CM, ETCHEVERRIGARAY EM. Herpesvirus Bovinos 1 y 5. Analecta Veterinaria. 1999;19,1/2:40-50. [ Links ]
PIEDRAHITA D, RAMÍREZ G, VERA V. Detección y caracterización por métodos moleculares de aislamientos colombianos de Herpesvirus bovino tipo 1. Rev Fac Med Vet Zoo. 2005;52:122-127. [ Links ]
PONTAROLLO RA, BABIUK LA, HECKER R, VAN DRUNEN LITTEL-VAN DEN HURK S. Augmentation of cellular immune responses to bovine herpesvirus-1 glycoprotein D by vaccination with CpG-enhanced plasmid vectors. J Gen Virol. 2002;83:2973-2981. [ Links ]
REDDY PS, IDAMAKANTI N, PYNE C, ZAKHARTCHOUK AN, GODSON DL, PAPP Z, et al. The immunogenicity and efficacy of replication-defective and replication -competent bovine adenovirus-3 expressing bovine herpesvirus-1 glycoprotein gD in cattle. Vet Immunol Immunopathol. 2000;76:257-68. [ Links ]
REDDY PS, IDAMAKANTI N, ZAKHARTCHOUK AN, BAXI MK, LEE JB, PYNE C, et al. Nucleotide sequence, genome organization and transcription map of bovine adenovirus type 3. J Virol. 1999;72:1394-1402. [ Links ]
SABIN AB, BOULGER LR. History of Sabin attenuated poliovirus vaccine. J Biol Stand. 1973;1:115-118. [ Links ]
SCHUDEL AA, CARRILLO BJ, WYLER R, METZLER AE. Infections of calves with antigenic variants of bovine herpesvirus 1 (BHV-1) and neurological disease. Zentralbl Veterinarmed B. 1986;33:303-10. [ Links ]
THIRY E, BUBLOT M, DUBUISSON J, PASTORET PP. Bovine herpesvirus-4 (BHV-4) infection in cattle. In G. Wittmann (ed.), Herpesvirus diseases of cattle, horses and pigs. Boston; 1989. p. 96-115. [ Links ]
TOUSSAINT JF, COEN L, LETELLIER C, DISPAS M, GILLET L, VANDERPLASSCHEN A, et al. Genetic immunisation of cattle against bovine herpesvirus 1: glycoprotein gD confers higher protection than glycoprotein gC or tegument protein VP8. Vet Res. 2005;36:529-544. [ Links ]
VAN DRUNEN LITTEL-VAN DEN HURK S. Rationale and perspectives on the success of vaccination against bovine herpesvirus-1. Vet Microbiol. 2006;113:275-282. [ Links ]
VAN DRUNEN LITTEL-VAN DEN HURK S, BRAUN RP, LEWIS PJ, KARVONEN BC, BACA-ESTRADA ME, SNIDER M, et al. Intradermal immunization with a bovine herpesvirus-1 DNA vaccine induces protective immunity in cattle. J Gen Virol. 1998;79:831-839. [ Links ]
VAN DRUNEN LITTEL-VAN DEN HURK S, GIFFORD GA, BABIUK LA. Epitope specificity of the protective immune response induced by individual bovine herpesvirus-1 glycoproteins. Vaccine. 1990;8:358-368. [ Links ]
VAN DRUNEN LITTEL-VAN DEN HURK S, SNIDER M, THOMPSON P, BABIUK LA. Strategies for induction of protective immunity to bovine herpesvirus-1 in newborn calves with maternal antibodies. Vaccine. 2008;26:3103-3111. [ Links ]
VAN DRUNEN LITTEL-VAN DEN HURK S, TIKOO SK, LIANG X, BABIUK LA. Bovine herpesvirus-1 vaccines. Immunol Cell Biol. 1993;71:405-420. [ Links ]
VAN OIRSCHOT JT, STRAVER PJ, VAN LIESHOUT JAH, QUAK J, WESTENBRINK F, VAN EXSEL ACA. A subclinical infection of bulls with bovine herpesvirus type 1 at an artificial insemination centre. Vet Rec. 1993;132:32-35. [ Links ]
WYLER R, ENGELS M, SCHWYZER M. Infectious Bovine Rhinotracheitis/ Vulvovaginitis (BHV1). In: Herpesvirus Diseases of Cattle, Horses and Pigs, Wittmann G., ed. Kluwer Academic Publishers, Boston, USA; 1989. p. 1-72. [ Links ]
WYLER R, ENGELS M, SCHWYZER M. Infectious Bovine Rhinotracheitis/ Vulvovaginitis (BHV1) Institute of Virology. University of Zurich; 1995. p. 1-55. [ Links ]
ZAKHARTCHOUK AN, PYNE C, MUTWIRI GK, PAPP Z, BACA-ESTRADA ME, et al. Mucosal immunization of calves with recombinant bovine adenovirus-3: induction of protective immunity to bovine herpesvirus-1. J Gen Virol. 1999;80:1263-1269. [ Links ]
ZAKHARTCHOUK AN, REDDY PS, BAXI M, BACA-ESTRADA ME, MEHTALI M, et al. Construction and characterization of E3-deleted bovine adenovirus type 3 expressing full-length and truncated form of bovine herpesvirus type 1 glycoprotein gD. Virology. 1998;250:220-229. [ Links ]
ZAMORANO P, TABOGA O, DOMINGUEZ M, ROMERA A, PUNTEL M, TAMI C, et al. BHV-1 DNA vaccination: effect of the adjuvant RN-205 on the modulation of the immune response in mice. Vaccine. 2002;20:21-22. [ Links ]
ZHU X, LETCHWORTH GJ. Mucosal and systemic immunity to bovine herpesvirus-1 glycoprotein D confer resistance to viral replication and latency in cattle. Vaccine. 1996;14:61-69. [ Links ]














