Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.14 no.2 Bogotá May/Aug. 2009
PRODUCCIÓN PRIMARIA EN UN LAGO DE AGUAS CLARAS DE LA AMAZONÍA COLOMBIANA (LAGO BOA)
Primary Production In A Clear Water Lake Of Colombian Amazon (Lake Boa)
GABRIEL ANTONIO PINILLA AGUDELO1
1Biólogo, Ph. D., Profesor Asociado. Universidad Nacional de Colombia, Sede Bogotá. Dirección para correspondencia: Avenida carrera 30 N.º 45-03, Edificio 421, oficina 205, Bogotá, Colombia. Fax: 57-1-316 53 10. Teléfono: 57-1-316 50 00, ext. 11319. gapinillaa@unal.edu.co
Presentado 8 de agosto de 2008, aceptado 19 de marzo de 2009, correcciones 15 de abril de 2009.
RESUMEN
Dentro de los aspectos funcionales de un sistema acuático uno de los más determinantes es la producción fitoplanctónica. En este trabajo se midió la producción primaria del fitoplancton (método del 14C) en un lago de aguas claras de la Amazonía colombiana, en diferentes momentos del ciclo hidrológico. La producción primaria osciló entre 0,6 y 2,3 g C m-2 d-1, valor este último medido durante la fase de aguas bajas. Estos resultados indican que la comunidad fitoplanctónica del lago Boa fluctúa desde condiciones de muy baja capacidad de asimilación de carbono inorgánico (aguas altas), hasta momentos en que este potencial se incrementa hasta cuatro veces (aguas bajas). Tales cambios drásticos obedecen a las fluctuaciones en la abundancia de microalgas, las que a su vez se presentan como respuesta a la variación trófica que tiene el lago durante el ciclo hidrológico. De esta manera, se pasa de condiciones oligotróficas en la época de inundación a un estado eutrófico cuando el sistema se desconecta del río en aguas bajas.
Palabras clave: producción primaria, aguas claras, fitoplancton, Amazonía colombiana.
ABSTRACT
Phytoplankton production is one of the most significant aspects in aquatic ecosystems. In this paper primary production of the phytoplankton community was measured (14C method) in a clear water lake in the Colombian Amazon region in different periods of the hydrological cycle. Primary production varied between 0.6 and 2.3 g C m-2 d-1, the last recorded at low water phase. Results show that the phytoplankton community of Lake Boa fluctuates from very low capacity of carbon assimilation during high water but increased four times during low water. The strong change in productivity follows the variation in algal abundance, which in turn reflects changes in water quality conditions during the hydrologic cycle. Thus, the lake passes from oligotrophic conditions during the flooding period to eutrophic conditions when the lake is disconnected from the river at low water phase.
Key words: primary production, clear waters, phytoplankton, Colombian Amazon.
INTRODUCCIÓN
En el estudio de los aspectos funcionales de un ambiente acuático es fundamental conocer la manera en que los organismos autótrofos captan la energía lumínica para incorporarla como energía química en el sistema. En la columna de agua esta función la cumplen las algas planctónicas. Dicha capacidad autotrófica se evalúa de diversas maneras, pero su estimación más directa se obtiene con la medición de la producción primaria. Las determinaciones de la producción primaria a través del 14C se han realizado en forma rutinaria por más de 50 años (Banse, 2002), y aunque presentan algunos inconvenientes constituyen la forma más acertada de medir la producción primaria del fitoplancton (Marra, 2003). La producción primaria es a su vez un reflejo del proceso fotosintético. Por ello, su medición permite obtener una idea clara de la capacidad de las comunidades fitoplanctónicas para asimilar carbono inorgánico y convertirlo en carbono orgánico.
En la región amazónica, las mediciones de producción primaria se han centrado principalmente en los ecosistemas de aguas y blancas y negras (Schmidt, 1976; Fisher y Parsley, 1979; Wissmar et al., 1981; Rai y Hill, 1984; Putz y Junk, 1997). La producción fitoplanctónica de las aguas claras ha sido menos estudiada (uno de los pocos trabajos es el de Schmidt, 1982), aunque existen algunas investigaciones recientes sobre la producción secundaria del bacterioplancton (Farjalla et al., 2002; Farjalla et al., 2006). Para la Amazonía colombiana, los trabajos sobre producción primaria son aún más escasos, en especial los relacionados con las aguas claras. En este documento se describen y analizan las variaciones en la producción primaria del fitoplancton del lago Boa, un sistema de aguas claras perteneciente a la cuenca media del río Caquetá, en relación con el ciclo hidrológico. Se quiso comprobar la hipótesis de que la producción primaria aumenta considerablemente en el periodo de aguas bajas, al contrario de lo que ocurre en la fase de aguas altas.
MATERIAL Y MÉTODOS
ÁREA DE ESTUDIO
El lago Boa es un sistema de aguas claras asociado al río o quebradón del Meta, que se localiza a 71°36’28’’ LW y 0°56’33’’ LS, en la cuenca media del río Caquetá, la cual se ubica en la región Amazónica colombiana (Pinilla, 2006a). Está conformado por un antiguo meandro (680 m de largo, 46 m de ancho medio y 2 a 6 m de profundidad), que se conecta al río Meta durante el pulso de inundación, el cual ocurre en los meses de mayo a julio. Durante la época de aguas bajas (octubre a marzo) el lago se aísla del río. Para las mediciones de producción primaria este lago se visitó cuatro veces (agosto de 1999 y enero, marzo y mayo de 2000), a fin de cubrir las principales fases del ciclo hidrológico: descenso, aguas bajas, ascenso y aguas altas.
MEDICIÓN DE LA PRODUCCIÓN PRIMARIA
Se empleó el método abreviado de asimilación de 14C modificado de la técnica de acidificación directa y burbujeo propuesta por Schindler y colaboradores (revisado por Dokulil, 1983; Bell y Kuparinen, 1984). Para ello se realizaron incubaciones de dos horas en la estación central del lago Boa, entre las diez de la mañana y las dos de la tarde. Se trabajó con muestras integradas de la columna de agua, las cuales se inocularon con NaH14CO3 (50 µ Ci mL-1). Las incubaciones se hicieron a profundidades del 100%, 58%, 18% y 6% de la radiación PAR incidente, la cual se midió con un fotómetro esférico Liquor®. De los frascos de incubación se tomaron tres réplicas por profundidad, de 5 mL cada una, las cuales se fijaron con 0,1 mL de HCl 5N en viales de 20 ml. Después de agitar los viales por 24 horas en el Laboratorio de Limnología de la Universidad Jorge Tadeo Lozano, a cada uno se le adicionaron 5 mL del coctel de centelleo Ecolume® (método de centelleo líquido). Las desintegraciones por minuto se determinaron en un contador de centelleo del Laboratorio de Bioquímica del Instituto Nacional de Salud.
ANÁLISIS DE DATOS
Los cálculos de producción primaria se realizaron de acuerdo a la metodología propuesta por Walsby, 1997. Los valores se obtuvieron en mg C m-3 h-1 y se graficaron en perfiles verticales, a partir de los cuales se estimó la producción integral por metro cuadrado (mg C m-2 h-1) mediante el método trapezoidal indicado por Lind, 1985. Estos resultados se extrapolaron a g C m-2 d-1 para las horas de luz según la metodología propuesta por el mismo autor (Lind, 1985).
RESULTADOS
Los datos de producción primaria del fitoplancton del lago Boa en mg C m-3 h-1 se presentan en la Tabla. 1 En ella se puede observar que los meses de aguas bajas (enero y marzo de 2000) mostraron la producción primaria más elevada, mientras que en aguas altas (mayo de 2000) esta variable fue notablemente menor. Durante la fase de descenso de la inundación (agosto de 1999) la producción tuvo valores intermedios.
En las figuras 1 y 2 se muestran las curvas de producción primaria en el perfil vertical de lago Boa. La primera figura se refiere a las etapas en que se presentaron volúmenes de agua elevados (fase de aguas en descenso Fig.1A; fase de aguas altas Fig. 1B). La segunda representa la situación contraria, es decir cuando el lago tuvo el volumen más bajo (mitad y final de la época seca, Fig. 2A y Fig. 2B respectivamente). Como se observa, la forma de las curvas de producción varió según la fase del ciclo hidrológico. Durante aguas bajas, cuando la concentración de fitoplancton fue alta en el lago (alcanzó 9,73 x 107 organismos L-1; Pinilla, 2006b) y la concentración de fósforo soluble llegó a 0,55 mg L-1 (Pinilla, 2005), la producción fue notablemente mayor. Luego, cuando se presentó el pulso de inundación y tanto la comunidad de algas como el fósforo soluble se redujeron (1,41 x 105 organismos L-1 y 0,15 mg L-1, respectivamente), se produjo un descenso notorio en la cantidad de carbono fijado. En todos los casos e independientemente de la fase hidrológica, la producción primaria decayó en aguas profundas, donde la luz fue menor (el coeficiente de extinción de la luz fue en promedio de 1,23; Pinilla, 2006b).
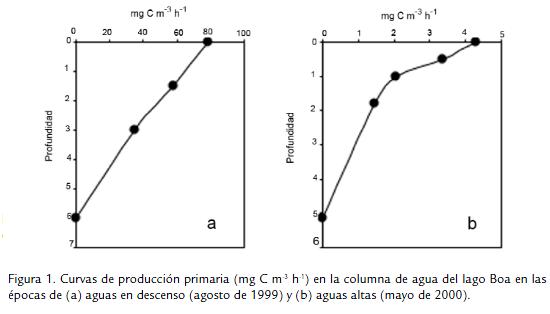
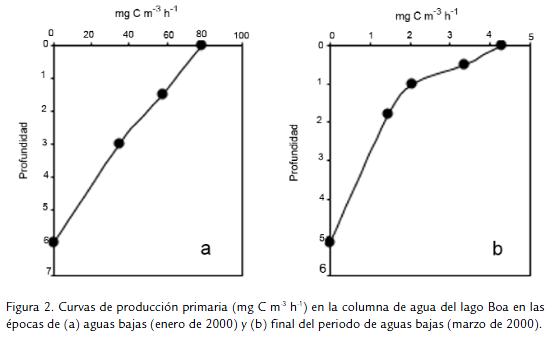
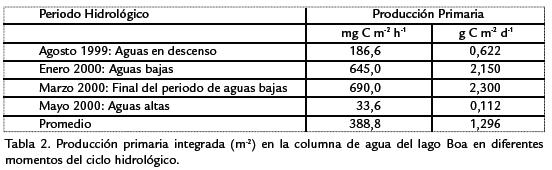
Los datos de producción primaria integrada en la columna de agua, tanto en horas como extrapolados a la duración del día (Tabla 2), refuerzan el hecho ya mencionado de que la comunidad fitoplanctónica del lago Boa tuvo una alta capacidad de fijar carbono inorgánico durante la fase de aguas bajas, es decir, en los meses secos cuando el lago se desconectó del río Meta.
DISCUSIÓN
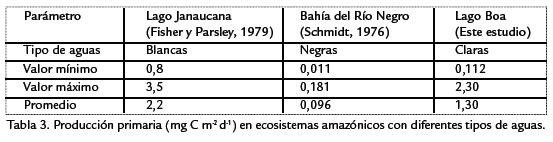
Fisher y Parsley, 1979, hallaron producciones primarias promedio de 2,2 g C m-2 d-1 (0,82 a 3,5 g C m-2 d-1) en el lago Janaucana (una várzea o lago alimentado por un río de aguas blancas), que los autores consideran altas. La producción primaria medida por Wissmar et al., 1981, en diferentes lagos de várzea de la cuenca amazónica fluctuó entre 0,06 y 82,66 mg C m-3 h-1, con promedio de 25,69 mg C m-3 h-1. En otros lagos de várzea de la región amazónica central Putz y Junk, 1997, registraron producciones fitoplanctónicas que oscilaron entre 2,15 g C m-3 d-1 en la época de aguas bajas y 0,32 g C m-3 d-1 en el período de ascenso de la inundación. Cuando la inundación empezó a descender en las várzeas la producción se incrementó (1,5 g C m-2 d-1), semejante a lo ocurrido en el lago Boa. Este incremento en aguas en descenso se debe al aumento en la transparencia. El valor medio anual señalado por Putz y Junk, 1997, para los lagos de várzea es de 0,8 g C m-2 d-1. En aguas negras (más oscuras y ácidas que las aguas claras) la producción medida por Schmidt, 1976, fue mucho menor (0,011 a 0,181 g C m-2 d-1) que la detectada en las várzeas. Rai y Hill, 1984, por su parte, midieron producciones que van desde 0,347 a 12,56 g C m-3 d-1, con promedio de 6,01g C m-3 d-1 en lagos amazónicos de diferentes tipos de aguas. Estos autores hallaron que en la mayoría de lagos de planos de inundación la producción primaria del fitoplancton solo es importante durante la fase de aguas bajas. Comparativamente con estos datos, la producción primaria medida en el lago Boa se encuentra dentro de los rangos registrados para la Amazonía. Sin embargo, tiende a ser menor que la de los lagos de várzea pero es más alta que la de las aguas negras (Tabla 3). Esto confirma que las aguas claras presentan buenas condiciones para el desarrollo y funcionamiento del fitoplancton, aunque en términos generales los nutrientes sean menores. Muy seguramente estos resultados se deben a la mayor transparencia y las condiciones menos ácidas de las aguas claras. En la mayoría de los casos, la producción primaria de los sistemas amazónicos depende fuertemente del pulso de inundación (Junk et al., 1989), fenómeno que produce una especie de "lavado" del ecosistema cuando los ríos entran a los lagos. Sin embargo, en algunas ocasiones la inundación puede significar la fertilización del lago y esto puede ocurrir cuando el río que lo alimenta es de aguas blancas.
Según Hill y Rai, 1982, la producción primaria en los ecosistemas acuáticos de la región amazónica es más alta de lo esperado, sin llegar a igualar la de lagos eutróficos de la zona templada. Los valores hallados en la cuenca del Amazonas (0,566 a 5,15 g C m-2 d-1 en promedio para los distintos tipos de lagos) son elevados si se tiene en cuenta que son ambientes oligotróficos con concentraciones de fitoplancton reducidas. Al parecer, las tasas de renovación del fitoplancton amazónico son extremadamente rápidas y permiten que el carbono se renueve completamente entre 0,3 y 1,7 días y que se produzcan de 3 a 5 toneladas de C ha-1 año-1 (Schmidt, 1976; Putz y Junk, 1997). Se podría pensar que esta alta velocidad de renovación de la comunidad fitoplanctónica es una adaptación a las fuertes fluctuaciones de estos ecosistemas pulsantes. La tasa de renovación alta y la producción relativamente elevada compensarían la baja abundancia de microalgas en las aguas amazónicas, de manera que su papel en la ecología de los ambientes acuáticos no podría verse solo desde la cantidad de células por litro, sino también desde la velocidad con que estas algas asimilan carbono y recirculan nutrientes. En otras palabras, la densidad puede ser baja, pero el flujo energético es muy alto.
En el lago Boa la producción primaria es relativamente baja en aguas altas pero se incrementa en forma importante en la fase de estiaje, por lo que se podría hipotetizar que en dicho periodo seco la asimilación de carbono por parte de la comunidad fitoplanctónica puede significar un aporte importante a la producción total del lago. De esta manera, las algas jugarían un papel importante en la captación de energía que queda disponible para los niveles tróficos superiores. Por el contrario, en la fase de inundación dicha producción primaria perdería importancia, por lo que el metabolismo del lago se tornaría de tipo heterotrófico.
Como lo señalan Rai y Hill, 1984, la producción primaria en los lagos amazónicos ocurre casi toda en los dos primeros metros. Este comportamiento se observó claramente en el lago Boa, en el cual incluso la producción primaria se concentró en el primer metro durante la fase de aguas bajas. La mayor producción primaria en aguas bajas estuvo asociada a una densidad fitoplanctónica más elevada en dicho periodo. A su vez, la elevada abundancia de algas ocasionó que los coeficientes de extinción de la luz fueran altos, es decir, provocó una atenuación más rápida de la energía lumínica con la profundidad. Los datos de producción primaria en el perfil vertical indican que dicha atenuación de luz, mayor en la época seca debido a la alta abundancia algal, sería un factor limitante para la fijación de carbono inorgánico por parte del fitoplancton en las capas cercanas al fondo.
Aún no es del todo claro si la producción íctica de la región amazónica proviene del fitoplancton o de otras plantas como las macrófitas y los árboles de la selva inundable (Junk et al., 1997). Las evidencias hasta ahora acopiadas indican que, al menos para algunas especies de peces, el carbono orgánico que asimilan proviene de las algas (revisado por Junk et al., 1997; Benedito-Cecilio et al., 2000; Leite et al., 2002; Thorp y Delong, 2002). Incluso en especies eminentemente frugívoras, como las del género Colossoma, un 35% del carbono asimilado se origina en el fitoplancton (Araujo-Lima et al., 1998). Sin embargo, la alta biomasa de peces en la cuenca amazónica no se podría explicar sólo a partir de la producción primaria del fitoplancton, por lo cual algunos autores han propuesto que el carbono orgánico acumulado en los peces se deriva de otras fuentes alternas, tales como el consumo directo de frutos, semillas e invertebrados de la selva que llegan a los ambientes acuáticos (Junk et al., 1997).
También se ha señalado que las vías detríticas, basadas en la degradación de materia orgánica por hongos y bacterias, constituyen otra ruta importante de carbono hacia los peces. En aguas claras Farjalla et al., 2002 y Farjalla et al., 2006, han demostrado la importancia de la producción del bacterioplancton, la cual depende en gran medida de la disponibilidad de fósforo soluble y de carbono orgánico disuelto. El carbono degradado detríticamente puede ser tanto alóctono como autóctono y puede provenir de plantas con metabolismo C4 (macrófitas, p.e.) o de plantas C3 (fitoplancton y plantas del bosque). Así por ejemplo, Waichman, 1996, sugiere que la fuente principal de carbono orgánico disuelto para el bacterioplancton heterotrófico del lago Calado es la comunidad de macrófitas, mientras que otros investigadores (Hedges et al., 1986; Hedges et al., 1994; Martinelli et al., 1999; Clapcott y Bunn, 2003) encuentran que la mayor parte de la materia orgánica particulada en los ríos amazónicos y en otros ríos subtropicales pertenece a plantas de metabolismo C3 (principalmente plantas de la selva). Oliveira et al., 2006, concluyen que en el lago Camaleão (de aguas blancas), las plantas terrestres C3 constituyen la principal fuente del carbono que se incorpora en la biomasa de los peces durante todo el ciclo hidrológico.
Estos datos indican que el carbono orgánico que proviene de fuentes distintas al fitoplancton, puede jugar un papel importante en la producción total de los sistemas acuáticos amazónicos. En el caso del lago Boa, la cantidad de materia orgánica producida por el fitoplancton se torna importante sólo en la época de aguas bajas, cuando la producción primaria de esta comunidad es suficientemente elevada. Muy posiblemente, la energía que llega a los peces en aguas en ascenso y aguas altas es alóctona y fluye principalmente por vías detríticas, a través del bucle microbiano. En conclusión, se puede decir que la producción primaria fitoplanctónica del lago Boa es relativamente alta en aguas bajas y reducida en aguas altas, lo que muestra directamente los cambios en el estado trófico del lago entre uno y otro periodo (oligotrófico en aguas altas y eutrófico en aguas bajas; Pinilla, 2006b), es decir, señala que este lago, como la mayoría de los lagos amazónicos, es distrófico.
AGRADECIMIENTOS
Este estudio se realizó dentro de un proyecto financiado por el Fondo de Investigaciones Científicas y Proyectos Especiales “Francisco José de Caldas” COLCIENCIAS y por la Universidad Jorge Tadeo Lozano (Contrato N° 1203-13-220-97). Agradezco al Laboratorio de Bioquímica del Instituto Nacional de Salud, donde se realizaron las mediciones de radiactividad, y al Dr. Richard Petersen (Portland State University) por su ayuda en el análisis de los datos de producción primaria.
BIBLIOGRAFÍA
ARAUJO-LIMA C, GOULDING M, FORSBERG B, VICTORIA R, MARTINELLI L. The economic value of the Amazonian flooded forest from a fisheries perspective. Verh Internat Verein Limnol. 1998;26:2177-2179. [ Links ]
BANSE K. Should we continue to measure 14C-uptake by phytoplankton for another 50 years?. Limnol. Oceanogr Bull. 2002;11(2):45-46. [ Links ]
BELL R, KUPARINEN J. Assessing phytoplankton and bacterioplankton production during early spring in Lake Erken, Sweden. Appl Environ Microb. 1984;48(6):1221-1230. [ Links ]
BENEDITO-CECILIO E, ARAUJO-LIMA C, FORSBERG B, BITTENCOURT L, MARTINELLI L. Carbon sources of Amazonian fishes. Fisheries Manag Ecol. 2000;7(4):305-315. [ Links ]
CLAPCOTT J, BUNN S. Can C4 plants contribute to aquatic food webs of subtropical streams?. Freshwater Biol. 2003;48(6):1105-1116. [ Links ]
DOKULIL M. Metodología de medición de fotosíntesis en fitoplancton. En: UNESCO (Programa sobre el Hombre y la Biósfera). Embalses, fotosíntesis y productividad primaria. Memorias Curso-taller: Universidad de Chile; 1983. p. 73-84. [ Links ]
FARJALLA V, ESTEVES F, BOZELLI R, ROLAND F. Nutrient limitation of bacterial production in clear water Amazonian ecosystems. Hydrobiologia. 2002;489:197-205. [ Links ]
FARJALLA V, AZEVEDO D, ESTEVES F, BOZELLI R, ROLAND F, ENRICHPRAST A. Influence of hydrological pulse on bacterial growth and DOC uptake in a clear-water Amazonian lake. Microb Ecol. 2006;52:334-344. [ Links ]
FISHER T, PARSLEY P. Amazon lakes: Water storage and nutrient stripping by algae. Limnol Oceanogr. 1979;24(3):547-553. [ Links ]
HEDGES J, CLARK W, QUAY P, RICHEY G, DEVOL A, SANTOS U. Compositions and fluxes of particulate organic material in the Amazon River. Limnol Oceanogr. 1986;31(4):717-738. [ Links ]
HEDGES J, COWIE G, RICHEY J, QUAY P, BENNER R, STROM M, FORSBERG B. Origins and processing of organic matter in the Amazon River as indicated by carbohydrates and amino acids. Limnol Oceanogr. 1994;39(4):743-761. [ Links ]
HILL G, RAI H. A preliminary characterization of the tropical lakes of the Central Amazon by comparision with polar and temperate systems. Arch Hydrobiol. 1982;96:97-111. [ Links ]
JUNK W, BAYLEY P, SPARKS R. The flood pulse concept in river-floodplain systems. - In: Dodge DP, editor. Proceedings of International Large River Symposium. Can Spec Publ Fish Aquat Sci; 1989. p. 110-127. [ Links ]
JUNK W, SOARES M, SAINT-PAUL U. The fish. En: Junk W, editor. The Central Amazon Floodplain: Ecology of a pulsing system. Berlin: Springer; 1997. p. 385-408. [ Links ]
LEITE R, ARAUJO-LIMA C, VICTORIA R, MARTINELLI L. Stable isotope analysis of energy sources for larvae of eight fish species form the Amazon floodplain. Ecol Freshw Fish. 2002;11(1):56-63. [ Links ]
LIND OT. Handbook of common methods in limnology. Dubuque and Iowa: Kendall-Hunt Publishing Company; 1985. [ Links ]
MARRA J. 14C-uptake by phytoplankton, now an in the future. Limnol. Oceanogr Bull. 2003;12(1):1-3. [ Links ]
MARTINELLI L, BALLESTER M, KRUSCHE A, VICTORIA R, DE CAMARGO P, BERNARDES M, et al. Landcover changes and δ13C composition of riverine particulate organic matter in the Piracicaba River Basin (southeast region of Brazil). Limnol Oceanogr. 1999;44(7):1826-1833. [ Links ]
OLIVEIRA A, SOARES M, MARTINELLI L, MOREIRA M. Carbon sources of fish in an Amazonian floodplain lake. Aquat Sci. 2006;68:229-238. [ Links ]
PINILLA GA. Ecología del fitoplancton en un lago amazónico de aguas claras (lago Boa, Caquetá medio, República de Colombia). Bogotá: Universidad Jorge Tadeo Lozano; 2005. [ Links ]
PINILLA GA. Evaluación de la eficiencia fotosintética del fitoplancton en un lago amazónico (lago Boa) y en un lago andino (lago Guatavita). Acta Amaz. 2006a;36(2):221-228. [ Links ]
PINILLA GA. Vertical distribution of phytoplankton in a clear water lake of Colombian Amazon (Lake Boa, Middle Caquetá). Hydrobiologia. 2006b;568(1):79-90. [ Links ]
PUTZ R, JUNK W. Phytoplankton and periphyton. En: Junk W, editor. The Central Amazon Floodplain: Ecology of a pulsing system. Berlin; Springer; 1997. p. 207-222. [ Links ]
RAI H, HILL G. Primary production in Amazonian aquatic ecosystems. En: Sioli H, editor. The Amazon: Limnology and landscape ecology of a mighty tropical river and its basin. The Hague: Junk Publ; 1984. p. 269-293. [ Links ]
SCHMIDT G. Primary production of phytoplankton in the three types of Amazonian waters. IV. On the primary productivity of phytoplankton in a bay of the lower Rio Negro (Amazonas, Brasil). Amazoniana. 1976;5(4):517-528. [ Links ]
SCHMIDT G. Primary production of phytoplankton in the three types of Amazonian waters. V. Some investigations on the phytoplankton and its primary productivity in the clear water of the lower Rio Tapajós (Pará, Brazil). Amazoniana. 1982;7(3):335-348. [ Links ]
THORP J, DELONG M. Dominance of autochthonous autotrophic carbon in food webs of heterotrophic rivers. Oikos. 2002;96(3):543-550. [ Links ]
WAICHMAN AV. Autotrophic carbon sources for heterotrophic bacterioplankton in a floodplain lake of central Amazon. Hydrobiologia. 1996;341:27-36. [ Links ]
WALSBY AE. Numerical integration of phytoplankton through depth and time in a water column. New Phytol. 1997;136:189-209. [ Links ]
WISSMAR R, RICHEY J, STALLARD R, EDMOND F. Plankton metabolism and carbon processes in the Amazon River, 175 tributaries and floodplain waters, Perú-Brazil, May-June 1977. Ecology. 1981;62(6):1622-1633. [ Links ]














