Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.14 no.3 Bogotá Sep./Dec. 2009
EFECTO DE LA INOCULACIÓN CON HONGOS FORMADORES DE MICORRIZAS ARBUSCULARES SOBRE PLÁNTULAS DE CAUCHO
Effects Of Inoculation With Arbuscular Mycorrhizal Fungi On Rubber Seedlings
TIFFANY SOSA RODRÍGUEZ1, Bióloga, M.Sc.; JIMENA SÁNCHEZ NIEVES2, M.Sc.; LUZ MARINA MELGAREJO3, Bióloga. Dr. Sc.; MARINA CARO MUÑOZ4, Ingeniera Agrónoma.
1Microbiología. Universidad Nacional de Colombia. Sede Bogotá. tsosar@unal.edu.co
2Microbiología. Profesora Asistente. Departamento de Biología. Universidad Nacional de Colombia. Sede Bogotá. jsanchezn@unal.edu.co.
3Profesora Asociada. Departamento de Biología. Universidad Nacional de Colombia. Sede Bogotá. lmmelgarejom@unal.edu.co
4Jefe Laboratorio Cultivo de tejidos Vegetales. Instituto de Biotecnología. Universidad Nacional de Colombia. Sede Bogotá. mcarom@unal.edu.co
Autor para correspondencia: jsanchezn@unal.edu.co, lmmelgarejom@unal.edu.co Carrera 30 Calle 45, Ciudad Universitaria, Edificio 421. Departamento de Biología, Laboratorio de Microbiología. Universidad Nacional de Colombia.
Presentado 19 de diciembre de 2008, aceptado 15 de abril de 2009, correcciones 18 de mayo de 2009.
RESUMEN
Hongos formadores de micorrizas arbusculares (HFMA) obtenidos a partir de suelos caucheros se multiplicaron en plantas de Lolium sp., con 73% de colonización radical luego de cuatro meses. Se obtuvieron siete morfotipos de HFMA, con los cuales se inocularon dos grupos de plántulas de Hevea brasiliensis: 1) producidas in vivo a partir de semilla; 2) producidas in vitro por rescate de embrión, para determinar efectos sobre mortalidad, crecimiento, micorrización y contenido de fósforo foliar. Los niveles de colonización por HFMA para las plántulas obtenidas in vitro e in vivo fueron de 12,6% y de 44,7%, respectivamente. La biomasa media total acumulada por las plántulas producidas in vitro fue de 0,41 y de 1,40 g por las procedentes del material in vivo, en comparación con los controles no inoculados, los cuales acumularon 0,37 y 0,40 g, respectivamente. El tratamiento con HFMA disminuyó la mortalidad en las plántulas obtenidas in vitro, aunque no tuvo un efecto significativo sobre el contenido de fósforo foliar. La respuesta del crecimiento de las plántulas inoculadas fue diferente dependiendo del origen del material vegetal y del tipo de inóculo (nativo o no nativo). La simbiosis entre HFMA y H. brasiliensis se desarrolló en condiciones controladas de crecimiento, aunque su avance dependió del estado de desarrollo de la plántula. No obstante, influyó en el crecimiento y en la disminución de la mortalidad de las plántulas, lo que abre la posibilidad de utilizarla como alternativa de inoculación en las fases tempranas de obtención del material vegetal.
Palabras clave: caucho natural, Hevea brasiliensis, micorrización.
ABSTRACT
Hevea brasiliensis rubber plants were inoculated with native arbuscular mycorrhizal fungi (AMF) during their greenhouse acclimatization. The AMF were multiplied for 4 months associated with Lolium sp. plants having 73% root colonization. Seven morphotypes were obtained. Two different groups of H. brasiliensis plants were inoculated with these morphotypes to determine AMF effect on mortality rate, growth, mycorrhization and leaf P content: those produced in vivo by seed germination and those produced in vitro by micropropagation. Plantlets produced in vitro returned 12.6% AMF colonization and 0.41 g accumulated dry biomass, whereas seedlings produced in vivo had 44.7% and 1.40 g, respectively, compared to control plants with no AMF inoculation which accumulated 0.37 g (in vitro) and 0.40 g (in vivo). AMF inoculation reduced the plants’ mortality rate regarding in vitro produced material; however, it did not influence foliar P content. Inoculated plants’ growth response was different, depending on plant material and the kind of inoculum used (native or foreign). Symbiosis developed between AMF and H. brasiliensis in controlled growth conditions although its advance was limited by the plants’ growth stage. Nevertheless, such association influenced inoculated plants’ biomass accumulation and decreased their mortality rate and could be used as an alternative treatment during the earliest stages of H. brasiliensis plantlet production.
Key words: Natural rubber, Hevea brasiliensis, mycorrhization.
INTRODUCCIÓN
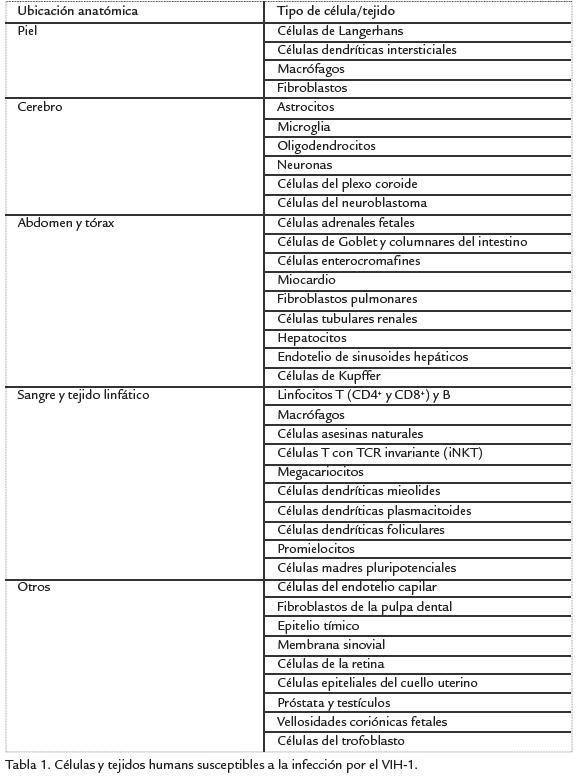
Durante los inicios de la industria del caucho natural (Hevea brasiliensis) se utilizaron semillas para el establecimiento de las plantaciones, pero actualmente esta técnica se encuentra en desuso y en su lugar se realiza propagación vegetativa de materiales clonales por injertación para obtener el material vegetal de partida. Por este método, semillas sexuales de origen parental generalmente desconocido (patrones) son recolectadas y plantadas en un vivero durante al menos seis meses para luego ser injertadas con una yema de seis a 12 semanas de edad procedente de un jardín clonal (Udayakumara y Seneviratne, 2005). Análogamente, se ha investigado la multiplicación vegetativa in vitro de H. brasiliensis por técnicas como la embriogénesis somática o la micropropagación, como alternativas que presentan ventajas respecto a la injertación tradicional, como la producción masiva de clones específicos de características uniformes, de alta calidad y libres de patógenos, y la producción permanente independiente del clima o de las estaciones (Carron et ál., 1989; Pospíšilová et ál., 1999). Es importante resaltar que cualquiera que sea la técnica de utilizada, las plántulas producidas deben pasar por un periodo de aclimatación en invernadero o vivero antes de establecerlas definitivamente en la plantación. En numerosos trabajos se ha reportado que durante la aclimatación se presentan altas tasas de mortalidad, en especial en las plántulas producidas in vitro después de haber sido transferidas a condiciones ex vitro, debido a factores como temperatura, baja humedad relativa y aumento en la radiación lumínica, que limitan la adaptación del material al estrés producido por el trasplante (Jain et ál., 1995; Majada y Sánchez, 2004; Kapoor et ál., 2008).
En Colombia, las áreas sembradas con caucho natural han tenido un aumento importante en los últimos cinco años, especialmente en departamentos como Antioquia, Córdoba, Cundinamarca, Meta y Caquetá (Santacruz, 2008). Dichas áreas seguirán en aumento debido a tres razones principales: (1) el caucho natural se está utilizando como un cultivo alternativo para la sustitución de cultivos ilícitos (ASOHECA, 2008) (2) la producción interna es deficiente, ya que se importa el 97% de la demanda (3) existen incentivos gubernamentales como la Ley de Incentivo Forestal que reconoce parte de las inversiones realizadas en dicho cultivo (FEDECAUCHO, 2008).
Para que la producción de caucho natural en Colombia crezca de manera competitiva sustituyendo las importaciones y proyectándose al mercado externo, es necesario mejorar la selección de los clones a sembrar y tecnificar el manejo de las plantaciones (Espinal et ál., 2005). Con este objetivo, ciertas investigaciones colombianas han desarrollado protocolos de producción in vitro de plántulas de caucho natural (Caro y colaboradores, comunicación personal), una tecnología compleja que ha sido investigada en otros países interesados en la industria heveícola como Francia, Malasia e India (Carron et ál., 1995; Malaysian rubber board, 2002; Jayashree et ál., 2003) y que se encuentra actualmente en estudio, especialmente con el fin de generar plántulas de caucho genéticamente transformadas (Montoro et ál., 2008).
A pesar de las ventajas asociadas la producción de material vegetal in vitro, ésta debe estar acompañada de estrategias que permitan garantizar el mantenimiento de dicho material en las fases posteriores del proceso, como el control de las condiciones ambientales en la fase de aclimatación y/o la asociación con microorganismos benéficos como los hongos formadores de micorrizas arbusculares (en adelante, HFMA). La segunda estrategia se ha implementado con éxito para reducir el estrés durante el transplante y garantizar un crecimiento rápido tanto del material vegetal propagado en condiciones de vivero o invernadero, como en plantas originadas en cultivo in vitro, debido a los efectos benéficos de esta asociación sobre la nutrición y el crecimiento de las plantas (Sbrana et ál., 1994; Elmeskaoui et ál., 1995; Sharma et ál., 1996; Siqueira et ál., 1998; Duponnois y Plenchette, 2003; Kapoor et ál., 2008).
En este contexto, se buscó responder la siguiente pregunta de investigación: ¿cómo afecta la asociación con hongos formadores de micorrizas arbusculares el crecimiento de las plántulas de caucho durante el proceso de aclimatación? Para responderla, se estudió el efecto de la inoculación con HFMA sobre la mortalidad, el crecimiento vegetativo y la cantidad de fósforo en el tejido foliar de plántulas de H. brasiliensis durante la fase de aclimatación en condiciones controladas de invernadero. Para su evaluación se realizaron ensayos de inoculación de micorrizas a plántulas de caucho natural con origen distinto: patrones procedentes de semilla germinada en sustrato artificial o patrones obtenidos in vitro por rescate de embrión, como un primer acercamiento para establecer el impacto de la inoculación sobre la supervivencia de futuros materiales de H. brasiliensis producidos por técnicas de cultivo in vitro.
MATERIALES Y MÉTODOS
OBTENCIÓN Y MULTIPLICACIÓN DE MORFOTIPOS DE HFMA NATIVOS
Los HFMA se obtuvieron a partir de muestras de suelo rizosférico tomadas en los primeros 0 - 10 cm de profundidad en los jardines clonales de cultivos de caucho de la empresa cauchera MAVALLE S.A. ubicados en el municipio de Remolino (Meta, Colombia, lat (DMS) 4º17’29N; long (DMS) 72º35’54W) a 178 msnm y temperatura diaria entre 24 y 30 ºC (Falling Rain Genomics, 2004).
El muestreo se realizó en jardines de nueve años de edad sembrados con los clones RRIM 600 (Malasia), GT1 (Gondang Tapen Estate INDONESIA) y AVROS 1581 (Sumatra). Posteriormente, se realizó la caracterización físico-química y del estado de la colonización con HFMA del suelo muestreado, mediante procedimientos de clareo y tinción de las raíces y cuantificación del porcentaje de colonización, de acuerdo a las metodologías de Vierheiling et ál., 1998, y Allen y Allen, 1980. Así mismo, se realizó la extracción de esporas por tamizado, decantación y centrifugación en gradiente de sacarosa al 70% de acuerdo a los procedimientos implementados por Gerdemann y Nicolson, 1963, y modificados por Sieverding, 1983. Posteriormente se cuantificó el número de esporas de HFMA en 100 g de suelo seco.
Otra parte de la muestra de suelo se colocó en macetas (200 g por maceta), con el fin de multiplicar y mantener el inóculo para experimentos en invernadero, ya que por lo general las poblaciones naturales por unidad de área de HFMA son bajas y dependen de diversos factores ambientales que no pueden ser controlados al momento del muestreo. Esta multiplicación se realizó en plantas “trampa” de pasto Ryegrass (Lolium sp.), que se caracterizan por presentar un alto nivel de micotrofía (Cano, 1996).
Las plantas trampa se mantuvieron en macetas de 1 kg llenas con sustrato de turba y arena de río (1:2; w/w) esterilizada empleando autoclave (15 minutos, a 15 psi, dos días consecutivos). Las plantas trampa se mantuvieron expuestas a fotoperiodo natural y fueron regadas cada tercer día manteniendo el sustrato cercano a capacidad de campo. Después de cuatro a seis meses de cultivo se suspendió el crecimiento de las plantas trampa en las macetas y se dejó secar el sustrato durante dos días a temperatura ambiente. Posteriormente el sustrato fue evaluado para determinar el estado de la micorrización con HFMA y la cuantificación de esporas presentes, y se almacenó para su posterior utilización como inóculo. Las esporas obtenidas se colocaron en montajes semipermanentes de polivinil lactoglicerol y fueron agrupadas de acuerdo a sus características morfológicas observadas con microscopio de luz a 100 y 400X siguiendo las claves del INVAM, 2008.
OBTENCIÓN DE MATERIAL VEGETAL
Las plántulas producidas in vivo fueron obtenidas a partir de semillas desinfectadas superficialmente (inmersión en hipoclorito de sodio al 5% por 15 minutos y lavado con agua estéril) que se sembraron en bandejas germinadoras usando como sustrato aserrín esterilizado. Un mes más tarde, cuando las plántulas alcanzaron una altura media de 20 cm, y un piso foliar, fueron trasplantadas de las bandejas a macetas de 1 kg llenas con sustrato constituido por una mezcla de turba y arena de río (1:2; w:w) previamente esterilizada con autoclave (15 minutos, a 15 psi, dos días consecutivos). Una semana después del trasplante, el primer piso foliar de las plántulas fue eliminado para simular el tratamiento que sufren las plántulas durante el proceso de injertación. Toda manipulación y mantenimiento de este material se realizó en condiciones de invernadero. Las plántulas producidas in vitro se obtuvieron por rescate de embrión de semillas de patrones de H. brasiliensis, una metodología común en diferentes prácticas de micropropagación de plantas que poseen semillas recalcitrantes de corta viabilidad (Moreno et ál., 2006). El rescate de embriones se realizó a partir de las semillas previamente desinfectadas con hipoclorito de sodio al 15% por 15 minutos y lavadas con agua estéril. El embrión y parte de cotiledón se colocaron a crecer sobre medio Murashige y Skoog, 1962, modificado con los macro y microelementos a la mitad de la concentración original. Las plántulas fueron mantenidas en un cuarto de cultivo con fotoperiodo de 14 horas y humedad relativa (HR) de 60%, temperatura media de 23 ºC e intensidad lumínica media de 880 lux (Luxómetro WWR Scientific 21800-014). Después de tres meses de crecimiento in vitro, cuando las plantas alcanzaban una altura media de 15 cm, se realizó la fase de pre-aclimatación, durante la cual se realizó una apertura gradual de los frascos. Una semana más tarde, se realizó el transplante de las plantas a macetas de 1 kg, utilizando un sustrato con las mismas características descritas anteriormente. Una vez transplantadas, estas plántulas se mantuvieron en el cuarto de cultivo durante una semana, al cabo de la cual se colocaron en condiciones de invernadero.
INOCULACIÓN CON HFMA Y ENSAYOS EN INVERNADERO
Los ensayos se realizaron en un invernadero (laboratorio de Cultivo de Tejidos Vegetales del Instituto de Biotecnología de la Universidad Nacional de Colombia - Sede Bogotá), donde las plántulas se mantuvieron con fotoperiodo natural, siendo regadas cada tercer día manteniendo el sustrato a capacidad de campo.
Las plantas producidas in vitro se mantuvieron bajo una cubierta de polisombra, registrándose condiciones de iluminación de 725 lux en la mañana (8:00 - 9:00), 673 lux al medio día (11:00 - 12:00) y 92,4 lux en las horas de la tarde (17:00 - 18:00; Luxómetro WWR Scientific 21800-014). La polisombra se utilizó para mantener condiciones de iluminación similares a las del cuarto de cultivo in vitro. Para mantener una humedad relativa mayor a la del ambiente y evitar otros factores de estrés, se colocaron cubiertas plásticas trasparentes alrededor de las plántulas (HR 70%). La temperatura y humedad relativa fueron medidas con un Termohigrómetro HAENNI ®, encontrando que la temperatura máxima promedio estuvo comprendida entre los 25 y los 30 ºC, mientras que la temperatura mínima estuvo entre los 15 y los 19 ºC. La humedad relativa máxima media fue de 90% (alcanzada a las cuatro de la mañana), mientras que el valor mínimo medio fue de 45% (alcanzado al medio día).
La inoculación con HFMA sobre plántulas de caucho producidas ex vitro e in vitro se realizó al momento del transplante a las macetas de 1 kg. Los tratamientos aplicados fueron: 1. (CT): plántulas control, no inoculadas. 2. (SF): plántulas inoculadas con un producto comercial de micorrizas marca MICORRIZAFER® (inóculo no nativo -control positivo). 3. (AM): plántulas inoculadas con los HFMA obtenidos a partir de suelos de cultivo de. caucho natural, multiplicados en Lolium sp. y cuyo inóculo estaba conformado por esporas, micelio externo y fragmentos de raíz micorrizados (inóculo nativo). El inóculo de los tratamientos SF y AM se pesó y cuantificó para adicionar 200 esporas por plántula y se colocó alrededor de las raíces (Adaptado a partir de Ridgway et ál., 2006). Los montajes experimentales de plántulas generadas in vivo e in vitro se mantuvieron por cuatro y tres meses respectivamente. Al final del experimento se cosecharon separando el vástago de la raíz. Las variables medidas fueron: crecimiento vegetativo (biomasa fresca y seca de hojas, tallo y raíces, área foliar), mortalidad (% de mortalidad y % de reducción de la mortalidad) y micorrización (porcentaje de colonización en raíces y contenido de esporas en 100 g de suelo). Adicionalmente, se tomaron muestras de sustrato y de hojas en cada tratamiento para realizar análisis de contenido de fósforo. El contenido de P soluble en el sustrato fue determinado por colorimetría, mientras que el contenido de P total en las hojas se obtuvo por digestión vía húmeda y posterior cuantificación por el método del lactato (Laboratorio de fertilidad de suelos CIAA, 2008).
A partir de las variables medidas en las plántulas se realizaron las siguientes relaciones: biomasa seca/biomasa fresca; biomasa seca de raíz/biomasa seca de tallo; porcentaje de mortalidad: (plantas vivas al final del experimento x 100%) / plantas sembradas al inicio del experimento; porcentaje de reducción de la mortalidad: 100 % -[(% mortalidad observado en el tratamiento x 100) / % mortalidad observado en el control].
DISEÑO EXPERIMENTAL Y ANÁLISIS ESTADÍSTICO
Se utilizó un diseño de control de error completamente al azar (DCA) y un diseño de tratamiento a una vía con 5 repeticiones por tratamiento. El factor a evaluar fue el tipo de inóculo de HFMA aplicado (nativo, no nativo, sin HFMA). Se realizaron pruebas para verificar que cumplieran los supuestos del análisis de varianza -ANDEVA, y se evaluó la influencia o no del factor establecido en cada tratamiento. Posteriormente se realizó la prueba de comparaciones múltiples de Fisher (LSD) para verificar si el factor considerado presentaba un efecto estadísticamente significativo en alguno(s) de los tratamientos. Para las variables que no presentaron diferencia estadísticamente significativa luego de realizar el ANDEVA, se realizó una confirmación del análisis con la prueba no paramétrica de Kruskal-Wallis. Los análisis se realizaron con el programa MINITAB 14®.
RESULTADOS Y DISCUSIÓN
HFMA NATIVOS DE PLANTACIONES DE CAUCHO NATURAL
La simbiosis con HFMA en campo se encontró bien desarrollada, presentando todas las estructuras típicas de la colonización (Tabla 1). Los porcentajes de colonización radical con HFMA no presentaron diferencias estadísticamente significativas (α=0,05); mientras que el contenido de esporas por gramo de suelo seco fue significativamente mayor para los suelos asociados al clon RRIM 600. En este suelo, que fue escogido para realizar la multiplicación y posterior inoculación sobre las plántulas, se encontraron al menos 11 morfotipos de HFMA.
Valores promedios obtenidos (n=5) con la desviación estándar entre paréntesis. Para el porcentaje de colonización total (%) y el contenido de esporas, las medias acompañadas por la misma letra no presentan una diferencia estadísticamente significativa entre ellas (prueba de comparación múltiple de Fisher con P < 0,05). El contenido deesporas se cuantificó en 100 g de suelo seco. Los porcentajes de colonización totalcuantificados fueron mayores que los reportados por Schwob et ál., 1999, en plantacionesproductoras de Brasil, en donde se reportaron valores entre 40 y 50% para cuatro decinco lugares muestreados. Los autores indicaron que dichos valores estuvieronestrechamente relacionados con la presencia de Meloidogyne exigua,nemátodo que tambiénse desarrolla al interior de los tejidos radicales. No obstante, en uno de los sitios muestreados en donde la presencia del nemátodo fue insignificante, el porcentaje de colonización radical reportado (80%) fue similar al encontrado en el presente trabajo.
Posteriormente, luego de multiplicación en macetas del suelo colectado en campo en los jardines de RRIM 600, se encontraron niveles de colonizaciónradical del 73,3 (4,34)% en plantas trampa de Loliumsp. El alto valor de colonizaciónencontrado en esta planta demostró que los morfotipos multiplicados presentaron unalto potencial de colonización de planta hospedera. El contenido de esporas en el sustrato de las plantas trampa (4,81 esporas por gramo de suelo), fue menor al encontrado en campo. En este sustrato artificial se encontraron siete morfotipos de HFMAque produjeron esporas, correspondiente al 64% de los morfotipos presentes en el suelo de campo.
La disminución de los morfotipos multiplicados con respecto a los morfotiposencontrados en campo puede estar relacionada con el cambio que ocurre bajo lascondiciones de crecimiento en la rizósfera: en el campo, los hongos hacen parte de unmicroecosistema natural complejo al que se encuentran adaptados y en donde interactúan con otros microorganismos rizosféricos, mientras que en el sustrato artificialde multiplicación en maceta, los HFMA encuentran condiciones físicas, químicas ybiológicas distintas, debido a que este sustrato se esteriliza para poder observar el efectodiferencial de dichos hongos sobre las plantas inoculadas (Andrade et ál., 1998a;Andrade et ál., 1998b), se sabe que el uso de un sustrato esterilizado puede actuar comoun elemento de selección artificial sobre los HFMA (Kapoor et ál., 2008). Las esporasencontradas tanto en muestras de suelo cauchero como en el inóculo comercialpresentaron características morfológicas típicas del género Glomus(forma globosa, hifasuspensora de forma cilíndrica a acampanada, ocasionalmente con una constricción enel punto de contacto con la espora, con continuidad entre las capas de la pared), deacuerdo a las claves del INVAM, 2008.
EVALUACIÓN DEL EFECTO DE LA INOCULACIÓN CON HFMA SOBRE PLÁNTULAS DE CAUCHO (H. BRASILIENSIS) PRODUCIDAS EX VITRO
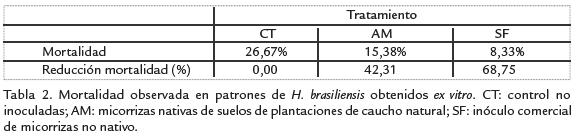
Las plántulas no inoculadas presentaron un porcentaje de mortalidad mayor con respectoa las tratadas con HFMA (Tabla 2), esta respuesta se considera buen indicio del efectobenéfico del tratamiento con HFMA sobre el material de H. brasiliensisproducido porgerminación de semillas en condiciones controladas (invernadero). La mayor reducciónde la mortalidad se observó en el tratamiento con micorrizas no nativas (SF; Tabla 2).Esta respuesta encontrada demuestra la necesidad de evaluar con mayor detalle enposteriores estudios la influencia del origen del inóculo de HFMA. En este caso, utilizarun inóculo de HFMA no nativo compuesto por morfotipos cuya eficiencia paraestablecer una simbiosis exitosa ya ha sido evaluada (seleccionado), mostró una mejorrespuesta con respecto a utilizar un inóculo nativo (no seleccionado).
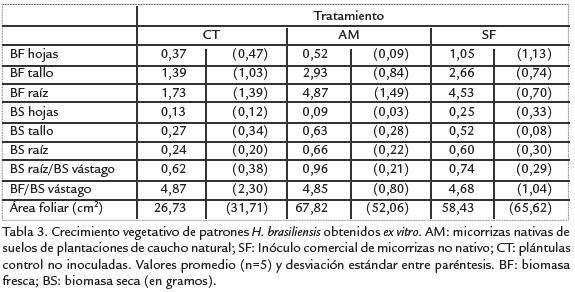
Al cuantificar el efecto de la inoculación sobre el crecimiento de las plántulas procedentes de semilla se encontró una respuesta positiva pero discreta de las diferentesvariables cuantificadas, en las que se observó diferencia numérica entre los tratamientoscon HFMA y el control (Tabla 3), puesto que hubo una respuesta de crecimiento mayoren las plantas inoculadas (AM y SF) con respecto al control no inoculado (CT). Estarespuesta del crecimiento de los patrones es comparable con la encontrada por Ikramet ál., 1993, en inoculaciones realizadas en condiciones de invernadero durante 5,5meses con diferentes especies de HFMA no nativas, en donde el incremento en labiomasa acumulada en los vástagos no fue significativo para todas las especies dehongo utilizadas. De acuerdo a los autores, las diferencias en la efectividad de los HFMApara estimular el crecimiento de los vástagos pueden deberse a diferencias entre losaislamientos y en cuanto al tiempo que les toma establecer una colonización temprana. La biomasa seca de las raíces presentó una diferencia notable, ya que los dos tratamientosrealizados con HFMA tuvieron una biomasa seca de raíz significativamente mayor a lamedida en el tratamiento control. En diferentes publicaciones se ha reportando que eltratamiento con HFMA favorece el desarrollo de un sistema radical más fuerte porqueincrementa la intensidad de enraizamiento y el área superficial de las raíces existentes(revisado por Kapoor et ál., 2008). De hecho, se ha determinado que la colonización dela raíz puede alterar la morfología puesto que se ha observado que las raíces colonizadasestán altamente ramificadas y pueden tener diámetros mayores.
Con respecto a la relación entre biomasa fresca y seca, no se encontró un efecto estadísticamente significativo de los HFMA en la acumulación de fotosintatos en el vástago delas plántulas, que se vería reflejada en una disminución en la relación BF/BS si los HFMAestimularan una mayor acumulación de materia seca en la plántula. Schwob et ál., 1998,38 Artícalcularon una relación semejante pero solamente encontraron una influencia moderadade la inoculación con HFMA. En contraste, se encontró un aumento en el valor de BSraíz/BS vástago en el tratamiento con micorrizas nativas (AM), relacionada con el aumento de materia asignada en las raíces descrito anteriormente. Al igual que para elcaso de la biomasa acumulada, las plántulas del control presentaron un área foliarmenor a las plántulas inoculadas (Tabla 3).
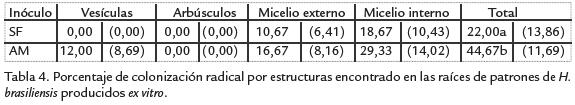
A diferencia del porcentaje de colonización (Tabla 4), el contenido de esporas por gramode suelo seco no presentó diferencias significativas entre los tratamientos aplicados: enel sustrato de las plantas inoculadas con micorrizas nativas de suelos caucheros (AM) seencontró un promedio de 0,47±0,11 esporas/g de suelo seco en tanto que en el sustratode las que se inocularon con el inóculo comercial (SF) se encontró un promedio de0,49±0,14 esporas/g de suelo seco. Por su parte, este contenido de esporas en el sustratofue menor al contenido medio de esporas encontrado bajo condiciones de campo ensuelos caucheros (Tabla 1).
Se muestran los valores obtenidos en porcentaje de colonización con la desviaciónestándar entre paréntesis. Los valores en la misma columna acompañados por letrasdiferentes presentaron una diferencia estadísticamente significativa de acuerdo al testde Fisher (α=0,05)
Luego de cuatro meses de tratamiento se obtuvieron niveles de colonización radical enlos patrones menores a los encontrados en campo. No obstante, dichos valores fueronsimilares a los encontrados en experimentos de inoculación realizados en Brasil concepas de Glomus mosseaesobre plántulas de H. brasiliensisen condiciones controladas de fitotrón (Schwob et ál., 1998). En relación a las estructuras de colonización encontradas en las raíces (Tabla 4), se encontró una colonización poco desarrollada, ya que seobservó micelio intrarradical y extrarradical, pero no se observaron arbúsculos madurosy las vesículas fueron escasas (solamente se observaron en el tratamiento AM).
De otro lado, se encontró una mayor cantidad de fósforo soluble en el sustrato de lasplántulas control (CT) que no fueron inoculadas (Tabla 5), en comparación con los tratamientos con HFMA nativos (AM) y con HFMA no nativos (SF). Así mismo, la cantidad defósforo soluble en el sustrato al final del experimento fue mayor en el tratamiento con AMcon respecto al tratamiento con SF. Con respecto al contenido de P en hojas, se encontróun valor de 0,4% en los tres tratamientos. Esta ausencia de diferencia entre la cantidadde P en las hojas de las plantas no inoculadas con respecto a las inoculadas sugiere almenos dos situaciones: en primer lugar, es posible que las condiciones de medición de esteparámetro deben controlarse de manera más rigurosa que permita detectar algunadiferencia (como aumentar el tiempo de exposición al tratamiento o usar otro método decuantificación de P foliar); en segundo lugar, es posible los morfotipos de HFMAinoculados evaluados no influyan este parámetro en particular (pueden estar influenciadoel transporte de otro elemento nutritivo o bien otra propiedad), tal como fue sugerido porIkram et ál.,1992.

EVALUACIÓN DEL EFECTO DE LA INOCULACIÓN CON HFMA SOBRE PLÁNTULAS DE CAUCHO (H. BRASILIENSIS) PRODUCIDAS IN VITRO
Las plántulas producidas in vitro se aclimataron 100% a las condiciones ex vitro.Sin embargo, al cuantificar el efecto de la inoculación sobre su crecimiento se encontró que solo algunas variables del crecimiento vegetativo (biomasa seca total, diámetro deltallo, área foliar) cuantificadas mostraron una diferencia numérica (pero no estadísticamente significativa) entre el tratamiento con HFMA no nativos (SF) y el control (Tabla 6). Por su parte, la única variable cuantificada que presentó un valor mayor en eltratamiento con HFMA nativos fue el diámetro del tallo. Ikram et ál., (1993) reportaronuna respuesta similar en el crecimiento de las plántulas de H. brasiliensisdespués de lainoculación con HFMA, en donde las plántulas inoculadas mostraron un crecimientomayor (aunque no estadísticamente significativo) que los controles.
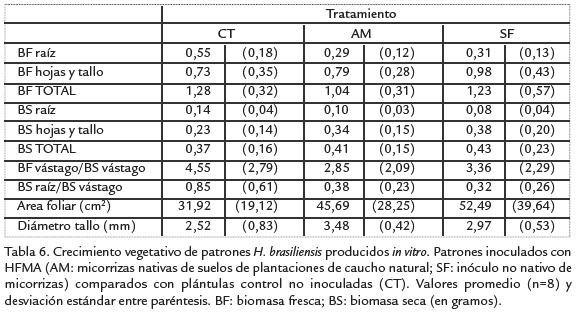
Por su parte, en este grupo de plántulas se observó una respuesta de la biomasa seca delas raíces distinta a la observada en los patrones producidos in vivo, ya que las plántulasdel control presentaron una biomasa mayor, diferencia que fue estadísticamente significativa con respecto a los tratamientos con HFMA. Este resultado es contrastante, debido a que la mayoría de ensayos de inoculación reportan un incremento en la biomasade las raíces de plantas micorrizadas (revisado por Kapoor et ál., 2008). En relación a los cocientes entre biomasa fresca y seca, se determinó que al tiempo de la cuantificaciónno se encontró un efecto estadísticamente significativo de los HFMA en la acumulaciónde biomasa en el vástago de las plántulas (Tabla 6), lo que indica que la asignación demateria seca en el vástago no resultó favorecida por el tratamiento con HFMA. A pesarde la ausencia de una diferencia estadística, se resalta el hecho que al igual que para elcaso de la biomasa acumulada, las plántulas del control presentaron valores de diámetrode tallo, longitud de vástago y área foliar menores a las plántulas inoculadas.
De otro lado, tres meses después del transplante, el porcentaje de colonización radical sípresentó diferencias significativas entre los tratamientos aplicados: en las raíces de lasplantas inoculadas con micorrizas nativas de suelos caucheros (AM) se encontró un porcentaje de colonización total significativamente menor al encontrado en las raíces deplantas colonizadas con HFMA no nativos. Adicionalmente, se encontró colonizaciónpor micelio intrarradical y micelio extrarradical (Tabla 7), pero no se observaron otrasestructuras, lo cual representa un indicio de colonización poco desarrollada. Por su parte,el contenido de esporas en 100 g de sustrato de los tratamientos con HFMA no presentó diferencias.

Se muestran los valores obtenidos en porcentaje de colonización con la desviaciónestándar entre paréntesis. Los valores en la misma columna acompañados por letrasdiferentes presentaron una diferencia estadísticamente significativa de acuerdo al testde Fisher (α=0,05). El contenido de esporas se cuantificó en 100 gramos de suelo seco.
La cantidad de fósforo soluble en el sustrato de las plántulas control (CT), en comparación con los tratamientos con HFMA nativos (AM) y con HFMA no nativos (SF), asícomo la cantidad de fósforo disponible al final del experimento y el contenido de P enhojas mostraron el mismo comportamiento que en el experimento con materialgenerado in vivo (Tabla 8). La tendencia observada en ambos grupos de plantas puededeberse al efecto del micelio externo de los hongos, que estaría realizando una tomaactiva del P disponible en solución. De hecho, se pudo confirmar la presencia de micelioextrarradical en los tratamientos con micorrizas (Tabla 4; Tabla 7) y se observó que esla parte del micelio del HFMA que se encontró con mayor abundancia en las muestras.

La toma activa de P desde la solución del suelo ha sido descrita por Jakobsen, 1992,quién realizó un experimento de compartimentalización en combinación con isótoposde P trazadores para medir la contribución relativa de las raíces y las hifas a la toma deP en arveja (Pisum sativum) creciendo en campo en un suelo fumigado con o sin inoculación de HFMA, encontrando que las raíces micorrizadas y en especial sus hifas externas,tomaron más P que las raíces no micorrizadas.
Se ha documentado también que los incrementos en la producción de hifas extrarradicales pueden darse en cantidades limitantes de P soluble en el sustrato como una respuesta del hongo para mejorar el acceso a dicho elemento (Janos, 2007). En este trabajo, estasituación se presentó con ambos tipos de material vegetal (generado in vivoo in vitro), endonde la cantidad de P soluble en el sustrato cuantificada al final del experimento estuvoen el rango de 1,6 a 4,6 ppm y 3,4 a 7,8 ppm respectivamente (Tabla 5; Tabla 8). Es importante señalar aquí que no se realizó aplicación alguna de solución nutritiva durante losexperimentos, y que la concentración inicial de fósforo en el sustrato fue de 7,23 ppm.
En cuanto al contenido de P en hojas y/o vástagos de las plantas inoculadas y en loscontroles, es interesante señalar que en trabajos previos con plántulas de H. brasiliensisinoculadas con HFMA en viveros, han encontrado que la respuesta en el crecimiento delas plantas a la inoculación no está relacionada con el contenido foliar de P, ya que dehecho, en la mayoría de los casos el contenido de este elemento no cambió significativamente por efecto de la inoculación. En los ensayos realizados no se encontró un aumento de la concentración de P en hojas pero sí una respuesta positiva del crecimientode las plántulas. A diferencia de lo anterior, Ikram et ál., 1992, e Ikram et ál., 1993, encontraron un aumento en la concentración de P foliar en el tratamiento con ciertascepas de HFMA evaluadas pero solamente en un tipo de suelo particular, lo que indicaque existen diferencias en la efectividad de los HFMA para estimular el crecimiento devástagos y toma de P en H. brasiliensis.
Nuevamente, las diferencias entre cepas de HFMA que pueden estar induciendo larespuesta diferencial en el crecimiento y la toma de P observada por otros autores, así como en la presente investigación, pueden deberse a diferencias entre las especies de HFMA en el tiempo que les toma establecer una colonización temprana, en la distribución de la red de micelio activa en el suelo o a diferencias fisiológicas en la tasa de toma de P y transporte al hospedero que restan aún por ser estudiadas. No obstante, el trabajo realizado permitió establecer claramente que (1) la simbiosis de HFMA con H. brasiliensis se encuentra bien desarrollada en las plantaciones de caucho natural; (2) el desarrollo de la colonización con HFMA y sus efectos sobre el crecimiento de plántulas de H. brasiliensis en condiciones controladas es moderado durante los primeros 4 meses de asociación; (3) el avance de la colonización y sus efectos sobre el crecimiento de las plántulas inoculadas debe evaluarse utilizando un inóculo seleccionado de HFMA sobre un material vegetal de H. brasiliensis uniforme (que puede provenir de cultivo in vitro). A partir de dichas consideraciones, será posible realizar nuevos ensayos de inoculación utilizando material de H. brasiliensis y HFMA de características uniformes que permitirán identificar claramente qué otras características fisiológicas de las plántulas de H. brasiliensis pueden ser influenciadas por el tratamiento con micorrizas durante la fase final de cultivo in vitro y/o durante la aclimatación.
AGRADECIMIENTOS
Las autoras agradecen el apoyo económico dado al proyecto por el Posgrado Interfacultades de Microbiología de la Universidad Nacional de Colombia, Sede Bogotá y del Ministerio de Agricultura y Desarrollo Rural de la República de Colombia en el marco de la Convocatoria Nacional para la Cofinanciación de Programas y Proyectos de Investigación, Desarrollo Tecnológico e Innovación para el Sector Agropecuario. Así mismo agradecen la valiosa asesoría científica de la investigadora Clara Peña y la Profesora Marina Correa de Restrepo.
BIBLIOGRAFÍA
ALLEN EB, ALLEN MF. Natural re-establishment of vesicular-arbuscular mycorrhizae following strip-mine reclamation in Wyoming. J Appl Ecol. 1980;17:139-147. [ Links ]
ANDRADE G, LINDERMAN R, BETHLENFALVAY G. Bacterial associations with the mycorrhizosphere and hyphosphere of the arbuscular mycorrhizal fungus Glomus mosseae. Plant Soil. 1998a;202:79-87. [ Links ]
ANDRADE G, MIHARA K, LINDERMAN R, BETHLENFALVAY G. Soil aggregation status and rhizobacteria in the mycorrhizosphere. Plant Soil. 1998b;202:89-96. [ Links ]
ASOHECA. Sembrando futuro. Asociación de Reforestadores y Cultivadores de Caucho del Caquetá [ASOHECA]. 2008. Disponible en: http://www.asoheca.org/. [ Links ]
CANO C. Manejo de un banco de Germoplasma de hongos formadores de micorrizas arbusculares (MA). En: Guerrero E, editor. Micorrizas. Recurso Biológico del suelo, Bogotá: Editorial Fondo FEN Colombia; 1996. p. 125-141. [ Links ]
CARRON MP, ENJALRIC F, LARDET L, DESCHAMPS A. Rubber (Hevea brasiliensis Müll. Arg.). En: Bajaj Y P S. (Editor) Biotechnology in Agriculture and Forestry, Vol. 5. Trees II. Springer-Verlag Berlin Heidelberg; 1989. p. 222-245. [ Links ]
CARRON MP, CAMPAGNA S, CHAINE C, ETIENNE H, LARDET L, LECONTE A. Somatic embryogenesis in rubber (Hevea brasiliensis Müll. Arg.). En: Jain S M, Gupta P K, Newton R J (editores). Somatic embryogenesis in woody plants. Dordrecht: Kluwer Academic Publishers; 1995. p. 117-136. [ Links ]
DUPONNOIS R, PLENCHETTE C. A mycorrhiza helper bacterium enhances ectomycorrhizal and endomycorrhizal symbiosis of Australian Acacia species. Mycorrhiza. 2003;13:85-91. [ Links ]
ELMESKAOUI A, DAMONT J, POULIN M, PICHÉ Y, DESJARDINS Y. A tripartite culture system for endomycorrhizal inoculation of micropropagated strawberry plantlets in vitro. Mycorrhiza. 1995;5:313-319. [ Links ]
ESPINAL C, MARTÍNEZ H, SALAZAR M, BARRIOS C. La Cadena del Caucho en Colombia una Mirada Global de su Estructura y Dinámica 1991-2005. Documento de Trabajo No. 63. Bogotá: Ministerio de Agricultura y Desarrollo Rural; 2005. [ Links ]
FEDECAUCHO. ¿Por qué invertir en Caucho Natural? Federación Nacional de Productores de caucho natural. [Fedecaucho]. 2008. Disponible en: http://www.fomentocauchero.com/sitio2008/main.php?funcion=x_seccion.php&sec=58 [ Links ]
GERDEMANN J, NICOLSON T. Spores of mycorrhizal Endogone species extracted from soil by wet sieving and decanting. Trans Br Mycol Soc. 1963;46,235-44. [ Links ]
INVAM [International Culture Collection of (Vesicular) Arbuscular Mycorrhizal Fungi] 2008 Disponible en: http://invam.caf.wvu.edu/ [ Links ]
IKRAM A, MAHMUD A, OTHMAN H. Growth response of Hevea brasiliensis seedling rootstock to inoculation with vesicular-arbuscular mycorrhizal fungal species in steam - sterilised soil. J Nat Rubber Res. 1993;8(3):231-242. [ Links ]
IKRAM A, MAHMUD A, GHANI M, IBRAHIM M, ZAINAL A. Field nursery inoculation of Hevea rasiliensis Muell Arg seedling rootstock with vesicular-arbuscular mycorrhizal (Vam) Fungi. Plant Soil. 1992;145(2):231-236. [ Links ]
JAIN S, GUPTA P, NEWTON R, Editores. Somatic Embryogenesis in Woody Plants Volume II. Angiospermes. Boston -London: Kluwer Academic Publishers, Dordrecht; 1995. [ Links ]
JAKOBSEN I. Phosphorus transport by external hyphae of vesicular-arbuscular mycorrhizas. En: Read D., Lewis D., Fitter A., Alexander I, editors. Mycorrhizas in Ecosystems. Wallingford: CAB International; 1992. p. 48-58. [ Links ]
JANOS D. Plant responsiveness to mycorrhizas differs from dependence upon mycorrhizas. Mycorrhiza. 2007;(17):75-91. [ Links ]
JAYASHREE R, REKHA K, VENKATACHALAM P, URATSU SL, DANDEKAR AM, et al. Genetic transformation and regeneration of rubber tree (Hevea brasiliensis Muell. Arg) transgenic plants with a constitutive version of an anti-oxidative stress superoxide dismutase gene. Plant Cell Rep. 2003;22(3):201-209. [ Links ]
KAPOOR R, SHARMA D, BHATNAGAR A. Arbuscular mycorrhizae in micropropagation systems and their potential applications. Sci Hortic 2008;116:227-239. [ Links ]
LABORATORIO DE FERTILIDAD DE SUELOS. Análisis de elementos solubles en suelos e Informe de resultado en foliares. Centro de investigaciones y asesorías agroindustriales - CIAA, Bogotá: Universidad Jorge Tadeo Lozano. 2008. [ Links ]
MALAYSIAN RUBBER BOARD [Biotechnology Unit]. 2002. Disponible en: http://www.lgm.gov.my/r&d/bsru/bsru.html [ Links ]
MAJADA J, SÁNCHEZ R. Ecofisiología del cultivo in vitro: Aclimatación de plantas. En: Reigosa M, Pedro N, Sánchez A, Editores. La Ecofisiología vegetal: Una ciencia de síntesis. Madrid: Thompson Eds; 2004. p. 1017-1054.
[ Links ]MONTORO P, LAGIER S, BAPTISTE C, MARTEAUX B, PUJADE-RENAUD V, et al. Expression of the hev2.1 gene promoter in transgenic Hevea brasiliensis. Plant Cell Tissue Organ Cult. 2008;94(1):55-63. [ Links ]
MORENO F, PLAZA G, MAGNITSKIY S. Efecto de la testa sobre la germinación de semillas de caucho (Hevea brasiliensis Muell.). Agron Colomb. 2006;24(2): 290-295. [ Links ]
MURASHIGE T, SKOOG F. A revised medium for rapid growth and bio assay with tobacco tissue culture. Physiol Plant. 1962;15:473-497. [ Links ]
POSPíILOVá J, TICHá I, KADLE EK P, HAISEL D, PLZáKOVá S. Acclimatization of micropropagated plants to ex vitro conditions. Biol Plant 1999;42(4):481-497. [ Links ]
REMOLINO. worldwide index of cities and towns. Global Gazetteer Version 2.1. Falling Rain Genomics, Inc. 2004 Disponible en: http://www.fallingrain.com/world/CO/19/Remolino.html [ Links ]
RIDGWAY H, KANDULA J, STEWART A. Optimising the medium for producing arbuscular mycorrhizal spores and the effect of inoculation on grapevine growth. N. Z. Plant Prot. 2006;59:338-342. [ Links ]
SANTACRUZ O. Comportamiento Del Caucho Natural En Colombia Y El Mundo (2002 - 2008). [Agronet] Secretaría técnica Nacional de Caucho Natural y su industria - Ministerio de Agricultura y Desarrollo Rural. 2008. Disponible en: http://www.agronet.gov.co/www/docs_agronet/20084915429_Bullets_Caucho_2008.pdf [ Links ]
SBRANA C, GIOVANNETTI M, VITAGLIANO C. The effect of mycorrhizal infection on survival and growth renewal of micropropagated fruit rootstocks. Mycorrhiza. 1994;5:153-156. [ Links ]
SCHWOB I, DUCHER M, SALLANON H, COUDRET A. Growth and gas exchange responses of Hevea brasiliensis seedlings to inoculation with Glomus mosseae. Trees Struct Funct. 1998;12:236-240. [ Links ]
SCHWOB I, DUCHER M, COUDRET A. Effects of climatic factors on native arbuscular mycorrhizae and Meloidogyne exigua in a Brazilian rubber tree (Hevea brasiliensis) plantation. Plant Pathol. 1999;48(1):19-25. [ Links ]
SHARMA M, BHATIA A, ADHOLEYA A. Growth responses and dependence of Acacia nilotica var. cupriciformis on the indigenous arbuscular mycorrhizal consortium of a marginal wasteland soil. Mycorrhiza. 1996;6:441-446. [ Links ]
SIEVERDING E. Manual de métodos de investigaciones en micorrizas vesículo arbusculares en el laboratorio. Palmira: Centro Internacional de Agricultura Tropical (CIAT); 1983. [ Links ]
SIQUEIRA J, SAGGIN-JÚNIOR O, FLORES-AYLAS W, GUIMARÃES P. Arbuscular mycorrhizal inoculation and superphosphate application influence plant development and yield of coffee in Brazil. Mycorrhiza. 1998;7:293-300. [ Links ]
UDAYAKUMARA E, SENEVIRATNE P. Position of the bud on the bud stick on success of bud graft and growth Hevea brasiliensis (Muel Arg). J Agric Sci. 2005;1(1):31-40. [ Links ]
VIERHEILIG H, COUGHLAN A, WYSS U, PICHE Y. Ink and vinegar, a simple staining technique for arbuscular-mycorrhizal fungi. Appl Environ Microbiol. 1998;64(12):5004-5007. [ Links ]














