Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.14 no.3 Bogotá Sep./Dec. 2009
EVALUACIÓN DEL ANTAGONISMO Y MULTIPLICACIÓN DE Trichodermasp. EN SUSTRATO DE PLÁTANO EN MEDIO LÍQUIDO ESTÁTICO
Evaluation Of Antagonism And Multiplication The Trichodermasp. In The Middle Static Liquid Banana Substrate
ELKIN AGAMEZ RAMOS1, Biólogo; JOSÉ BARRERA VIOLETH2, Docente M.Sc.; LUIS OVIEDO ZUMAQUÉ2, Docente M.Sc.
1Investigador del Grupo de Investigación: Agricultura Sostenible, Universidad de Córdoba, Montería, Colombia. elkin28@gmail.com
2Facultad de Ciencias Agrícolas. Universidad de Córdoba, Montería, Colombia. jbarrera11@sinu.unicordoba.edu.co
Presentado 12 de octubre de 2008, aceptado junio 29 de 2009, correcciones julio 27 de 2009.
RESUMEN
Se evaluó la capacidad antagónica de nueve aislados del hongo Trichoderma sp. proveniente de la colección de cepas del Laboratorio de Fitopatología de la Universidad de Córdoba, Colombia y su producción de esporas en medios de cultivo líquido estático, a través de pruebas in vitro de antagonismo, utilizando dos hongos fitopatógenos: Fusarium sp. y Rhizoctonia sp.; esta prueba permitió seleccionar el aislado con la mayor actividad antagónica, para así ajustar la producción de esporas mediante un proceso de fermentación en estado líquido en condición estática mediante procesos de buferización y sin buferización con fosfato 0,2N, utilizándose como sustrato principal harina de plátano (HP) 5%, además de complementos nutricionales que constituyeron los tratamientos: HPM (solución de melaza 5%), HPL (solución de levadura granulada al 2%), HPU (solución de urea 0,1%), y como testigo PGL (papa glucosa líquida). En los ensayos de antagonismo se seleccionó el aislado C2 de Trichoderma sp. por presentar la mayor capacidad antagónica frente al hongo Fusarium sp., con un porcentaje de inhibición del 78,30% y reportando un índice 4 de antagonismo, en los procesos de producción de esporas el tratamiento HPL (harina de plátano más levadura sin buffer) se destacó por su favorable producción de conidias, con una concentración de 1,1 x 109 conidias/mL. Los procesos de buferización se diferenciaron significativamente, demostrando que la variable buffer influyó en la producción de conidias, los medios que se amortiguaron mostraron una producción de 1,01 x 109 conidias/mL, con respecto a los que no se amortiguaron 6,3 x 108 conidias/mL.
Palabras clave: Trichoderma sp., Fusarium sp., Rhizoctonia sp., antagonismo, espora, fermentación líquida.
ABSTRACT
The antagonistisc ability of nine isolated natives fungi Trichoderma sp from the collection of strains at Laboratory of phytopathology at University of Cordoba, Colombia was assessed so as its production of spores in crop liquid static medium, cross the in vitro proof antagonism using two phytopathogenic fungi: Fusarium sp. and Rhizoctonia sp., this proof let select the isolated with the major antagonistic activity and adjust the production of spores through fermentation process in liquid static by means of buffer and without buffer with phosphate 0,2 N, being used as principal substrate plantain flour (HP) 5%, besides of nutritional supplements that formed the trataments: HPM (molasses solution 5%), HPL (granulated yeast solution at 2%), HPU (urea solution 0.1%), and as witness PGL (potato glucose liquid). In the test of antagonism was selected the isolated C2 of Trichoderma sp. by present the major antagonistic ability in front of the fungi Fusarium sp., with a inhibition percentage at 78,30% and reporting a index 4 of antagonism, in the process of spores production, the tratament HPL (plantain flour plus yeast without buffer) stressed for the favorable production of conidias, with a concentration of 1,1 x 109 conidias/mL. The buffer process were significant differentiated, showing that the variable buffer influenced in the production of conidias, the mediums that shocked in the production show 1,01 x 109 conidias/mL, Ïwith respect at don’t shocked 6,3 x 108 conidias/mL.
Key words: Trichoderma sp., Fusarium sp., Rhizoctonia sp., antagonism, spores, liquid fermentation.
INTRODUCCIÓN
El hongo Trichoderma sp. es un antagonista, que ataca a un gran número de fitopatógenos por lo cual es ampliamente utilizado en el control biológico de diversas enfermedades, debido a su ubicuidad, a su facilidad para ser aislado y cultivado, a su rápido crecimiento en un gran número de sustratos; lo cual permite obtener niveles de inóculos muy altos en poco tiempo y no atacan a plantas superiores, dejando ver la posibilidad de aprovechar recursos disponibles en el medio, como por ejemplo los desechos de cultivos agrícolas (Papavizas et ál., 1982; Bell et ál., 1982).
Las especies de Trichoderma son biocontroladores de patógenos fúngicos del suelo, el micoparasitismo es el principal mecanismo de acción de Trichoderma sp. Este agente antagonista envuelve el hongo patógeno y penetra sus células causándole un daño extensivo a nivel celular (pared, membrana y desorden citoplasmático), principalmente en los géneros Phytophthora, Rhizoctonia, Sclerotium, Pythium y Fusarium entre otros (Harman et ál., 1981). Trabajos realizados por Benhamou y Chet, 1993, afirman que estos daños no son ocasionados por las sustancias producidas en el avance del antagonista, sino que los daños comienzan a observarse cuando ambos hongos tanto Trichoderma sp. como Rhizoctonia solani entran en contacto, reiterando que el mecanismo de acción es el micoparasitismo. La relación antagónica de Trichoderma sp. frente a Glomus mossae, reportada en trabajos por McAllister et ál., 1994, indican a que a pesar de estar las hifas del hongo antagonista en contacto, no se observa el enrollamiento, afirmando que no es el micoparasitismo el mecanismo de acción sino la producción de antibióticos péptidos. Aunque otro estudio hecho por García y Zambrano, 1991, en donde se evaluó el tipo de antagonismo de tres aislamientos de Trichoderma sp. ante Macrophomina phaseolina y concluyeron que la antibiósis parece ser el mecanismo de acción en esta relación, pero que hace falta continuar investigando sobre los posibles antibióticos producidos. Las especies de Trichoderma actúan como hiperparásitos competitivos que producen metabolitos antifúngicos y enzimas hidrolíticas a los que se les atribuyen los cambios estructurales a nivel celular, tales como vacuolización, granulación, desintegración del citoplasma y lisis celular, encontrados en los organismos con los que interactúa (Ezziyyani et ál., 2004).
El hongo Trichoderma sp. puede encontrar tanto fuera como dentro de la rizósfera; es en la rizósfera donde puede colonizar y proteger las raíces de las plantas. Pero ésta no es la única ventaja que las plantas superiores reciben de Trichoderma sp. varios autores han señalado el incremento en peso de las plántulas que se desarrollan en presencia de este hongo. Por ejemplo, el aumento en peso de las plantas de fríjol; del peso de los brotes de plántulas de trigo; plántulas de manzanas más largas y vigorosas, incremento en la tasa de germinación y el peso seco de brotes y guías de plantas de tomate, en el aumento del crecimiento del sistema radicular de plantas mejoradas de maíz dulce; así mismo, se ha encontrado interacción sinergística entre Trichoderma sp. y un hongo micorrísico en el desarrollo de Citrus reshni (Smith et ál., 1990).
Esta investigación propone utilizar harina de plátano como sustrato para la producción de Trichoderma sp. en medios de cultivo líquidos estáticos, teniendo en cuenta, que en la zona (Córdoba-Colombia) se generan 6.849 toneladas/año de “puntilla” (plátano que no es exportado, y se comercializa en el mercado interno) que corresponde a un 10% de la pérdida de poscosecha del cultivo de plátano; cabe resaltar, que la harina de plátano proporciona elementos que son requeridos en el metabolismo del hongo Trichoderma sp. teniendo en cuenta el principio de especificidad del antagonista Trichoderma sp. por grupos de patógenos que se encuentran en su mismo hábitat (Acevedo y Arcia, 1989), la producción de aislados nativos de Trichoderma sp. en medio líquido estático, es una alternativa importante que contribuirá a la utilización del control biológico de enfermedades que atacan a los cultivos de importancia económica en la agricultura de la región, al mismo tiempo que incita a reducir el uso de agroquímicos. El objetivo de este trabajo fue evaluar el antagonismo de nueve aislados nativos de Trichoderma sp. mediante ensayos de antagonismo in vitro, a partir de los resultados obtenidos en esta prueba se seleccionó el aislado Trichoderma sp., con el índice más alto de antagonismo para así llevar a cabo un proceso de producción de esporas en medios líquidos en condición estática mediante procesos de buferización y sin buferización con fosfato 0,2N, utilizándose como medio principal harina de plátano 5% y sometidos a procesos de buferización, esto con la finalidad de contribuir con información útil para la consecución de herramientas que permitan la obtención de posibles productos agroecológicos con aislados de Trichoderma sp., los cuales en futuras investigaciones se puedan experimentar en el campo para el control de plagas fúngicas y dar así un paso al uso e implementación de una tecnología orgánica y sostenible, en el que se utilicen fungicidas de bajo impacto ambiental.
MATERIALES Y MÉTODOS
ÁREA DE ESTUDIO
Esta investigación se realizó en el Laboratorio de Fitopatología de la Universidad de Córdoba, ubicada geográficamente en el norte del municipio de Montería (Córdoba, Colombia), localizada entre los 08º 45’ 27’’ latitud Norte y 75º 53’ 24’’ longitud Oeste, a 49 msnm, temperatura promedio de 28,3 °C, precipitación anual de 1.249 mm, y una humedad relativa anual que oscila entre 80 y 85%.
OBTENCIÓN DE LOS AISLADOS DE TRICHODERMA SP.
Se utilizaron nueve aislados de Trichoderma sp., proveniente de la colección de cepas del Laboratorio de Fitopatología de la Universidad de Córdoba, los cuales fueron aislados de cultivos de plátano en los municipios de Tierralta, Moñitos (Córdoba) y San Juan de Urabá (Antioquia), cado uno de estos aislados fueron codificados de la siguiente forma: C1, C2 C3, C4 C5, C6, C7, C8 y C9. Los aislados fueron activados en papa-dextrosaagar ((PDA) 20 g de D(+) glucosa, 22 g de extracto de papa, 15 g de agar) e incubados por siete días a 25-28 °C.
ENSAYOS DE ANTAGONISMO
Para la realización de los bioensayos se empleó la técnica de enfrentamiento (antagonistapatógeno) por medio del cultivo dual (Pinzón et ál., 1999). Se utilizaron como hongos patógenos: Fusarium sp. y Rhizoctonia sp., los cuales fueron proporcionados por el Laboratorio de Fitopatología, Facultad de Ciencias Agrícolas de la Universidad de Córdoba y como hongos antagonistas los nueve aislados de Trichoderma sp.
EVALUACIÓN DE LA CAPACIDAD ANTAGÓNICA DE TRICHODERMA FRENTE A FUSARIUM SP. Y RHIZOCTONIA SP.
La evaluación del antagonismo se realizó en función del porcentaje de inhibición del crecimiento micelial (% MI) del patógeno y en el grado de invasión-destrucción sobre la colonia de estos, teniendo como base un periodo de evaluación de 10 días. Para determinar el grado de invasión-destrucción de Trichoderma sp. se empleó la escala que determina cualitativa y cuantitativamente la capacidad antagónica que posee el hongo Trichoderma en invadir y destruir la colonia de los hongos patógenos, utilizando índices o valores que van desde 0-4, considerando como índice 3 una capacidad antagónica satisfactoria para una cepa de Trichoderma sp. (Tabla 1; Bell et ál., 1982; Calistru et ál., 1997; Ortiz y Orduz, 2001).

DISEÑO EXPERIMENTAL
Los tratamientos en el bioensayo de antagonismo, se distribuyeron en un diseño completamente al azar (DCA) ajustado a un arreglo factorial 9 x 2 (nueve aislados de Trichoderma sp. frente a dos patógenos: Fusarium sp. y Rhizoctonia sp.) con tres repeticiones por cada tratamiento. Los datos obtenidos fueron sometidos a un análisis de varianza y prueba de comparación de medias Tukey, utilizando el software estadístico SAS versión 5.0 con (a = 0,05). A partir de estos ensayos y con base a la evaluación obtenida, se seleccionó el aislado con el mayor índice de antagonismo de acuerdo a la escala de evaluación antagónica y porcentaje alto de inhibición micelial (IM %), para así llevarse a cabo los ensayos de producción de esporas en medios líquidos estáticos.
PRODUCCIÓN DE ESPORAS EN MEDIOS DE CULTIVOS LÍQUIDOS ESTÁTICOS
Sustratos implementados para la preparación de los medios líquidos. Para la producción de esporas de Trichoderma sp. en medios líquidos estáticos, se utilizó como ingrediente principal harina de plátano, la cual fue preparada a partir de la pulpa del fruto y además se utilizaron agar papa glucosa líquida (no comercial), soluciones de melaza, levadura y úrea 0,1%.
Preparación de los medios líquidos. Los medios fueron preparados con base a harina de plátano al 5% p/v, los cuales, adicionalmente se agregaron otros nutrientes de acuerdo a los tratamientos (Tabla 2). La unidad experimental de cada tratamiento estuvo constituida por un erlenmeyer de 500 mL, los cuales contenían 100 mL de cada medio líquido. El pH de cada medio se ajustó a 5,5 con HCl 0,1N y NaOH 5%, con ayuda de pH-metro análogo WPA modelo C-14; una vez preparados cada uno de los tratamientos los medios de cada tratamiento fueron sometidos a esterilización en autoclave a 121 ºC durante 30 minutos.
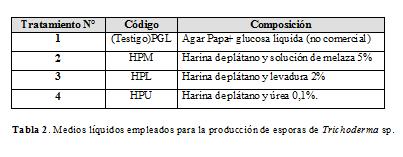
Por otra parte los cuatro tratamientos fueron sometidos a un proceso de buferización con fosfato 0,2 N y estos mismos cuatro medios sin proceso de buferización. De la misma manera se realizó la preparación de los medios anteriormente descritos este último sin ajustar el pH y sin buferización de los mismos
Inoculación de los medios líquidos estáticos. Los medios de cultivo fueron inoculados con soluciones de Trichoderma sp. provenientes de cultivos puros de cinco días de incubación, con una concentración de 2x107 conidias/mL, la concentración se determinó mediante el recuento de esporas en cámara de Neubauer (Improve 0,100 mm), tomando los discos con esporas y agregándolos en un tubo de ensayo con 10 mL de agua destilada estéril que contenía Tween 80 al 0,1%, esta solución madre se homogeneizó en un agitador vibratorio durante 30 segundos, se realizaron diluciones seriadas decimales con la adición de Tween 80 al 0,1% (Fernández y Vega, 2001).
Diseño experimental. Los tratamientos se distribuyeron en un diseño completamente al azar (DCA) con un arreglo factorial 2x4 (dos procesos de buferización y cuatro medios líquidos). Los datos obtenidos fueron sometidos a un análisis de varianza y prueba de comparación de medias Tukey, utilizando el software estadístico SAS versión 5.0 y con a = 0,05. Al cabo de siete días se realizó un conteo de esporas en cámara de Neubauer (Fernández y Vega, 2001).
RESULTADOS Y DISCUSIÓN
BIOENSAYOS DE ANTAGONISMO
El análisis de varianza muestra que estadísticamente existen diferencias significativas en el crecimiento del hongo Fusarium sp.; en la Tabla 1 se observa esta diferencia entre los crecimientos de los aislados de Trichoderma sp. que afectan a cada uno de los fitopatógenos en forma distinta.
Con respecto a los resultados obtenidos, la mayor inhibición la causó el aislado C2, el cual inhibió el crecimiento de Fusarium sp. en un 78,30% y el aislado C1 que redujo el crecimiento de Rhizoctonia sp. en un 18,67%. Al enfrentarse los aislados de Trichoderma sp. contra el hongo Rhizoctonia sp., se observó una reducción en el crecimiento de este último, pero no existieron diferencias significativas entre los tratamientos. El comportamiento de Rhizoctonia sp. en competencia con los aislados C5 y C9 fue similar al comportamiento del mismo en cultivo puro. Mientras que el crecimiento de Fusarium sp. presentó diferencias estadísticas al enfrentarse a los nueve aislados de Trichoderma sp. en cultivos duales; mostrando un menor crecimiento micelial al competir con el aislado C2, seguido de los aislados C4, C8, C7 y C1, los demás aislados inhibieron el crecimiento de Fusarium sp., pero en menor proporción (Tabla 3).
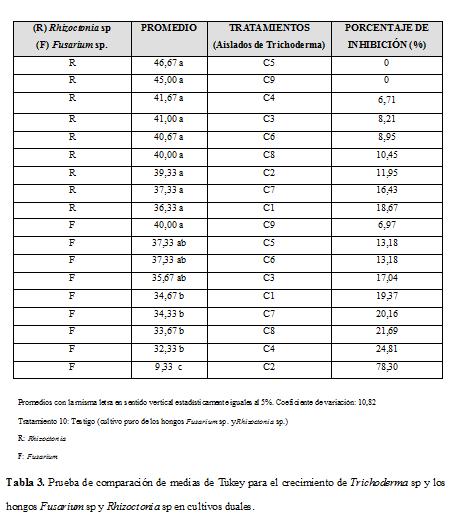
Los aislados C2 y C1 presentaron capacidad antagónica eficiente (índice 4 y 3) para controlar los hongos fitopatógenos Fusarium sp. y Rhizoctonia sp. respectivamente, demostrando un buen nivel de competencia por espacio y nutrientes, demostrando así su mecanismo de acción por micoparasitismo, lo cual coincide con lo observado en diferentes estudios realizados por Angulo et ál., 1992, quienes atribuyen el efecto de este mecanismo en el control in vitro de este hongo.
Resultados similares obtuvo Ezziyyani et ál., 2005, al comprobar la capacidad micoparasítico de T. harzianum frente a Phytophthora capsici, el cual utiliza como alimento, además de ejercer una notable competencia por espacio y por nutrientes sobre el mismo; McAllister et ál., 1994, utilizaron Trichoderma como alternativa ecológica para el control de Fusarium demostrando que todos los aislados mostraron efecto micoparasítico, obstruyendo de esta forma las funciones biológicas y fisiológicas del patógeno, además de detener su crecimiento. Una vez más se demuestra la particular habilidad parasítica de los diferentes aislamientos de Trichoderma sp. frente a un mismo fitopatógeno. Stefanova, 1999, demuestra la actividad metabólica de cepas de Trichoderma sp. para el control de los hongos, fitopatógenos Phytophthora nicotianae, Phytophthora capsici, Rhyzoctonia solani y Pythium sp., además de provocar un efecto fungistático notable sobre los fitopatógenos por la emanación de sustancias volátiles por parte de Trichoderma. En trabajos realizados por Benhamou y Chet, 1993, reiteran que los daños contra Rhizoctonia solani comienzan a observarse cuando ambos hongos entran en contacto y no antes por las sustancias producidas en el avance del antagonista, presentándose invasión y esporulación sobre la colonia de Rhizoctonia solani e inhibición de la producción de esclerócios.
Los índices de antagonismo que presentaron los diferentes aislados de Trichoderma sp. exhibieron en su mayoría buenos resultados como los mostrados por el aislado C2 al enfrentarse a Fusarium sp. (índice 4), este mismo grado de antagonismo presentaron los aislados C4, C5 y C8, los aislados restantes detuvieron el crecimiento micelial de este, e invadieron la colonia, pero la esporulación sobre el patógeno fue poca, sin embargo, pueden considerarse buenos antagonistas; al enfrentarse con Rhizoctonia sp., el aislado C8 fue el que obtuvo el mayor índice de antagonismo, al momento de invadirlo, probablemente por la naturaleza nativa de los aislados, lo que favorece a la afinidad que determinadas especies de Trichoderma puedan tener por un fitopatógeno en especial. Estas diferencias en los resultados obtenidos demuestran la alta variabilidad en la actividad antagónica de los diferentes aislamientos de Trichoderma sp. Mihuta-Grimm y Rowe, 1986, ensayaron 255 aislamientos de Trichoderma sp. obtenidos de diferentes zonas, donde el 15% de los mismos fueron efectivos al controlar Rhizoctonia; determinaron que las cepas aisladas del mismo lugar son más efectivas que las procedentes de otros sitios, de igual manera Acevedo y Arcia, 1989, señalan la importancia de buscar antagonistas efectivos en cada área geográfica
EVALUACIÓN DE LA PRODUCCIÓN DE ESPORAS DE TRICHODERMA SP. EN MEDIOS LÍQUIDOS
Se seleccionó el aislado C2 de Trichoderma por presentar el índice de antagonismo más alto en los bioensayos de antagonismo, a partir de este resultado el aislado C2 se llevó a un proceso de producción de esporas en medio líquido estático. En el análisis de varianza no se evidenciaron efectos significativos (P< 0,05) de los tratamientos sobre la multiplicación del hongo. En la Tabla 4, se observa que los tratamientos PGL y HPM, siempre mostraron una tendencia positiva a favorecer la producción de conidias. En investigaciones realizadas por Martínez, 2000, reporta que al cultivar Trichoderma harzianum en el medio de avena (11%) no afecta su capacidad antagónica frente a Fusarium oxisporum, demostrando la posibilidad de emplear este medio en la producción a escala industrial de Trichoderma harzianum para el control biológico de este fitopatógeno.
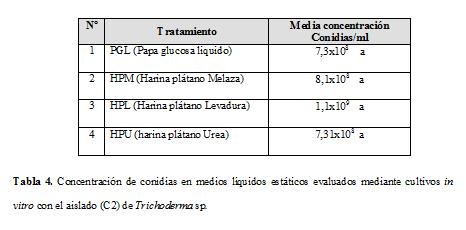
Al comparar la producción de esporas en los medios bufferizados y no bufferizados se obtuvieron diferencias altamente significativas, en la Tabla 5, se observó que la variable buffer influyó en la producción de conidias, los medios que se amortiguaron mostraron una producción de conidias menor respecto a los que no se amortiguaron, de los cuales el medio harina plátano levadura (HPL) exhibió los mejores resultados con una concentración media de 1,1x109 conidias/mL junto a 8,1x109 conidias/mL obtenidos del medio harina plátano úrea (HPM; Tabla 4). Sin embargo, las concentraciones obtenidas de los medios de cultivo, en general, se encuentran dentro de los valores requeridos (1x107 conidias/mL), en las producciones a escala comercial para biopreparados, como lo exige el registro y control de los bioinsumos y extractos vegetales de uso agrícola en Colombia (ICA, 2004).

En trabajos realizados en medios líquidos se han obtenido concentraciones de 1,8x109, 3,6-5,8x108 conidias/mL en el medio melaza de trapiche de caña panelera y levadura panadera granulada; 8,7x107 conidias/mL en medio avena 11% p/v, pH 5,5; 1x108 conidias/mL obtenida en el medio melaza, almidón de maíz y levadura (Fernández, 2002). Bautista y Acevedo, 1993, obtuvieron 7x105 clamidosporas/mL y 3,2x109 micelio más clamidosporas/mL por fermentación sumergida.
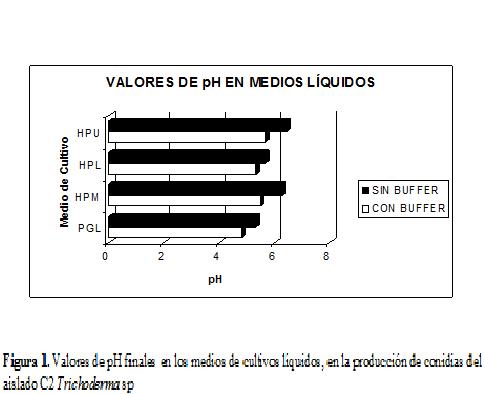
Los valores de pH que se obtenidos en los medios amortiguados se mantuvieron en un rango de 4,82-5,7 (Fig. 1); mientras que el pH en los medios no amortiguados varió en un rango de 4,98 a 6,46; estos valores se pueden considerar como valores admisibles en la producción de Trichoderma sp., ratificando así que el rango de pH en que normal-mente se desarrolla Trichoderma sp. es de cinco a seis, como lo demuestra el estudio realizado por Valencia y Castro, 2004, donde se evaluó el crecimiento de Trichoderma sp. con valores de pH de 4, 5 y 6, los cuales no mostraron diferencias significativas, y en consecuencia no afectó el crecimiento del hongo. Valencia y Castro, 2004, demostró que las conidias de Trichoderma sp. requieren de una fuente de nutrimentos para la germinación in vitro; y que la respuesta de la conidia a los nutrimentos se ve afectada por la concentración de iones de hidrógeno, con mayor germinación bajo condiciones ácidas que en condiciones neutras.
CONCLUSIONES
Los aislados de Trichoderma sp. mostraron en general un efecto antagonista sobre los hongos fitopatógenos Fusarium sp. y Rhizoctonia sp., destacándose el aislado C2 de Trichoderma sp, que demostró ser un eficiente antagonista del hongo Fusarium sp. el cual registro un índice de antagonismo 4 y de igual forma el aislado C1 inhibió el crecimiento del hongo Rhizoctonia sp. con índice antagonismo 3, al enfrentarse en los ensayos duales. La harina de plátano como medio de cultivo para la multiplicación de Trichoderma sp., es viable, por su alta producción de conidias, cuando se utilizan el medio (HPL) de harina de plátano al 5% y levadura al 2% sin buffer, obteniéndose con este medio concentración final de 1,1x109 conidias/ml, y pH 5,7 a los siete días del proceso.
Los medios líquidos evaluados mediante procesos de buferización arrojaron valores de pH 5,5-5,6, lo que indica buenos resultados para el crecimiento optimo de Trichoderma sp.; en general, de los medios de cultivo líquidos.
BIBLIOGRAFÍA
ACEVEDO R, ARCIA A. Especificidad de Trichoderma sp. En el control biológico de Sclerotium cepivorum Berk, in vitro. Fitopatol Venez. 1989;2(2):56.
[ Links ]ANGULO J, ARVELAEZ G, GUZMÁN S, LEÓN J, GONZÁLES M, MOLINA J, PARRA J. Control integrado del Marchitamiento vascular del clavel ocasionado por Fusarium oxisporum F. sp. Diamthi. Agron Colom. 1992;10:78-69.
[ Links ]BAUTISTA L, ACEVEDO R. Producción de clamidosporas de Trichoderma en medio líquido. Fitopatol Venez. 1993;6(2):55-57
[ Links ]BELL D, WELLS H, MARKHAM C. In vitro antagonism of Trichoderma species against six fungal plant pathogens. Phytopathol. 1982;72:379-382.
[ Links ]BENHAMOU N, CHET I. Hyphal interactions between Trichoderma harzianum and Rhizoctonia solani: Ultraestructure and Gold Cytochemistry of the mycoparasitic process. Phytopathol. 1993;83(10):1062-1071.
[ Links ]CALISTRU C, MCLEAN M, BERJAK P. In vitro studies on the potential for biological control of Aspergillus flavus and Fusarium moniliforme by. Trichoderma species. Mycopathol. 1997;139:115-121
[ Links ]EZZIYYANI M, PÉREZ C, AHMED S, REQUENA M, CANDELA M. Trichoderma harzianum como biofungicida para el biocontrol de Phytophthora capsici en plantas de pimiento (Capsicum annuum L.). An Biol. 2004;26:35-45.
[ Links ]EZZIYYANI M, REQUENA M, PÉREZ C, CANDELA M. Efecto del sustrato y la temperatura en el control biológico de Phytophthora capsici en pimiento (Capsicum annuum L.). An Biol. 2005;27:119-126.
[ Links ]FERNÁNDEZ O, VEGA L. Microorganismos antagonistas para el control fitosanitario, En: Manejo integrado de plagas, Costa Rica; 2001(62). p. 96-100.
[ Links ]GARCÍA R, DURAN M, RIERA R. Producción de biomasa de Trichoderma harzianum por fermentación líquida. Fitosanidad 2006 INISAV (Cuba) 10(4):295-298. Disponible en: http://www.fao.org/agris/search/display.do?f=./2007/CU/CU0705.xml;CU2007102127
[ Links ]HARMAN G, CHET I, BAKER R. Factors affecting Trichoderma hamatum applied to seed as a biocontrol agent. Phytopathol. 1981;71:569-572.
[ Links ]MCALLISTER C, GARCÍA I, GODEAS A, OCAMPO J. Interactions between Trichoderma koningii, Fusarium solani and Glomus mosseae. Soil Biol Biochem. 1994;26(10):1369-1374.
[ Links ]MIHUTA-GRIMM L, ROWE C. Trichoderma spp. as biocontrol agents of Rhizoctonia damping-off of radish in organic soil and comparison of four delivery systems. Phytopathol. 1986;76(3):306-312.
[ Links ]PAPAVIZAS G, LEWIS J, ABD-ELMOITY T. Evaluation of new biotypes of Trichoderma harzianum for tolerance to Benomyl and enhanced biocontrol capabilities. Phytopathol. 1982;72:126-132.
[ Links ]PINZÓN L, SALGADO R, MARTÍNEZ G. Antagonismo entre diferentes cepas de Trichoderma sp. y Fusarium oxisporum. F.SP. Dianthi (PRIL. & DELL). Snyd. & Hand. Fitopatol Colomb. 1999;23:7-11
[ Links ]STEFANOVA M, LEIVA A, LARRINAGA L, CORONADO M. Actividad metabólica de cepas de Trichoderma spp. para el control de hongos fitopatógenos del suelo. Rev Fac Agron (LUZ). 1999;16:509-516
[ Links ]VALENCIA J, CASTRO B. Aspectos biológicos de aislamientos de Trichoderma spp. antagónicos a Rosellinia bunodes. Cenicafé. 2004;55(1):16-28.
[ Links ]













