Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.14 no.3 Bogotá Sep./Dec. 2009
RESPUESTA FISIOLÓGICA Y CAPACIDAD ANTAGONISTA DE AISLAMIENTOS FILOSFÉRICOS DE LEVADURAS OBTENIDOS EN CULTIVOS DE MORA (Rubus glaucus)
Physiological Responses And Antagonistic Capacity Of Yeast Phyllospheric Isolates Obtained In Blackberry Crops (Rubus glaucus)
CLAUDIA M. MEDINA1, M.Sc.; DIANA CRISTANCHO1, Bact; DANIEL URIBE1*, Ph. D.
1Laboratorio Microbiología Agrícola, Instituto de Biotecnología, Universidad Nacional de Colombia, Sede Bogotá D.C., Colombia.
*Correspondencia: Daniel Uribe, duribev@unal.edu.co. Instituto de Biotecnología, Universidad Nacional de Colombia, A.A. 14490, Bogotá D.C, Colombia, Sur América.
Presentado 9 de octubre de 2008, aceptado 2 de julio de 2009, correcciones 17 de septiembre de 2009.
RESUMEN
La filósfera es un ecosistema complejo que a pesar de contar con un gran número de microorganismos asociados, presenta pocos estudios diseñados para entender las características ecofisiológicas de los microorganismos que lo habitan. Las levaduras, como elemento importante de este hábitat, están expuestas a un ambiente variable afectado por la planta hospedera, edad y posición de la hoja, disponibilidad y calidad de nutrientes, temperatura, pH, radiación y actividad del agua. Estos factores producen una presión de selección para el establecimiento de poblaciones naturales o introducidas de levaduras que puedan desplazar otras poblaciones de hongos fitopatógenos. En este estudio se obtuvieron 80 aislamientos de levaduras filosféricas de dos cultivos de mora (Rubus glaucus), a las que se les determinó su nicho potencial en términos de su capacidad para crecer a diferentes condiciones de temperatura, pH, estrés osmótico y tolerancia a radiación UV. El estrés osmótico fue la condición evaluada más restrictiva para las levaduras obtenidas, ya que únicamente seis aislamientos presentaron un crecimiento superior a 0,3 unidades de DO a 405 nm, cuando fueron crecidas a 50% y 60% de glucosa. Este estudio permitió seleccionar diez aislamientos filosféricos de levaduras, destacados por su capacidad para crecer en un amplio rango de condiciones. De estos, cuatro aislamientos LvF 34, LvF 43, LvF 44 y LvF 50 se destacaron por su capacidad de antagonismo contra el hongo fitopatógeno Botritys cinérea. Su determinación taxonómica permitió reportar por primera vez las especies Candida kunwinensis y Rhodotorula colostri con potencial biocontrolador.
Palabras clave: levaduras; filósfera; Rubus glaucus; ecofisiología, estrés osmótico.
ABSTRACT
The phyllosphere is a complex ecosystem in which despite of having a great number of associated microorganisms, few studies have been designed to understand the ecophysiological characteristics of the microorganism’s inhabitant. Yeasts, as an important element of this habitat, are exposed to a variable environment, affected by the host plant, age and leaf position, availability and nutrient quality, temperature, pH, radiation and water activity. All these factors produce an important selection pressure for the establishment of natural or introduced populations of yeast which may displace other phytopathogenic fungi. In this study 80 isolates of phyllospheric yeast were obtained from two blackberry crops (Rubus glaucus). Its potential niche was determined in terms of its capacity to growth at different conditions of temperature, pH, osmotic stress and UV radiation. The osmotic stress was the most restrictive evaluated condition for the obtained yeast. Only six isolates presented a growth higher to 0.3 OD units at 405 nm, when grown at 50% or 60% of glucose. This study identified the ecological niche of ten yeast phyllospheric isolates, selected for their capacity to growth at a wide range of conditions. Four of these isolates LvF 34, LvF 43, LvF 44 and LvF 50 were selected for their antagonistic capacity against the phytopathogenic fungi Botritys cinérea. Its taxonomic determination allowed us to report for the first time isolates of Candida kunwinensis and Rhodotorula colostri with biocontrol capacity.
Key words: Yeast; phyllosphere; Rubus glaucus; ecophysiology, osmotic stress.
INTRODUCCIÓN
Todas las especies vegetales soportan el crecimiento de una diversidad importante de microorganismos, especialmente bacterias y hongos, asociada a la filósfera, la cual conforma lo que conocemos como microflora epífita (Lindow y Leveau, 2002; Inacio et ál., 2002; Yang et ál., 2001). Estos microorganismos epífitos se desarrollan en un ambiente muy hostil, básicamente a expensas de los pocos nutrientes que exuda la planta (Lages et ál.,1999). Su supervivencia depende en buena parte de su adaptación a condiciones ambientales extremas tales como amplias fluctuaciones en la disponibilidad de agua, estres osmótico, cambios de temperatura y exposición a radiación UV (Ellis et ál., 1999).
El hábitat aéreo creado a partir de la filósfera, proporciona una serie de nichos microbianos relativamente complejos, los cuales frecuentemente superan el área de colonización de la superficie del suelo (Lindow y Leveau, 2002). Sin embargo, a pesar del gran tamaño de las poblaciones microbianas asociadas a estos nichos, pocos estudios se han realizado para entender los microorganismos asociados y la ecología particular del mismo y la mayoría de estos estudios poseen un sesgo hacia los microorganismos fitopatógenos (Lages et ál. 1999; Inacio et ál. 2002). Es por esto que recientemente se ha generado un interés particular en entender la dinámica de las poblaciones de microorganismos benéficos asociados a la filósfera, con el objeto de modular el tamaño de la población de microorganismos deletéreos para la planta o sus productos a nivel de post-cosecha (Lindow y Leveau, 2002).
Las levaduras, como cualquier otro microorganismo de la filósfera, no se distribuyen aleatoriamente en un ambiente particular. Ellas forman comunidades de especies, las cuales están definidas por los hábitats y los nichos que las especies forman, entendiendo por nicho la suma de los factores químicos, físicos y bióticos requeridos para una existencia exitosa (Lachance y Starmer, 1998). Las levaduras que habitan la filósfera, están expuestas a un ambiente variable afectado por la planta hospedera, la edad y posición de la hoja, la disponibilidad y calidad de los nutrientes, la temperatura, pH, radiación y especialmente a la actividad del agua (Lindow y Leveau, 2002; Hohmann y Magger, 1997; Yang et ál., 2001). Es por esto que tan importante como conocer las poblaciones de microorganismos asociados a la filósfera de una planta particular, es entender el nicho específico que estos microorganismos pueden potencialmente ocupar, especialmente si se pretende que estos puedan ser empleados como agentes de control biológico.
La mora de castilla es uno de los cultivos de fruta que despierta mayor interés en Colombia dada su buena comercialización como fruta fresca y como materia prima en la industria alimenticia para la elaboración de jugos, mermeladas o concentrados de pulpa. Esto ha permitido un incremento relativamente rápido. Pasando de una producción de 17.700 Ton en 1992 a 78.738 toneladas año en el año 2003, en un área cultivada de 10.011 hectáreas (Azohofrucol, 2008). Sin embargo, la producción de mora de Castilla en nuestro país, se ve afectada por el ataque de enfermedades, siendo la más importante y limitante el moho gris producido por el hongo Botrytis cinerea (Dashwood y Fox, 1998; Molina et ál. 2004). La incidencia de este tipo de agentes fitopatógenos ha llevado a una aplicación excesiva de fungicidas que en algunas ocasiones puede alcanzar hasta las dos aplicaciones semanales de tres productos comerciales, lo cual genera fenómenos de resistencia en hongos como B. cinerea.
Considerando la creciente importancia del cultivo de mora en nuestro país, las limitaciones de este cultivo para su desarrollo debido a la presencia de agentes fitopatógenos, además del poco conocimiento de las poblaciones de levaduras asociadas a la filósfera de este cultivo, en el presente estudio se lleva a cabo el aislamiento y caracterización ecofisiológica de la población de levaduras filosféricas en dos cultivos de la mora de Castilla (Rubus glaucus), ubicados en el departamento de Cundinamarca. Así mismo, los aislamientos mejor adaptados a las cambiantes condiciones de este nicho, serán evaluados en términos de su capacidad biocontroladora contra el hongo fitopatogeno B. cinérea, con el objeto de determinar su potencial para ser empleados en un futuro en el control biológico de agentes fitopatógenos en cultivo y/o post-cosecha.
MATERIALES Y METODOS
MUESTREO
Los aislamientos nativos de levaduras fueron recolectados a partir de foliolos de plantas sanas de mora de castilla Rubus glaucus Benth provenientes de cultivos localizados en el departamento de Cundinamarca (Colombia) en los municipios de Fusagasugá (Fusa) (1.728 msnm y 19 ºC temperatura promedio) y San Bernardo (1.600 msnm y 20 ºC temperatura promedio). Las muestras fueron tomadas recorriendo el cultivo en zig-zag tomando tres foliolos por planta, cada uno ubicado en el estrato alto (80-120 cm), medio (40-80 cm) y bajo (5-40 cm) respectivamente. Diez plantas fueron muestreadas por cultivo para un total de 30 foliolos recolectados, cada uno de los cuales se empacaron individualmente en bolsas de papel y se transportó en nevera de icopor. Una vez en el laboratorio, este material se almacenó en un cuarto frío a una temperatura de 4 °C para su posterior análisis, el cual nunca superó las 48 horas.
AISLAMIENTO DE LAS LEVADURAS FILOSFÉRICAS
El aislamiento de las levaduras, se realizó haciendo un lavado individual a partir de cada foliolo de mora en un matraz con 50 mL de Tween 80 al 1%. Este preparado se dejó en agitación durante 90 minutos a 250 rpm. Diferentes diluciones del mismo fueron sem-bradas en agar YM (extracto de levadura 3 g.L-1; extracto de malta 3 g.L-1; sacarosa 10 g.L-1; peptona 5 g.L-1; agar -agar 17 g.L-1) acidificado a pH 5,5. Las cajas de Petri fueron incubadas a 25 ºC en oscuridad por cuatro días, luego fueron analizadas realizando el conteo en placa, y el subcultivo de máximo cinco colonias puras correspondientes a diferentes morfotipos por foliolo. Para cada uno de los aislamientos se describió la morfología de colonia, la morfología microscópica y la prueba de ureasa de acuerdo a los procedimientos estándar descritos por Yarrow, 1998. Las colonias aisladas fueron crio-conservadas a -70 ºC en glicerol al 12% y evaluadas en términos de características ecofisiológicas relevantes.
CARACTERIZACIÓN FUNCIONAL DE LAS LEVADURAS
Evaluación de la osmotolerancia, temperaturas y pH óptimos de crecimiento de las levaduras filosféricas. La caracterización ecofisiológica de las levaduras se realizó evaluando la habilidad de estas para crecer a diferentes condiciones de temperatura, pH y osmotolerancia. Estas pruebas se realizaron en caldo Saboureaud Dextrosa SD (peptona universal 10 g.L-1; glucosa 40 g.L-1), modificado de acuerdo con la prueba a realizar. Para la evaluación del inicio del crecimiento de las levaduras a los diferentes pH (Chand-Goyal y Spotts, 1997; Droby et ál., 1999; Elmer y Reglinski, 2006; Gasch et ál., 2000), el caldo de cultivo se ajustó con ácido clorhídrico 0,1 N para los pH ácidos y con hidróxido de sodio 0,1 N para los pH alcalinos. Para la evaluación de crecimiento bajo condiciones de estrés osmótico, el medio SD se ajustó adicionando glucosa hasta obtener una concentración de 50% y 60%, y en la evaluación del crecimiento a diferentes temperaturas el caldo sin modificar fue incubado a 5 ºC, 25 ºC, 30 ºC y 37 ºC. El inóculo de cada uno de los aislamientos de las levaduras se obtuvo a partir de cultivos de 48 horas de edad en Agar YM, incubados a 25 °C. A partir de estos cultivos se realizó una suspensión de cada levadura en agua destilada estéril, ajustando la concentración a 1 x 106 células.mL-1.
Todas las pruebas descritas se desarrollaron en microplacas de 96 pozos con 300 µL de capacidad en las cuales se adicionaron 150 µL del caldo (modificado según la prueba) en cada pozo y 50 µL del inoculo de cada levadura por triplicado, es decir tres pozos por levadura. El blanco consistió en tres pozos con 150 µL del medio, inoculado con 50 µL de agua estéril. La lectura de la biomasa en las microplacas se realizó midiendo la densidad óptica (DO), luego de 48 horas de incubación a 25 °C, mediante un lector ELISA marca Merk Sensident Scan a una longitud de onda de 405 nm.
DETERMINACIÓN DE LA TOLERANCIA A LUZ UV-C Y UV-B
Se determinó la tolerancia a luz UV-C (254 nm) mediante la exposición a la lámpara monocromática a 254 nm (Minerallight® Lamp, Model UVGL-25, UVP Inc., San Gabriel CA), ubicada a 20 cm de distancia de la caja de cultivo, para una dosis de 95 µW.cm2 durante 90 segundos. La dosis de luz UV fue medida empleando un radiómetro UVX 31. El tiempo de exposición fue seleccionado como la DL90 de una cepa control de Sachromyces cereviceae mediante la exposición a diferentes dosis (datos no mostrados). Una suspensión de cada aislamiento a una concentración de 1x103 células.mL-1 fue obtenida a partir de cultivos de 48 horas en agar YM, incubados a 25 °C. Posteriormente en una caja de Petri con agar YM dividida en cuatro cuadrantes, se inocularon cinco gotas de 10 µL por cuadrante, las gotas se dejaron secar en cabina de flujo laminar (Labconco® Purifier Clean Bench, Kansas MI) y fueron expuestas sin tapa a la fuente de luz UV-C, en condiciones de oscuridad. Luego las cajas se taparon y se protegieron de la luz forrándolas con papel aluminio. Un tratamiento de la misma suspensión celular, sin exponer a luz UV-C, fue empleado como control. Finalmente, ambos tratamientos se incubaron a 25 °C durante 48 horas, tiempo después del cual se contaron las colonias producidas a partir de cada gota, con el objeto de calcular el porcentaje de inhibición para cada aislamiento, comparándolo con el número de colonias obtenidas en el control. Para determinar la tolerancia a luz UV-B se siguió el mismo procedimiento anterior empleando una lámpara monocromática a 302 nm (Minerallight® Lamp, Model UVGL25, UVP Inc, San Gabriel CA), con una dosis de 335 µW.cm2 y con un tiempo de exposición de 8 min.
PRUEBA DE ANTAGONISMO in vitro CONTRA BOTRYTIS CINEREA
Los aislamientos de levaduras que presentaron un mejor comportamiento en términos de crecimiento a las diferentes condiciones fisiológicas evaluadas, fueron analizados en términos de su capacidad biocontroladora. La evaluación fue realizada mediante la determinación de la inhibición del crecimiento de B. cinerea en medio agar papa dextrosa Difco (APD), siguiendo la metodología de Bautista et ál., 2007. Brevemente, se enfrenta un inóculo de 1 mm2 de un hongo de B. cinerea (previamente crecido durante ocho días en APD), a dos estrias de 48 h de crecidas de 5 cm cada una, sembradas en los bordes de la caja. La inhibición de crecimiento del hongo se observa a los cinco días de incubación a 25 ºC midiendo la distancia en cm del borde de ambas colonias. Los aislamientos se clasificaron en tres categorías: 1) presenta halo de inhibición; 2) crecimiento del hongo sobre el límite del crecimiento de la levadura y 3) crecimiento del hongo por encima de la levadura.
PRUEBA DE ANTAGONISMO in vivo CONTRA B. CINEREA
La capacidad biocontroladora de las levaduras seleccionadas, fue evaluada además en una prueba de antagonismo in vivo, utilizando como sustrato pétalos de rosa variedad Vendela. La evaluación de las levaduras fue realizada empleando una suspensión celular mixta a 1+0,5x104 del agente fitopatógeno, previamente crecido durante 5-7 días en APD y 1+0,5x107 de cada levadura evaluada crecida por 48 horas en agar YM. De esta forma 10 µL de la suspensión fue aplicada por cada pétalo, cinco pétalos fueron empleados por tratamiento con tres replicas cada uno. Los pétalos fueron almacenados en condiciones de cámara húmeda, a temperatura ambiente (15+3 ºC) y en oscuridad. La prueba de patogenicidad de B. cinerea, fue evaluada mediante una escala de severidad de la lesión producida por B. cinerea al contacto con el pétalo de rosa. De esta manera se desarrollo una escala de severidad dependiendo el grado de la infección (0 = sin infección, 1 = 0-25% del área del pétalo infectado, 2 = 26-50% del área del pétalo infectado, 3 = 51-75% del área del pétalo infectado y 4 = 76-100% de infección). Cada ensayo se repitió en el tiempo.
DETERMINACIÓN TAXONÓMICA DE LAS LEVADURAS
La determinación taxonómica de los mejores aislamientos en términos de su actividad antagonista in vitro e in vivo, fue realizada en el laboratorio de Control Biológico de Plagas Agrícolas de CORPOICA Tibaitatá, (Mosquera, Cundinamarca, Colombia), empleando el sistema de BioloMICS (The Biological Manager for Identification, Clasification and Statistics). Este sistema consiste en la evaluación de la capacidad de asimilación de más de sesenta sustratos y la fermentación de 14 azúcares. Los resultados fueron comparados con la base de datos de BioloMICS, la cual consiste en 107 géneros y 902 especies de levaduras con las cuales se comparan los resultados obtenidos (BioAware, 2007).
ANÁLISIS ESTADÍSTICO
Los datos fueron sujetos a un análisis de varianza (ANDEVA) usando la prueba de Turkey y un análisis de correspondencia multivariado con el objeto de determinar algún nivel de correlación entre los diferentes factores (temperatura, pH, estrés osmótico y tolerancia a UV-C) analizados (SAS Institute, 1994).
RESULTADOS
De todas las muestras de foliolos de mora analizados en ambos cultivos se encontraron 84 morfotipos diferentes, 31 y 53 de Fusa y San Bernardo respectivamente. Nuestros resultados sugieren una mayor diversidad de levaduras filosféricas provenientes del cultivo de San Bernardo, descrita en función del número de morfotipos, sin embargo se encontró una mayor abundancia en la finca de Fusa (Tabla 1). Vale la pena mencionar que con excepción de los resultados de abundancia en el estrato alto de la finca de Fusa, no se observó ninguna tendencia que indique una mayor distribución de levaduras en un estrato particular. De forma similar no existen diferencias significativas en cuanto a la diversidad o número de morfotipos para cada uno de los estratos. Sin embargo, se encontró un mayor número de morfotipos en el estrato bajo, posiblemente debido a la cercanía con el suelo, lo cual sugiere que la fuente de tal diversidad proviene de leva-duras del suelo. La falta de diferencias entre los estratos, posiblemente se deba a la arquitectura enredada y compleja de las plantas de mora, la cual tiende a homogenizar la población microbiana a lo largo de la planta.
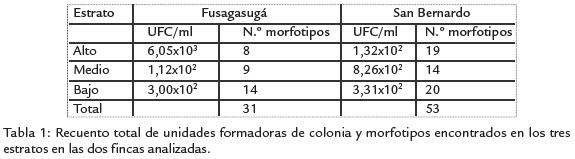
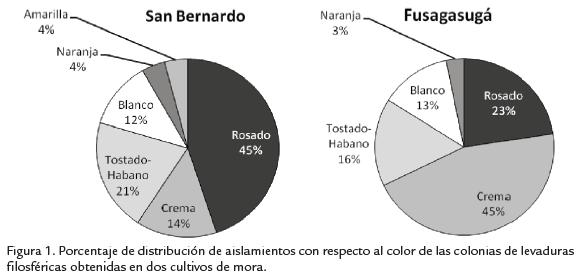
De los aislamientos obtenidos, un 86% corresponden a basidiomicetos. Sin embargo, en la distribución de ascomicetos se observaron diferencias entre las fincas evaluadas, ya que este grupo estuvo representado por el 29% (nueve morfotipos) y el 4% (dos morfotipos) de los aislamientos en los cultivos de Fusa y San Bernardo, respectivamente. En cuanto a la distribución del color de las colonias por cultivo, la figura 1 muestra una distribución homogénea de las colonias blancas en la filósfera de ambos cultivos,con 13% y 12% para los cultivos de Fusa y San Bernardo, respectivamente. Esto indicaque la distribución de colonias con algún tipo de coloración es igualmente homogénea.Sin embargo, es de anotar que la distribución del tipo de color por cultivo mostró unadiferencia estadística (p>0,05) para la distribución del color crema, el cual predominaen el cultivo de Fusa (45%; Fig. 1). El color rosado aunque predomina para San Ber-nardo (45%) no hay diferencias estadísticas con respecto a Fusa.
CARACTERIZACIÓN ECOFISIOLÓGICA DE LAS LEVADURAS
Se determinó la capacidad que poseen 80 aislamientos nativos de levaduras para crecera diferentes condiciones de cultivo, con el objeto de identificar su potencial biotecnoló-gico fundamentalmente como agente biocontrolador del hongo fitopatógeno Botrytiscinerea. En relación con la temperatura, como era de esperarse la temperatura óptimade crecimiento para la mayoría de los aislamientos (31/49 de San Bernardo y 21/31 deFusa) corresponde a 25 ºC y 30 ºC siendo mayor el número de levaduras con capacidadpara crecer a 25 ºC (31 aislamientos entre ambas localidades). Merece la pena mencio-nar además que las levaduras provenientes de Fusa presentaron en general mayorcapacidad de crecimiento ya que el 61% (19/31) lograron un crecimiento correspon-diente a una DO de 0,3 o mayor, a la temperatura óptima de crecimiento luego de 48horas de incubación, mientras que de los aislamientos de San Bernardo únicamente el18% (9/49) alcanzó dicha DO a su temperatura óptima de crecimiento (Fig. 2, panelA). Vale mencionar que para todos estos aislamientos la temperatura óptima de crecimiento corresponde a 25 ºC. Por otra parte únicamente cinco aislamientos (tres de San Bernardo y dos de Fusa) presentaron como temperatura óptima de crecimiento a los 5 ºC. Sin embargo, ninguno de estos logró un crecimiento superior a las 0,25 unidades de DO a 405 nm, lo que a pesar de su potencial para ser empleados a nivel de control de fitopatógenos en cadena de frío en post-cosecha, descarta las posibilidades de emplearlos debido a la dificultad para obtener un número importante de propágulos para su formulación. Únicamente tres aislamientos (LvF 35, LvF 59 y LvF 41), tuvieron la capacidad de crecer a 37 ºC en forma similar a temperaturas de 25 ºC y 30 ºC. Característica que los descarta como posibles agentes biocontroladores, por su potencial como patógenos oportunistas del hombre al crecer a la temperatura corporal.
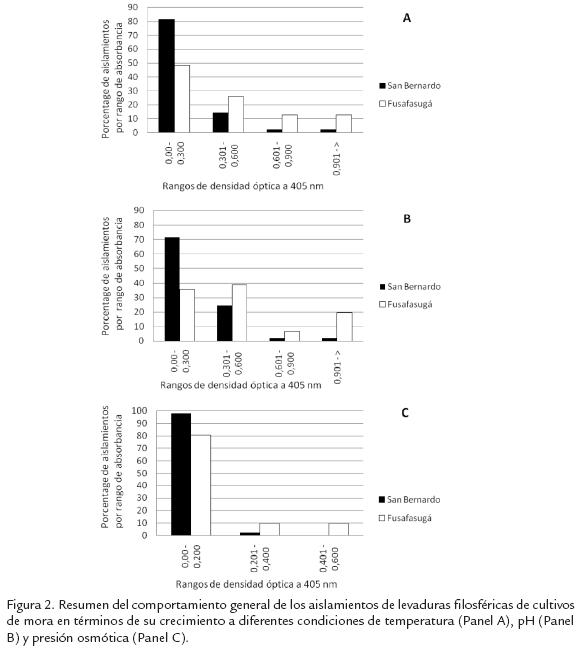
En relación a la capacidad de crecer a diferente pH (Fig. 2B), en este trabajo se encontró que el 44% de los aislamientos analizados presentaron un crecimiento superior a 0,3 unidades de DO a algún pH evaluado y de estos el 63%, lograron su crecimiento óptimo en 2 o 3 pHs diferentes. Llama la atención que de los 15 aislamientos que crecieron con una DO superior a 0,3 unidades en el cultivo de San Bernardo, siete (60%) crecieron en pH 9 o pH 7 y nueve, mientras que únicamente cuatro (27%) mostraron su óptimo a pH ácido (pH 3 o 5) o ácido y neutro. Situación similar ocurrió con los aislamientos obtenidos en el cultivo de Fusa donde ocho (40%), aislamientos presentaron su óptimo de crecimiento a pH alcalino o neutro y alcalino, mientras que únicamente cuatro (20%) aislamientos estuvieron en el espectro ácido de la escala. Como era de esperarse para las levaduras (Hohmann y Magger, 1997), la mayoría de aislamientos en ambos cultivos (73% y 85% de los aislamientos para San Bernardo y Fusa respectivamente), encontraron su óptimo de crecimiento a pH 7, solo o asociado con otros rangos de pH. Merece la pena mencionar que nuevamente los aislamientos de Fusa presentaron un mayor crecimiento en comparación a los aislamientos de San Bernardo ya que 64,5% (20/31 aislamientos), presentaron un crecimiento igual o superior a 0,3 unidades de DO mientras que en San Bernardo únicamente 30,6% (15/49 aislamientos) superaron el margen de 0,3 unidades de DO a 405 nm (Fig. 2, )panel B.
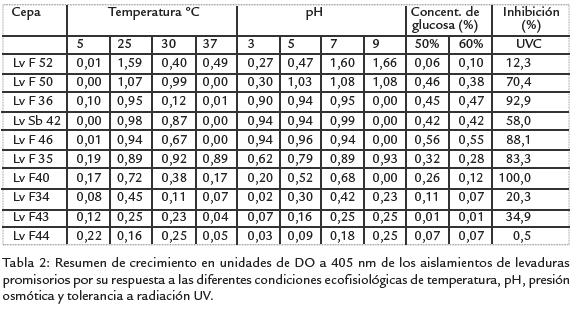
De las diferentes condiciones evaluadas en este estudio, el estrés osmótico, creado con glucosa como soluto no iónico para determinar la capacidad osmotolerante de las leva-duras, fue el más restrictivo del crecimiento. Para el caso de los aislamientos provenientes de San Bernardo, 48 de los 49 aislamientos crecen a una unidad de DO inferior a 0,1 a 405 nm después de 48 horas de incubación, a ambas concentraciones de glucosa. De los aislamientos provenientes de Fusa cerca al 20% (6/31) de los aislamientos crecieron a una concentración superior a las 0,2 unidades de DO (Fig. 2, , panel C). Esta característica, si bien mostró muy pocos aislamientos promisorios, es bien importante ya que está referida a la capacidad de tolerar condiciones de baja actividad de agua. El análisis de agrupamiento por correspondencia, analizando el comportamiento de los aislamientos obtenidos en función de crecimiento a diferentes condiciones de pH, temperatura y osmotolerancia separó un grupo de siete aislamientos (LvF 46; LvF 35; LvF 50; LvF 52; LvF 36; LvF 40 y LvSb 42; resultados no mostrados). Estos aislamientos se destacan por presentar los valores más altos en términos de la producción de biomasa para las características analizadas. Todos los aislamientos mencionados presentaron valores superiores a 0,72, 0,68 y 0,26 unidades DO a 405 nm para el crecimiento a diferentes condiciones de temperatura, pH y osmotolerancia respectivamente. La única excepción la presentó el aislamiento LvF 52 para osmotolerancia, el cual presentó un crecimiento de 0,063 y 0,102 unidades de DO a 50% y 60% de glucosa respectivamente.
TOLERANCIA A LUZ UV-B Y UV-C
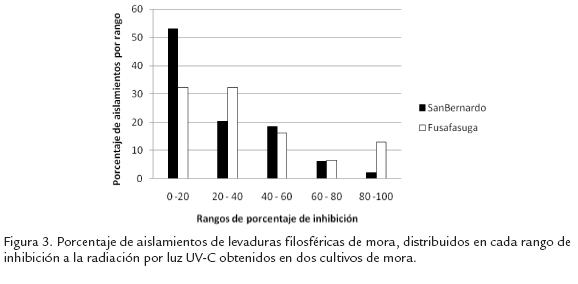
Los aislamientos obtenidos del cultivo de mora de San Bernardo presentan una población alta (53%) de los aislamientos con máxima tolerancia a la radiación UV-C (rango de inhibición entre 0,0 - 0,2; Fig. 3, ). Por otra parte la población de Fusa, si bien presenta un menor número de aislamientos en el rango de menor inhibición por luz UV-C (32%), esta población es importante, sugiriendo que la población de levaduras filosféricas en plantas de mora es enriquecida en términos de su tolerancia a la radiaciónn UV. Merece la pena mencionar que el análisis de correlación de Pearson entre la tolerancia a UV-C, estrato y coloración no mostró niveles de correlación importantes. Con el objeto de conocer si existe algun nivel de correlación entre la tolerancia a la radiación germinicida de luz UV-C y la luz UV-B, se seleccionaron aleatoriamente aislamientos de levaduras representantes de los rangos de tolerancias establecidos en la figura 3, . Como se puede observar en la Figura 4 el 50% de los aislamientos analizados presentan diferencias superiores al 20% en términos del porcentaje de inhibición por la radiación con UV-C y UV-B. Aunque las dosis de exposición a cada fuente de radiación son diferentes, es de esperar una respuesta más homogénea entre estos dos tratamientos, ya que ambos valores representan la DL90 de un mismo aislamiento de levadura. Sin embargo, estos resultados sugieren diferencias en el efecto de ambas fuentes de radiación sobre cada organismo y el mecanismo de protección de estos contra ambas radiaciones.
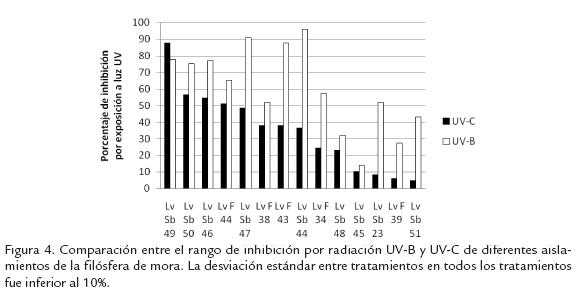
La Tabla 2 muestra el crecimiento en términos de DO a 405 nm de los siete aislamientos destacados de acuerdo al análisis de agrupamiento por correspondencia multivariado. Igualmente se incluyen tres aislamientos (LvF 34, LvF 43 y LvF 44), que a pesar de nomostrar buenos niveles de crecimiento a diferentes temperaturas, pH y condiciones deosmotolerancia, fueron seleccionados para las pruebas de antagonismo in vitroe in vivocontra B. cinereapor su tolerancia a la radiación UV. En esta tabla se muestra que lossiete aislamientos agrupados como los más destacados presentan un crecimientoóptimo a 25 ºC, como era de esperar de acuerdo a la temperatura de las zonas demuestreo. Merece destacar el aislamiento LvF 35 que presenta la misma capacidad decrecimiento a 25 ºC, 30 ºC y 37 ºC, lo que sugiere una gran plasticidad de este asila-miento en términos de su tolerancia a diferentes temperaturas. Sin embargo, su creci-miento a 37 ºC sugiere un riesgo como potencial agente patógeno al hombre o animalesde sangre caliente. Por otra parte, estos aislamientos muestran una gran tolerancia alas diferentes condiciones de pH evaluadas. La mayoría crecieron de forma similar endos o tres pHs diferentes siendo los pHs 5 y 7 los de mayor preferencia para todos losaislamientos. La Tabla 2 muestran además que los aislamientos con una buena capa-cidad para crecer bajo condiciones de estrés osmótico, son altamente inhibidos por laluz UV-C, ya que los aislamientos con crecimiento superior a 0,3 unidades de DO,presentan una inhibición a la luz UV-C superior al 60%. Por otra parte, los aislamientosLvF34, LvF43, LvF44 y LvF52, que presentan baja tolerancia al estrés osmótico, no esinhibido por la luz UV-C bajo las condiciones evaluadas.
ANTAGONISMO IN VITRO EN IN VIVO CONTRA BOTRYTIS CINEREA
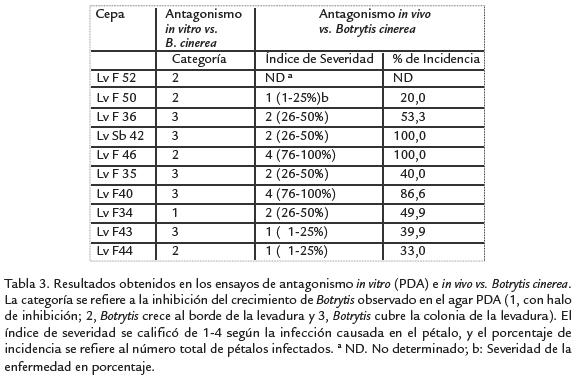
Los diez mejores aislamientos en términos de su crecimiento bajo las condiciones eco-fisiológicas evaluadas, fueron evaluados para determinar su capacidad antagonistacontra B. cinereain vitroe in vivo(Tabla 3). El análisis de antagonismo in vitromostró queunicamente un aislamiento (LvF 34) presentó una actividad biocontroladora de interes,mostrando un halo de inhibición de 5 mm, cuatro aislamientos mostraron categoría 2y los otros cinco aislamientos mostraron categoría 3. Sin embargo, al hacer la evalua-ción in vivose encontró que al menos tres aislamientos (LvF 43, LvF 44 y LvF 50), presentaron una inhibicición de crecimiento de B. cinereaa la categoría 1, permitiendo el desa-rrollo de la enfermedad únicamente entre 1-25%. Los aislamientos mencionados hansido seleccionados como promisorios por su actividad biocontroladora contra B. cinereapor lo que fueron seleccionados para su caracterización taxonómica mediante el sistemade BioloMICS. Los resultados de este caracterización indican la presencia de dos es-pecies, Candida kunwiensis(LvF 34 y LvF 44) y Rhodotorula colostri(LvF 43).
DISCUSION
El control biológico de agentes fitopatógenos en cultivos de frutas, especialmente enpost-cosecha, ha recibido gran atención en los últimos años debido a los riesgos aso-ciados con el empleo de agentes químicos en términos de la salud humana y ambiental,además del creciente surgimiento de cepas de hongos fitopatógenos como B. cinérearesistentes a dichos agentes (Chand-Goyal y Spotts, 1997; Droby et ál.,1999; Elmer yReglinski, 2006; McLaughlin et ál.,1992). En este contexto, las levaduras se han plan-teado como una alternativa de interés para el control de agentes fitopatógenos enfrutales de interés comercial (Elmer y Reglinski, 2006; McLaughlin et ál.,1992). Sinembargo, en algunos casos la eficacia del biocontrolador no ha sido consistente debido,entre otras cosas, por la influencia de diferentes condiciones ambientales (Teixido etál.,1998). Los parámetros ambientales más relevantes son la actividad de agua (aw),temperatura, pH del fruto y tolerancia a UV. Estos cuatro factores interactúan y deter-minan la capacidad de crecimiento y establecimiento de los microorganismos sobre elfruto (Teixido et ál.,1998). Por tal motivo antes de identificar la capacidad antagonistade un aislamiento de levadura, es importante hacer una selección de aislamientos quepuedan ocupar el nicho ambiental en el cual van a ser empleados. Los cultivos de mora analizados están localizados en zonas agroclimáticas muy similares. Sin embargo, presentan algunas diferencias en cuanto al manejo fitosanitario del cultivo. En la zona de Fusa por ejemplo, se hace una aplicación de fungicidas (Antracol®, Derosal®, Fitoraz®), dos veces por semana, mientras que en el cultivo de San Bernardo se hace una aplicación de productos similares de fungicidas pero una vez cada dos semanas. Este tipo de prácticas fitosanitarias, ejercen una mayor presión de selección de microorganismos tolerantes a la acción de fungicidas en la zona de Fusa. Algunas de las diferencias en la abundancia de levaduras, número de morfotipos e incluso fenotípicas, encontradas entre los cultivos analizados, pueden estar relacionadas con estas prácticas de manejo, debido a la tolerancia diferencial a los productos empleados. Buck y Burpee, 2002, por ejemplo encontraron que el empleo de Benomyl®, reduce la población de Sporobolomyces roseus y Aureobasidium pullulans, pero no causa ningún efecto sobre Cryptocccus spp., lo que indica que respuestas de este tipo pueden alterar la abundancia y diversidad de levaduras en un nicho particular.
En general a pesar de haberse seleccionado un mayor número de aislamientos de San Bernardo que en Fusa, el número de aislados con mayor capacidad para crecer bajo condiciones adversas de temperatura, pH y estrés osmótico fue encontrado en Fusa (Fig. 2). La temperatura es uno de los factores que más limita el crecimiento de los microorganismos, sin embargo, las levaduras han desarrollado mecanismos de adaptación los cuales les han permitido crecer de forma eficiente en diferentes rangos de temperatura (Beales, 2004; Gasch et ál., 2000). Es así como las temperaturas óptimas para el crecimiento de las levaduras varían de menos de 0 ºC hasta cerca de 47 ºC, dependiendo de las especies y las condiciones de crecimiento (Hohmann y Magger, 1997). En este trabajo la mayoría de los aislamientos que presentaron un crecimiento superior a las 0,3 unidades de DO, su temperatura óptima de crecimiento fue los 25 ºC. Únicamente tres de estos (LvF50, LvF51 y LvSb25), crecieron igualmente a 30 ºC. Y un solo aislamiento (LvF35) además de estas dos temperaturas, creció bien a 37 ºC. Tal resultado era de esperarse, ya que desde el punto de vista ecológico usualmente existe una relación entre la temperatura óptima de crecimiento y aquella a la que una levadura es obtenida en la naturaleza (Phaff y Starmer, 1987), lo cual indica que estas levaduras están bien adaptadas a las condiciones de campo de donde fueron obtenidas.
En cuanto al pH, las levaduras pueden crecer en rangos tan amplios que van desde pH cercanos a dos hasta cerca a nueve (Hohmann y Magger, 1997). Esto se pudo confirmar en el presente estudio ya que si bien la mayoría de aislamientos presenta su crecimiento óptimo a pH neutro, un buen número de estos puede crecer en dos o tres condiciones diferentes. Esto indica una relativamente buena adaptación a diferentes condiciones de pH por parte de los aislamientos seleccionados, sugiriendo la presencia de diversos mecanismos para llevar a cabo tal adaptación, i.e la producción de ácidos orgánicos, los cuales modifican el pH del medio para hacerlo más adecuado para su crecimiento (Beales, 2004; Fredlund et ál., 2002). Únicamente cuatro aislamientos (LvSb42, LvF36, LvF46 y LvF63), presentaron su producción óptima de biomasa a niveles superiores a 0,3 unidades de DO a pH 3, característica importante para un controlador biológico a nivel de post-cosecha, ya que un buen número de frutas (particularmente la mora), presenta un pH ácido al ocurrir algún daño en los tejidos superficiales (Teixido et ál., 1998).
Las levaduras en substratos tales como hojas, frutas y flores están expuestas a ambientes altamente variables en relación con la exposición a diferentes condiciones de estrés osmótico o actividad de agua (aw; Lindow y Leveau, 2002). La actividad de agua es definida como el potencial químico del agua libre en solución y es reconocido como un factor altamente restrictivo para el crecimiento de las levaduras, al punto que ha sido empleado por siglos en la preservación de frutas secas y alimentos ricos en azúcares tales como mermeladas (Rahmann, 1999). Las plantas en general proporcionan ambientes muy cambiantes en términos de estrés osmótico para las levaduras, ya que pueden pasar rápidamente de ambientes muy ricos osmóticamente al estar expuestos a flores o frutos, a ambientes hipo-osmóticos si son lavados por una gota de lluvia (Lindow y Leveau, 2002). Estas condiciones generan un importante factor de selección al momento de identificar levaduras con un potencial biotecnológico como controladores biológicos de fitopatógenos en estos ambientes.
En este trabajo se encontró que efectivamente una baja aw definida por altas concentraciones de glucosa fue el factor más restrictivo para las levaduras analizadas. Contrario a la temperatura y el pH, únicamente seis (7,5%) de los aislamientos obtenidos lograron crecer a 0,3 unidades o más de DO a 50% y 60% de glucosa. De estos aislamientos, cinco pertenecen al cultivo de Fusa indicando nuevamente una mayor adaptación de las levaduras de este cultivo a las condiciones ambientales extremas analizadas en este trabajo. Los aislamientos con mayor capacidad para tolerar altas concentraciones de glucosa, posiblemente han desarrollando mecanismos como osmosensores y regulación de nutrientes y transporte de osmolitos entre otros, que les han permitido adaptarse a los cambios repentinos en la aw (Beales, 2004; Gasch et ál., 2000; Lindow y Leveau, 2002; Lages et ál., 1999). La luz UV se presenta como un agente limitante del crecimiento microbiano a nivel filosférico de gran importancia (Lindow y Brandl, 2003). Las longitudes de onda alcanzando la superficie terrestre están clasificadas como UV-A (320 a 400 nm) y UV-B (290 a 320 nm). La radiación con UV-B es particularmente dañina para los organismos vivientes, ya que los fotones de estas longitudes de onda poseen una energía suficiente para causar daño directo al DNA a través de la formación de fotoproductos de DNA, de los cuales los dímeros de pirimidina son los más comunes (Sundin, 2002). La energía presente en los fotones de la radiación producida por UV-C (220 -290 nm), si bien no entran a través de la atmósfera terrestre, son importantes gracias a su aplicación industrial como control de plagas a nivel de post-cosecha. Esto debido a su acción germinicida y/o como inductores de resistencia en el hospedero, las cuales están siendo aplicadas en conjunto con levaduras como controladores biológicos (Stevens et ál., 1998; Wilson et ál., 1994).
El análisis de componentes principales no mostró ninguna relación entre el color de las colonias y la tolerancia a la luz UV-C/UV-B, resultados no mostrados. Por otra parte, es importante resaltar que la filósfera de mora evaluada en este estudio, presentó más variabilidad en cuanto al número de colores de colonia diferentes, que la filósfera de gramíneas, analizados en países templados (Buck y Burpee, 2002; Southwell et ál., 1999). En el pasto A. palustris por ejemplo, Buck y Burpee, 2002, reportaron la prevalencia de colonias blancas en más del 95% de las colonias aisladas, mientras que Southwell et ál., 1999, reportaron la predominancia de levaduras rosadas en filósfera de trigo y cebada. Estos trabajos sugieren que en dichos cultivos hay menos diversidad de levaduras con respecto a la filósfera de mora. Sin embargo, estudios posteriores deben ser realizados para determinar y entender la fuente de tal variabilidad en los cultivos analizados.
Los resultados obtenidos en este trabajo permitieron aislar una variedad importante de levaduras filosféricas en plantas de mora, con diferencias en coloración y respuesta a diferentes condiciones ecofisiológicas. Merece destacar al menos diez de estos aislamientos (Tabla 2), que debido a su capacidad para tolerar un amplio rango de condiciones ambientales adversas en términos de temperatura, pH, estrés osmótico y radiación UV, son aislamientos ampliamente adaptados a las condiciones cambiantes de este nicho ecológico. De estos diez aislamientos se destacaron cuatro por su actividad biocontroladora contra B. cinerea (Tabla 3). Estos son LvF 34 (Candida kunwiensis), el cual aparentemente produce compuestos antifúngicos solubles en agua al ser el único aislamiento capás de inhibir el crecimiento de B. cinerea en la prueba de agar in vitro. Los otros aislamientos de interés fueron LvF 44 y LvF 50, (C. kunwiensis el primero y sin identificar el segundo), los que a pesar de mostrar una supresión moderada del crecimiento de B. cinerea en el ensayo in vitro mostraron la mejor actividad en la prueba in vivo al reducir la severidad de la enfermedad a la categoría 1 (1-25% de infección), y los índices de incidencia más bajos entre los diez aislamientos analizados, 33% y 20% para los aislamientos LvF 44 y LvF 50 respectivamente. Finalmente tenemos el aislamientos LvF 43 (R. colostri), el cual a pesar de no presentar inhibición de B. cinerea en la prueba in vitro, redujo la manifestación de los síntomas de enfermedad en los pétalos de rosas a categoría 1 con un índice de incidencia por debajo del 40%.
Los mecanismos de acción de levaduras antagonistas contra hongos fitopatógenos incluyen competencia por nutrientes, degradación de componentes de la pared celular, producción de compuestos antifúngicos difusibles o volátiles, inducción de resistencia y micopatasitismo (El-Tarabily y Sivasithamparan, 2006). Los resultados de antagonismo de los aislamientos seleccionados en este estudio sugieren la presencia de compuestos antifúngicos difusibles (LvF 34) y competencia por espacio y/o nutrientes (LvF 44 y LvF 50) como los mecanismos de acción de los aislamientos de levaduras evaluados. Sin embargo, estudios más detallados para entender su mecanismo de acción deben ser llevados a cabo. Merece la pena mencionar que si bien los géneros Candida y Rhodotorula han sido previamente relacionados con el control biológico de fitopatógenos (Elmer y Reglinski, 2006; McLaughlin et ál., 1992; Teixido et ál., 1998; El-Tarabily y Sivasithamparan, 2006), en nuestro conocimiento este es el primer reporte de las especies C. kunwiensis y R. colostri identificadas como levaduras filosféricas con capacidad antagonista contra un hongo fitopatógeno (Inacio y Fonseca, 2003; Brysh-Herzberg 2004; Hong, 2004). Los resultados obtenidos en este estudio nos permiten concluir que los cuatro aislamientos seleccionados son altamente promisorios para ser desarrollados como agentes biocontroladores de B. cinerea a nivel de campo o post-cosecha, por lo que se están llevando actualmente estudios en nuestro laboratorio para determinar su potencial como agente biocontrolador contra hongos fitopatógenos como B. cinerea, el cual es altamente limitante para la industria frutícola a nivel mundial.
AGRADECIMIENTOS
Los autores agradecen a COLCIENCIAS por el apoyo financiero otorgado en el marco del proyecto “Estudio de la diversidad funcional de levaduras habitantes de la superficie foliar en mora y su relación con el control biológico de Botrytis cinerea”, contrato número 204-2005 y al laboratorio de Control Biológico de Plagas de Corpoica Tibaitatá por la determinación taxonómica de los aislamientos de levaduras.
BIBLIOGRAFÍA
AZOHOFRUCOL. Disponible en revista Frutas y Hortalizas en el URL: http://www.frutasyhortalizas.com.co/portal/includej/product_view.php. Revisado en octubre de 2008. [ Links ]
BAUTISTA G, MENDOZA H, URIBE D. Biocontrol of Rhizoctonia solani in Solanum phureja plants using native Pseudomonas fluorescens. Acta biol Colomb. 2007;12(1):19-32. [ Links ]
BEALES N. Adaptation of microorganisms to cold temperatures, weak acid preservatives, low pH, and osmotic stress: A Review. Compr Rev Food Sci Food Saf. 2004;3:1-10. [ Links ]
BIOAWARE. Disponible en el URL: http://www.bio-aware.com/BioloMICS.aspx. Revisado en diciembre de 2007. [ Links ]
BRYSH-HERZBERG M. Metschnikowia kunwiensis comb.nov., the teleomorph of Candida kunwiensis. FEMS Yeast Res. 2004;4:605-507. [ Links ]
BUCK JW, BURPEE L. The effects of fungicides on the phylloplane yeast populations of creeping bentgrass. Can J Microbiol. 2002;48:522-529. [ Links ]
CHAND-GOYAL T, SPOTTS RA. Biological control of postharvest disease of apple and pear under semi-commercial conditions using three saprophytic yeast. Biol Control. 1997;10:199-206. [ Links ]
DASHWOOD EP, FOX RA. Infection of flowers and fruits of raspberry by Botrytis cinerea. Plant Pathol. 1998;37:423-430. [ Links ]
DROBY S, LISCHINSKI S, COHEN L, WEISS B, DAUS A. Characterization of an Epiphytic Yeast Population of Grapefruit Capable of Suppression of Green Mold Decay Caused by Penicillium digitatum. Biol Control. 1999;16:27-34. [ Links ]
EL-TARABILY KA, SIVASITHAMPARAN K. Potential of yeast as biocontrol agents of soil-borne fungal plant pathogens ans as plant growth promoters. Mycoscience. 2006;47:25-35. [ Links ]
ELLIS RJ, THOMPSON IP, BAILEY MJ. Temporal fluctuations in the pseudomonad population associated with sugar beet eaves. FEMS Microbiol Ecol. 1999;28:345-356. [ Links ]
ELMER PAG, REGLINSKI T. Biosupression of Botrytis cinerea in grapes. Plant Pathol. 2006;55:155-177. [ Links ]
FREDLUND E, DRUVEFORS U, BOYSEN ME, LINGSTEN K-J, SCHNURER J. Physiological characteristics of the biocontrol yeast Pichia anomala J121. FEMS Yeast Res. 2002;2:395-402. [ Links ]
GASCH AP, SPELLMAN PT, KAO CM, CARMEL-HAREL O, EISEN MB, et al. Genomic expression programs in the response of yeast cells to environmental changes. Mol Biol Cell. 2000;11:4241-4257. [ Links ]
HOHMANN S, MAGGER W. Yeast Stress Responses. RG. Landes Company, Austin Tex; 1997. [ Links ]
HONG SG, BAE KS, HERZBERG M, TITZE A, LACHANCE MA. Candida kunwiensis sp. nov., a yeast associated with flowers and bumblebees. Int J Syst Evol Micr. 2003;53:367-372 [ Links ]
INACIO J, PEREIRA P, DECARVALHO M, FONSECA A, AMARAL-COLLACO MT, SPENCER-MARTIN I. Estimation and diversity of philoplane mycobiota onselet plants in a mediterranean-type ecosystem in Portugal. Micro Ecol. 2002;44:344-353. [ Links ]
INACIO J, A FONSECA. Reinstainment of Rhodothorula colostri (Castelli) Lodder and Rhodothurula crocea Shiffrine and Paff, former synonyms of Rhodoturula aurantiaca (Saito) Lodder. FEMS Yeast Res. 2004;4:557-561. [ Links ]
LACHANCE M, STARMER WT. Ecology and yeasts. The Yeasts (Fourth Edition); 1998:21-30. [ Links ]
LAGES F, SILVA-GRAC M, LUCAS C. Active glycerol uptake is a mechanism underlying halotolerance in yeasts: a study of 42 species. Microbiol. 1999;145:2577-2585. [ Links ]
LINDOW E, LEVEAU HJ. Phyllosphere microbiology. Curr Opin Biothec. 2002;13:259-265 [ Links ]
LINDOW SE, BRANDL T. Microbiology of the phyllosphere. Appl Environ Microbiol. 2003;69:1875-1883. [ Links ]
MCLAUGHLIN RJ, WILSON CR, DROBY S, CHARLUTZ E. Biological control of posthavests diseases of grape, peach and apple with the yeast Kloeckera apiculata and Candida guilliermondii. Plant Dis. 1992;76:413-470. [ Links ]
MOLINA GS, LA ROTTA MC, TORRES E. Incidencia de infecciones quiescentes de Botritys cinerea en flores y frutos de mora de castilla (Rubus glaucus Benth) Agron Col. 2004;22:101-109. [ Links ]
PHAFF H, STARMER WT. Yeasts associated with plant, insects and soil. In: Rose A.H., Harrison J.S (eds). The yeast, Vol 1, 2nd edn. Harvard University Press, Cambridge; 1987:123-180. [ Links ]
RAHMANN MS. Handbook of food preservation. Marcel Dekker Inc. New York, N Y. 1999. [ Links ]
SAS Institute. Sas-Stat Users Guide, Aceclus-freq, Version 6, vol 1. Forth Ed. Cary, North Carolina, USA; 1994. [ Links ]
SOUTHWELL RJ, BROWN JF, WELSBY SM. Microbial interactions on the phylloplane of wheat and barley after applications of mancozeb and triadimefo. Aust Plant Pathol. 1999;28:139-148. [ Links ]
STEVENS C, KHAN VA, LU JY, WILSON CL, PUSEY PL, KABWE MK. The germinicidal and hormetic effects of UV-C light on reducing Brown rot disease and yeast microflora of peaches. Crop Prot. 1998;17:75-84. [ Links ]
SUNDIN GW. Ultraviolet radiation on leaves: its influence on microbial communities and their adaptations In S.E. Lindow, E, I, Hecht-Poinar and V. Elliot (ed), Phyllosphere microbiology. APS Press. St Paul. Min; 2002:27-42. [ Links ]
TEIXIDO N, VINAS I, USALL J, SANCHIS V, MAGAN N. Ecophysiological responses of the biocontrol yeast Candida sake to water, temperature and pH stress J Appl Microbiol. 1998;84:192-200. [ Links ]
WILSON CL, EL-GHAOUTH A, CHALUTZ E, DROBY S, STEVENS C, et al. Potential of induced resistance to control postharvest diseases of fruits and vegetables. Plant Dis. 1994;78:837-884. [ Links ]
YANG C-H, CROWLEY DE, BORNEMAN J, KEEN NT. Microbial phyllosphere populations are more complex than previously realized. Proc Natl Acad Sci U S A. 2001;98:3889-3894. [ Links ]
YARROW D. Methods for the isolation, maintenance and identification of yeasts. The Yeasts (Fourth Edition), 1998:77-100. [ Links ]














