Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.15 no.2 Bogotá Mayo/Aug. 2010
CRIOCONSERVACIÓN DE SEMEN EN PECES: EFECTOS SOBRELA MOVILIDAD ESPERMÁTICA Y LA FERTILIDAD.
Semen Cryopreservation in Fish: Effects on Sperm Motility and Fertility.
JOSÉ GREGORIO MARTÍNEZ1, Ing Acuícola, M.Sc.; SANDRA PARDO CARRASCO1*, MVZ, Ph. D. 1 FCA/DPA/BIOGEM/ Universidad Nacional de Colombia, Sede Medellín.*Autor para correspondencia: Calle 59A #63-20, bloque 50, of. 313.Tel.: 574 430 90 44, scpardoc@unal.edu.co
Presentado 12 de octubre de 2009, aceptado 28 de enero de 2010, correcciones 2 de marzo de 2010.
RESUMEN
La crioconservación de semen de peces, como de otras especies, presenta aún efectos que disminuyen la calidad espermática y comprometen directamente la capacidad de la célula para participar exitosamente en los procesos de fertilización y desarrollo embrionario. Características como movilidad y capacidad de fertilización del espermatozoide son consideradas criterios de calidad que permiten medir el éxito o fracaso del proceso, pues se consideran variables integradoras, siendo indicadores que dependen no de un solo factor sino de la estabilidad y bienestar del conjunto de estructuras, enzimas y compuestos funcionales subcelulares que dan lugar a estas características espermáticas. Daños en la membrana (adenilato ciclasa, canales iónicos, agrupamiento de otras proteínas, entre otras) y su implicación en la ruta de señalización que da lugar a la activación espermática, degradación del ATP, fragmentación del ADN nuclear y mitocondrial (genoma), degradación de enzimas Kinasas y otras proteínas citosólicas (proteoma) son considerados hoy día como algunos de los factores moleculares que más se afectan durante la crioconservación y que disminuyen ostensiblemente la capacidad fertilizante y la movilidad del espermatozoide en los peces. Propuestas sobre los mecanismos moleculares por los cuales se interrelacionan y actúan estos factores subcelulares como consecuencia de la crioconservación, son algunos de los temas tratados en la presente revisión. Comprender los principios y factores que están involucrados en el origen de dichos daños, permitirá mejorar los procesos de crioconservación, haciéndolos menos nocivos y más eficientes.
Palabras clave: crioconservación, fertilización, genoma, movilidad espermática, proteoma.
ABSTRACT
The cryopreservation of semen in fish, as in many species even shows effects that decrease sperm quality and directly engage cell ability to successfully participate in the processes of fertilization and embryonic development. The characteristics such as mobility and fertilizing capacity of fertilization of sperm are considered to be quality criteria that allow to measure the success or failure of the process, since they are considered integrative variables, being indicators that depend not on a single factor, but on the stability and welfare of all structures, enzymes and subcellular functional compounds that give place to these spermatic characteristics. Membrane damage (adenylate cyclase, ion channels, grouping of other proteins, among others) and their implication in the route of signaling pathway leading to spermatic activation, ATP degradation and fragmentation of nuclear and mitochondrial DNA (genome), degradation of kinase enzymes and other cytosolic proteins (proteome) are considered today, as some of the molecular factors that most affect during cryopreservation and markedly decreasing the fertilizing capacity and mobility of sperm in fish. Proposals on the molecular mechanisms, by which these subcellular factors interact and act as consequence of cryopreservation are some of the topics covered in this review. Understanding the principles and factors that are involved in the origin of such damages, will allow to improved cryopreservation processes, making them less harmful and more efficient.
Key words: cryopreservation, fertilization, genome, proteome, spermatic motility
INTRODUCCIÓN
El éxito de la piscicultura depende, entre otros factores, de tecnologías confiables de producción de alevinos con calidad y en cantidad suficiente para garantizar la viabilidad del cultivo. Dicha viabilidad ha sido focalizada por la industria piscícola en la calidad de los ovocitos más que en las células espermáticas, cuando realmente es la calidad de ambos gametos lo que determina el éxito o fracaso de la fertilización y la sobrevivencia larval (Rurangwa et al., 2004).
El buen desempeño productivo de los alevinos y sucalidad, han sido correlacionados como variables dependientes de la nutrición y alimentación de las larvas (Fernández etal., 2009), del manejo en cautiverio (densidad de siembra) (Slembrouck et al., 2009), o del control de factores físico-químicos del agua (temperatura, salinidad, pH, entre otros) (Ludwig y Lochmann, 2009); sin embargo, actualmente los estudios vienen enfocando sus esfuerzos en demostrar que la calidad de los alevinos posee estrecha relación con la calidad de los gametos que los originan (Bobe y Labbé, 2010), los cuales pueden verse afectados por daños celulares y moleculares, desencadenando, probablemente, detrimento de su calidad y por tanto de su viabilidad (Cosson, 2007). Dichos daños pueden ser originados por diversos factores intrínsecos, como los ocasionados durante la espermatogénesis (Dabrowsky y Ciereszco, 2001) o extrínsecos, como los provocados durante procesos de almacenamiento o manipulación, tal como la crioconservación del semen (He y Woods, 2004). La crioconservación es una técnica ampliamente utilizada en la acuicultura para la conservación de gametos, especialmente de células espermáticas (Lahnsteiner et al., 2000; Velasco-Santamaría et al., 2006; Pan et al., 2008), constituyendo una herramienta importante para la conservación de la diversidad (Wildt et al., 1999; Bobe y Labbé, 2010) y para la acuicultura (Watson y Holt, 2001).
Sin embargo, la crioconservación de semen en peces, como en muchas otras especies, aún no es una técnica perfecta, teniendo efectos sobre la calidad espermática que compromete directamente la capacidad de la célula para participar con éxito en los procesos de fertilización y desarrollo embrionario (Maria etal., 2006), afectando la calidad morfológica de la larva (Horváth y Urbanyi, 2000) y por lo tanto su sobrevivencia.
De esta forma, entender los mecanismos intracelulares y los factores que puedan estar interviniendo y ocasionando dichos daños, permitiría contribuir al desarrollo de protocolos de crioconservación más exitosos y seguros para el almacenamiento de semen y por tanto de alevinos de mayor calidad.
El objetivo de esta revisión fue: i) Describir algunos efectos de la crioconservación del semen sobre la calidad y el desempeño espermático, particularmente sobre la movilidad y la capacidad fecundante del espermatozoide, y ii) Describir los daños moleculares y celulares que ocurren en el espermatozoide durante la crioconservación, así como los principios físicos y bioquímicos que los generan.
1. CALIDAD ESPERMÁTICA
La calidad espermática ha sido revisada por diversos autores, entre ellos Billard et al., 1995, Rurangwa et al., 2004 y más recientemente Bobe y Labbé, 2010, definiéndola, desde un punto de vista biológico, como la habilidad que tiene el espermatozoide para fertilizar exitosamente y subsecuentemente desarrollar un embrión normal. Dicha habilidad está regida por parámetros que permiten predecir y determinar el grado de calidad del gameto.
Las variables que permiten inferir la calidad y bienestar de la célula espermática son: movilidad, integridad de la membrana plasmática, concentración de nucleótidos (metabolismo energético), actividad mitocondrial, Integridad de ADN, morfología y tasa de fertilización. Recientemente se ha observado que los daños provocados a células espermáticas por prácticas biotecnológicas como la crioconservación y ginogénesis, confieren importancia a estas variables de calidad del espermatozoide y su relación con el desarrollo embrionario, la malformación y la sobrevivencia larval (Kato et al., 2001).
1.1 Movilidad espermática
La movilidad es la condición por la cual el espermatozoide puede alcanzar el ovocito para lograr exitosamente la fertilización (Tabares etal., 2005) y ha sido considerada como una de las principales variables de calidad espermática en peces (Rurangwa et al., 2004), siendo una variable de calidad integradora, al combinar varios componentes celulares (Fig. 1) responsables de la activación y sostenibilidad de la movilidad y movimiento progresivo del espermatozoide (Bobe y Labbé, 2010). Los mecanismos involucrados en la activación de la movilidad espermática son considerados de vital importancia en la regulación de procesos como fertilización artificial y la crioconservación (Inaba, 2007; Ohta y Shinriki, 1998).
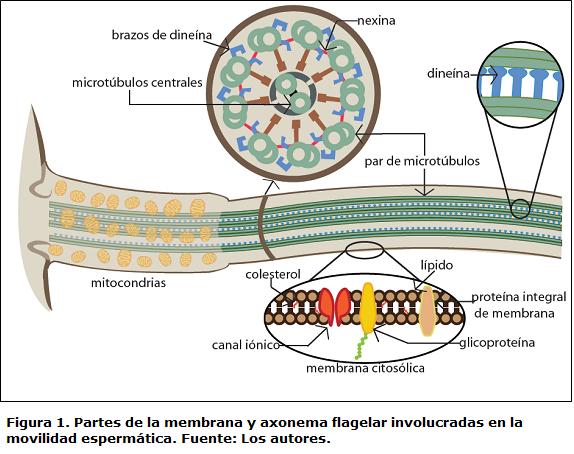
La activación de la movilidad espermática en peces de fertilización externa ocurre por los cambios iónicos y de osmolaridad que suceden cuando los espermatozoides entran en contacto con el agua una vez liberados en el proceso de reproducción (Linhart et al., 2002). Adicionalmente han sido reportadas varias glicoproteínas como activadoras de la movilidad, sintetizadas en las células foliculares y transferidas a la capa externa del ovocito maduro, las cuales durante la reproducción llegan a receptores de la membrana plasmática de los espermatozoides induciendo rutas de señalización intracelulares (Oda et al., 1998).
La activación espermática en peces ha sido revisada por algunos autores (Krasznaiet al., 2000; Tabares et al., 2005; Alavi y Cosson, 2006; Bobe y Labbé, 2010) encontrando que esta puede depender de la presencia extracelular de iones como Na+, Ca2+ o K+, y, en algunos casos, sólo de la variación de la osmolaridad extracelular originada o no por iones, como lo demuestran Ciereszko et al., 2000. Sin embargo, el mecanismo transduccional que se genera al interior de la célula no ha sido esclarecido para todas las especies. Existe un modelo basado en la activación seminal mediada por canales iónicos (Fig. 2), que se ha constituido en la base para la comprensión del proceso en peces. Así, en salmónidos, la diminución en la concentración de K+ extracelular (choque hiposmótico de K+) da inicio a la activación de la movilidad espermática. El mecanismo consiste en que la disminución del K+ extracelular causa un eflujo de K+ intracelular que consecuentemente, origina una hiperpolarización de la membrana, incremento de Ca+ intracelular (Tanimoto et al., 1994) y finalmente la síntesis de cAMP acoplada a la activación de la adenilato ciclasa (Morisawa y Ishida, 1987). El mecanismo por el cual la hiperpolarizacion de la membrana origina la activación de la adenilato ciclasa es desconocido, sin embargo los canales de potasio mencionados en peces pueden ser similares a los reportados para paramecio, en donde se acoplan a la activación de la adenilato ciclasa (Izumi et al., 1999). No obstante, el inicio de la movilidad puede no implicar una ruta de señalización dependiente de cAMP, como ocurre en carpa, a pesar de la hiperpolarización por eflujo e influjo de iones (Krasznai et al., 2000).
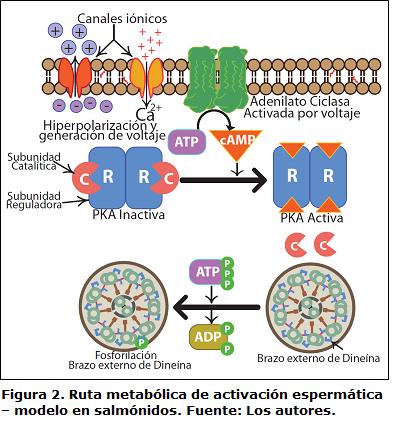
Una vez originado el cAMP en la ruta de señalización intracelular, es posible que continúe la transducción de señales por medio de activación de proteínas como la proteína Kinasa A (PKA). En salmónidos, la subunidad reguladora de la PKA es dependiente de cAMP, y es claramente fosforilada durante la activación de la movilidad espermática (Inaba, 2007). Esto se comprobó mediante microscopía electrónica observándose que la PKA se encuentra localizada circundando el brazo externo de la dineína, proteína que se encuentra formando un complejo con cada uno de los pares de microtúbulos del axonema flagelar (Fig. 1). Esto concuerda con la fosforilación de la cadena ligera de la dineína que se observa en la activación de la movilidad (Itoh etal., 2003). Se sabe a su vez, que la subunidad catalítica de PKA, de bajo peso molecular y con una secuencia N-terminal muy corta, está involucrada en funciones de anclaje a los microtúbulos del axonema flagelar (Agustín et al., 2000) posiblemente mediada por la dineína.
Por su homología en cuanto a función con el brazo externo de la dineína en paramecio, cuyo peso es determinado en 29 KDa (Hamasaki et al., 1991), la fosforilación de la cadena ligera del brazo externo de la dineína en peces, cause posiblemente la activación del microtúbulo (Inaba, 2007), originando un proceso de deslizamiento y tensión que resulta en oscilaciones del flagelo (Gibbons, 1989).
Es claro, que el inicio de la activación espermática en peces implica una constante fosforilación de proteínas desde nucleótidos como el ATP (Hayashi et al., 1987), incluso durante el mantenimiento de todo el proceso de movilidad, en el caso de la fosforilación de la cadena ligera del brazo externo de la dineína por parte de la PKA (Inaba, 2007). Una vez activa por la PKA, la dineína posee la habilidad para obtener energía en forma constante durante la movilidad a partir de la ruptura de enlaces fosfoéster, fenómeno que depende de su propia capacidad hidrolítica del ATP, la cual le permite obtener energía a partir de nucleótidos de adenosina trifosfatada, liberando la energía necesaria para cumplir con actividades de trabajo, fuerza y deslizamiento sobre los microtúbulos; por lo que se le conoce a esta proteína como dineína-ATPasa (Gibbons, 1989).
Evidentemente, una gran cantidad de ATP es necesaria para la activación y sostenibilidad de la movilidad espermática (Cosson et al., 1991, 1995), el cual es aportado en la mayoría de los peces por la mitocondria, por lo que se podría afirmar que su daño afectaría negativamente la movilidad.
1.1.1 Efectos de la crioconservación sobre la movilidad espermática
Durante la crioconservación se pueden originar dos tipos de daños a la mitocondria que afectarían la movilidad: un daño directo sobre su ADN o su membrana, y uno indirecto provocado por la fragmentación del ADN nuclear, del cual depende la mitocondria para obtener algunas proteínas que no codifica su genoma (Kurland y Andersson, 2000).
Durante la crioconservación de semen en Polyodon spathula se originaron daños a nivel de ADN nuclear, provocando una marcada disminución de la movilidad espermática posdescongelación, causada aparentemente por inadecuada osmolaridad del diluyente y de la concentración del crioprotector (Li et al., 2008). En trabajos realizados por Irvine et al., 2000, se observó que semen con alto grado de daño en su ADN presentó baja movilidad y velocidad (Li et al., 2008). Es posible que el ADN del que se hable en estos casos sea nuclear, el cual desempeña funciones importantes en la codificación de proteínas necesarias para la mitocondria en la cadena respiratoria (Cooper, 1997), pues en las células animales la mitocondria sólo posee ADN que codifica, en su mayoría, para proteínas de la respiración aeróbica celular que da lugar a la producción de ATP. Estas son por ejemplo las citocromo oxidasas (b y c) y el complejo ATP-sintasa, entre otras proteínas de importancia (Andersson et al., 2003); sin embargo, la mitocondria depende del ADN nuclear para importar otras proteínas que le permiten desempeñar su función energética, entre ellas, la ADN polimerasa, que participa en la replicación del genoma mitocondrial, ARN polimerasa, que interviene en la transcripción de genes, las enzimas del ciclo de Krebs, el ciclo de la úrea y gran cantidad de las proteínas de la membrana mitocondrial interna (Cooper, 1997). Considerando que el proceso de respiración espermática es importante durante la movilidad para llevar a cabo los procesos de fosforilación oxidativa (Kopeika et al., 1997), que ocurre en la mitocondria y que da lugar a la síntesis de ATP, puede suponerse que daños en el ADN, bien sea mitocondrial o especialmente el nuclear por efectos de la crioconservación, podrían afectar la síntesis de proteínas involucradas en la producción energética celular, causando la disminución de la movilidad espermática.
Aunque estas relaciones entre ADN y movilidad espermática no han sido elucidadas, algunos autores afirman que más allá de los daños de fragmentación ocasionados al ADN nuclear, la disminución en la movilidad debe asociarse más con daños en la mitocondria que con cualquier otro lugar de la célula, reafirmando la condición de esta organela como núcleo energético del espermatozoide (Fraser y Strzezek, 2007) y de cuya disponibilidad de ATP depende la detención o prolongación de la movilidad (Dreanno et al., 1999).
No obstante, aunque la fragmentación del ADN se manifiesta en un gran porcentaje de células espermáticas cuando son expuestas a radiación ultravioleta, esta no ocasiona disminución de la movilidad espermática en lampreas (Ciereszko et al., 2005), lo que desvirtúa la relación entre el ADN y su injerencia en la generación de ATP, puesto que la movilidad no debería ocurrir en este caso sin la estabilidad de la molécula genómica. Esto es si consideramos que de la integridad del ADN nuclear o mitocondrial depende la síntesis de proteínas para la producción de ATP. Entonces, es posible pensar que al interior de la célula espermática existan otras fuentes de energía independientes tanto de la fosforilación oxidativa (a cargo de la mitocondria) como de las proteínas codificadas por el genoma espermático que se requieren en la mitocondria para la generación de energía durante la movilidad. En espermatozoides de trucha, se ha encontrado la presencia de moléculas como la fosfocreatina, un compuesto que sirve como fuente de grupos fosforilos para la síntesis rápida y anaeróbica de ATP a partir de ADP, verificándose su funcionalidad en la movilidad espermática de esta especie cuando fue adicionado en presencia de ADP a espermatozoides desprovistos de membrana (Saudrais et al., 1998).
Al parecer, el grado de fragmentación del ADN provocado por la crioconservación puede o no estar correlacionado con la producción de energía para la movilidad espermática, por lo que en algunos casos la medición directa de los efectos de la crioconservación sobre la concentración y disponibilidad de la molécula energética (ATP), sería el mecanismo más eficiente para predecir la capacidad móvil de una célula espermática posdescongelación.
He y Woods, 2004, evaluaron el efecto de la concentración de algunos crioprotectores sobre el contenido de ATP; así, durante la crioconservación de semen de Morone saxatilis, el dimetilsulfóxido en una concentración del 10% permitió mantener intacta la membrana plasmática del espermatozoide, aunque disminuyó significativamente el contenido de ATP mitocondrial y por ende su actividad. Sin embargo, cuando fue utilizada la glicina como crioprotector se incrementó el porcentaje de esperma posdescongelación con actividad mitocondrial intacta y contenido de ATP, pero disminuyó significativamente la protección a la integridad de la membrana plasmática.
No sólo los crioprotectores se consideran causantes del daño al sistema de activación de la movilidad espermática, por lo visto, son varios los factores que durante la crioconservación pueden afectar la movilidad, así, en Xiphosphorus helleri esta fue disminuida significativamente por el aumento de la relación semen: diluyente, sin que la congelación hubiese sido fuente de variación (Huang et al., 2004), por el contrario, en lamprea se demostró una disminución marcada de la movilidad espermática durante la congelación conforme aumentaba la fragmentación de su ADN cuando el semen era almacenado a bajas temperaturas (Ciereszko et al., 2005).
Por otra parte, Zilli et al., 2005, plantean que no solamente la alteración en el genoma sino también en el proteoma, originada por la crioconservación, puede causar disminución de la movilidad espermática. Así mismo, los autores formulan que la activación del genoma es uno de los primeros eventos críticos en la vida de un nuevo organismo y que el arreglo de la activación de esos genes debe ser controlado correctamente, evento que depende de los cambios en la estructura de la cromatina y sobre todo de la disponibilidad de proteínas involucradas en la expresión génica como son los factores de transcripción (Latham y Schultz, 2001).
Zilli et al., 2005, a través de análisis espectrométrico de masa y electroforesis en dos dimensiones, lograron comparar el proteoma espermático de Dicentrarchus labrax antes y después de la crioconservación, encontrando un total de 163 proteínas espermáticas en semen fresco y la desaparición de 21 de ellas en semen descongelado. Entre estas proteínas degradadas se encuentran factores de transcripción de genes como SBK1, importante durante los eventos de fusión espermatozoide-ovocito. A su vez se detectó también la degradación de la Ciclina E, que interviene en la activación de la Ciclina dependiente de Kinasa 2 (cdk2). En la actualidad se sabe que cdk2 fosforila proteínas fosfatasas como PP1gamma2, la cual se considera una enzima clave en el desarrollo y regulación de la movilidad espermática (Huang y Vijayavaghavan, 2004). De este modo, se concluyó que disminuciones en la movilidad espermática de Dicentrarchus labrax posdescongelación, se atribuían a la ausencia y degradación de proteínas como estas, fundamentales en los eventos de señalización intracelular que dan lugar a la movilidad espermática.
Sin embargo, no en todos los peces la congelación resulta lesiva. En brema de mar Acanthopagrusschlegeli, la crioconservación no afectó significativamente la movilidad espermática posdescongelación, a la vez que no indujo mutaciones en su genoma (Hsu et al., 2008). Esto demuestra que la movilidad puede no siempre verse afectada por el proceso de criogenia, a tal punto que en algunos casos el tipo de crioprotector puede mantener intacta la movilidad posdescongelación logrando que sea idéntica a la del semen fresco. Es el caso que ocurre cuando el DMSO más sucrosa como diluyente, son usados en la congelación de células espermáticas de Maccullochella peelii peelii (Ceccon et al., 2008). En la mayoría de los casos, el DMSO es el crioprotector permeable con mayor éxito y mejores resultados tanto en peces de agua salada (Suquet et al., 2000) como de agua dulce (Viveiros y Godinho, 2009) (Tabla 1).
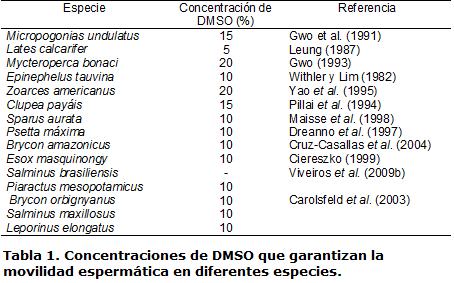
No obstante, la toxicidad de este compuesto puede variar entre especies, siendo lesivo para algunas (Tabla 2), por lo que se debe recurrir a otros crioprotectores diferentes al DMSO, quienes han demostrado tener funciones protectoras que garantizan una mejor integridad de la movilidad posdescongelación en células espermáticas en diferentes peces.

No es claro aún el mecanismo por el cual la presencia de ciertos crioprotectores pueden afectar la movilidad en algunas especies de peces y en otras mantenerla cercana a valores del semen fresco. Además, se sabe que aun conociéndose la efectividad del crioprotector en una especie de pez, la variación en su concentración puede causar efectos tóxicos que son inversos a los deseados.
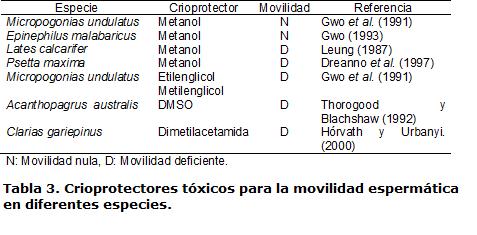
Mediante citometría de flujo se reveló que un alto porcentaje de células espermáticas de Psetta maxima no presentó daños en la membrana plasmática, en la mitocondria, ni sobre la movilidad espermática en presencia de DMSO (Ogier de Baulny, 1997). Sin embargo, el DMSO se mostró tóxico a altas concentraciones en semen de Lates calcarifer en donde la movilidad posdescongelación se redujo cuando la concentración de DMSO fue mayor al 5% (Leung, 1987), evento que ocurrió igualmente en Mycteroperca bonaci cuando la concentración se incrementó 30% (Gwo, 1993). Casos similares de disminución de la movilidad espermática se han presentado en semen posdescongelación al utilizar este crioprotector en Sparus aurata (Cabrita et al., 2005), Prochilodus lineatus (Viveiros et al., 2009) y Epinephilus marginatus (Cabrita et al., 2009). Otros crioprotectores han mostrado efectos negativos sobre la movilidad espermática posdescongelación, disminuyéndola o anulándola por completo (Tabla 3).
Es claro hasta ahora que la crioconservación, en especial el crioprotector, puede causar daños con efectos sobre la movilidad espermática, sin embargo, el mecanismo por el cual este evento ocurre a nivel subcelular o molecular no es claro, aunque algunos autores mencionan que sus efectos sobre la célula espermática se dan justo antes de la congelación, disminuyendo la movilidad (Suquet et al., 2000). Algunas hipótesis plantean la posibilidad que los crioprotectores interactúen directamente con las reservas de ATP, inestabilizando la molécula energética y disminuyendo su concentración en la célula espermática. Así, He y Woods, 2004, en Morone saxatilis, encontraron que el nivel de ATP precongelación disminuyó considerablemente cuando el DMSO entró en contacto con las células espermáticas, y que adicionalmente, su descenso se vio aún más acentuado después de la congelación. De la misma forma Cabrita et al., 2005 en Sparus aurata, observaron una disminución del ATP del 53,6%, resultado que se correlacionó con una marcada disminución de la movilidad espermática y despolarización de la membrana mitocondrial. Anteriormente, se destacó la importancia de la membrana plasmática en la ruta de activación de la movilidad espermática como portadora de las principales proteínas que dan inicio a las señales transduccionales en este proceso, entre ellas la adenilato ciclasa y los canales iónicos. Así, otra de las posibles causas de la disminución de la movilidad espermática puede verse asociada a daños de membrana citoplasmática durante la crioconservación, las cuales pueden deberse a varios factores:
- a.
- Modificación de la bicapa fosfolipídica por algunos crioprotectores como el glicerol, considerando su capacidad de insertarse entre los fosfolípidos, llegando a afectar las vías del metabolismo intermedio (Hammerstedt y Graham, 1992).
- b.
- Estrés térmico de la membrana citoplasmática provocada por la transición de los fosfolípidos de fase líquida a fase de gel durante la congelación, excluyendo a las proteínas integrales de membrana, agrupándolas y disminuyendo por tanto su actividad catalítica o funcional (Labbé et al., 1997).
- c.
- Clusterización de proteínas integrales de la cara protoplasmática (interna) de la membrana espermática, causadas por la rápida separación lateral de lípidos, posiblemente originado por la alta tasa de congelación al que se pueda ver sometida la célula espermática (Drokin et al., 1998).
- d.
- Daño mecánico por ruptura de la membrana por efectos de la nucleación y consecuente formación de cristales de hielo (Darin y White, 1977; Drokin et al., 1989)
- e.
- Ruptura de la membrana basada en la transición de la fase termo trópica de lípidos de la bicapa. Así, si el tiempo para la separación de fases durante la congelación no es suficiente, pueden originarse poros en la membrana espermática durante la descongelación, por el incorrecto agrupamiento lipídico (Quinn, 1985).
- f.
- Ruptura de la membrana durante la congelación o descongelación por los procesos de deshidratación o hidratación, en los cuales la excesiva fricción del agua al transportarse a través de la bicapa sobrepasa la capacidad de difusión de la membrana (Muldrew y McGann, 1990).
- g.
- Formación de poros de agua en bicapas de palmitoil-fosfatidilcolina, provocadas por la molécula de DMSO, introduciéndose inicialmente dentro de la bicapa y ocupando una posición justo por debajo de las cabezas de los grupos de lípidos, reduciendo el grosor de la bicapa y ejerciendo compresión sobre las cabezas de los grupos de lípidos, lo que reduce su área y disminuye la rigidez de la membrana, produciéndose entonces la formación del poro (Notman et al., 2006).
1.2 Fertilización
La fertilización es definida como el proceso en el cual un gameto haploide masculino interactúa con uno femenino para formar un cigoto diploide. En este evento el espermatozoide realiza dos grandes contribuciones: proporciona el material genético paterno al huevo e inicia la ruta de señalización intracelular que permite la activación del ovocito y desarrollo del embrión, aportes sin los cuales la fertilización no podría darse (Whitaker y Swann, 1993). La capacidad del espermatozoide para desempeñar exitosamente esta función puede depender, en gran medida, de la activación de la movilidad originada por el proceso de transducción de señales, como ya fue descrito anteriormente, lo que demuestra la importancia de las proteínas (incluyendo canales iónicos y enzimas) y su síntesis celular en la activación espermática y la fertilización. Estas proteínas tienen sus orígenes en el ADN, cuya naturaleza puede ser de tipo nuclear o mitocondrial y de cuya estabilidad o daño dependería la expresión o no de dichas proteínas, aspecto que podría afectar la capacidad fertilizante del espermatozoide.
1.2.1 Efectos de la crioconservación sobre la capacidad fertilizante
Los daños en ADN causados por la crioconservación han sido reportados en varias especies animales como peces (Zilli et al., 2003; Li et al., 2008), primates (Li et al., 2007), caprinos (Peris et al., 2004) e incluso en humanos (Sharma et al., 2004).
Así mismo y con respecto a los daños a nivel de ADN ocasionados por la crioconservación en semen de peces, Miskolczi et al., 2005, proponen la hipótesis de daño mecánico directo por el desarrollo intracelular de hielo, comparándolo con el daño de fractura de ADN que pudiera ocasionar la radiación. Por otra parte, también atribuyen el origen de estos daños a radicales libres de oxígeno.
Para evidenciar si los daños en el ADN pueden causar efectos sobre la capacidad fertilizante del espermatozoide, en goldfish Carassius auratus fueron provocados daños en el ADN nuclear por radiación ultravioleta (UV) sin que esta capacidad fuese afectada (Pachos et al., 2001). Esto igualmente ocurrió cuando la fragmentación del ADN en células espermáticas de lamprea marina, provocada por estrés oxidativo (peróxido de hidrógeno), no tuvo efectos negativos sobre la tasa de fertilización (Ciereszko et al., 2005), sin embargo, la radiación UV en células espermáticas de esta misma especie, produjo una disminución marcada de la tasa de fertilización.
La crioconservación origina daños de fragmentación de ADN similares a los provocados por el peróxido de hidrógeno y la radiación UV (Zilli et al., 2003) tal y como ocurre en Dicentrarchus labrax (Zilli et al., 2003) y trucha arcoíris (Labbé et al., 2001), siendo el más común la fragmentación originada por estrés oxidativo a causa de radicales libres de oxígeno, apareciendo en las primeras etapas de almacenamiento y manipulación (Pérez et al., 2009). Sin embargo, no en todas las especies afecta a la capacidad de fertilización del espermatozoide. Suquet et al., 1998, en Psetta máxima y Chereguini et al., 2002 en Scophthalmus maximus, demostraron que la fertilización y otros parámetros relacionados con el desarrollo larval, fueron similares utilizando semen fresco y crioconservado. Sin embargo, el análisis de ADN en estas células no fue realizado. Otros autores afirman que la fragmentación de ADN puede estar asociada con la disminución de la habilidad de fertilización (Sun et al., 2000; Gwo et al., 2003).
La no incidencia de la fragmentación de ADN del espermatozoide sobre la fertilización puede deberse a que durante este proceso algunos ovocitos activan el sistema enzimático de reparación de ADN propio, el cual actúa sobre el ADN de las células espermáticas reparando el daño, permitiendo así que se lleve a cabo la fertilización y el normal desarrollo del embrión (Kopeika et al., 2004), una habilidad ya conocida para mamíferos y otros peces (Ashwood y Edwards, 1996; Ahmadi y Ng, 1999).
Los daños en ADN causados por estrés oxidativo y radiación UV son provocados mediante mecanismos diferentes y por tanto su reparación por el ovocito tiene vías heterogéneas. Así, la radiación UV ocasiona daños por modificación de las bases como formación de dímeros de pirimidinas tipo ciclobutanos, glicoles de timina y fotoproductos de pirimidina-pirimidona (Sancar, 2000), por su parte el estrés oxidativo lo genera a partir de radicales libres de oxígeno o de hidroxilos quienes causan más de 20 diferentes tipos de daño al ADN, especialmente la oxidación y fragmentación de los anillos nitrogenados de las bases (Slupphaug et al., 2003). La Reparación por Escisión de Base (BER, por sus siglas en Inglés) se constituye en el principal sistema de reparación del daño generado por la oxidación del ADN (Brozmanova et al., 2001). Las principales lesiones que repara BER son la desaminación, oxidación y ausencia de bases (Memisoglu y Samson, 2000). BER inicia su acción con el reconocimiento de bases anormales por glicosidasas específicas y el clivaje de los enlaces glicosídicos que unen la base a la columna de azúcar fosfato. Estos sitios son procesados adicionalmente mediante rutas de reparación (Dianov et al., 2003). En lamprea marina, se sugiere que BER demuestra ser eficiente en ovocitos y embriones, siendo capaz de reparar serias lesiones causadas por peróxido de hidrógeno, un agente oxidante del ADN (Ciereszko et al., 2005).
Conservar las características intactas posdescongelación que permitan a un espermatozoide lograr con éxito la fertilización, ha sido explicado también desde la resistencia celular. De acuerdo con Kopeika y Kopeika, 2007, es posible que las células espermáticas posean atributos que les permitan prevenir los daños y desarrollar criorresistencia durante su congelación. Es así como durante la crioconservación de células de Saccharomyces cerevisiae (eucariota), se detectó mediante microarreglos de ADN, la expresión de algunos genes inducidos por la congelación, así como aquellos relacionados con el rescate celular, defensa y virulencia y metabolismo energético. Estos genes eran clasificados específicamente como codificantes de proteínas de choque térmico, proteínas protectoras del estrés oxidativo y enzimas involucradas en el metabolismo de glucosa (Odani et al., 2003). Así también, en humanos recientemente se ha descubierto un gen codificante para un factor de protección contra el choque térmico espermático y que está asociado específicamente al cromosoma Y, denominado HSFY (Y-specific heat shock factor) (Vinci et al., 2005). Aunque estos mecanismos no han sido identificados aun en peces, es posible que algunos genes similares se estén expresando en células espermáticas de algunas especies durante la congelación, variando el nivel de expresión según la especie, haciendo posible que la fragmentación sea inhibida o contrarrestada en menor o mayor grado, permitiendo que la fertilización no se afecte o se vea alterada (según el caso de activación o no de los genes en la especie) por el proceso de crioconservación al que fue sometido.
Adicionalmente, existen otros factores externos que también pueden proteger la célula espermática y permitir la garantía de eficiencia fertilizante de los espermatozoides. En Morone saxatilis, se encontró que a pesar de que la crioconservación disminuía considerablemente la capacidad fertilizante del espermatozoide, esta podría ser mejorada cuando se adicionaba glicina en presencia de DMSO en el diluyente durante la congelación (He y Woods, 2004), en contraste, en esta misma especie y bajo el mismo experimento, la sola presencia de DMSO (sin glicina), sin importar su concentración, no garantizaba el incremento de la tasa de fertilización. Los autores sugirieron en este caso, que la glicina tiene la habilidad de mejorar la capacidad fertilizante del espermatozoide. Aunque aún no se elucida el mecanismo, se afirma que la glicina puede interactuar electrostáticamente con los grupos fosfatos de los fosfolípidos de la membrana plasmática, formando una capa en la superficie de la misma (Anchordoguy et al., 1988). Hipotéticamente este evento podría generar deshidratación al esperma antes de la congelación, disminuyendo el punto de congelación intracelular, haciendo que la tasa de congelación difiera de aquellas en donde no hay glicina.
La importancia de la disminución del punto de congelación radica en que la presencia de agua intracelular es posiblemente uno de los principales factores responsables de la formación de cristales de hielo durante la crioconservación, causando diversos tipos de daños (Viveiros et al., 2001; Zachariassen, 2000), por lo que la disminución del agua intracelular facilita la acción del crioprotector interno, permitiéndole disminuir más eficientemente el punto de congelación, además de proteger al espermatozoide contra otros daños causados por la congelación (Medina-Robles et al., 2005), entre ellos daños a la membrana mitocondrial y a la membrana plasmática (Ogier et al., 1997), esta última, estrechamente relacionada con eventos de fusión y fertilización (Frits y Baren, 2000; Yu et al., 2002). No obstante la habilidad protectora del DMSO en otras especies resulta ser tóxico para la célula espermática. En el pez gato Pelteobagrus fulvidraco, el DMSO e incluso el glicerol disminuyeron significativamente la tasa de fertilización, mientras el metanol demostró proteger al espermatozoide alcanzando tasas de fertilización de hasta el 90% (Pan et al., 2008). La efectividad y toxicidad de los crioprotectores puede variar de acuerdo a la especie e incluso entre peces y otros animales (Velasco-Santamaría et al., 2006; Horvath et al., 2003).
Es posible que la alteración de otras variables celulares o moleculares esté interviniendo positiva o negativamente en los índices de fertilización espermática. Para ello, se han intentado establecer relaciones entre la capacidad fertilizante del espermatozoide con el contenido de ATP o con la movilidad (Ogier et al., 1997), sin embargo, no siempre estas variables pueden correlacionarse, puesto que se ha encontrado que la habilidad para fertilizar un ovocito por parte del espermatozoide depende del conjunto de variables y de otras como la integridad de membrana (Bobe y Labbé, 2010). En Morone saxatilis se mostró que espermatozoides, aparentemente inmóviles (0%) posdescongelación, originaron tasas de fertilización hasta del 88%. Casos similares se reportan en Ciprinus carpio (Warnecke y Pluta, 2003).
CONCLUSIONES
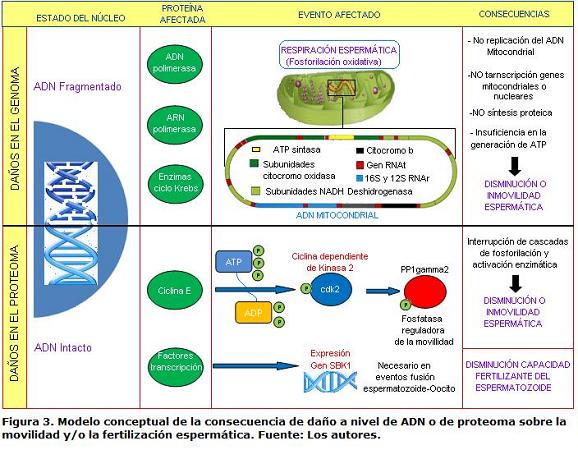
La revisión permitió recopilar y analizar efectos de la crioconservación sobre la calidad y el desempeño espermático, los cuales se presentan a través del modelo conceptual de la figura 3. Básicamente se encontró, en lo publicado hasta ahora, que los efectos pueden ser de dos tipos: Daños en el genoma y en el proteoma. Los daños en el genoma impiden la replicación y la transcripción de genes mitocondriales o nucleares e impidiendo, por consiguiente, la síntesis de proteínas claves en la producción energética, trayendo como consecuencia la disminución de la movilidad o la inmovilidad espermática, daño que sin embargo puede ser enmendado en algunos casos por los sistemas de reparación de ADN del ovocito. Los daños en el proteoma se traducen en la interrupción de la cascada de fosforilación y activación enzimática, afectando la movilidad del espermatozoide, así como su capacidad fertilizante.
BIBLIOGRAFÍA
AGUSTÍN JT, WILKERSON CG, WITMAN GB. The unique catalytic subunit of sperm cAMP-dependent protein kinase is the product of an alternative C mRNA expressed specifically in spermatogenic cells. Mol Biol Cell. 2000;11:3031-3044.
[ Links ]AHMADI A, NG SC. Fertilizing ability of DNA-damaged spermatozoa, J Exp Zool. 1999;284(6):696-704.
[ Links ]ALAVI SMH, COSSON J. Sperm motility in fishes: (II) Effects of ions and osmotic pressure. Cell Biol Int. 2006;30(1):1-14.
[ Links ]ALAVI SMH, RODINA M, POLICAR T, LINHART O. Relationship between semen characteristics and body size in Barbus barbus L. (Teleostei: Cyprinidae) and effects of ions and osmolality on sperm motility. Comp Biochem Physiol A Mol Integr Physiol. 2009;153(4):430-437.
[ Links ]ANCHORDOGUY T, CARPENTER JF, LOOMIS SH, CROWE JH. Mechanisms of interaction of amino acids with phospholipid bilayers during freezing, Biochem Biophys Acta. 1988;946:299-306.
[ Links ]ANDERSSON GE, KARLBERG O, CANBACK B, KURLAND CG. On The Origin Of Mitochondria: A Genomics Perspective. Phil Trans R Soc Lond B Biol Sci. 2003;358:165-179.
[ Links ]ASHWOOD-SMITH MJ, EDWARDS RG. DNA repair by oocytes. Mol Hum Reprod. 1996;2:46-51.
[ Links ]BILLARD R, COSSON J, CRIM LW, SUQUET M. Sperm physiology and quality. In: Bromage NR, Roberts RJ, editores. Broodstock Management and Egg and Larval Quality. Cambridge: Cambridge University Press; 1995. p. 53-76.
[ Links ]BOBE J, LABBÉ C. Egg and sperm quality in fish. Gen Comp Endocrinol. 2010;165(3):535-48
[ Links ]BROZMANOVA J, DUDAS A, HENRIQUES JA. Repair of oxidative DNA damagean important factor reducing cancer risk. Neoplasma. 2001;48: 85-93.
[ Links ]BRUCE A, BRAY D. Molecular Biology Of The Cell. New York: Garland Publishing Inc.; 1994. p. 704-715.
[ Links ]CABRITA E, ENGROLA S, CONCEIÇÃO LEC, POUSÃO-FERREIRA P, DINIS MT. Successful cryopreservation of sperm from sex-reversed dusky grouper, Epinephelus marginatus. Aquaculture. 2009;287:152-157.
[ Links ]CABRITA E, ROBLES V, CUÑADO S, WALLACE JC, SARASQUETE C, HERRÁEZ MP. Evaluation of gilthead sea bream, Sparus aurata, sperm quality after cryopreservation in 5 ml macrotubes. Cryobiology. 2005;50:273-284.
[ Links ]CAROLSFEL DJ, GODINHO HP, ZANIBONI FILHO E, HARVEY BJ. Cryopreservation of sperm in Brazilian migratory fish conservation. J Fish Biol. 2003;63: 472-489.
[ Links ]CECCON-LANES CF, OKAMOTO M, VARONI-CAVALCANTI P, COLLARES T, FARIAS-CAMPOS V, DESCHAMPS JC, et al. Cryopreservation of Brazilian flounder (Paralichthys orbignyanus) sperm. Aquaculture. 2008;275:361-365.
[ Links ]CHEREGUINI O, GARCÍA DE LA BANDA I, RASINES I, FERNANDEZ A. Growth and survival of young turbot (Scophthalmus maximus L.) produced with cryopreserved sperm. Aquac Res. 2002;33:637-641.
[ Links ]CIERESZKO A, WOLFE TD, DABROWSKI K. Analysis of DNA damage in sea lamprey (Petromyzon marinus) spermatozoa by UV, hydrogen peroxide, and the toxicant bisazir. Aquat Toxicol. 2005;73:128-38.
[ Links ]CIERESZKO A, GLOGOWSKI J, DABROWSKI K. Biochemical characteristics of seminal plasma and spermatozoa of freshwater fishes. In: Tiersch TR and Mazik PM, editors. Cryopreservation in Aquaculture Species. Baton Roue, Louisiana: World Aquaculture Society; 2000. p. 20-48.
[ Links ]CIERESZKO A. Effects of extenders and time of storage before freezing on motility and fertilization of cryopreserved Muskellunge spermatozoa. Trans Am Fish Soc. 1999;128:542-548.
[ Links ]COOPER GEOFFREY M. The Cell: A Molecular Approach. Washington: ASM Press; 1997. p. 10-12, 391, 392.
[ Links ]COSSON J. The motility apparatus of fish spermatozoa. In: Alavi SMH, Cosson JJ, Coward K, Rafiee G, editors. Fishspermatology. Oxford: Alpha Science Int; 2007. p. 281-316.
[ Links ]COSSON MP, COSSON J, ANDRÉ F, BILLARD R. cAMP/ATP relationship in the activation of trout sperm motility: their interaction in membrane-deprived models and in live spermatozoa. Cell Motil Cytoskel. 1995;31:159-176.
[ Links ]COSSON MP, COSSON J, BILLARD R. cAMP dependence of Movement initiation intact and demembranated trout spermatozoa. Bull Inst Zool Acad Sinica. 1991;16:263-266.
[ Links ]CRUZ-CASALLAS PE, PARDO-CARRASCO SC, ARIAS-CASTELLANOS JA, LOMBO-CASTELLANOS PE, LOMBO-RODRÍGUEZ DA, PARDO-MARIÑO JE. Cryopreservation of Yamú Brycon siebenthalae Milt. J. World Aquacult Soc. 2004; 35: 529-35.
[ Links ]DABROWSKI K, CIERESZKO A. Ascorbic acid and reproduction in fish: endocrine regulation and gamete quality. Aquac Res. 2001;32:623-638.
[ Links ]DARIN-BENNET A, WHITE IG. Influence of the cholesterol content of mammalian spermatozoa on susceptibility to cold shock. Cryobiology. 1977;24:466-470.
[ Links ]DIANOV GL, SLEETH KM, DIANOVA II, ALLINSON SL. Repair of abasic sites in DNA. Mutat Res. 2003;531:157-163.
[ Links ]DREANNO C, SEGUIN F, COSSON J, SUQUET M, BILLARD R. Metabolism of turbot (Scophthalmus maximus) spermatozoa: relationship between motility, intracellular nucleotide content, mitochondrial respiration. Mol Reprod Dev. 1999;53: 230-243.
[ Links ]DREANNO C, SUQUET M, QUEMENER L, COSSON J, FIERVILLE F, et al. Cryopreservation of turbot (Scophthalmus maximus) spermatozoa. Theriogenology. 1997;48:589-603.
[ Links ]DROKIN S, STEIN H, BARTSCHERER H. Effect of cryopreservation on the fine structure of spermatozoa of Rainbow Trout (Oncorhynchus mykiss) and Brown Trout (Salmo trutta F. Fario). Cryobiology. 1998;37:263-270.
[ Links ]DROKIN SI, KOPEIKA EF, GRISCHENKO VI. Differences in the resistance to cryopreservation and specificity of lipid content of spermatozoa of marine and freshwater fish species. Rep. USSR Acad. Sci. 1989;304:1493-1496.
[ Links ]FERNÁNDEZ I, PIMENTEL MS, ORTIZ-DELGADO JB, HONTORIA F, SARASQUETE C, ESTÉVEZ A, et al. Effect of dietary vitamin A on Senegalese sole (Solea senegalensis) skeletogenesis and larval quality. Aquaculture. 2009;295(3):250-265. [ Links ]
FOGLI DA SILVEIRA W, KAVAMOTO ET, NARAHARA MY. Avaliacao da qualidade e crio-preservacao em forma de -pellets- do semen do bagre, Rhamdia hilarii (Valenciennes, 1840). Bol Inst Pesca. 1985;12:7-11. [ Links ]
FRASER L, STRZEZEK J. Effect of different procedures of ejaculate collection, extenders and packages on DNA integrity of boar spermatozoa following freezing-thawing. Anim Reprod Sci. 2007;99:317-329.
[ Links ]FRITS MF, BAREN MG. Dynamic of the mammalian sperm plasma membrane in the process of fertilization. Biochem Biophys Acta. 2000;1469:197-235.
[ Links ]GIBBONS IR. Microtuble-based motility: an overview of a fast-moving field. In: Warner FD, Satir P and Gibbons IR, editores. Cell movement: the dynein ATPases. New York: Alan R, Liss; 1989. p. 3-24.
[ Links ]GWO JC, STRAWN K, LONGNECKER MT, ARNOLD CR. Cryopreservation of Atlantic croaker spermatozoa. Aquaculture. 1991;94:355-375.
[ Links ]GWO JC, WU CY, CHANG WS, CHENG HY. Evaluation of damage in Pacific oyster (Crassostrea gigas) spermatozoa before and after cryopreservation using comet assay. Cryo Lett. 2003;24:171-180.
[ Links ]GWO JC. Cryopreservation of black grouper (Epinephelusmalabaricus)spermatozoa. Theriogenology. 1993;39:1331-1342.
[ Links ]HAMMERSTEDT RH, GRAHAM JK. Cryopreservation of poultry sperm: the enigma of glycerol. Cryobiology. 1992;29:26-38.
[ Links ]HAYASHI H, YAMAMOTO K, YONEKAWA H, MORISAWA M. Involvement of tyrosine protein kinase in the initiation of flagellar movement in rainbow trout spermatozoa. J Biol Chem. 1987;262:16692-16698.
[ Links ]HE S, WOODS LC. Changes in motility, ultrastructure, and fertilization capacity of striped bass Morone saxatilis spermatozoa following cryopreservation. Aquaculture. 2004;236:677-686.
[ Links ]HAMASAKI T, BARKALOW K, RICHMOND J, SATIR P. cAMP-stimulated phosphorylation of an axonemal polypeptide that copurifies with the 22S dynein arm regulates microtubule translocation velocity and swimming speed in Paramecium. Proc Natl Acad Sci USA. 1991;88:7918-7922.
[ Links ]HORVÁTH A, MISKOLCZI E, URBANYI B. Cryopreservation of common carp sperm. Aquat Lives Resou. 2003;16:457-460.
[ Links ]HORVÁTH A, URBÁNYI B. The effect of cryoprotectants on the motility and fertilizing capacity of cryopreserved African catfish clarias gariepinus (Burchell 1822) sperm. Aquac Res. 2000;31:317-324.
[ Links ]HSU TH, LIN KH, GWO JC. Genetic integrity of black sea bream (Acanthopagrus schlegeli) sperm following Cryopreservation. J Appl. Ichthyol. 2008;24:456-459.
[ Links ]HUANG C, DONG Q, WALTER RB, TIERSCH TR. Initial studies on sperm cryopreservation of alive bearing fish, the greens word tail Xiphophorus helleri. Theriogenology. 2004;62:179-194.
[ Links ]HUANG Z, VIJAYARAGHAVAN S. Increased phosphorylation of a distinct subcellular pool of protein phosphatase, PP1gamma2, during epididymal sperm maturation. Biol Reprod. 2004;70:439-447.
[ Links ]INABA K. Molecular mechanisms of the activation of flagellar motility in sperm. In: Alavi SMH, Cosson JJ, Coward K, Rafiee G, editores. Fish Spermatology. Oxford UK: Alpha Science Inc; 2007. p. 267-279.
[ Links ]IRVINE DS, TWIGG JP, GORDON EL, FULTON N, MILNE PA, AITKEN RJ. DNA integrity in human sperm: relationships with semen quality. J Androl. 2000;21:33-44.
[ Links ]ITOH A, INABA K, OHTAKE H, FUJINOKI M, MORISAWA M. Characterization of cAMP dependent protein kinase catalytic subunit from rainbow trout sperm. Biochem Biophys Res Commun. 2003;305:855-861.
[ Links ]IZUMI H, MARIAN T, INABA K, OKA Y, MORISAWA M. Membrane hyperpolarization by sperm activating and attracting factor increases cAMP level and activates sperm motility in the ascidian Ciona intestianalis. Dev Biol. 1999;213:246-256.
[ Links ]KATO K, MURATA O, YAMAMOTO S, MIYASHITA S, KUMAI H. Viability, growth and external morphology of meiotic and mitoticgynogenetic diploids red sea bream, Pagrus major. J Appl Ichthyol. 2001;17(3):97-103.
[ Links ]KOCH JFA, VIVEIROS ATM, MARIA AN, ORFAO LH. Diluidores e crioprotetores na criopreservacao do semen de piapara Leporinus obtusidens. In: Proceedings of the 44th meeting of the Brazilian Animal Science Society, Jaboticabal, SP, Brazil. 2007. p. 1-3.
[ Links ]KOPEIKA E Y KOPEIKA J. Variability of sperm quality after cryopreservation in fish. En: Alavi SMH, Cosson JJ, Coward K, Rafiee G, editores. Fish Spermatology. Oxford UK: Alpha Science Inc; 2007. p. 347-396.
[ Links ]KOPEIKA EF, CHEREPANOV VV, DZUBA BB, TSVETKOVA LI. Oxygen and fish spermatozoa cryoresistance. 34th Annual Meeting of the society for Cryobiology, Barcelona, España; 1997. p. 8-12.
[ Links ]KOPEIKA J, KOPEIKA E, ZHANG T, RAWSON DM, HOLT WV. Effect of DNA repair inhibitor (3-aminobenzamide) on genetic stability of loach (Misgurnus fossilis) embryos derived from cryopreserved sperm. Theriogenology. 2004;61:1661-1673.
[ Links ]KRASZNAI Z, MARIAN T, IZUMI H, DAMJANOVICH S, BALKAY L, TRON L, MORISAWA M. Membrane hyperpolarization removes inactivation of Ca2+ channels, leading to Ca2+ influx and subsequent initiatiation of sperm motility in the common carp. Proc Natl Acad Sci USA. 2000;97:2052-2057.
[ Links ]KURLAND CG, ANDERSSON SGE. Origin And Evolution Of The Mitochondrial Proteome. Microbiol. Mol Biol Rev. 2000;64:786-820.
[ Links ]LABBÉ C, CROWE LM, CROWET JH. Stability of the lipid component of Trout sperm plasma membrane during freeze - thawing. Criobiology. 1997;34:176-182.
[ Links ]LABBÉ C, MARTORIATI A, DEVAUX A, MAISSE G. Effect of sperm cryopreservation on sperm DNA stability and progeny development in rainbow trout. Mol Reprod Dev. 2001;60:397-404.
[ Links ]LAHNSTEINER F, BERGER B, HORVARTH A, URBANYI B, WEISMANN T. Criopreservation of spermatozoa in cyprinid fishes. Theriogenolgy. 2000;54:1477-1498.
[ Links ]LATHAM KE, SCHULTZ RM. Embryonic genome activation. Front Biosci. 2001;6:748-759.
[ Links ]LEUNG LKP. Cryopreservation of spermatozoa of the barramundi, Lates calcarifer (Teleostei: Centropomidae). Aquaculture. 1987;64:243-247.
[ Links ]LI P, WEI Q, LIU L. DNA integrity of Polyodon spathula cryopreserved sperm. J Appl Ichthyol. 2008;24:121-125.
[ Links ]LI MW, MEYERS S; TOLLNER TL, OVERSTREET JW. Damage to chromosomes and DNA of rhesus monkey sperm following cryopreservation. J Androl. 2007;28:493-501.
[ Links ]LINHART O, COSSON J, MIMS SD, SHELTON WL, RODINA M. Effects of ions on the motility of fresh and demembranated paddlefish (Polyodon spathula) spermatozoa. Reprod. 2002;124:713-719.
[ Links ]LUDWIG GM, LOCHMANN SE. Effect of Temperature on Larval Sunshine Bass Growth and Survival to the Fingerling Stage. N Am J Aquacult. 2009;71:260-266.
[ Links ]MAISSE G, LABBE C. OGIER DE BAULNY B, LEVERONI S, HAFFRAY P. Cryoconservation du sperme et des embryons de poisons. INRA Productions Animales. 1998;11:57-65.
[ Links ]MARIA AN, VIVEIROS ATM, FREITAS RTF, OLIVEIRA AV. Extenders and cryoprotectants for cooling and freezing of piracanjuba (Brycon orbignyanus) semen, an endangered Brazilian teleost fish. Aquaculture. 2006;260:298-306.
[ Links ]MCNIVEN MA, GALLANT RK, RICHARDSON GF. Dimethyl-acetamide as a cryoprotectant for rainbow trout spermatozoa, Theriogenology. 1993;40:943-948.
[ Links ]MEDINA RV, VELAZCO SY, CRUZ CP. Aspectos generales de la crioconservación espermática de peces teleósteos. Rev Col Cienc Pec. 2005;18:34-48.
[ Links ]MEMISOGLU A, SAMSON L. Contribution of Base Excision Repair, Nucleotide Excision Repair, and DNA Recombination to Alkylation Resistance of the Fission Yeast Schizosaccharomyces pombe. J Bacteriol. 2000;182:2104-2112.
[ Links ]MISKOLCZI E, MIHALFFY S, PATA KV, URBANYI B, HORVÁTH A. Examination of larval malformation in african catfish (Clarias gariepinus) following fertilization with cryoconserved sperm. Aquaculture. 2005;247:119-125.
[ Links ]MORISAWA M, ISHIDA K. Short-term changes in levels of cyclic AMP, adenylate cyclase, and phosphodiesterase during the initiation of sperm motility in rainbow trout. J Exp Zool. 1987;242:199-204.
[ Links ]MORISAWA M, ODA S, YOSHIDA M, TAKAI H. Transmembrane signal transduction for the regulation of sperm motility in fishes and ascidians. In: C. Gagnon, editor. The male gamete from basic science to clinical applications. Vienna, IL: Cache River Press; 1999. p. 149-160.
[ Links ]MULDREW K, MCGANN LE. Mechanisms of intracellular ice formation. Biophys J. 1990;57:525-532. [ Links ]
NOTMAN R, NORO M, O MALLEY B, ANWAR J. Molecular Basis for Dimethylsulfoxide (DMSO) Action on Lipid Membranes. JACS Communications. 2006.
[ Links ]ODA S, IGARASHI Y, MANAKA K, KOIBUCHI N, SAKAI-SAWADA M, SAKAI K, et al. Sperm-activiting proteins obtained from the herring eggs are homologous to trypsin inhibitors and synthesized in follicle cells. Dev Biol. 1998;204:55-63.
[ Links ]ODANI M, KOMATSU Y, OKA S, IWAHASHI H. Screening of genes that respond to cryopreservation stress using yeast DNA microarrays. Cryobiology. 2003;47:155-164.
[ Links ]OGIER DE BAULNY B, LE-VERN Y, KERBOEUF D, MAISSE G. Flow cytometric evaluation of mitochondrial activity and membrane integrity in fresh and cryopreserved Rainbow trout (Oncorhynchus mykiss) spermatozoa. Cryobiology. 1997;34:141-149.
[ Links ]OHTA H, SHINRIKI Y. Changes in osmotic pressure that trigger the initiation of sperm motility in the river sculpin Cottus hangiongensis. Fish Phys Bioch. 1998;18:29-35.
[ Links ]PACHOS I, NATSIS L, NATHANAILIDES C, KGOLOU I, KOLETTAS E. Induction of gynogenesis and androgenenesis in goldfish Carassius auratus (Var. Oranda). Reproduction Domestic Animal. 2001;36:195-198.
[ Links ]PAN J, DING S, GE J, YAN W, HAO C, CHEN J, et al. Development of cryopreservation for maintaining yellow catfish Pelteobagrus fulvidraco sperm. Aquaculture. 2008;279:173-176.
[ Links ]PÉREZ-CEREZALES S, MARTÍNEZ-PÁRAMO S, CABRITA E, MARTÍNEZ-PASTOR F, DE-PAZ P, HERRÁEZ MP. Evaluation of oxidative DNA damage promoted by storage in sperm from sex-reversed rainbow trout. Theriogenology. 2009;71:605-613.
[ Links ]PERIS SI, MORRIER A, DUFOUR M, BAILEY JL. Cryopreservation of ram semen facilitates sperm DNA damage: relationship between sperm andrological parameters and the sperm chromatin structure assay. J Androl. 2004;25:224-233.
[ Links ]PILLAI MC, YANAGIMACHI R, CHERR GN. In vivo and in vitro initiation of sperm motility using fresh and cryopreserved gametes from pacific Herring Clupea pallasi. J Exp Zool. 1994;269:62-68.
[ Links ]QUINN PJA. Lipid-phase separation model of low temperature damage to biological membrane. Cryobiology. 1985;22:128-146.
[ Links ]RURANGWA E, KIME DE, OLLEVIER F, NASH JP. The measurement of sperm motility and factors affecting sperm quality in cultured fish. Aquaculture. 2004;234:1-28.
[ Links ]SANCAR GB. Enzymatic photoreactivation: 50 years and counting. Mutat. Res. 2000;451:25-37.
[ Links ]SAUDRAIS C, FIERVILLE F, CIBERT C, LOIR M, LE RUMEUR E, COSSON J. The use of creatine-phosphate plus ADP as energy source for motility of membrane deprived trout spermatozoa. Cell Motil. Cytoskeleton. 1998;41:91-106.
[ Links ]SHARMA RK, SAID T, AGARWAL A. Sperm DNA damage and its clinical relevance in assessing reproductive outcome. Asian J. Androl. 2004;6:139-148.
[ Links ]SLEMBROUCK J, BARAS E, SUBAGJA J, HUNG LT, LEGENDRE M. Survival, growth and food conversion of cultured larvae of Pangasianodon hypophthalmus, depending on feeding level, prey density and fish density. Aquaculture. 2009;294:52-59.
[ Links ]SLUPPHAUG G, KAVLI B, KROKAN HE. The interacting pathways for prevention and repair of oxidative DNA damage. Mutat Res. 2003;531:231-251.
[ Links ]SUN JG, JURISICOVA A, CASPER RF. Detection of deoxyribonucleic acid fragmentation in human sperm: correlation with fertilization in vitro. J Androl. 2000;21:33-44.
[ Links ]SUQUET M, DREANNO C, DORANGE G, NORMANT Y, QUEMENER L, GAIGNON JL, et al. The ageing phenomenon of turbot spermatozoa: effects on morphology, motility and concentration, intracellular ATP content, fertilization, and storage capacities. J Fish Biol. 1998;52:31-41.
[ Links ]SUQUET M, DREANNO C, FAUVEL C, COSSON J Y BILLARD R. Cryopreservation of sperm in marine fish. Aquaculture Res. 2000;31:231- 243.
[ Links ]TABARES CJ, TARAZONA A, OLIVERA A. Fisiología de la activación del esperma-tozoide en peces de agua dulce. Rev Col Cienc Pec. 2005;18:149-161.
[ Links ]TANIMOTO S, KUDO Y, NAKAZAWA T, MORISAWA M. Implication that potassium flux and increase in intracellular calcium are necessary for the initiation of sperm motility in salmonid fishes. Mol Reprod Dev. 1994;39:409-414.
[ Links ]THOROGOOD J, BLACKSHAW A. Factors affecting the activation, motility, and cryopreservation of the spermatozoa of the yellowfin bream, Acanthopagrus australis (Guu ther). Aquacult. Fish Manage. 1992;23:337-44.
[ Links ]TIERSCH TR, et al. Cryopreservation of sperm of the endangered Razorback sucker. Trans. Am. Fish Soc. 1998;127:95-104.
[ Links ]VELASCO-SANTAMARÍA YM, MEDINA-ROBLES VM, CRUZ-CASALLAS EP. Cryopreservation of yamú (Brycon amazonicus) sperm for large scale fertilization. Aquaculture. 2006; 256:267-271.
[ Links ]VINCI G, RAICU F, POPA L, POPA O, COCOS R, MCELREAVEY KA. Deletion of a novel heat shock gene on the Y chromosome associated with azoospermia. Mo. Hum. Reprod. 2005;11:295-298.
[ Links ]VIVEIROS ATM, ORFÃO LH, MARIA AN, ALLAMAN IB. A simple, inexpensive and successful freezing method for curimba Prochilodus lineatus (Characiformes) semen. Anim Reprod Sci. 2008b;112:293-300.
[ Links ]VIVEIROS ATM, LOCK EJ, WOELDERS H, KOMEN J. Influence of cooling rates and plunging temperatures in an interrupted slow-freezing procedure for semen of the African catfish, Clarias gariepinus. Cryobiology. 2001;43:276-287.
[ Links ]VIVEIROS ATM, GODINHOS HP. Sperm quality and cryopreservation of Brazilian freshwater fish species: a review. Fish Physiol Biochem. 2009;35:137-150.
[ Links ]VIVEIROS ATM, OLIVEIRA AV, MARIA AN, ORFAO LH, SOUZA JC. Sensibilidade dos espermatozoides de dourado (Salminus brasiliensis) a diferentes soluções crioprotetoras. Arq Bras Med Vet Zootec. 2009b;61(4):883-889.
[ Links ]WARNECKE D, PLUTA H-J. Motility and fertilizing capacity of frozen/thawed common carp (Cyprinus carpio L.) sperm using dimethyl-acetamide as the main cryoprotectant. Aquaculture. 2003;215:167-185.
[ Links ]WATSON PF, HOLT WV, editores. Cryobanking the Genetic Resource, Wildlife Conservation for the Future. London, UK: Taylor and Francis; 2001.
[ Links ]WHITAKER M, SWANN K. Lighting the fuse at fertilization. Development. 1993; 117:1-12.
[ Links ]WILDT DE, WEMMER C. Sex and wildlife: the role of reproductive science in conservation. Biodivers Conserv. 1999;8:965-976.
[ Links ]WITHLER FC, LIM LC. Preliminary observations of chilled and deep-frozen storage of grouper (Epinephelus tauvina) sperm. Aquaculture. 1982;27:389-392.
[ Links ]YAO Z, CRIM LW, RICHARDSON GF, EMERSON CJ. Cryopreservation, motility and ultraestructure of sperm from the ocean pout (Macrozoarces americanus L.), an internally fertilizing marine teleost. In: FW Goetz & P Thomas, editores. Reproductive Physiology of Fish. Proceedings of the Fifth international Symposium. Austin, TX; 1995. p. 149.
[ Links ]YU S, KOJIMA N, HAKOMORI SI, KUDO S, INOUE S, INOUE Y. Binding of rainbow trout sperm to egg is mediated by strong carbohydrate-tocarbohydrate interaction between (KDN)GM3 (deaminated neuraminyl ganglioside) and Gg3-like epitope. Proc Natl Acad Sci USA. 2002;99:2854-2859.
[ Links ]ZACHARIASSEN KE, KRISTIANSEN E. Ice nucleation and antinucleation in nature. Cryobiology. 2000;41:257-279.
[ Links ]ZILLI L, SCHIAVONE R, ZONNO V, ROSSANO R, STORELLI C, VILELLA S. Effect of cryopreservation on Sea Bass sperm protein. Biol Reprod. 2005;72:1262-1267.
[ Links ]ZILLI L, SCHIAVONE R, ZONNO V, STORELLI C, VILELLA S. Evaluation of DNA damage in Dicentrarchus labrax sperm following cryopreservation. J Cryobiology. 2003; 47: 227-235.














